Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá jul./dez. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.38961
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.38961
ARTÍCULO CORTO
Actividad antifúngica de extractos de biomasa celular de neem sobre aislamientos de dermatofitos
Antifungal activity of neem cellular biomass extracts on dermatophytes isolates
Daniel Iván Ospina Salazar1, Rodrigo Alberto Hoyos Sánchez2, Myrtha Arango Arteaga3, Fernando Orozco Sánchez4, Jhon Diego Ríos Salazar5
1 Estudiante Maestría Ciencias Agrarias, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia Sede Medellín, Medellín, Colombia. diospinas@unal.edu.co.
2 Profesor asociado, Departamento de Ciencias Agronómicas, Facultad de Ciencias Agrarias, Universidad Nacional de Colombia Sede Medellín, Medellín, Colombia.
3 Laboratorio de Micología Médica, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
4 Profesor asociado, Escuela de Química, Facultad de Ciencias, Universidad Nacional de Colombia Sede Medellín, Medellín, Colombia.
5 Estudiante Maestría Ciencias Química, Facultad de Ciencias, Universidad Nacional de Colombia Sede Medellín, Medellín, Colombia.
Recibido: marzo 10 de 2014 Aprobado: octubre 22 de 2014
Resumen
Las líneas celulares de neem (Azadirachta indica A. Juss.) cultivadas en suspensión líquida han demostrado producir metabolitos secundarios bioactivos, particularmente triterpenoides. En consecuencia, se han realizado estudios para el control de microorganismos de importancia médica, como los hongos dermatofitos. El objetivo principal de este trabajo fue evaluar a través de un método de referencia in vitro la actividad antifúngica de diferentes extractos de cultivos celulares de neem sobre varios aislamientos de Trichophyton mentagrophytes, Trichophyton rubrum y Epidermophyton floccosum. Se realizó un escalado de cultivos de suspensiones celulares de neem, a partir de los cuales se obtuvo un extracto crudo metanólico. Éste extracto fue fraccionado posteriormente por cromatografía en columna de silica gel. Con los extractos obtenidos se determinó la Concentración Mínima Inhibitoria (CMI), siguiendo el método de microdilución en caldo M38-2, con cinco aislamientos de T. mentagrophytes, cinco de T. rubrum y tres de E. floccosum. Se usó como control positivo el antimicótico Terbinafina. Los resultados mostraron que el extracto crudo de biomasa celular de neem inhibe el crecimiento hasta en 100 % de T. mentagrophytes, T. rubrum y E. floccosum. Al evaluar las fracciones por separado, se observó que las de menor polaridad exhibieron en general mayor actividad antifúngica (CMI=109 μg/mL) que el extracto crudo per se (CMI=2500 μg/ mL) y las fracciones más polares (CMI=7000 μg/mL). Lo anterior indica que las células de neem cultivadas en suspensión producen compuestos con actividad antifúngica, siendo más bioactivos los presentes en las fracciones de menor polaridad.
Palabras clave: método de microdilución en caldo, cromatografía, cultivo de células en suspensión, concentración mínima inhibitoria, compuestos bioactivos.
Abstract
Cell lines of neem (Azadirachta indica A. Juss.) grown in liquid suspension have shown to produce bioactive secondary metabolites, particularly triterpenoids. In consequence, its use as a control of medical microorganisms (like dermatophytes) is proposed. The main goal of this study was to assess the antifungal activity of methanolic extracts from neem cultured cell suspensions on several isolates of Trichophyton mentagrophytes (five isolates), Trichophyton rubrum (five isolates) and Epidermophyton floccosum (three isolates). Neem cell suspension cultures were scaled up, from which a raw methanolic extract was obtained. This extract was fractionated by silica gel column chromatography. The raw methanolic extract and its fractions were used in order to determine the Minimal Inhibitory Concentration (MIC) on the dermatophytes isolates by following M38-A2 broth microdilution method. Antimycotic Terbinafine was used as positive control. The results shown that neem raw cellular biomass extract inhibits the growth of T. mentagrophytes, T. rubrum and E. floccosum in at least 100%. In the evaluations of the separated fractions, it was observed that the low polarity fractions had higher antifungal activity (MIC=109 μg/mL) than the raw extract per se (MIC=2500 μg/mL) and the most polar ones (MIC=7000 μg/mL). The latter suggest that neem cells cultured in liquid suspension produces compounds with antifungal activity, being more active those present in the low polarity fractions.
Key words: broth microdilution method, chromatography, suspension cell culture, minimal inhibitory concentration, bioactive compounds.
Introducción
Los dermatofitos son un grupo de hongos filamentosos taxonómicamente relacionados que producen infecciones en la piel, el pelo y las uñas tanto del ser humano como de los animales, las cuales reciben el nombre de tiñas (del latín tinea). Trichophyton rubrum es el agente causal principal de tinea pedis (pies), la infección más común por dermatofitos (Fernández-Torres, 2005). Trichophyton mentagrophytes y Epidermophyton floccosum se presentan comúnmente en tinea unguium (uñas), la cual afecta a un 15-20 % de individuos entre cuarenta y sesenta años, alcanzando una incidencia de hasta el 48 % entre la población mayor de setenta años (Roseeuw et al. 1999). La prevalencia a nivel mundial de las infecciones causadas por dermatofitos constituyen motivo constante de investigación sobre nuevos métodos de control, de ahí la relevancia actual del uso de los extractos vegetales, entre ellos el de neem (Azadirachta indica A. Juss.).
Los extractos del árbol de neem son de los más poderosos que se pueden encontrar en la farmacopea de la India para combatir varias enfermedades. Esto se ha demostrado a través de estudios con microorganismos patógenos que dan cuenta de su bioactividad. Natarajan et al. (2003) encontraron una CMI de extractos orgánicos de hojas y semillas de neem de 31 μg/mL, sobre los dermatofitos T. rubrum, T. mentagrophytes y Microsporum nanum. También reportan una distorsión en el patrón de crecimiento de estos hongos a una concentración 15 μg/mL. Este mismo autor (Natarajan et al.,2002) menciona que extractos de semillas de neem exhibieron una menor CMI en evaluaciones con T. rubrum, T. mentagrophytes, T.violaceum, M. nanum y E. floccosum que el extracto de hojas. La inhibición en el crecimiento de algunos dermatofitos como T. rubrum y T. mentagrophytes se atribuye a la mayor concentración de triterpenoides en estas partes de la planta.
Algunos autores han observado la existencia de efectos sinérgicos entre los diferentes compuestos presentes en los extractos de neem. Govindachari et al. (1998) observaron que la mezcla de fracciones obtenidas por HPLC de un extracto metanólico separado del aceite de semillas de A. indica resultó efectiva contra Drechslera oryzae, Alternaria tenuis y Fusarium oxysporum (26 % – 72 % de inhibición respecto al control).
No obstante, indicaron que los compuestos por separado, como azadiradiona, nimbina y salanina no poseían el mismo poder antifúngico. En el mismo sentido se expresan Suresh et al. (1997), quienes a partir de extractos hexánicos y metanólicos de hojas de neem obtuvieron varias fracciones por HPLC, entre otras, los triterpenoides nimonol e isomeldenina, y evaluaron la formación de pústulas de Puccinia arachidis en foliolos de maní, Arachis hypogaea. Los resultados mostraron que la formación de pústulas era menor en los tratamientos con limonoides mezclados con trazas correspondientes a compuestos análogos. Los anteriores resultados respaldan la idea de que algunos metabolitos secundarios presentes en los extractos orgánicos de neem poseen mayor actividad antifúngica al actuar de forma combinada que aislada.
La capacidad de algunos compuestos presentes en A. indica para inhibir el crecimiento de microorganismos se ha explicado desde el punto de vista bioquímico. Lyer and Williamson (1991) atribuyeron las propiedades antifúngicas de los extractos orgánicos de neem a la inhibición en la actividad proteasa en dermatofitos. Okemo et al. (2001) sostienen que la cinética de acción de ciertos extractos de A. indica frente a microorganismos como Candida albicans,Escherichia coli y Pseudomonas aeruginosa es dependiente de la concentración y el tiempo, y está relacionada con la pared celular. Extractos acuosos de hojas de neem incrementaron la hidrofobicidad superficial de las células de Candida albicans, así como la formación de biopelícula en esta levadura (Polaquini et al., 2006).
No obstante lo anterior, falta información acerca de la capacidad de células de A. indica cultivadas en suspensión líquida, de producir metabolitos con actividad antifúngica. Debido a que esta técnica de cultivo in vitro se ha evaluado para la producción de otros compuestos bioactivos, como la azadiractina, de comprobada acción antialimentaria en insectos lepidópteros (Orozco- Sánchez, 2007), se justifica determinar el potencial de dicha técnica para la producción de metabolitos con otro tipo de atributos biocidas.
En consideración de lo anterior, se plantea evaluar la actividad antifúngica de un extracto metanólico de células de A. indica cultivadas en suspensión líquida, así como identificar las fracciones químicas responsables de dicho efecto, empleando el método de referencia in vitro M38-A2 para hongos filamentosos y dermatofitos.
Metodología
Material Vegetal
Las suspensiones celulares de A. indica se iniciaron por transferencia en forma aséptica de una cantidad estimada de 500 mg de callos friables de 8 semanas de edad a matraces Erlenmeyer de 250 mL con 50 mL de medio líquido consistente en sales básicas Murashige & Skoog (MS, 1962) con orgánicos mínimos (MSMO, Sigma M 6899), sacarosa 3 % (p/v), glicina 2 mg/L, ácido nicotínico 0.5 mg/L, Piridoxina-HCl 0.5 mg/L y tiamina-HCl 0.1 mg/L, y suplementado con ácido indol butírico (IBA) 19,7 μM (4 mg/L) y 6-benzil amino purina (BAP) 4,44 μM (1 mg/L), todo diluido en agua destilada. El pH fue ajustado a 5.8 con NaOH 1 M. Se taparon los Erlenmeyer con tapones de algodón y se procedió a esterilizar en autoclave a 121 °C, 20 lb/pulg2 durante 20 min. Las suspensiones fueron incubadas en condiciones de oscuridad a 25 °C en un agitador orbital a 120 rpm. El crecimiento de las suspensiones fue medido semanalmente marcando el nivel del sedimento celular. Cada dos semanas, se dejaron en sedimentación las suspensiones para desaguar el medio de cultivo viejo, agregándose inmediatamente un medio líquido fresco y estéril a las células remanentes o sedimentadas. Esta operación se realizó durante tres meses hasta obtener una cantidad considerable de biomasa celular.
Obtención de extractos
La biomasa celular fue filtrada en un montaje con papel de filtro, embudo Büchner, matraz Kitasato y bomba de vacío. Posteriormente, esta biomasa fue liofilizada en un equipo Labconco Freezone 6 (USA) durante 24 horas a -36 °C y 10-3 Mbar para extraer toda el agua. Esta biomasa celular se percoló en metanol sucesivamente hasta agotar el material. Los extractos metanólicos resultantes se concentraron al vacío en un rotoevaporador R-3000 Büchi a 42 °C hasta obtener una pasta seca (extracto crudo). Una parte de este extracto se rotuló y se guardó hasta los bioensayos de actividad antifúngica. Se realizó un procedimiento de fraccionamiento de la otra parte del extracto crudo, por cromatografía en columna, con base en la información de Jarvis et al. (1999). Se inició con 2,3 g de extracto crudo de biomasa celular, el cual se mezcló homogéneamente con 30 g de silica gel de 63- 200 micrones (Panreac) para conformar la cabeza de la columna. Posteriormente, se agregaron 60 g de silica gel a una columna cromatográfica de 50 cm de altura y 2,5 cm de diámetro y encima se depositó la cabeza mezclada con el extracto. Se realizó un fraccionamiento con mezclas de solventes de diferente polaridad, iniciando con hexano (H), mezcla de hexano - acetato de etilo (Ac), y finalizando con metanol (MeOH) de la siguiente forma:
1: 350 mL H
2: 450 mL H:Ac 7:3
3: 650 mL H:Ac 6:4
4: 275 mL H.Ac 3:7
5: 550 mL H:Ac 1:9
6: 300 mL MeOH
La fracción hexánica fue descartada ya que no produjo ningún rendimiento, mientras que las demás se guardaron para su uso posterior en los bioensayos.
Determinación de la actividad antifúngica
Los aislamientos de dermatofitos fueron gentilmente proveídos por el laboratorio de micología médica de la facultad de medicina de la Universidad de Antioquia, donde fueron aislados e identificados de acuerdo a los criterios de clasificación micológica de Kane et al. (1997) y Rebell (1977). Estos aislamientos se cultivaron en Papa-Dextrosa-Agar para promover la formación de conidias:
Trichophyton rubrum: cinco aislamientos
Trichophyton mentagrophytes: cinco aislamientos
Epidermophyton floccosum: tres aislamientos
Los ensayos de actividad antifúngica sobre los aislamientos de dermatofitos se llevaron a cabo de acuerdo al protocolo M38-A2 del Clinical and Laboratory Standards Institute (CLSI, 2008). Las colonias de 7 días de crecimiento fueron cubiertas con 3 mL de solución salina estéril al 0,85% p/v y suavemente removidas con un asa estéril para liberar las conidias en la solución. Se realizó conteo en cámara de Neubauer y se ajustó la concentración final a un rango de 1,0 - 3,0x103 UFC/mL.
Se prepararon microplacas estériles de 96 pozos de fondo en U con los diferentes extractos de neem, mediante diluciones dobles seriadas, a partir de una solución madre 1x106X de cada extracto en MeOH y dimetil sulfóxido (DMSO) en relación 1:2, llevado a concentración final 1:50 en medio de cultivo RPMI 1640, suplementado con glucosa al 2%, HEPES como amortiguador de pH y sin bicarbonato de sodio. Se empleó el antimicótico comercial Terbinafina como control positivo, y como control de solvente una mezcla de MeOH y DMSO en proporción 1:2. Se dejó un control negativo (sin extracto ni antimicótico) y un control de esterilidad (sin inocular).
Una vez preparadas las placas con el rango de concentraciones a evaluar, se procedió a inocular cada pozo con 100 μL de la suspensión de conidias ajustada previamente. Las placas fueron cultivadas a 35 °C durante 7 días en oscuridad. Cada bioensayo se hizo por triplicado en un diseño completamente aleatorizado. Los datos se analizaron por medio de la prueba del rango múltiple de Duncan, procesándolos en el programa SAS 9.3. El porcentaje de inhibición del crecimiento de los hongos fue estimado visualmente comparando la turbidez del control negativo con el del tratamiento, signándole un valor en porcentaje, adaptando la metodología de Fernández-Torres (2005). La Concentración Mínima Inhibitoria (CMI) fue establecida como aquella en la que la turbidez fue nula, es decir, pozos traslúcidos.
Resultados y discusión
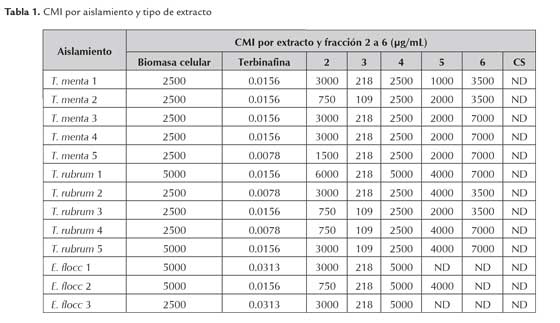
Los resultados mostraron en mayor o menor grado un efecto inhibitorio sobre el crecimiento de los trece aislamientos de dermatofitos, dependiendo del tipo de extracto y la concentración. Dentro del rango de concentraciones desplegado entre todos los extractos, la CMI fluctuó entre 109 y 7000 μg/mL; el control positivo (Terbinafina) exhibió el mayor poder antifúngico al inhibir totalmente el crecimiento hasta 0.0078 μg/ mL. No se detectó un efecto inhibitorio en el crecimiento de los dermatofitos debido al control de solvente (MeOH:DMSO 1:2), por lo tanto su contribución a la actividad de los extractos es descartable. Como se muestra en las figuras 1 y 2, la escala de turbiedad en las placas multipozos fue un indicador acertado del crecimiento de los hongos en presencia de los extractos de neem.
Los resultados obtenidos permiten relacionar la actividad antifúngica (a menor CMI mayor actividad antifúngica) con el tipo de extracto. En primer lugar, es importante resaltar que por lo menos dos de las fracciones separadas (2 y 3) del extracto crudo de biomasa celular exhibieron una CMI inferior (109 - 750 μg/mL respectivamente) que el extracto crudo per se (2500 μg/mL) en varios de los aislamientos de dermatofitos evaluados. Adicionalmente, se observó una tendencia hacia un aumento de la CMI en la mayoría de los aislamientos, al estimar su crecimiento con fracciones de mayor polaridad. Ésta CMI, incluso, podía estar por encima de la del extracto crudo. En algunos casos, no se detectó inhibición del crecimiento.
Para ilustrar lo anterior, en la tabla 1 se indican las CMI para cada aislamiento y extracto (mediana de tres repeticiones).
De los datos obtenidos se podría inferir que los compuestos bioactivos son de naturaleza no polar, pues fueron separados en las fracciones con mayor proporción de hexano, como la 2 y 3. Por otra parte, en las fracciones separadas con mayor proporción de acetato de etilo o MeOH, como la 5 y la 6, la menor actividad antifúngica puede atribuirse a una menor concentración de compuestos bioactivos.
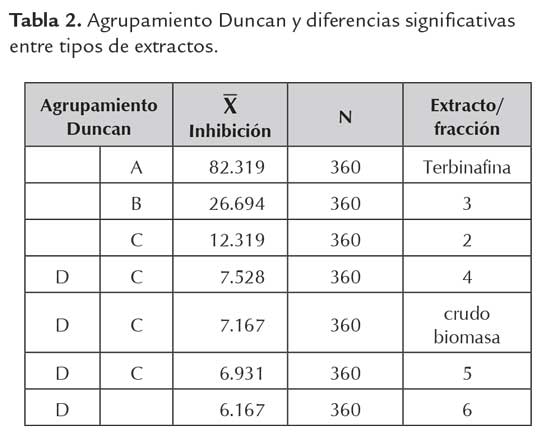
En el análisis estadístico posterior se observa una tendencia similar, al mostrar diferencias significativas en el promedio de porcentaje de inhibición entre las fracciones, en un orden de menor a mayor polaridad, como se ilustra en la tabla 2.
Los resultados podrían interpretarse como contrarios a lo expuesto por Govindachari et al. (1998), quienes reportan que la fracción metanólica obtenida de aceite de A. indica exhibió mayor poder antifúngico frente a Drechslera oryzae, Fusarium oxysporum y Alternaria tenuis que la fracción hexánica. Esto se atribuyó a que dicha fracción contenía mayormente cadenas de ácidos grasos, mientras que en la metanólica se identificaron varios triterpenoides como azadiradiona, nimbina y salanina. En concordancia con lo anterior, este mismo autor (Govindachari et al. 2000), señala también que algunos compuestos puros aislados pueden reducir el crecimiento fúngico por sí solos, como la azadiradiona proveniente de aceite de semillas de neem por HPLC preparativo, al evaluarla frente a Puccinia arachidis.
Por otra parte, los reportes de Suresh et al. (1997) y Mahmoud et al. (2011), indican que la mezcla de ciertas fracciones de extractos de neem aisladas por HPLC exhiben una actividad antifúngica incrementada, respecto a compuestos puros aislados (como nimonol e isomeldenina), sugiriendo entonces un efecto sinérgico entre los triterpenoides presentes en los extractos de A. indica.
Debe tenerse en cuenta que las fracciones evaluadas en este trabajo no son compuestos puros en sí, sino que siguen siendo mezclas complejas de compuestos de polaridad semejante. Ante las diferentes observaciones de otros investigadores, y los resultados de este trabajo, se puede concluir que los compuestos presentes en los extractos de neem, bien provengan de la planta in situ o de cultivos celulares, poseen actividad antifúngica. Con base en los datos de este estudio, se sugiere que dichos compuestos se encuentran en las fracciones de menor polaridad del extracto crudo de biomasa celular.
No obstante, cabe la explicación, aún sin estudios comparativos, de que puede ocurrir un efecto antagónico por la presencia de gran variedad de compuestos en el extracto crudo de biomasa celular, lo que explicaría por qué es menos bioactivo que las fracciones separadas de sí mismo.
Conclusiones
El extracto metanólico de biomasa celular de A. indica puede inhibir el crecimiento de T. mentagrophytes, T.rubrum y E. floccosum, a concentraciones relativamente altas, como lo mostraron CMI mayores a 2500 μg/ mL. Sin embargo, se encontraron fracciones de menor polaridad con mayor actividad antifúngica (CMI=109 μg/mL). Esto indica que en el metabolismo secundario de las células de A. indica cultivadas en suspensión líquida, se producen compuestos bioactivos, tal como ocurre en partes de la planta in situ como hojas y semillas, mencionado por otros autores. Se sugiere que el efecto de estas fracciones es enmascarado en el extracto crudo posiblemente por antagonismo. Se requieren, por lo tanto, procedimientos cromatográficos adicionales para lograr aislar de forma pura los compuestos presentes en el extracto crudo de biomasa celular.
En consideración de que los cultivos de células de A. indica en suspensión pueden ser elicitados para la producción de metabolitos con actividad biológica, como lo señala Orozco-Sánchez (2007), la investigación se debe orientar hacia la obtención de líneas celulares con un metabolismo incrementado en la producción de compuestos de baja polaridad (posiblemente triterpenoides) por su conocida capacidad de inhibir el crecimiento de varios tipos de hongos, incluyendo los dermatofitos.
Agradecimientos
Los autores agradecen el apoyo logístico e investigativo brindado en los Laboratorios de Crecimiento y Desarrollo de las Plantas, Ciencia de los Alimentos, Productos Naturales y Bioconversiones de la Universidad Nacional de Colombia Sede Medellín, y muy especialmente al personal del Laboratorio de Micología Médica de la Facultad de Medicina de la Universidad de Antioquia.
Referencias bibliográficas
1. CLSI. 2008. Reference Method for Broth Dilution Antifungal SusceptibilityTesting of Filamentous Fungi; Approved Standard-Second Edition. CLSI document M38-A2. Wayne, PA: Clinical and Laboratory Standards Institute. [ Links ]
2. Fernández-Torres, B. 2005. Sensibilidad antifúngica de los dermatofitos. Reus, España: Facultat de Medicina i Ciències de la Salut. Universitat Rovira i Virgili. [ Links ]
3. Govindachari, TR.; Suresh, G.; Gopalakrishnan, G.; Banumathy, B.; Masilamani, S. 1998. Identification of antifungal compounds from the seed oil of Azadirachta indica. Phytoparasitica. 26(2): 109-116. [ Links ]
4. Govindachari, TR.; Suresh, UG.; Gopalakrishnan, G.; Masilamani, S.; Banumathi, B. 2000. Antifungal activity of some tetranortriterpenoids.Fitoterapia. 71: 317-320. [ Links ]
5. Jarvis, AP.; Morgan, ED.; Edwards, DC. 1999. Rapid separation of triterpenoids from neem seed extracts. Phytochemical Analysis. 10: 39-43. [ Links ]
6. Kane, J; Summerbell, R; Sigler, L; Krajden, S; Land G. 1997. Laboratory handbook of dermatophytes: a clinical guide and laboratory handbook of dermatophytes and other filamentous fungi from skin, hair, and nails. Belmont, EEUU: Star Publishing Company. [ Links ]
7. Lyer, SR.; Williamson, D. 1991. Efficacy of some plant extracts to inhibit the protease activity of Trichophyton species. Geobios. 18: 3-6. [ Links ]
8. Mahmoud, DA.; Hassanein, NM.; Youssef, KA.; Abou Zeid, MA. 2011. Antifungal activity of different neem leaf extracts and the nimonol against some important human pathogens. Brazilian Journal of Microbiology. 42: 1007-1016. [ Links ]
9. Natarajan, V.; Pushkala, S.; Karuppiah, VP.; Prasad, PV. 2002. Antidermatophytic activity of Azadirachta indica (neem) by in vitro study. Indian Journal of Pathology and Microbiology. 45(3):311-3. [ Links ]
10. Natarajan, V.; Venugopal, PV.; Menon, T. 2003. Effect of Azadirachta indica (neem) on the growth pattern of dermatophytes. Indian Journal of Medical Microbiology. 21(2): 98-101. [ Links ]
11. Okemo, PO.; Mwatha, WE.; Chabrab, SC.; Fabryc, W. 2001. The kill kinetics of Azadirachta indica A. Juss. (Meliacae) extracts on Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa and Candida albicans. African Journal of Science and Technology (AJST) Science and Engineering Series. 2(2), 113-118. [ Links ]
12. Orozco, F.; Vergara, R.; Capataz-Tafur, J.; Hoyos-Sánchez, R. 2007. Efecto antialimentario de los extractos de suspensiones celulares de Azadirachta indica sobre Spodoptera frugiperda J.E. Smith en condiciones de laboratorio. Revista Facultad Nacional de Agronomía. 61: 3703 – 3715. [ Links ]
13. Polaquini, SRB.; Svidzinski, TIE.; Kemmelmeier, C.; Gasparetto, A. 2006. Effect of aqueous extract from Neem (Azadirachta indica A. Juss) on hydrophobicity, biofilm formation and adhesion in composite resin by Candida albicans. Archives of Oral Biology. 51(6): 482-490. [ Links ]
14. Rebell, G; Taplin, D. 1979. Dermatophytes, their recognition and identification. Coral Gables, EEUU: University of Miami Press. Roseeuw, D. 1999. Achilles foot screening project: preliminary results of patients screened by dermatologists. Journal of European Academy Dermatology. 12: S6-9. [ Links ]
15. Suresh, G.; Narasimhan, NS.; Masilamani, S.; Partho, RD.; Gopalakrishnan, G. 1997. Antifungal fractions and compounds from uncrushed green leaves of Azadirachta indica. Phytoparasitica. 25(1): 33-39. [ Links ]