Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.16 no.2 Bogotá July/Dec. 2014
https://doi.org/10.15446/rev.colomb.biote.v16n2.47248
http://dx.doi.org/10.15446/rev.colomb.biote.v16n2.47248
ARTÍCULO CORTO
Inducción de callos embriogénicos y formación de proembriones somáticos en Pterogyne nitens Tull "tipa colorada"
Embriogenic calli induction and somatic proembryo formation in Pterogyne nitens Tull
Maritza Vacca Molina1, María Luisa Cristina Bonomo2, Zulma Avilés3, Lucía Díaz4
1Ing. Agr. Ms. Sc. Cátedra de Fisiología Vegetal. Facultad de Ciencias Naturales. Universidad Nacional de Salta.maritzavaccamolina@yahoo.com.ar
2 Lic. en Cs. Biológicas. Cátedra de Introducción a la Biología. Facultad de Ciencias Naturales. Universidad Nacional de Salta. mbonomo@unsa.edu.ar
3 Lic. en Cs. Biológicas. Cátedra de Fisiología Vegetal. Facultad de Ciencias Naturales. Universidad Nacional de Salta. zulmaviles_3@hotmail.com
4 Ing. Agr. Dr. en Agronomía. Cátedra de Caña de Azúcar. Facultad de Agronomía y Zootecnia. Universidad Nacional de Tucumán. luciapdiaz@yahoo.com
Recibido: enero 31 de 2014 Aprobado: octubre 20 de 2014
Resumen
Pterogyne nitens es un árbol que crece en bosques húmedos del Norte de la Argentina. Por su calidad maderera la especie se utiliza en forestación, reforestación o enriquecimiento de bosques nativos. Una alternativa a los métodos convencionales de propagación son las técnicas de cultivo de tejidos vegetales mediante el uso de la embriogénesis somática. El objetivo del presente trabajo es inducir la formación de callos embriogénicos y la obtención de proembriones somáticos evaluando la influencia del tipo de explanto, tipo y concentración de reguladores de crecimiento y composición del medio basal. Para la inducción de callos embriogénicos se utilizan explantos extraídos de hojas cotiledonares, foliolos, tallos y raíces de plántulas de dos meses de edad. Se emplean tres medios de cultivos MSC, MS50 y MSMOD. Cada medio de cultivo se suplementa con 2,4-D ó ANA en distintas concentraciones. A los 45 días los explantos provenientes de hojas cotiledonares en los medios de MSC con 2,4-D en concentraciones de 67.87, 107.41, 113.12, 135.74 y 180.99 μM, se logra en mayor proporción la formación de masas callosas amarillas. Con 107.41 μM de 2,4-D en el medio MSC se observa la formación de estructuras proembrionarias. Los segmentos radiculares en todos los tratamientos evaluados, no desarrollan callos.
Palabras clave: Tipa colorada, micropropagación, embriogénesis, forestales, leguminosa.
Abstract
Pterogyne nitens is a tree that grows in wet forests of Northern Argentina. Due to its quality timber especies are used in afforestation, reforestation or enrichment of native forests. An alternative to conventional methods of propagation is the techniques of plant tissue using somatic embryogenic. The aim of this study is to induce the formation of embryogenic callus and of somatic obtaining proembryos, evaluating the influence of type of explant, type and concentration of growth regulators and composition of the basal medium. For induction of embryogenic callus from explants extracted cotyledonary leaves, leaflets, stems and roots of seedling of two months old are used. Three means of MSC culture, MS50 and MSMOD are also used. Each culture medium is supplemented with 2,4-D at different concentration or ANA. After 45 days the explants from cotyledon leaves in MSC media supplement with 2,4-D at concentrations of 67.87, 107.41, 113.12, 135.74 and 180.99 μM, promote greater proportion of yellow callus formation masses. With 107.41 μM 2,4-D proembryos structures formation are observed. The root segments in all treatment tested, do not develop calluses.
Key words: Tipa colorada, micropropagation, embryogenesis, forestry, legume.
Introducción
La "tipa colorada" (Pterogyne nitens) pertenece a la familia Fabaceae, subfamilia Caesalpinoideae. El nombre vulgar de la misma varía de acuerdo al país de origen: en Bolivia es conocida como "ajunau", en Paraguay como "yvyrar" y en Brasil se la llama "amendoim". En Argentina entre las denominaciones figuran "virar", "tipa colorada" y "tipilla" (Dimitri et al., 2000). Su área de distribución geográfica abarca los países de Bolivia, Brasil, Paraguay, Uruguay y Argentina.
Es un árbol que crece en ambientes húmedos y alcanza los 25 m de altura, de tronco recto y cilíndrico con unos 90 cm de diámetro y fuste de 6 a 8 m; tiene corteza tánica, con tinte rojizo en las grietas. Su madera posee un veteado parecido al de la caoba y ha sido clasificada como madera dura o semidura. Cuando se la somete a un secado lento, no presenta deformaciones o rajaduras, manchas ni ataque de insectos.
Esta especie, de gran calidad maderera, es apta para ser utilizada en planes de forestación, reforestación o enriquecimiento de los bosques naturales del noroeste argentino, que han sufrido intensas explotaciones (Del Castillo et al., 1997; Dimitri et al., 2000). Entre sus usos se mencionan el empleo de la madera para la fabricación de muebles de estilo (Dimitri et al., 2000), herramientas como arados, bateas, mangos de hachas y utensilios de cocina (Moraes et al., 2006). Como producto forestal no maderero se incluye su uso ornamental y como fuente de extracción de tanino, tintas, alimentos y medicinas. Como medicina, se destaca su empleo como expectorante, antigripal y para combatir la presencia de parásitos, el dolor de hígado y estómago. En estudios fitoquímicos, se aislaron cinco alcaloides guanidínicos de las hojas y tallos, los cuales mostraron una importante actividad antitumoral; de los extractos de flores fueron aislados e identificados cuatro flavonoides, con acción antiinflamatoria (Regasini et al., 2008).
Según del Castillo et al.(1997) la explotación de los bosques de la Selva de Yungas (Jujuy, Salta y Tucumán) se inició entre los siglos XVI y XIX intensificándose en años posteriores, lo que produjo el agotamiento del bosque. El remanente de la selva pedemontana mantiene el aspecto de selva, pero su valor forestal actual y potencial es casi nulo. Entre las especies más buscadas en las áreas pedemontanas se encuentra la tipa colorada, considerándose una especie amenazada por pérdida de área (Pece et. al., 2010). En Brasil, la madera de P. nitens es utilizada en forma indiscriminada para la construcción civil. En consecuencia, por tratarse de un género monoespecífico, esta leguminosa se encuentra seriamente amenazada de extinción (Regasini et al., 2008, Oliveira et al., 2006).
Hasta el presente no se ha reportado para esta especie un programa de selección de individuos élites y menos aún un esquema de mejoramiento. En la propagación vía sexual, se informan altos porcentajes de germinación con tratamientos de escarificación (Pece et. al., 2010); por la vía vegetativa mediante enraizamiento de esquejes no hay información disponible. Avilés et al. (2009) utilizando técnicas de cultivo de tejidos vegetales logra la inducción y desarrollo de yemas axilares, con bajo porcentaje de enraizamiento. La embriogénesis somática (ES) se considera para las especies forestales, como la vía de regeneración más adecuada ya que ofrece la posibilidad de una alta tasa de producción de propágulos, criopreservación de callos embriogénicos, rejuvenilización, producción de semilla sintética y la utilización de cultivos embriogénicos en transformación genética (Peña-Ramírez et al., 2011). Se basa en el principio de la formación de un embrión a partir de células somáticas diferentes a un gameto o al producto de la unión de gametos. En la naturaleza se la conoce como una forma de apomixis, la cual recibe el nombre de embrionía adventicia (Merkle, 1995). Los embriones somáticos bipolares se asemejan a embriones sexuales, se desarrollan de manera similar y atraviesan todos los estadios de la embriogénesis, son genéticamente idénticos al progenitor y germinan dando origen a una plántula completa sobre un sustrato. Es requisito que se genere material fiel al donante sin variabilidad intraclonal y, fundamentalmente para el sector forestal, que sea susceptible de automatización para reducir los costes de producción (Celestino et. al., 2005).
La embriogénesis somática ha sido reportada en varias especies, Pinus pinea (Carneros et al., 2009); Quercusrubra (Vengadesan y Pijut, 2009), Quercus suber (Hernández et al., 2011); Acrocomia aculeata (Ferreira Moura et al., 2008); Eucalyptus sp. (Pinto et al., 2008); Cupresssus sempervirens L. (Giovanelli y Carlo, 2007); Melia azedarach (Sharry et al., 2006); leguminosas (Marinucci et al., 2004); Araucaria angustifolia (Santos et al., 2002), Coffea canephora (López Gómez et al., 2010), Hevea brasiliensis (Lardet et al., 2009), Vitis sp. (Gambino et al., 2007 ; Tsvetkov et al, 2014 ), Picea abies (Businge et al., 2012), Phoenix dactylifera (Kurup et al., 2014) etc.; sin embargo, aún no se encontraron estudios que informen su aplicación en Pterogyn enitens. Debido a la importancia económica, de conservación y difusión de esta especie, el estudio de la ES constituye un aporte al conocimiento, tendiente a generar protocolos viables de propagación. El objetivo del presente trabajo fue inducir la formación de callos embriogénicos y la obtención de proembriones somáticos en tipa colorada mediante la elección del tipo de explanto, tipo y concentración de reguladores de crecimiento y composición del medio basal.
Materiales y métodos
Material vegetal y desinfección
Para los distintos experimentos se emplearon frutos maduros recolectados de la localidad de Orán (Salta, Argentina) entre los meses de mayo y junio de los años 2011 y 2012. Las semillas se extrajeron de los frutos, se sometieron a desinfección superficial mediante lavado en una solución de detergente y agua en agitación a una velocidad de 250 rpm durante 30 min, enjuagándose con agua corriente. Posteriormente las semillas estuvieron en inmersión en alcohol etílico al 70 % (v/v), durante 2 min, seguida de una solución de hipoclorito de sodio (NaOCl) al 10 % (p/v), preparada a partir de un producto comercial conteniendo 55g/L de cloro activo, con el agregado de tres gotas de Tween 20® por litro de solución durante 10 min. Luego se enjuagó cinco veces con agua destilada estéril.
La desinfección se completó en condiciones de asepsia, en cámara de flujo laminar. Las semillas desinfectadas fueron incubadas en el medio de cultivo de Murashige y Skoog (1962) (MS) reducido en macro y micronutrientes al 50% de su concentración salina original (MS50), solidificado con 5 g/L de agar (Sigma ®), suplementado con 0.1 g/L de myo-inositol, vitaminas de MS (0.5 mg/L de ácido nicotinico, 0.5 mg/L de piridoxina-HCl, 0.1 mg/L de tiamina-HCl y 2 mg/L de glicina) y 30 g/L de sacarosa. El pH se ajustó a 7 antes de la adición del agente solidificante. La corrección del pH se realizó con KOH o con H3PO4. El medio se esterilizó en autoclave a 15 libras de presión (PSi) a 121ºC, durante 20 min.
Después de establecer las semillas en medio de cultivo, se incubaron durante 60 días bajo iluminación
fluorescente a 25 μmol m-2 s-1 con un fotoperiodo de 16 horas y a 25 ± 2°C. A partir de plántulas obtenidas por esta vía, se seccionaron diferentes tipos de explantos: hojas cotiledonares, explantos foliares, segmentos caulinares y radiculares; los cuales se utilizaron en los ensayos realizados en el presente trabajo.
Inducción de callos y proembriones somáticos
Para la inducción de callos se utilizaron tres medios de cultivo basados en la fórmula salina de MS. Se denominó MSC al medio con la fórmula original completa, MS50 al medio en el que se redujo la concentración de todos los macro y micronutrientes a la mitad y MSMOD al medio modificado en NH4NO3 (825 mg/L) y KNO3 (950 mg/L) con las sales restantes al 100% de su formulación original. Los medios fueron solificados con 2 g/L de Phytagel (Sigma ®), suplementado con 0.1 g/L de myo-inositol, 0.5 g/L de caseína hidrolizada (Sigma ®) y 30 g/L de sacarosa (Neolab ®). El pH se ajustó a 7 antes de la adición del agente solidificante. El medio se esterilizó en autoclave a 15 libras de presión (PSi) a 121ºC, durante 20 min. Cada medio de cultivo se suplementó con 2,4-D (ácido 2,4 diclorofenoxiacético) en concentraciones de 67.87, 107.41, 113.12, 135.74, 180.99 y 226.24 μM ó ANA (ácido naftalenacético) en concentraciones de 53.70, 80.56, 107.41 y 134.26 μM. Se generaron treinta tratamientos (con reguladores de crecimiento) y tres tratamientos testigos (sin reguladores de crecimiento y para cada composición salina ensayada) (tabla 1). Todos estos tratamientos se aplicaron sobre los distintos tipos de explantos y en las tres bases salinas consideradas.
A los 45 días, se evaluó el porcentaje (%) de formación de masas callosas en los distintos tipos de explantos empleados. Los experimentos se condujeron en un diseño completamente aleatorizado (DCA), con treinta repeticiones por tratamiento, con 4 explantos en cada unidad experimental. Los cultivos se incubaron en cámara de cría en oscuridad a 25±2 °C y se repicaron en los mismos medios cada 20 días. El porcentaje de formación de callos se analizó con el paquete Estadístico InfoStat (Di Rienzo et. al., 2011) empleándose la prueba no paramétrica de Kruskal Wallis (p≤ 0.05) para comparar los mismos.
Estudios histológicos
El carácter embriogénico de los callos fue determinando mediante análisis histológico. Las muestras de tejidos que desarrollaron callos se fijaron en FAA (paraformaldehido al 35%, ácido acético glacial y etanol al 70% (1:1:9)(v/v/v); posteriormente se deshidrataron en una serie de alcoholes (70°, 80°, 90°, 96°, 100° y xilol) y se incluyeron en Paraplast (D'Ambrogio de Argüeso, 1986). Se obtuvieron cortes de 8 μm con un micrótomo de rotación marca Minot. Se realizaron dos tipos de tinciones, una con Safranina - Fast Green y otra con el colorante Violeta de Cresilo. Se realizaron las observaciones con microscopio óptico.
Las muestras tomadas para microscopía electrónica fueron fijadas y deshidratadas, se les realizó secado por punto crítico CO2 y fueron metalizadas con oro.
Las observaciones y fotografías se realizaron con microscopio electrónico de barrido (MEB) JEOL modelo JSM 5480 LV perteneciente al Laboratorio de Microscopía Electrónica de Barrido de la Universidad Nacional de Salta (LASEM).
Resultados y discusión
Material vegetal y desinfección
La germinación de semillas de especies forestales en condiciones in vitro permite obtener material vegetal con adecuado estado fitosanitario. En el presente trabajo, el porcentaje de germinación alcanzado en condiciones in vitro fue del 90 %, similar al obtenido en condiciones de campo. A diferencia del protocolo de germinación propuesto por Peres Biruel et al., (2007), en el presente trabajo, la escarificación química de las semillas no fue necesaria. El medio de cultivo utilizado no afectó la capacidad de germinación de las semillas. El éxito de los sistemas de propagación de plantas por biotecnología depende en gran medida del control y la prevención de la contaminación microbiana. En este ensayo, la contaminación registrada fue del 1 %, lo que indica que el protocolo de desinfección de semillas para la obtención de plantas asépticas fue adecuado. Oliveira do Nascimento et al. (2006) informa en semillas, la presencia de siete géneros de hongos, siendo Aspergillus sp. y Penicillium sp. los que tuvieron mayor porcentaje de ocurrencia, los cuales tienden a perjudicar la calidad de la semilla por pérdida de viabilidad. En el presente ensayo, no se detectó la presencia de hongos patógenos que afecten la germinación.
Inducción de callos y de proembriones somáticos
La composición salina de los medios (MS, MS50 y MSMOD) influye sobre la respuesta de los explantos, detectándose diferencias estadísticas significativas (H=27,48 n=99 p<0,0001). Cuando se utilizó el medio MSC, que contiene el 100 % de sales de Murashige y Skoog, se favoreció la formación de callos. El medio MS provee los seis nutrientes principales (N, P, K, Ca, Mg y S) y constituye uno de los factores claves en la morfogénesis in vitro, de manera que una reducción en su concentración puede afectar el desarrollo morfogenético (Ramage y Williams 2002). En Pinus pinea la ES es dependiente de la composición nutritiva del medio (Carneros et al., 2009). En el presente trabajo, la reducción del contenido de nitrógeno en el medio (MS50 y MSMOD) no favoreció la respuesta callogénica de los explantos. Así, la importancia del abastecimiento de nitrógeno durante la embriogénesis puede ser un reflejo de los requerimientos de nitrógeno por la continua síntesis de proteínas, ácidos nucleícos y sustancias de reserva (Merkle 1995).
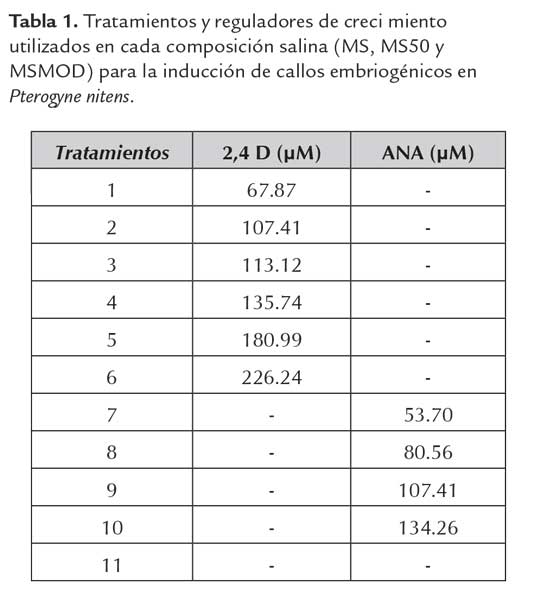
Los explantos provenientes de hojas cotiledonares generaron una mayor formación de masas callosas cuando se los cultivó con 2,4-D en concentraciones de 67.87, 107.41, 113.12, 135.74 y 180.99 μM disminuyendo para la concentración de 226.24 μM, asimismo se observó formación de callo solo para la menor concentración de ANA (53.70 μM). Para segmentos foliares y tallo se observó una menor formación de masas callosas con el incremento de la concentración de 2,4-D (figura 1) arrojando diferencias estadísticas significativas (H=8.79 n=99 p=0,0041).
Por el contrario, los segmentos radiculares en todos los tratamientos evaluados, resultaron ineficaces para la generación de callos; la respuesta nula obtenida con este tipo de explantos se debe a que en estos tejidos las células no fueron capaces de asumir actividad meristemática y por tanto no respondieron a ninguna de las concentraciones de 2,4-D y perecieron. A pesar de que cualquier parte de la planta es factible de emplearse como explanto, no todos los tejidos tienen la totipotencia celular para responder a estímulos externos que disparan la competencia para generar callos, en un inicio, y posteriormente, la organogénesis o embriogénesis somática (Hernández Meneses et al., 2013).
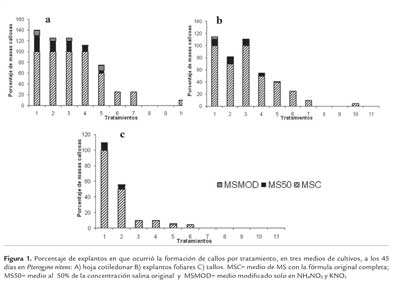
Los reguladores de crecimiento y las concentraciones utilizadas, presentaron diferencias estadísticas significativas (H=140,78 n= 27 p <0,0001). El 2,4-D promovió en todos los casos, la formación de masas callosas amarillas las cuales comenzaron en las zonas de corte de los segmentos empleados (figura 2). Los cortes histológicos de hojas cotiledonares muestran el inicio de la formación de callos en la región de corte (figura 3A). Los callos formados cubrieron la totalidad de los segmentos cotiledonares (figura 3B) y foliares. Una respuesta similar en cotiledones es reportado por Marinucci et al., 2004, en cinco leguminosas forestales. El utilizado para la inducción de la ES (Gaj 2004). Sobre las células del explanto, funciona como una sustancia inductora de estrés más que una fitohormona y en respuesta al estrés éstas adquieren capacidad embriogénica en diferentes grados, debido a la expresión de genes específicos de la embriogénesis (Kikuchi et al., 2006). El 2,4-D es más efectivo en la inducción de la embriogénesis somática que el AIA endógeno, debido a que la auxina artificial no se puede metabolizar en las células vegetales (Stasolla et al., 2004).
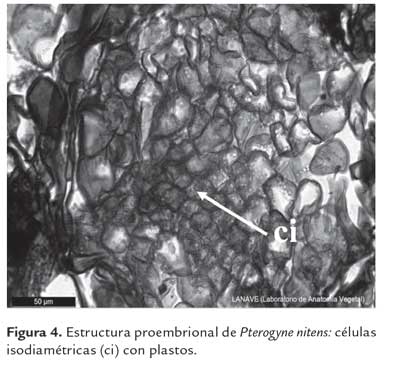
Las hojas cotiledonares y fragmentos de foliolos fueron los explantos que desarrollaron callos de consistencia frágil y coloración amarillenta o lechosa, en los cuales mediante histología se verifica la presencia de células meristemáticas con alto contenido de almidón (figura 4). Una observación similar fue informada por Deo et al. (2009) en Colocasia esculenta var. esculenta, los cuales encontraron en callos nodulares de color amarillo cremoso dos tipos de células: pequeñas células isodiamétricas con grandes núcleos y citoplasma denso, típicas de células embriogénicas y células parenquimáticas vacuoladas conteniendo pocos plástidos típicas de células no embriogénicas. Según Salinas (1990), los callos embriogénicos tienen una coloración amarillenta o amarillo verdosa, de forma amorfa o nodular y de consistencia frágil y están constituidos por células isodiamétricas con abundantes gránulos de almidón. El análisis de los callos al MEB muestra la consistencia de los mismos. Los callos friables considerados embriogénicos, mostraron una superficie desorganizada pero con cierto grado de compactación entre las células (figura 5 A). La presencia de células isodiamétricas en estos callos, concuerda con las observaciones realizadas por Peña Ramírez et al. (2011), para callo embriogénico en Cedrela odorata. Mientras que los callos no embriogénicos se caracterizaron por presentar células alargadas, sin uniones entre ellas, con una desorganización total del tejido (figura 5 B).
Los explantos caulinares desarrollaron callos no embriogénicos traslúcidos, que se disgregan fácilmente (figura 2 C, 5 B). Las secciones radiculares generaron escasas masas callosas, las que con el transcurso del tiempo se oxidaron (figura 2 D).
En los tratamientos suplementados con ANA la presencia de callos embriogénico fue escasa a nula. El tipo y la concentración de auxinas es un factor crítico para la inducción y formación de embriones somáticos (Sharry et al., 2006).
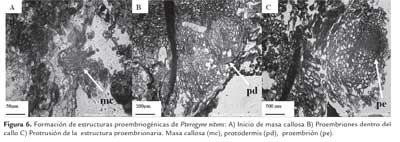
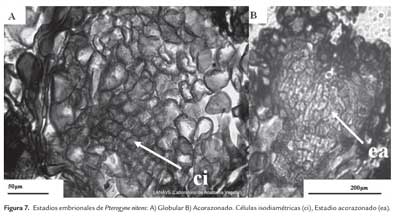
En los explantos cotiledonares los tratamientos suplementados con 2,4-D en concentraciones de 107.41, 113.12 y 135.74 μM se observó el desarrollo de masas proembriogénicas (figura 6) siendo el primero de estos valores, el que reveló la formación de ES (figura 7). El nivel endógeno de hormonas es uno de los factores cruciales que influyen en el potencial embriogénico de los explantos. En Arabidopsis thaliana se ha encontrado que tanto los primordios cotiledonares como los cotiledones tienen altos niveles de auxina endógena los cuales se correlacionan con la alta competencia
embriogénica exhibida por estos tejidos (Gaj 2004).
En soja, Bermúdez Caraballoso et al. (2012), informan que el incremento en la respuesta embriogénica como resultado de la exposición a 2,4-D exógeno, está asociada con un incremento de los niveles de AIA endógeno, lo cual sugiere que la auxina sintética 2,4-D tiene un efecto indirecto significativo sobre la embriogénesis somática posiblemente debido a disturbios causados sobre el metabolismo de la auxina endógena. En nuestro estudio, la observación de diferentes tipos de callos (embriogénico y no embriogénico) puede ser debida a cambios en el medio de cultivo atribuibles a la degradación hormonal, absorción diferencial de los nutrientes del medio y estrés osmótico.
En Colocasia esculenta var. esculenta, las estructuras embriogénicas generalmente están localizadas en la periferia de las masas callosas distribuidas en grupos, entremezcladas con grandes células parenquimáticas (Deo et al., 2009). Samaj et al. (2003), describe en maíz una estructura globular a la que denomina 'pre-embryogenic units', rodeada por grandes células parenquimáticas las cuales podrían estar actuando como "células nodrizas". Al igual que lo reportado para Cedrela odorata L. (Peña Ramírez et al., 2011), las masas celulares presentaron diferentes grados de organización, con múltiples zonas meristemáticas, incluyendo proembriones con presencia de protodermis, y estructuras embrionarias globulares. Se observaron los estadios globulares y acorazonado, sin embargo no se registró sincronía durante el proceso inductivo desarrollado (figura 7).
La incubación de los cultivos en oscuridad es considerada necesaria para la formación de callos embriogénicos que luego dan lugar a embriones somáticos bien formados en Strelitzia reginae (Arzate Fernández et al., 2008) y Cydonia oblonga (Morini et al., 2000). El efecto del 2,4-D podría estar relacionado con la inducción de la respuesta morfogenética, ya que la degradación de esta auxina es más lenta cuando los explantos se incuban en oscuridad (Arzate Fernández et al., 1998). En los ensayos no se observó necrosis tisular por producción de compuestos fenólicos, por lo tanto, no fue necesaria la inclusión de carbón activado ni de antioxidantes en los medios de cultivos.
Una variedad de factores modifican las respuestas morfogenéticas observadas en los explantos cultivados in vitro. Todos estos factores pueden resumirse en el término "control fisiológico", haciendo referencia a los factores físicos y químicos que se encuentran dentro de las células o en el ambiente que rodea a las células, modificando las respuestas morfogenéticas, dentro de los límites genéticos o restricciones epigenéticas.
Conclusiones
Se logró la formación de proembriones de tipa colorada (Pterogyne nitens Tull.) a partir de la inducción de callos embriogénicos provenientes de explantos de hojas cotiledonares. El medio MSC con 107.41μM de 2,4-D favorece la inducción de callos embriogénicos con capacidad de formación de embriones somáticos. Se continúa trabajando para la obtención de embriones totalmente diferenciados.
Agradecimientos
Al Consejo de Investigación de la Universidad Nacional de Salta quien financió este trabajo y a la Lic. Marcela Hernández, Dra. Virginia Martínez, Dra. Olga Martínez y Lic. María Inés Irazusta por la permanente colaboración brindada.
Referencias bibliográficas
1. Arzate Fernández, A. M.; Nakazaki, T.; Tanisaka, T. 1998. Production of diploid and triploid interspecific hybrids between Lilium concolor and L. longiflorum by ovary slice culture. Plant Breeding. 117: 479-484. [ Links ]
2. Arzate Fernández, A. M.; Piña Escutia, J. L.; Zavaleta, H. A. 2008. Inducción de proembriones somáticos en ave de paraíso (Strelitzia reginae Banks). Revista Fitotecnia Mexicana. 31: 183-186. [ Links ]
3. Avilés, Z.; Vacca Molina, M.; Bonomo de Villa, M.L.C. 2009. Establecimiento in vitro de Tipa Colorada (Pterogyne nitens Tull.). VII Simposio Nacional de Biotecnología REDBIO-Argentina. 20 -24 abril de 2009, Rosario, Santa Fe, Ediciones Instituto Nacional de Tecnología Agropecuaria, p 88. [ Links ]
4. Bermúdez Caraballoso, I.; Blanco, T.; Pérez Pérez, J.; García, L. R.; Veitía, N.; Collado, R.; Torres, D.; Romero, C. 2012. Efecto de la concentración de 2,4-D en la formación de embriones somáticos en variedades cubanas de soya. Biotecnología Vegetal. 12(2) : 93 - 97. [ Links ]
5. Businge, E.; Brackmann, K.; Moritz, T.; Egertsdotter, U. 2012. Metabolite profiling reveals clear metabolic changes during somatic embryo development of Norway spruce (Picea abies). Tree physiology. 32 (2): 232-244. [ Links ]
6. Carneros, E.; Celestino, C.; Klimaszewska, K.; Park, Y.; Toribio, M.; Bonga, J. M. 2009. Plant regeneration in Stone pine (Pinus pinea L.) by somatic Embryogenesis. Plant Cell Tissue and OrganCulture. 98: 165–178. [ Links ]
7. Celestino, C.; Hernández, I.; Carneros, E.; López Vela, D.; Toribio, M. 2005. La embriogénesis somática como elemento central de la biotecnología Forestal. Investigación Agraria: Sistemas yRecursos Forestales. 14 (3): 345-357. [ Links ]
8. D'Ambrogio de Argüeso, A. 1986. Manual de técnicas en histología vegetal. Editorial Hemisferio Sur S.A. Buenos Aires, Argentina, p 83. [ Links ]
9. Del Castillo, E. M.; Gil, M. N.; Terán, M.; Cravero, S.; Zapater, M. A.1.997. "Tipa colorada": su autoecología. Resúmenes del primer taller internacional de recursos filogenéticos del Noroeste argentino. Salta. Argentina. [ Links ]
10. Deo, P.; Harding, R.; Taylor, M.; Tyagi, A.; Becker, D. 2009. Somatic embryogenesis, organogenesis and plant regeneration in taro (Colocasia esculenta var. esculenta). Plant Cell Tissue and Organ Culture. 99: 61–71. [ Links ]
11. Di Rienzo, J. A.; Casanoves, F.; Balzarini, M. G.; Gonzalez, L.; Tablada, M.; Robledo, C.W. 2011. Infostat versión 2010. Grupo Infostat, Universidad Nacional de Córdoba, Argentina. [ Links ]
12. Dimitri, M. J.; Leonardis, R. F.; Biloni, J. S. 2000. El nuevo libro del árbol. Especies forestales de la Argentina oriental. Tercera edición. Tomo II. Ed. El Ateneo. Buenos Aires, p120. [ Links ]
13. Ferreira Moura, E.; Contin Ventrella, M.; Yoshimitsu Motoike, S.; de Sá Júnior, A. Q.; Carvalho, M.; Manfio, C. E. 2008. Histological study of somatic embryogenesis induction on zygotic embryos of macaw palm (Acrocomia aculeata (Jacq.) Lodd. ex Martius). Plant Cell Tissue and Organ Culture. 95: 175–184. [ Links ]
14. Gaj, M. D. 2004. Factors influencing somatic embryogenesis induction and plant regeneration with particular reference to Arabidopsis thaliana (L.) Heynh. Plant Growth Regulator. 43: 27-47. [ Links ]
15. Gambino, G.; Ruffa, P.; Vallania, R.; Gribaudo, I. 2007. Somatic embryogenesis from whole flowers, anthers and ovaries of grapevine (Vitis spp.). Plant Cell Tissue and Organ Culture. 90 (1): 79-83. [ Links ]
16. Giovanelli, A.; Carlo, A. 2007. Micropropagation of Mediterranean cypress (Cupressus sempervirens L.). Protocols for Micropropagation of Woody Trees and Fruits. Part 1: 93-105, doi: 10.1007/978-1-4020-6352-7_9. [ Links ]
17. Hernández, I.; Cuenca, B.; Carneros, E.; Alonso Blázquez, N.; Ruiz, M.; Celestino, C.; Ocaña, L.; Alegre, J.; Toribio, M. 2011. Application of plant regeneration of selected Cork Oak tree by somatic embryogenesis to implement multivarietal forestry for cork production.Tree and Forestry Science and Biotechnology. 5 (1): 19-26. [ Links ]
18. Hernández Meneses, E.; López Peralta, M. C. G.; Estrada Luna, A. A. 2013. Callogénesis de Heliconia collinsiana GRIGGS in vitro: establecimiento, inducción y proliferación. Revista Mexicana de Ciencias Agrícolas. 4 (8): 1175-1186. [ Links ]
19. Kikuchi, A.; Sanuky, N.; Higashi, K.; Koshib, T.; Kamada, H. 2006. Abscisic acid and stress treatment are essential fot the adquisition of embryogenic competence by carrot somatic cells. Planta. 40: 211-216. [ Links ]
20. Kurup, S.; Aly, M.; Lekshmi, G.; Tawfik, N. 2014. Rapid in vitro regeneration of date palm (Phoenix dactylifera L.) cv. Kheneizi using tender leaf explant. Emirates Journal of Food and Agriculture. 26 (6), doi-10. [ Links ]
21. Lardet, L.; Dessailly, F.; Carron, M. P.; Montoro, P.; Monteuuis, O. 2009. Influences of aging and cloning methods on the capacity for somatic embryogenesis of a mature Hevea brasiliensis genotype. Tree physiology. 29 (2): 291-298. [ Links ]
22. López Gómez, P.; Iracheta Donjuan, L.; Castellano Juárez, M.; Méndez López, I.; Sandoval Esquivez, A.; Aguirre Medina, J.; Ojeda Zacarías, M.; Gutiérrez Díez, A. 2010. Influencia del explante y medio de cultivo en la embriogénesis somática en hojas de café. Revista Fitotecnia Mexicana. 33 (3): 205-213. [ Links ]
23. Marinucci, L.; Ruscitti, M.; Abedini, W. 2004. Morfogénesis in vitro de leguminosas forestales nativas de la República Argentina.Revista de la Facultad de Agronomía, La Plata. 105 (2).24. [ Links ]
24. Merkle, S. A. 1995. Strategies for dealing with limitations of somatic embryogenesis in hardwood trees. In Vitro Cellular and Developmental Biology A. 31, p. 6. [ Links ]
25. Moraes, M. R.; Ollgaard, B.; Kvist, L. P.; Borchsenius, F.; Balslev, H. 2006. Botánica Económica de los Andes Centrales. Universidad Mayor de San Andrés. La Paz. 533 pp. [ Links ]
26. Morini, S.; D'onofrio, C.; Bellocchi, G.; Fisichella, M. 2000. Efect 2,4D and light quality on callus production and differentiation from in vitro culture quince leaves. Plant Cell Tissue and OrganCulture. 63: 47-55. [ Links ]
27. Murashige, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiology Plantarum. 15: 473-497. [ Links ]
28. Oliveira do Nascimento, W. M.; Cruz, E. D.; Duarte Moraes, M. H.; Machado Menten, J. O. 2006. Qualidade sanitária e germinação de sementes de Pterogyne nitens Tull. (Leguminosae - Caesalpinoideae). Revista Brasilera de Sementes. 28 (1): 149-153. [ Links ]
29. Pece, M.; Gaillard, C.; Acosta, M.; Bruno, C.; Saavedra, S. 2010. Tratamientos pregerminativos para tipa colorada (Pterogyne nitens Tul.). Foresta Veracruzana. 12 (1): 17-25. [ Links ]
30. Peña Ramírez, Y. J.; García Sheseña, I.; Hernández Espinoza, A.; Domínguez Hernández, A.; Barredo Pool, F. A.; González Rodríguez, J. A.; Robert, M. 2011. Induction of somatic embryogenesis and plant regeneration in the tropical timber tree Spanish red cedar [Cedrela odorata L.(Meliaceae)]. Plant Cell Tissue and Organ Culture. 105: 203–209. [ Links ]
31. Peres Biruel, R.; Borba Filho, A. B.; de Araújo, E. C. E.; Fraccaro, F.; de Andrade, S.; Perez, C. J. G. 2007. Efeitos do condicionamento seguido ou não de secagem em sementes de Pterogyne nitens Tul. sob estresse. Ciência Florestal, Santa Maria. 17 (2): 119-128. [ Links ]
32. Pinto, G.; Silva, S.; Park, Y. S.; Neves, L.; Araujo, C.; Santos, C. 2008. Factors influencing somatic embryogenesis induction in Eucalyptus globulus Labill.: basal medium and anti-browning agents. Plant Cell Tissue and Organ Culture. doi:10.1007/s11240-008-9418-5. [ Links ]
33. Ramage, C. M.; Williams, R. 2002. Mineral nutrition and plant morphogenesis. In Vitro Cellular &Develomental Biology Plant. 38: 116-124. [ Links ]
34. Regasini, L.; Fernandes, D. C.; Castro Gamboa, I.; Siqueira Silva, D. H.; Furlan, M.; da Silva Bolzani, V.; Barreiro, E. J.; Monteiro Cardoso Lopes, E.; Marx Young, M. C.; Brandão Torres, L.; Rebuglio Vellosa, J. C.; Mascarenhas de Oliveira, O. M. 2.008. Constituintes químicos das flores de Pterogyne nitens (Cesalpinoideae). Quimica Nova. 31 (4): 802-806. [ Links ]
35. Salinas, R. 1990. Inducción de embriogénesis somática en camote (Ipomoea batatas Lam). Universidad Nacional Agraria La Molina. 51 p. [ Links ]
36. Samaj, J.; Baluska, F.; Pretova, A.; Volkmann, D. 2003. Auxin deprivation induces a developmental switch in maize somatic embryogenesis involving redistribution of microtubules and actin filaments from endoplasmic to cortical cytoskeletal arrays. Plant Cell Reports. 21: 940–945. [ Links ]
37. Santos, W. A. L.; Silveira, V.; Steiner, N.; Vidor, M.; Guerra, M. P. 2002. Somatic Embryogenesis in Parana Pine (Araucaria angustifolia (Bert.) O. Kuntze). Brazilian archives of Biology and Technology. 45 (1): 97 – 106. [ Links ]
38. Sharry, S.; Cabrera Ponce, J. L.; Herrera Estrella, L.; Rangel Cano, R. M.; Lede, S.; Abedini, W. 2006. An alternative pathway for plant in vitro regeneration of chinaberry -tree Melia azedarach L. derived from the induction of somatic embryogenesis. Electronic Journal of Biotechnology. 9 (3): 0-0. [ Links ]
39. Stasolla, C.; Bozhkov, P. V.; Chu, T. M.; van Zyl, L.; Egertsdotter, U.; Suarez, M. F.; Craig, D; Wolfinger, R.; Von Arnold, S.; Sederoff, R. R. 2004. Variation in transcript abundance during somatic embryogenesis in gymnosperms. Tree Physiology. 24 (10): 1073-1085. [ Links ]
40. Tsvetkov, I.; Dzhambazova, T.; Kondakova, V.; Batchvarova, R. 2014. In vitro long-term storage and regeneration of Bulgarian Grapevine Variety "Velika" via repetitive somatic embryogenesis. Universal Journal of Plant Science. 2 (2): 48-51. DOI: 10.13189/ ujps.2014.020204. [ Links ]
41. Vengadesan, G.; Pijut, P. M. 2009. Somatic embryogenesis and plant regeneration of northern red oak (Quercus rubra L.). Plant Cell Tissue and Organ Culture. 97: 141–149. [ Links ]