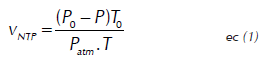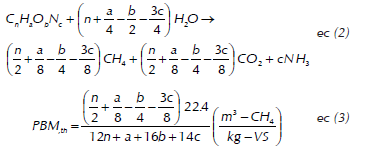Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.1 Bogotá Jan./June 2015 Epub July 08, 2021
https://doi.org/10.15446/rev.colomb.biote.v17n1.39971
Artículos/Investigación
Efecto de la carga orgánica de la gallinaza de jaula en el potencial de biometanización
* MSc, Universidad Industrial de Santander, Colombia. jdmbatista05@gmail.com.
** PhD, Professor, School of Chemical Engineering, Universidad Industrial de Santander, Colombia, licasmol@uis.edu.co.
*** PhD, Professor, School of Chemical Engineering, Universidad Industrial de Santander, Colombia, escala@uis.edu.co.
El propósito de este estudio fue evaluar el efecto de la carga orgánica expresada en función de la relación inóculo/sustrato (RIS) sobre el potencial de biometanización de la gallinaza de jaula usando como inóculo lodo estiércol bovino. Se llevaron a cabo ensayos de biodegradación anaerobia a temperatura mesofílica de 39 °C. Para cada una de las cargas orgánicas evaluadas (16.6, 11.0, 8.3, 6.6 y 5.5 g SV/L) se cuantificaron las variables: ácidos grasos volátiles totales, alcalinidad, concentración amonio y volumen acumulado de metano. El mayor potencial de biometanización (0.58 m3 CH4/kg SV) se alcanzó cuando la biodegradación anaerobia se llevó a cabo con una RIS de 1.0. Los resultados obtenidos demuestran que la gallinaza es un sustrato potencial para ser degradado por digestión anaerobia y el rendimiento del proceso es directamente proporcional a la concentración de sustrato. Este estudio también confirma que la RIS permite diluir la concentración de compuestos inhibitorios como el amonio en el caso de la gallinaza de jaula.
Palabras clave: digestión anaerobia; gallinaza de jaula; relación inóculo/sustrato; amonio
The aim of this study was to evaluate the effect of inoculum to substrate radio (ISR) on biomethane potential of chicken manure using cattle slurry as inoculum. Biomethane potential assays were carried out at 39 °C mesophilic temperature. Total fatty acids, total alkalinity, ammonium concentration and accumulative methane volume were measured to evaluate organic load (16.6, 11.0, 8.3, 6.6 y 5.5 g VS/L). The highest biomethane potential (0.58 m3 CH4/kg SV) was reached when anaerobic biodegradation was carried out to ISR of 1.0. The results demonstrated that chicken manure is a potential substrate to be degraded by anaerobic digestion and process performance is directly proportional to substrate concentration. This study also confirms that ISR allow dilution of inhibitory components as ammonium by the case of chicken manure.
Key words: anaerobic digestion; chicken manure; inoculum substrate ratio; ammonia
Introducción
El sector avícola es uno de los sustentos de la economía y alimentación en Colombia. La mayoría de granjas avícolas existentes en el país se encuentran en los departamentos de Cundinamarca (28 %), Santander (24 %) y valle del cauca (13 %) (Escalante et al., 2010). En los diferentes procesos de la actividad avícola se generan residuos como: gallinaza, pollinaza, aves muertas, residuos grasos y cáscaras de huevos. Estos residuos causan problemas de contaminación ambiental, salud pública y animal (Delgado, 2011). La gallinaza de Jaula (GJ) mezcla de deposiciones sólidas y líquidas de los animales, es el residuo orgánico más representativo que generan las explotaciones avícolas tanto por su volumen como por sus características fisicoquímicas (Rosales et al., 2007). Durante el proceso industrial de cría especializada en aves de corral, se genera una cantidad promedio de GJ de 107.98 toneladas por millar de aves (Escalante, et al., 2010). Mediante procesos biológicos y térmicos, es posible aprovechar los subproductos de los procesos avícolas en la elaboración de nuevos productos como el compost de gallinaza y harina de carne respectivamente (Huang et al., 2011; Rosales et al., 2007). Sin embargo, estas tecnologías no son suficientes para tratar las cantidades generadas por el sector los volúmenes de residuos generados en el sector. La GJ está compuesta principalmente por proteína (20.5 %), celulosa (20 %), hemicelulosa (23.2 %), lignina (1.6 %) y ácidos grasos volátiles (AGV) (0.3 %). Esta elevada concentración de materia orgánica convierten a la GJ en un sustrato atractivo para la digestión anaerobia (DA) (Li et al., 2013). Los sistemas de bioconversión anaerobia son procesos biológicos donde la materia orgánica es reducida hasta metano y dióxido de carbono por la acción de diferentes grupos microbianos que trabajan en sintrofía. Los microorganismos involucrados en la DA corresponden a) Bacterias fermentativas-hidrolíticas b) Bacterias acetogénicas y c) Arqueas metanogénicas. El primer grupo está representado por los géneros Peptostreptococcus, Propionibacterium, Bacteroides, Micrococcus y Clostridium los cuales producen enzimas que desdoblan lo polímeros orgánicos hasta monómeros fácil fermentables. Luego las bacterias acidogénicas metabolizan los monómeros para generar acetatos, propionatos y butiratos que son reducidos posteriormente por las bacterias acetogénicas hasta acetato, dióxido de carbono e hidrógeno. Finalmente, las arqueas metanogénicas actúan sobre el acetato e hidrogeno para transformarlo en metano (Gerardi, 2003). Estudios sobre DA a condiciones mesofílicas, han reportado rendimientos en la producción de metano entre 0.29 y 0.50 m3 CH4/kg SV, utilizando GJ como sustrato y lodo anaerobio de plantas de tratamiento de aguas residuales como inóculo (Li et al., 2013; Nui et al., 2013).
Un parámetro importante a nivel operacional en DA es la carga orgánica representada mediante la relación Inóculo/sustrato (RIS) (Hashimoto et al., 1989). Se ha demostrado experimentalmente, que la RIS afecta la velocidad de biodegradación del sustrato, por tanto este parámetro permite especificar el potencial de biometanización (PBM) y hacer estudios de DA comparables para cualquier tipo de sustrato (Raposo et al., 2011). Los primeros estudios relacionados con la influencia de carga orgánica sobre PBM en términos de la RIS, se llevaron a cabo en operación discontinua, usando ensilado de maíz como sustrato y lodo estiércol bovino como inóculo en concentraciones volumétricas de 0 (control), 10, 30, 50, 70 y 90 %. Los resultados mostraron que para altas cargas orgánicas (valores de RIS por debajo de 0.25) la velocidad de biodegradación del sustrato fue lenta comparada con la velocidad de biodegradación del sustrato para valores en la RIS cercanos a 2 (Hashimoto et al., 1989). Resultados similares fueron obtenidos por Raposo et al., (2006), para la DA del mismo sustrato usando lodo estiércol bovino como inóculo a RIS entre 1 y 3.
La influencia de la RIS sobre el PBM también ha sido estudiada para los desechos de comida y residuos agroindustriales. Se comprobó que existe una relación lineal decreciente entre los rendimientos de biogás y la RIS (Liu et al., 2009). Neves et al., (2004), afirmó que para la DA de desechos de cocina utilizando lodo granular y lodo suspendido como inóculo, la selección de la RIS llega a ser más determinante que la misma actividad metabólica del inóculo. Por consiguiente, en los estudios de DA se requiere establecer una carga orgánica en función de una RIS, que permita el arranque y estabilización del proceso.
El criterio para establecer un valor de RIS gira en torno a la complejidad de biodegradación del sustrato. En el caso de la GJ, concentraciones de ácidos grasos volátiles (AGV) entre 2000 - 4800 mg/L y alcalinidad (AT) entre 4700 - 13600 mg/L permiten un adecuado arranque del proceso anaerobio (Salminen y Rintala, 2002; Callaghana et al., 2002). Sin embargo, la GJ también contiene nitrógeno amoniacal que en concentraciones superiores a 5000 mg/L ejercen un efecto tóxico o inhibidor sobre la actividad microbiana afectando la estabilidad del proceso (Nue et al., 2013).
Owen et al. (1979), establecieron que valores superiores a 1 en la RIS permiten diluir la concentración de compuestos tóxico presentes en el sustrato. Adicionalmente, Chynoweth et al. (1993) observaron que para sustratos como la celulosa se requiere una RIS de 2.0 para evitar inhibición por elevada acumulación de ácidos grasos volátiles (AGV). La acidificación producida por la baja capacidad buffer en la biodegradación anaeróbica de residuos de cocina y la inhibición causada por la libración ortofosfatos en la DA de algas también fueron controladas al establecer una RIS superior a 1.0 permitiendo operar el proceso en valores de pH dentro del rango adecuado (6.0-8.5) para la DA (Zeng et al., 2010; Neves et al., 2004).
El objetivo de este trabajo fue evaluar la influencia de la relación inóculo sustrato sobre el potencial de biometanización de la GJ. El desarrollo de este objetivo, permite establecer el efecto que involucra la variabilidad de sustrato en la digestión de residuos con alta concentración de amonio.
Materiales y métodos
Sustrato e inóculo. El sustrato utilizado en la experimentación corresponde a GJ recolectada de una granja avícola localizada en el municipio de Lebrija-Santander, Colombia. La GJ se mantuvo refrigerada a baja temperatura (4 °C) durante la etapa de caracterización y análisis. Se utilizó como inóculo lodo estiércol bovino, procedente de un frigorífico en Santander.
Diseño experimental. El potencial de biometanización (PBM) de la GJ fue determinado experimentalmente de acuerdo al protocolo establecido por Angelidaki et al., (2009). Se evaluaron cinco cargas orgánicas 16.6 (RIS 1.0), 11.0 (RIS 1.5), 8.3 (RIS 2.0), 6.6 (RIS 2.5) y 5.5 (RIS 3.0) g SV/L, en biodigestores de 60 ml, con una cantidad fija de inóculo de 0.58 g de SV. Para garantizar condiciones de anaerobiosis en el sistema, los biodigestores fueron purgados con nitrógeno durante 2 min y sellados con tapones de butilo y agrafes de aluminio. Los ensayos de biodegradación se llevaron a cabo por triplicado durante 30 días en condiciones mesofílicas de temperatura (39 °C±2) en una incubadora (BD-53+ RS422 WTB BINDER).
Procedimientos y métodos analíticos. Los ácidos grasos volátiles (AGV), alcalinidad total (AT), pH, NH4 + y volumen de metano acumulado fueron considerados como las variables de respuesta del proceso. Los AGV fueron cuantificados por titulación con NaOH (0.1 N) y la AT por titulación con HCl (0.1 N) (Anderson y Yang, 1992). El pH fue determinado mediante un medidor de pH (pH meter 691 Metrohm) y el NH4 + de acuerdo al protocolo 4500-NH3D del Standard Methods for the Examination of Water and Wastewater (APHA, 2005). El biogás producido durante el tiempo de experimentación se burbujeó en una solución alcalina (NaOH) con fenolftaleína como indicador y pH 12, en la cual el CO2 es absorbido. El volumen de solución alcalina desplazada es equivalente al volumen de metano generado por el sistema anaerobio (Angelidaki et al., 2009). El metano se cuantificó en condiciones normales de temperatura y presión mediante la ecuación (1).
Donde, V NTP es el volumen de gas a condiciones normales (ml), V es el volumen de gas generado durante el ensayo de biometanización, P o es la Presión de metano en condiciones normales (1013.25 mbar), T es la temperatura de ambiente a la cual se realizó la medición, P es la Presión de vapor (mbar) a temperatura T y P atm es la presión atmosférica del lugar en el cual se llevó a cabo el ensayo. El PBM de la GJ se expresó en términos de volumen normalizado de metano acumulado sobre sólidos volátiles adicionados del sustrato (SV-Ad). El potencial teórico de biometanización (PBM th) del sustrato se calculó mediante la estequiometria representada en la ecuación de Buswell (2 y 3), la cual asume conversión completa de toda la materia orgánica en biogás (Buswell y Neave, 1930).
Donde, 22.4 es el volumen de un mol de gas a condiciones estándar de temperatura y presión. Los resultados experimentales fueron analizados con el software StatGraphics plus 5.1, StatPoint® Inc. (Virginia, EE.UU). El test de Fisher's fue usado para verificar diferencias estadísticas entre los resultados.
Resultados
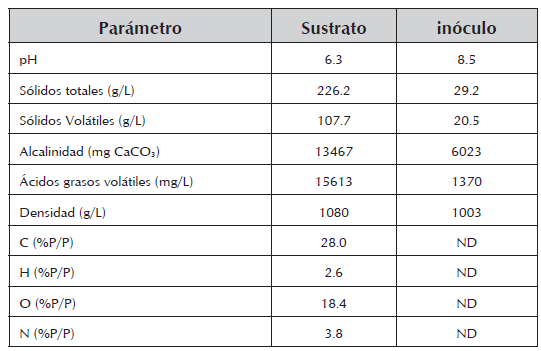
Caracterización fisicoquímica del sustrato e inóculo. En la tabla 1, se presenta la caracterización fisicoquímica de sustrato e inóculo, la cual se llevó a cabo de acuerdo con los protocolos del Standard Methods for the Examination of Water and Wastewater (APHA, 2005).
El pH del sustrato y del inóculo se encuentra en el rango de operación para el desarrollo de DA reportado en la literatura (Raposo et al., 2006). La materia orgánica del sustrato representada por la concentración de sólidos totales, sólidos volátiles y ácidos grasos volátiles de la gallinaza de jaula, permiten identificarla como una fuente de carbono atractiva para DA.
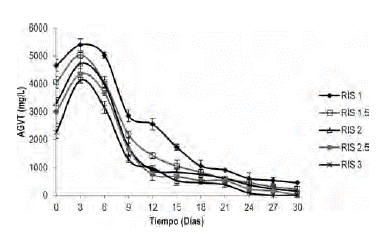
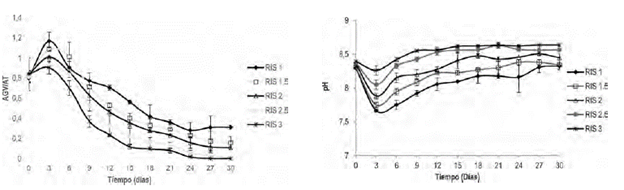
Evolución de la etapa acidogénica de la digestión anaerobia de gallinaza de jaula. La cinética de consumo de AGV durante 30 dias de biodegradación, se presenta para las RIS de 1.0, 1.5, 2.0, 2.5 y 3.0 (figura 2). Se observa que para las diferentes relaciones inóculo-sustrato, el inicio del proceso presenta la misma tendencia exponencial; indicando afinidad del inóculo hacia el sustrato (Quintero et al., 2012). Se ha demostrado que concentraciones de AGV superiores a los 6000 mg/L pueden causar inhibición del proceso anaerobio (Castillo et al., 2007), en este estudio la máxima concentración de AGV fue de 5400 mg/L (RIS 1), valor que se encuentra por debajo del límite que ocasionaria inhibición por acidificación. A partir del día 6, la concentración de AGV disminuyó por debajo de 450 mg/L, lo que demuestra alto grado de reducción de materia orgánica y consecuentemente actividad metabolica de los microorganismos acetogénicos, capaces de reducir los AGV hasta acetato (Wang et al., 1999).
Estabilidad del proceso anaerobio. Los procesos anaerobios alcanzan la estabilidad en rangos de AGV/AT entre 0.2-0.8. (Raposo et al., 2011). Relaciones de AGV/AT superiores a 0.8 indican que no hay balance entre la población de microorganismos acidogénicos y metanogénicos (Wan et al., 2011). En la figura 2a, se muestra el cambio en la estabilidad del proceso de digestión anaerobia de la gallinaza para diferentes RIS.
Se demostró que la estabilidad del proceso de digestión anaerobia de gallinaza se favorece a cargas orgánicas inferiores a 16 g SV/l, equivalentes a RIS superiores a 1.0. Sin embargo, durante el inicio del proceso se evidenció inestabilidad en el sistema para todas las relaciones estudiadas con valores de AGV/AT superiores a 0.8. Esto se debe a que las velocidades de producción de ácidos son mayores a las de consumo de los mismos, razón por la cual la relación AGV/AT se encuentra en los límites de estabilidad para el experimento con RIS de 3. Debido a la capacidad buffer del inóculo (0.23, ver tabla 1), el sistema alcanza estabilidad, al noveno día de biodegradación y la relación AGV/AT se conserva en un rango 0.0 y 0.3, el cual es adecuado para operar un proceso a condiciones estables. Estos resultados concuerdan con la estabilidad alcanzada (AGV/AT = 0.4) para la digestión de lodo estiercol bovino y gallinaza diluida al 15% (Callaghan et al., 2002).
La evolución del pH, para las diferentes RIS se presenta en la figura 2b. El pH para las RIS evaluadas osciló en un rango de entre 7.5 y 8.5, valores adecuados para el crecimiento de consorcios microbianos metanogénicos (Gerardi, 2003). Durante el proceso biodegradativo el pH disminuyó durante los primeros 3 días producto de incrementos en la concentración de AGV. Luego del cuarto día el pH se incrementó gradualmente hasta estabilizarse. Este comportamiento se puede explicar con base a lo reportado por Lay et al., (1998), los sustratos con alta carga organica como la GJ tienden a presentar rápidos incrementos en la concentración de AGV causando fuertes descensos en el pH y desestabilizando el reactor. Sin embargo incrementos progresivos en la concentración de amonio aumentan el pH al comportarse como una base (Lay et al., 1998; Yenigun et al., 2013). Angelidaki et al., (2003), describió resultados similares para sistemas con diferentes residuos orgánicos, puntualizando que para el caso de la GJ se pueden presentar interacciones entre la producción de AGV y pH que conducen a un estado de equilibrio.
Efecto de la concentración de amonio sobre la digestión anaerobia de la gallinaza de jaula. En la figura 3 se muestra que la variación de la concentración de amonio para cada una de las relaciones evaluadas tiene una tendencia similar. Las concentraciones de amonio son proporcionales a la carga orgánica adicionada. La máxima concentración de amonio (2066 mg/L) se presenta en el arranque del proceso para la RIS de 1.0, que equivale a una carga orgánica de gallinaza de 16.6 g SV/L. El proceso se estabiliza a los 9 días de digestión alcanzando concentraciones de amonio que oscilan entre 225 mg/L y 550 mg/L. Teniendo en cuenta que concentraciones de amonio superiores a 2000 mg/L inhiben el sistema anaerobio; se observa que la digestión anaerobia de gallinaza de jaula no presenta efecto inhibitorio por iones amonio, excepto para cargas orgánicas superiores a 16.6 g SV/l (equivalente a RIS de 1).
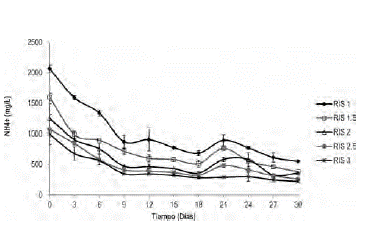
Figura 3 Variación de la concentración de amonio en la digestión anaerobia de la gallinaza de jaula.
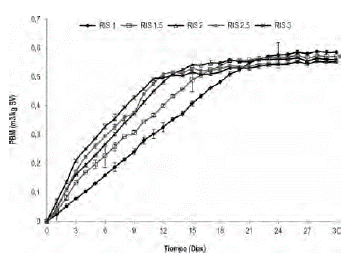
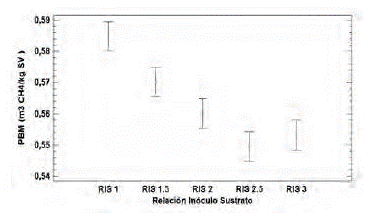
Biodegradabilidad anaerobia de la gallinaza de jaula. Según la composición elemental la gallinaza de jaula utilizada en este estudio (%p/p C:28; H:2.6; O:18.4; N:3.8) tiene teoricamente un potencial de biometanización (PBM) de 0.59 m3 CH4/kg-SV. La producción específica de metano del inóculo (lodo estiércol bovino) fue de 0.17 m3 CH4/kg-SV, este valor se sustrajo de los respectivos PBM para cada uno de los ensayos (figura 4). El máximo PBM fue de 0.58 m3 CH4/kg-SV para RIS de 1.0 alcanzando una eficiencia del proceso del 98%. La producción más baja de metano fue de 0.55 m3 CH4/kg SV para los valores de RIS de 2.5 y 3.0, que corresponden a cargas orgánicas adicionadas de 6.6 g SV/L y 5.5 g SV/L respectivamente. Los valores obtenidos en este estudio son superiores a los reportados por Li et al., (2013), quienes alcanzaron producciones de 0.30 m3 CH4/kg-SV a partir de una carga orgánica de 3.0 g SV/L de gallinaza de jaula. Lo anterior indica que el proceso de digestión anaerobia de la gallinaza de jaula presenta altos rendimientos de producción de metano.
La comparación de medias para el PBM de la gallinaza de jaula a las RIS evaluadas (análisis estadístico), mostró que existen diferencias significativas entre cada uno de los experimentos con un valor de p = 0.0001 (figura 5). Por consiguiente, se corrobora que cargas orgánicas inferiores a 17 gSV/L, no inhiben el proceso anaerobio de la gallinaza de jaula, demostrando un efecto inverso entre la carga orgánica de la gallinaza de jaula (expresada en función de la RIS) y el potencial de biometanización de este sustrato.
Conclusiones
La producción específica de metano a partir de gallinaza de jaula se favorece al operar el proceso con cargas orgánicas inferiores a 17 g SV/L . En consecuencia, las relaciones inóculo (lodo estiércol bovino)/sustrato (gallinaza de jaula) superiores a 1.0 reducen la inhibición de la digestión anaerobia causada por la acumulación de ácidos grasos volátiles y iones amonio; dado que las máximas concentraciones de estos compuestos son 5400 mg/L y 2066 mg/L respectivamente. Como resultado, el potencial de biometanización de la gallinaza de jaula es de 0.58 m3 CH4/kg-SV, alcanzando una eficiencia del proceso del 98%.
Dado que a concentraciones de carga orgánica superiores a 17 g SV/l, el proceso de digestión anaerobia se inhibe, es recomendable enfocar las investigaciones con gallinaza de jaula hacia la codigestión de este sustrato con residuos industriales ricos en carbohidratos, lípidos y proteínas como por ejemplo melaza de caña, glicerol residual y lactosuero respectivamente.
Bibliographic References
Anderson, G.K., y Yang, G. (1992). Determination of bicarbonate and total volatile acid concentration in anaerobic digesters using a simple titration. Water Environment Research, 64, 53-59. [ Links ]
Angelidaki, I., y Ellegaard, L. (2003). Codigestion of manure and organic wastes in centralized biogas plants: status and future trends. Apply Biochemistry Biotechnology, 109 (1-3), 95-105. [ Links ]
Angelidaki, I., Alves, M., Bolzonella, D., Borzacconi, D., Campos, J. L., Guwy, A. J., Kalyuzhnyi, S., Jenicek, P., y van-Lier, J.B. (2009). Defining the biomethane potential (BMP) of solid organic wastes and energy crops: a proposed protocol for batch assays. Water Science & Technology, 59 (5), 934 -917. [ Links ]
APHA, (2005). Standard methods for the examination of water and wastewater. American Public Health Association, Washington, ISBN 978-0-87553-047-5. [ Links ]
Buswell, E.G., y Neave, S.L. (1930). Laboratory studies of sludge digestion. Illinois of State Water Survey. [ Links ]
Callaghana, F.J., Wasea, D.A.J., Thayanithya, K., y Forsterb, C.F. (2002). Continuous co-digestion of cattle slurry with fruit and vegetable wastes and chicken manure. Biomass and Bioenergy, 27, 71-77. [ Links ]
Chynoweth, D.P., Turick, C.E., Owens, J.M., Jerger, D.E., y Peck, M.W. (1993). Biochemical methane potential of biomass and waste feedstocks. Biomass Bioenergy, 5, 95-111. [ Links ]
Delgado, H.A. (2011). Farm Animal Welfare in Colombia: A country situation report. Disponible en: http://portal.fedegan.org.co:7782/portal/page?_pageid=93,136296&_dad=portal&_ schema=PORTAL [ Links ]
Escalante, H., Orduz, J. y Zapata, L. (2010). Atlas del potencial energético de la biomasa residual en Colombia. Unidad de plane-ación minero energética, Universidad Industrial de Santander, UIS. [ Links ]
Fotidisa, I.A., Kougiasa, P.G., Zaganas, I.D., Kotsopoulos, T.A., y Martzopoulos, G.G. (2014). Inoculum and zeolite synergistic effect on anaerobic digestion of poultry manure. Environmental Technology, 35 (10), 1219-1225. [ Links ]
Gerardi, H. (2003). The Microbiology of Anaerobic Digesters. A John Wiley & Sons, Inc., Publication. USA. [ Links ]
Hashimoto, A.G. (1989). Effect of inoculum/substrate ratio on methane yield and production rate from straw. Biological Wastes, 28, 247-255. [ Links ]
Huang, G., Wang, X., y Han L. (2011). Rapid estimation of nutrients in chicken manure during plant-field composting using physico-chemical properties. Bioresource Technology, 102, 1455-1461. [ Links ]
Lay, J.J., Li Y.Y., y Noike, T. (1998). The influence of pH and ammonia concentration on the methane production in high-solids digestion. Water Environment Research, 70, 1075-82. [ Links ]
Liu, G., Zhang, R., El-Mashad, H.M., y Dong, R. (2009). Effect of feed to inoculum ratios on biogas yields of food and green wastes. Bioresource Technology, 100, 5103-5108. [ Links ]
Li, Y., Zhang, R., Liu, G., Chen, C., He, Y., y Liu, X. (2013). Comparison of methane production potential, biodegradability, and kinetics of different organic substrates. Bioresource Technology, 149, 565-569. [ Links ]
Neves, L., Oliveira, R., y Alves, M.M. (2004). Influence of inoculum activity on the bio-methanization of a kitchen waste under different waste/inoculum ratios. Process Biochemistry, 39, 2019-2024. [ Links ]
Niu, Q., Qiao, W., Qiang, H., Hojo, T., y Li, Y. (2013). Mesophilic methane fermentation of chicken manure at a wide range of ammonia concentration: Stability, inhibition and recovery. Bioresource Technology, 137, 358-367. [ Links ]
Owen, W.F., Stuckey, D.C., Healy, J.B. 1979. Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Research. 13(6):485-92. [ Links ]
Quintero, M., Castro, L., Ortiz, C., Guzmán, C., Escalante, H. (2012). Enhancement of starting up anaerobic digestion of lignocel-lulosic substrate: fique's bagasse as an example. Bioresource Technology, 108, 8-13. [ Links ]
Raposo, F., Banks, C.J., Siegert, I., Heaven, S., Borja, R. (2006). Influence of inoculum to substrate ratio on the biochemical methane potential of maize in batch tests. Process Biochemistry, 41, 1444-1450. [ Links ]
Rosales, L., Bermúdez, J., Moronta, R., Morales, E. (2007). Gallinaza: Un Residual Avícola como fuente alternativa de nutrientes para producción de biomasa microalgal. Revista Colombiana de Biotecnología, 9(1), 41-48. [ Links ]
Salminen, E., y Rintala, J. (2002). Anaerobic digestion of organic solid poultry slaughterhouse waste - a review. Bioresource Technology, 83, 13-26. [ Links ]
Wang, H., Gawa, O., Kato, Y. (1999). Degradation of volatile fatty acids in highly effcient anaerobic digestion. Biomass and Bioenergy, 16: 407-416. [ Links ]
Wan, C., Zhou, Q., Fu, G., Li, Y. (2011). Semi-continuous anaerobic co-digestion of thickened waste activated sludge and fat, oil and grease. Waste Management, 31, 1752-1758. [ Links ]
Xie, S., Wu, G., Lawlor, P.G., Frost, J.P., Zhan, X. (2012). Methane production from anaerobic co-digestion of the separated solid fraction of pig manure with dried grass silage. Bioresource Technology, 104, 289-297. [ Links ]
Yenigun, O., Demirel, B. (2013). Ammonia inhibition in anaerobic digestion: A review, Process Biochemistry, 48, 901- 911. [ Links ]
Zeng, S., Yuan, X., Shia, X., Qiu, Y. (2010). Effect of inoculum/substrate ratio on methane yield and orthophosphate release from anaerobic digestion of Microcystis spp. Journal of Hazardous Materials, 178, 89-93. [ Links ]
Recibido: 10 de Febrero de 2014; Aprobado: 09 de Abril de 2015











 text in
text in