Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.1 Bogotá jan./jun. 2015 Epub 13-Jul-2021
https://doi.org/10.15446/rev.colomb.biote.v17n1.50718
Artículos/Investigación
Micropropagación de plantas de lechosa en recipientes de inmersión temporal a partir de brotes axilares
* National Agricultural Research Center. Instituto Nacional de Investigaciones Agrícolas. Apdo. 4653. Maracay 2101. Aragua State. Venezuela. Emails: avegas@inia.gob.ve; melanigs@hotmail.com; adlopez@inia.gob.ve; jgalbarran@inia.gob.ve; aschmidt@inia.gob.ve; esalazar@inia.gob.ve; ymujica@inia.gob.ve; casadobatista@yahoo.es; jgfernandez@inia.gob.ve; cmarin@inia.gob.ve
** † Master's Student, Distinction in Genetics. School of Agronomy. Universidad Central de Venezuela. Maracay 2101. Aragua State. Venezu ela.†04/2012.
Se estandarizaron las condiciones de iniciación, multiplicación, enraizamiento y aclimatización de plantas hermafroditas de lechosa cv Maradol provenientes de brotes axilares, producidos en recipientes de inmersión temporal RITA®. En cada envase, contentivo de 200 ml de medio de cultivo líquido de Fitch, se colocaron cuatro brotes de 2 a 3 cm de longitud. Los biorreactores se conectaron a tres líneas de inmersión de 5, 2 y 1 min cada 4h y se colocaron 6 envases en promedio por línea, en condiciones de fotoperíodo de 16 h. Transcurridos 30 a 45 días, se cuantificaron los brotes y se clasificaron de acuerdo al tamaño: < 2 cm (pequeños), entre 2 a 3 cm (medianos), > 3 cm con y sin raíz (grandes). Los dos primeros tipos de brotes se continuaron multiplicando en los mismos medios; y los más elongados se aclimatizaron utilizando el Sistema Autotrófico Hidropónico (SAH). Se determinó la sanidad y la fidelidad de las plantas producidas mediante pruebas de ELISA y RAPD, respectivamente. Durante un periodo de 6 meses se reciclaron un total de 47 recipientes, los cuales produjeron 1.091 brotes: 377 pequeños; 482 medianos; 175 grandes sin raíz y 57 con raíz. Usando el SAH se obtuvo 89,5% de plantas aclimatizadas cuando se usaron brotes enraizados, y 41,6% a partir de brotes sin raíces. Con la combinación de las técnicas RITA y SAH se logró un sistema continuo y eficiente de producción de plantas sanas y fieles al tipo, en comparación con los métodos convencionales de micropropagación y aclimatización.
Palabras clave: Carica papaya; RITA®; sistema autotrófico; estabilidad genética
We standardized initiation, multiplication, rooting and acclimatization conditions of papaya cv Maradol hermaphrodite plants from axillary buds produced in temporary immersion reactor RITA®. Recipients contained 200 ml of Fitch liquid culture medium, and four shoots of 2 to 3 cm. in length were placed in each. The bioreactors were connected to three different immersion lines of 5, 2, and 1 min each 4h, with 6 containers per line on average, in 16 h photoperiod. After 30 to 45 days, the shoots produced were quantified and classified according to size: <2 cm (small), from 2 to 3 cm (medium), >3 cm with or without roots (large). The first two types of shoots were multiplied in the same culture media, and more elongated shoots were acclimatized using Autotrophic Hydroponic System (AHS). The sanity and fidelity of the produced plants were determined using ELISA and RAPD, respectively. For a period of six months 47 vessels were recycled and 1,091 shoots were produced: 377 small; 482 medium; 175 large without roots and 57 rooted shoots. Using AHS, 89.5% acclimatized plants were obtained when rooted shoots were used, and 41.6% from rootless shoots. With the combination of RITA and AHS techniques we achieved a continuous and efficient production of healthy and true to type papaya plants, in comparison to conventional micropropagation and acclimatization procedures.
Key words: Carica papaya; RITA®; autotrophic system; genetic stability
Introducción
La lechosa (Carica papaya L.) es uno de los frutales tradicionales de mayor importancia en Venezuela, con una superficie sembrada de 10.614,01 ha y una producción de 199.002 Tm (FAO, 2013). En la actualidad se ha alcanzado un gran avance tecnológico en este rubro y la tendencia es a sustituir los huertos de cultivares criollos de baja tecnología por híbridos del grupo Maradol, dependientes de semillas certificadas importadas, las cuales producen plantas uniformes de menos porte, mayor productividad y calidad de los frutos (Aular y Casares, 2011).
La lechosa se propaga convencionalmente por semillas, sin embargo se han señalado problemas de latencia, los cuales afectan la germinación y conservación a mediano y largo plazo, por lo que la siembra debe efectuarse lo más cercano posible a la época de recolección; solo un porcentaje de las plantas son andromonoicas, con flores hermafroditas, y producen frutos elongados comerciales, y por esta razón se siembran tres plantas por punto; se producen plantas heterogéneas cuando provienen de semillas no seleccionadas e híbridos; además, la sanidad de las semillas debe estar garantizada, ya que algunas enfermedades, como la bacteriosis producida por Erwinia sp., se transmiten por esa vía (Guevara et al., 1993; Posada, 2005).
Con protocolos eficientes de micropropagación de cultivares hermafroditas de lechosa se reduciría de 6.000 a 2.000 el número de plantas que se necesitarían para sembrar una hectárea. Ensayos de campo han demostrado que las plantas obtenidas de la micropropagación de yemas resultaron uniformes, conservaron 100% de hermafroditismo y sus frutos elongados, mientras que las plantas de semillas mostraron solo 75% de flores hermafroditas y por lo tanto 25% dieron frutos redondos que son menos comerciales (Talavera et al., 2009). En este frutal, los protocolos de micropropagación precisan ser mejorados para llevarlos a la fase comercial. Se consideran superadas las fases de iniciación a partir de plantas de campo, la elongación y la multiplicación de cultivares, híbridos y plantas transgénicas, particularmente se han logrado coeficientes de multiplicación altos (entre 2,5 hasta 12 veces). Sin embargo, los bajos porcentajes de enraizamiento in vitro y ex vitro de los brotes, y la alta mortalidad de las plántulas obtenidas in vitro durante la fase de aclimatización se han señalado como los principales cuellos de botella, y en más de una década se han generado diversos trabajos que abordan estos temas (Chan et al., 2003; Rohman et al., 2007; Talavera et al., 2009).
Adicionalmente, en un esquema de propagación comercial, la presencia de virus en los tejidos in vitro iniciales se deberían monitorear. Este aspecto no ha sido abordado en los trabajos revisados sobre micropropagación. Los virus que afectan con frecuencia al cultivo de lechosa son: la Mancha Anillada de la Lechosa (Papaya ringspot virus, PRSV), el Mosaico de la Lechosa (Papaya mosaic virus, PapMV) y el Mosaico del Pepino (Cucumber mosaic virus, CMV). A fin de detectarlos, el uso de la técnica de inmunodiagnóstico ELISA (enzyme linked immunosorbent assay), es la estrategia más sencilla, económica y eficaz, ya que estos virus son muy buenos inmunógenos, permitiendo obtener anticuerpos policlonales con muy altos títulos. En el país se han obtenido de manera experimental anticuerpos policlonales específicos contra la proteína de la cápside viral (Marys et al., 2000), sin embargo, existen estuches comerciales de comprobada eficiencia como Agdia®, empleados extensamente en el mundo para el diagnóstico de estos y otros virus.
El desarrollo de sistemas de inmersión temporal (SIT) ha permitido la optimización de la multiplicación de especies vegetales, y la propagación a escala comercial, debido que se reducen los costos operativos mediante el uso de los medios líquidos, de mayor facilidad de manipulación; se disminuyen los tiempos de establecimiento de los explantes iniciales in vitro; se aumentan las tasas de multiplicación de los explantes; se obtienen plantas con mayor vigor, en comparación con las formas convencionales de propagación in vitro en medios semisólidos o líquido semisumergido o sumergido; las plantas se comportan mejor durante la fase de aclimatización, que el material obtenido de medios semisólidos y líquidos; se posibilita la automatización de algunas de las etapas del cultivo in vitro, lo cual reduce el trabajo manual para la producción comercial de plantas (Colmenares y Giménez, 2003; Berthouly y Etienne, 2005; Niemenak et al., 2008). Sin embargo, pueden aparecer anormalidades fisiológicas, especialmente la hiperhidricidad, la cual se reduce al exponer los explantes al medio líquido de manera intermitente, por lo que se considera crucial ajustar los tiempos de inmersión, de manera de evitar la expresión de la hiperhidricidad (Berthouly y Etienne, 2005).
Los SIT pueden utilizarse en la propagación masiva de plantas elites, mediante la multiplicación de brotes axilares, microtubérculos y embriones somáticos. Se han señalado experiencias exitosas de micropropagación de frutales, como la uva, Amelanchier x grandifolia, bananos, plátanos, cítricos, piña, usando diferentes sistemas de inmersión temporal, y algunas de ellas, se producen en escala comercial (Colmenares y Giménez, 2003; Jiménez 2005; Berthouly y Etienne, 2005; Niemenak et al., 2008).
En lechosa, se conocen algunas experiencias previas de micropropagación mediante sistemas de inmersión temporal. Damiano et al. (2003), utilizando el sistema de doble frasco, operado manualmente, obtuvieron mayores tasas de propagación de brotes de lechosa, al compararlo con los cultivos en medio semisólido y líquido estacionario. Posada et al. (2003), emplearon el SIT para la multiplicación y germinación de embriones somáticos de lechosa cv. Maradol Roja, usando sistemas de filtración 'Sartorius' de 250 ml de capacidad. La frecuencia de inmersión fue de tres veces al día durante un minuto. Como resultado fue posible multiplicar los embriones somáticos, logrando coeficientes de multiplicación de 40, en el medio de cultivo suplementado con 1 mg.l-1 de 2,4-D, transcurridos 45 días, y una germinación del 87%. Existe un estudio anterior sobre cultivos líquidos de embriones somáticos en agitación, para el escalamiento de la producción masiva de plantas de lechosa (Castillo et al., 1998), en el cual se cuantifica y evalúa el potencial de la producción de embriones somáticos, a partir de explantes de hipocotilos de papaya cv. Solo, en medios líquidos en agitación, a 120 rpm. Según esta investigación, se produjeron 455 embriones somáticos por cada 200 mg de callo, en el medio líquido de maduración, después de 112 días, en comparación con 174 en medio solidificado. Según los autores, el uso de un sistema líquido para la producción de embriogénesis secundaria resultó una estrategia más eficiente para la proliferación a gran escala de embriones inmaduros, ya que se requieren periodos de cultivo más cortos para obtener mayores rendimientos. Se indica que el sistema líquido es adecuado para la automatización de la producción rápida de embriones somáticos y la propagación contínua en biorreactores.
En cuanto a la estabilidad genética de las plantas micropropagadas, se ha demostrado que son estables, a partir de la proliferación de brotes axilares y meristemos, por sus características morfológicas, agronómicas e industriales y por los análisis citológicos, isoenzimáticos y moleculares, y se considera el sistema más adecuado para la multiplicación clonal de la lechosa (Lopez et al., 2006). Sin embargo se han observado pequeñas diferencias entre plantas micropropagadas y las producidas por semilla, siendo las primeras ligeramente de menor porte y más precoces, lo cual es ventajoso para la cosecha (Fitch et al., 2005, May et al., 2007, Talavera et al., 2009). Por otro lado, cuando se ha utilizado la embriogénesis somática como proceso de micropropagación, se han conseguido variaciones morfológicas tales como, la altura de la planta, número y longitud de flores, al igual que número de frutos, las dimensiones y la forma de los mismos, sobre todo cuando se usaron altas concentraciones de 2,4-D (15 mg.l-1), y estas diferencias se pudieron asociar a patrones polimórficos obtenidos en el análisis molecular del ADN usando iniciadores arbitrarios (RAPD) (Homhuan et al., 2008). En otro estudio y con concentraciones bajas de 2,4-D, de 2 mg.l-1, hubo un porcentaje alto de variaciones de ploidia, del 14%, en las plantas in vitro regeneradas (Clarindo et al., 2008). Las tasas de multiplicación pudieran ser aumentadas significativamente en 20 veces o más al utilizar la embriogénesis somática, pero existe el riesgo de aumentar la variabilidad de las plantas producidas (Posada, 2005; Clarindo et al., 2008; Homhuan et al., 2008).
En el presente trabajo se estandarizaron las condiciones de iniciación, multiplicación y enraizamiento, de plantas de lechosa hermafroditas a partir de brotes axilares, en Recipientes de Inmersión Temporal Automatizado (RITA®); y la aclimatización de las plantas micropropagadas; además se evaluó la estabilidad genética y la sanidad de las mismas, mediante marcadores RAPDs y la técnica de ELISA, respectivamente.
Materiales y métodos
Micropropagación a partir de brotes axilares de plantas hermafroditas, tipo IV o elongata, del cv. Maradol en recipientes de inmersión temporal
Siembra de los brotes axilares en los medios líquidos y semisólidos
Material vegetal. Se emplearon brotes axilares de plantas hermafroditas cv. Maradol, obtenidos de cultivos semisólidos, los cuales se colocaron en recipientes de inmersión temporal automatizados RITA® (CIRAD, Francia), con 200 ml de medio de cultivo líquido. Los medios estuvieron constituidos por las sales y vitaminas de Murashige y Skoog (1962), complementados con bencil amino purina (BAP) (0,2 mg.l-1) y cinetina (0,1 mg.l-1) (Fitch, 1993). Se implantaron cuatro brotes, de 2 a 3 cm de longitud por recipiente, en condiciones asépticas. Los recipientes se conectaron a tres líneas, con los siguientes tiempos de inmersión: línea 1: 5 min.4h-1; línea 2: 2 min.4h-1; línea 3: 1 min.4-1h y se colocaron 6 envases en promedio por línea, en condiciones de fotoperíodo de 16 h de iluminación diaria, a una intensidad de 32 μmolm-2s-1 de luz fluorescente blanca, una temperatura entre 23,2 y 25°C, y HR entre 50,9 a 55,4%. Transcurridos entre 30 a 45 días, se cuantificaron los brotes nuevos enraizados o sin raíz obtenidos y se clasificaron de acuerdo al tamaño, por un período de seis meses. Los brotes menores de 2 a 3 cm se continuaron multiplicando en los mismos medios de cultivo; los brotes elongados >3 cm enraizados o sin raíz se aclimatizaron utilizando el Sistema Autotrófico Hidropónico (SAH) (Rigato et al., 2001). Además se calculó la tasa de proliferación de las líneas de producción (número de brotes producidos - número de brotes sembrados/número de brotes sembrados).
En el caso de las siembras en cultivo semisólidos, se utilizaron envases de vidrio de 200 ml, contentivos de 30 ml de medio Fitch (1993), solidificado con agar a 7gl-1, en los cuales se implantaron 4 brotes medianos, de 2 a 3 cm de longitud, en un total de 15 frascos, y se reciclaron transcurridos entre 30 a 45 días. Los frascos sembrados permanecieron a las mismas condiciones de luz y temperatura especificadas anteriormente. Este ensayo se repitió una vez. Se calculó la tasa de proliferación de los brotes en los medios semisólidos como se mencionó en el párrafo anterior.
Se elaboró una matriz de datos categorizados por línea y mes con las variables: número de envases sembrados, número de envases cosechados, tipos de brotes, número de brotes, número de brotes contaminados con bacterias y hongos. La matriz fue tabulada en la hoja de cálculo Microsoft® Excel 2007 y exportada a la aplicación Infostat v. 1.0/P (InfoStat, 2002). Los datos fueron modelados bajo un arreglo factorial 3x4 (Número de líneas x Tipos de brotes) con 4 repeticiones, bajo un diseño totalmente aleatorizado, para cada mes de producción. Además, se analizó el conjunto de la producción a los seis meses mediante un análisis de la varianza combinado en el tiempo (mes, línea y tipo de brote). Previamente fueron probados exitosamente los supuestos de normalidad para ambos modelos Infostat (InfoStat, 2002). Para el análisis de la interacción Línea x Tipo de brote, se empleó la prueba de Ji al cuadrado a un nivel de p=0,05. El análisis factorial de Correspondencias Múltiples fue empleado para observar los patrones de asociación entre las tres líneas de producción y los cuatro tipos de brote (Agresti, 1990; Greenacre y Hastie, 1987).
Aclimatización: Se utilizaron dos métodos para la aclimatización de los brotes.
Método convencional: Se aclimatizaron 304 brotes enraizados o no, procedentes de los RITA®, usando el procedimiento convencional: Se preparó una mezcla de sustrato comercial Sunshine® N°5 y tierra cernida en proporción 3:2, luego se esterilizó y se llenaron vasos plásticos de 270 ml previamente perforados. Los brotes con raíces se lavaron con suficiente agua destilada para eliminar completamente el agar, tomando la precaución de no dañar las mismas. Los brotes sin raíz fueron tratados con una solución de AIB a 8 mg.L-1 (Posada, 2005). Los brotes fueron transplantados individualmente en los vasos plásticos, y se cubrieron con otro vaso transparente, de menor capacidad, con la finalidad de crear una cámara húmeda con un microclima adecuado para su adaptación. Se regaron con una solución compuesta por sales MS al 50%, cada dos a tres días. A partir de la segunda semana, se retiraron progresivamente los vasos que cubrían las plantas hasta lograr la aclimatización de la misma. Posteriormente se transplantaron a bolsas negras o materos.
Sistema de aclimatización hidropónico (SAH): Se sembraron 24 brotes enraizados, y 24 brotes sin raíz, cada tipo separadamente, en cajas plásticas transparentes desechables de 32 x 25 cm, conteniendo sustrato comercial Sunshine® N°5, al cual previamente se le aplicó una solución compuesta por sales MS al 50%, en una proporción 1:1 (peso/volumen). En las cajas se aplicó 400g de sustrato y el riego se realizó una vez por semana con la solución antes mencionada. Esta experiencia se repitió una vez.
En ambos métodos los brotes trasplantados se mantuvieron en una temperatura de 23,2 a 25°C y una humedad relativa de 50,9 al 55,4%, en cámaras de crecimiento con 16 h de iluminación diaria.
Se evaluó el porcentaje de sobrevivencia durante la aclimatización (número de brotes enraizados aclimatizados/número de brotes sembrados x 100). Se aplicó una prueba binomial a los porcentajes de sobrevivencia obtenidos. Las plantas estuvieron aptas para la siembra en campo en un periodo de tres a cuatro meses y fueron transplantadas en cuatro áreas diferentes del estado Aragua, en donde fueron evaluadas morfológicamente (datos no mostrados).
Extracción y amplificación de ADN de lechosa por RAPD
Se muestrearon 20 brotes tomados al azar de los RITA®, en las líneas de producción. Para la extracción del ADN se utilizó el protocolo de Dellaporta modificado por CIAT (1999), a partir de tejido foliar.
Una vez extraído el ADN genómico se verificó su calidad y concentración. Los 20 iniciadores utilizados fueron las veinte secuencias de la serie OPA de Operon technologies, según el protocolo de Chen et al. (2011). La visualización y análisis se realizó con el equipo Chemi -Doc Bio Rad, Software Quantity One Versión 4-2. Los productos RAPD se compararon con el patrón de peso molecular del ADN del fago Lambda digerido con BST E2.
Aplicación de las pruebas diagnóstico de virus fitopatógenos en las plantas regeneradas
Se usaron hojas de los brotes de lechosa cv. Maradol provenientes de la propagación masiva en los RITA®, para la detección de los virus fitopatógenos. Se tomaron cuatro muestras aleatorias de los brotes multiplicados en las tres líneas de inmersión.
La técnica de diagnóstico que se utilizó fue los inmunoensayos ELISA directos con doble capa de anticuerpos policlonales y anticuerpo de detección conjugado con fosfatasa alcalina, de la casa comercial AGDIA®, los cuales fueron diseñados específicamente para detección de los virus que afectan más frecuentemente a la lechosa, tales como, la Mancha Anillada de la Lechosa (Papaya ringspot virus, PRSV), el Mosaico de la Lechosa (Papaya Mosaic Virus, PapMV) y el Mosaico del Pepino (Cucumber mosaic virus, CMV). Se usó el protocolo descrito por Noa-Carrazana et al. (2007) para su aplicación. Se incluyeron testigos negativos o sanos y positivos (suministrados con el estuche y disponibles en el laboratorio). Las lecturas se realizaron a una longitud de onda de 405 nm, para medir absorbancia con un espectrofotómetro o lector de placas de ELISA, marca LAB SYSTEM, modelo MultiSkan EX. Para el cálculo del punto de corte se utilizó el doble del valor del promedio de absorbancia del testigo sano.
Resultados y discusión
Micropropagación a partir de brotes axilares de plantas de lechosa hermafroditas, tipo IV o elongata cv. Maradol en recipientes de inmersión temporal
Durante un período de seis meses se cosechó un total de 47 recipientes, en las tres líneas, con diferentes tiempos de inmersión, los cuales produjeron un total de 1.091 brotes. Se produjo un promedio mensual de 182 brotes, en 6 envases cosechados por mes, como promedio. El rango de brotes cosechados por mes fluctuó, entre 68 y 298, al igual que los envases cosechados, los cuales estuvieron entre 4 a 12.
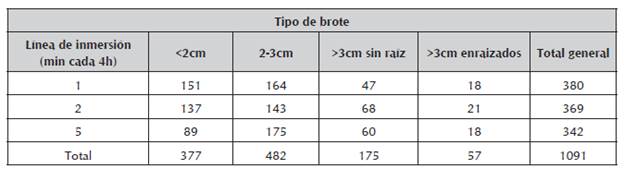
Los brotes producidos fueron clasificados de la siguiente manera: 377 brotes pequeños (<2 cm), 482 brotes medianos (2 a 3 cm), 175 brotes grandes (mayores de 3 cm) sin raíz y 57 brotes grandes con raíz. La mayoría de los brotes fueron de tamaño mediano, cercano a la mitad de los brotes producidos (44,18%), y sirvieron para ser reciclados y multiplicados en los RITA®; los brotes grandes, enraizados y sin raíces, representaron el 21,26%, y se aclimatizaron directamente. Por otro lado, los brotes pequeños (34,56%), se colocaron en medios semisólidos Fitch (1993), para su mantenimiento y desarrollo. Según el ANAVAR no hubo diferencias significativas con respecto al número total de brotes producidos en las tres líneas de inmersión evaluadas, sin embargo se observó que difieren en cuanto al tipo de brotes producidos: en las frecuencias de 1 y 2 min se produjo la mayor cantidad de brotes de tamaño <2 cm; en la frecuencia de 5 min. 4h-1 fue mayor la proliferación de brotes de 2-3 cm; así mismo los brotes mayores de 3 cm, con y sin raíz se produjeron predominantemente en la línea con una frecuencia de riego de 2min.4h-1. De esta manera, en las líneas de 1 y 5 min.4h-1 se produjo una mayor cantidad de brotes pequeños y medianos, y la frecuencia de 2 min.4-1h sirvió para la producción de los cuatro tipos de brotes, incluyendo los elongados, enraizados o sin raíz, aptos para la fase ex vitro (tabla 1). Lo descrito anteriormente se puede visualizar en el análisis de correspondencia múltiple entre el tipo de brote y la frecuencia de inmersión (figura 1). En general, hubo fluctuaciones en el número promedio de brotes/mes, en las líneas de producción, con una mayor cantidad de brotes en los primeros tres meses y en el mes 6 (Datos no mostrados).
Tabla 1 Número acumulado de acuerdo al tipo de brote de lechosa cv Maradol producido en los RITA®, usando tres líneas de frecuencias de inmersión, a los seis meses de la micropropagación.
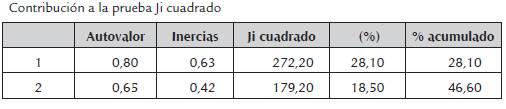
Ji Cuadrado Pearson 22,51 6 p: 0,0010
Ji Cuadrado MV-G2 23,16 6 p: 0,0007
Coef.Conting.Cramer 0,08 Coef.
Conting.Pearson 0,14
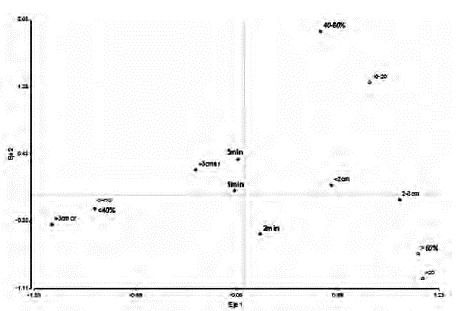
Figura 1 Análisis de correspondencias múltiples entre las tres frecuencias de inmersión (1, 2 y 5 min cada 4h) y los tipos de brotes de lechosa producidos en los RITA, a los seis meses de la micropropagación.
De acuerdo a los resultados anteriores, las tasas de proliferación se calcularon en 5,3, 6,0 y 5,9 veces, para las líneas 1, 2 y 3, respectivamente, y la tasa de proliferación promedio de 5,7. En los resultados de Damiano et al. (2003), esta tasa fue significativamente más alta, de hasta 24 ± 3,32 para brotes de lechosa micropropagados en el SIT de doble frasco, con un período de inmersión de 60 min/día, en medio de multiplicación MS con 0,15 y 0,015 mg.l-1 de BAP y AIB, respectivamente, en comparación con los testigos en medios semisólidos, y hubo inhibición en la multiplicación de los brotes, en los cultivos líquidos estáticos. Sin embargo, los brotes proliferados se mostraron poco elongados y difíciles de separar para la siguiente etapa de enraizamiento in vitro, la cual no fue abordada en ese trabajo.
Las tasas de proliferación encontradas en la presente investigación fueron similares, a las obtenidas en café (C. arabica y C. canephora), durante la multiplicación de micro esquejes (Berthouly y Etienne, 2005) y en brotes de banano (Alvard et al., 1993), con tiempos de inmersión de 20 min.2h-1, con este mismo sistema. Sin embargo, Colmenares y Giménez (2003), lograron tasas mucho más altas, trabajando con varias especies de musáceas, 8,4 para banano cv. Williams y 11,2 para plátano Hartón, con tiempos de inmersión de 20 min.4h-1.
Los brotes producidos por la proliferación de las yemas axilares de lechosa cv. Maradol, en los RITA®, formaron macollas, alrededor de los brotes iniciales y fueron más alargados que los de los medios semisólidos. Por otro lado, debido al empobrecimiento de los medios líquidos, después de los 30 días en cultivo, hubo senescencia de las hojas y se indujo el enraizamiento de algunos de los brotes. Las raíces producidas tuvieron un aspecto normal fibroso, sin formación de callo en la base (figura 2 b).

Figura 2 Proceso de micropropagación de plantas de lechosa cultivar Maradol a partir de brotes en los RITA® y aclimatización mediante el sistema autotrófico hidropónico (SAH). a) RITA mostrando el crecimiento de los brotes en condiciones controladas; b) detalle de la producción de brotes y plántulas en uno de los envases; c) aspecto de los brotes sin raíces, provenientes de los RITA, tratados con AIB; d) Endurecimiento paulatino de las plantas, después de los 26 días del trasplante, en el sistema autotró fico hidropónico (SAH); e) Detalle del desarrollo de las raíces de las plantas; f) Desarrollo de las plantas aclimatizadas, 26 días después del transplante en el SAH.
Con la micropropagación de brotes de lechosa en los RITA® no hubo necesidad de la aplicación de ácido giberélico (AG3) para la elongación de los brotes, ni de auxinas para la inducción de raíces, como ha sido recomendado por varios autores (Drew et al., 1991; Solis et al., 2011). Este proceso hace innecesarios los cambios a diferentes medios de cultivo, hecho que disminuye los costos operacionales de elaboración y la manipulación, además que acorta los tiempos de producción de plantas completas.
En este estudio, las tasas de multiplicación obtenidas en el sistema RITA® y el vigor de las plantas fue mayor, más del doble, en comparación con la estimada de 2 a 2,5, en el sistema convencional semisólido, cada 30 a 45 días. En este último caso, los brotes fueron más pequeños y rara vez enraizaban en el medio de multiplicación. Algunos autores han reportado tasas de proliferación similares de 3,42 (Solis et al., 2011), sin embargo, otros autores han obtenido tasas mucho mayores de 7,50, 9,87, 12,73 veces (Lai et al., 2003; Gallardo, 2002; Rohman et al., 2007), en medios semisólidos.
En la presente investigación, la aparición de brotes hiperhídricos fue baja (plantas de 3 envases de los 47 cosechados), lo que representó el apenas 6% de los envases utilizados. De igual manera, Damiano et al.(2003) y Posada et al.(2003), no encontraron problemas de hiperhidricidad en los brotes o embriones somáticos micropropagados.
El porcentaje de contaminación fue bajo (12,5%), en los primeros 2 meses, predominantemente de origen bacteriano (5%), posiblemente debido a contaminación endógena de los tejidos, la cual no fue percibida en los medios semisólidos. Varios autores han señalado la presencia de bacterias endógenas, no fitopatógenas, en el cultivo in vitro de lechosa (Posada, 2005), este problema fue fácilmente detectable en los medios líquidos, lo cual hizo que los brotes contaminados fueran descartados al inicio de la micropropagación; y durante la producción de brotes en los meses 2, 5 y 6, hubo una baja contaminación por hongos (7%), debido posiblemente a contaminación del ambiente.
Aclimatización de brotes y las plantas de lechosa
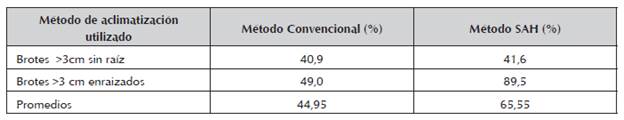
Utilizando el método convencional se lograron porcentajes de sobrevivencia bajos: 40,9% y 49,0%, utilizando brotes > 3 cm enraizados o no, respectivamente, y no hubo diferencias significativas entre los resultados (tabla 2).
Tabla 2 Porcentajes de sobrevivencia de los brotes con o sin raíces aclimatizados de lechosa cv Maradol, producido en los RITA®.
Método convencional: brotes aclimatizados en vasos plásticos, conteniendo una mezcla de sustrato comercial Sunshine® N°5 y tierra cernida.
Metodo SAH: aclimatizados en bandejas, de 32 x 25 cm, conteniendo sustrato comercial Sunshine® N°5.
Solo hubo diferencias significativas entre los porcentajes de sobrevivencia de los brotes enraizados in vitro, aclimatizados usando en método SAH, con respecto los demás tratamientos.
Considerando ambos métodos, el convencional tiene menor porcentaje de sobrevivencia a un nivel de p<0,01
Utilizando el SAH, se incrementó el porcentaje de plantas aclimatizadas, lográndose un 89,5% cuando se usaron brotes de >3 cm enraizados in vitro, sin embargo fue bajo cuando se aclimatizaron brotes sin raíz, y hubo diferencias significativas entre estos porcentajes (tabla 2).
La sobrevivencia in vivo durante la aclimatización fue mayor con los brotes enraizados in vitro, en comparación los resultados logrados por otros autores, los cuales oscilan entre 65 y 85%, (Posada, 2005; Tetsushi et al., 2008; Anandan et al., 2011). Aproximadamente a los 26 días, las plantas se mostraron muy vigorosas, presentaron abundantes raíces fibrosas, y estuvieron aptas para el transplante a macetas (figura 2 d, e, f). Cuando se usaron los brotes sin raíces se observó la aparición de raíces en algunas de las plantas, a los 30 días de transplantadas en el sustrato, y hubo que esperar 30 días más para que estuvieran aptas para el trasplante a macetas. En la fase de aclimatización pareció necesario la presencia de raíces para una mayor sobrevivencia en el sustrato estéril, tal como ha sido señalado por otros autores, quienes han observado que si bien las raíces no son del todo funcionales debido a la escasez de pelos absorbentes, un mayor tamaño y número de raíces inducen la formación ex vitro de nuevas raíces y pelos absorbentes, que extraerán del suelo los nutrientes necesarios para el desarrollo de las plántulas (Solis et al., 2011).
Las bandejas tuvieron ventajas con respecto al uso de vasos individuales, en cuanto a que implicó una mayor facilidad en el manejo de los lotes de plantas en un mismo envase para la aplicación de riego semanal y el control de la humedad, y por su peso ligero estas bandejas pueden ser enviadas y distribuidas a los productores. Las plantas estuvieron aptas para la siembra en campo en un periodo de tres a cuatro meses y fueron morfológicamente normales y de sexo hermafrodita (datos no mostrados).
Amplificación de ADN de brotes de lechosa cv. Maradol hermafrodita por RAPD, producidos en los RITA
Los resultados indicaron que no hubo diferencias entre los patrones de fragmentos amplificados en las 20 muestras analizadas, provenientes de los RITA®, ya que los fragmentos se distribuyeron de manera similar para los 20 iniciadores utilizados, demostrando la uniformidad genética de los brotes micropropagados. Estos resultados, garantizaron la fidelidad de las plantas producidas, a partir de la multiplicación de yemas axilares (figura 3). Resultados similares fueron obtenidos por López et al., (2006), micropropagando el mismo cultivar, a partir de segmentos nodales, y utilizando marcadores AFLP, además de las características morfológicas de las plantas en campo.
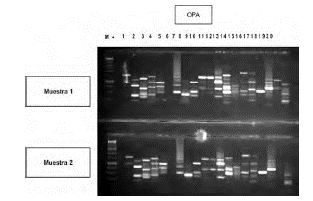
Figura 3 ADN amplificado de dos muestras foliares de las vitroplantas cultivar Maradol con 20 iniciadores OPERON®, mostrando fragmentos similares amplificados. En el primer carril se muestra el patrón de peso molecular del ADN del fago Lambda digerido con BST E2, y en los carriles 1 al 20, los fragmentos amplificados con los iniciadores.
Pruebas diagnóstico de enfermedades virales en los brotes de lechosa cv. Maradol hermafrodita, producidos en los RITA
Las muestras foliares analizadas de los brotes micropropagados resultaron negativas para los virus de la Mancha Anillada de la Lechosa (Papaya ringspot virus, PRSV), el Mosaico de la Lechosa (Papaya Mosaic Virus, PapMV) y el Mosaico del Pepino (Cucumber mosaic virus, CMV), dando lecturas similares o menores a los testigos negativos para cada prueba, entre 0,0 a 0,03, mientras los testigos positivos dieron 3,08, 2,6 y 2,1, respectivamente. Estos análisis garantizaron la sanidad de dichos brotes.
Conclusiones
En este trabajo se logró un sistema continuo de producción de plantas de lechosa cv. Maradol hermafroditas, tipo elongata, sanas y fieles al tipo, mediante la estandarización de los procedimientos de iniciación, multiplicación, enraizamiento y aclimatización de plantas producidas con el sistema RITA, a partir de brotes axilares in vitro. Se demostró que el sistema de inmersión temporal fue más eficiente, ya que se aumentó la tasa de multiplicación a un promedio de 5,7, en comparación al método convencional, en medios semisólidos, bajo las mismas condiciones ambientales. Los brotes no fueron sensibles al medio líquido, en las frecuencias de inmersión utilizadas.
Líneas con frecuencias de inmersión de 1 o 5 min.4h-1 producen brotes pequeños y medianos, y la frecuencia de 2 min.4-1h sirvió para la multiplicación de los cuatro tipos de brotes, incluyendo los elongados aptos para aclimatización o fase ex vitro.
La utilización del SAH con brotes enraizados in vitro, incrementó la eficiencia en el proceso de aclimatización de plantas, ya que mejoró el porcentaje de sobrevivencia y facilitó el manejo de las mismas.
La aplicación de las dos técnicas conjuntas SIT y SAH fueron las más eficientes para la multiplicación y aclimatización de plantas.
Con las pruebas moleculares e inmunológicas se garantizó la estabilidad genética y la sanidad, respectivamente, de las plantas producidas, a través de este proceso de micropropagación.
Bibliographic References
Alvard, D., Teisson, C. (1993). Comparation of methods of liquid medium for banana micropropagation. Plant Cell Tiss Org, 32, 55-56. [ Links ]
Agresti, A. (1990). Categorical Data Analysis. John Wiley & Sons, Inc., New York. [ Links ]
Anandan, R., Thirugnanakumar, S., Sudhakar, D., Balasubramanian, P. (2011). In vitro organogénesis and plantlet regeneration of Carica papaya L. Journal of Agricultural Technology, 7, 1339-1348. [ Links ]
Aular, J., Casares, M. (2011). Consideraciones sobre la producción de frutas en Venezuela. Revista Brasileira de Fruticultura, 33, 187-198. [ Links ]
Berthouly, M., Etienne, H. (2005). Temporary immersion system: a new concept for use liquid medium in mass propagation. In Liquid Culture for in vitro Plant Propagation. A.K. Hvoslef-Eide, W. Preil (eds). pp 165-195. [ Links ]
Chen, P., Salazar, E., Fernández, H., Castro, L., Russo, A., Vásquez, S. (2011). Detección de polimorfismos RAPD en materiales de Musa sp. con respuesta diferencial al ataque de Xanthomonas campestris pv. musacearum. Agron. Tropic, 61, 125-132. [ Links ]
CIAT. (1999). Protocolos para marcadores moleculares. González, D., Palacios, N., Gallego, G., Tohme, J. (comps y eds.). 82 p. [ Links ]
Castillo, B., Smith, M., Yadava, U. (1998). Liquid system scale up of Carica papaya L. somatic embryogenesis. J. Horticultural Science and Biotechnology, 73, 307-311. [ Links ]
Clarindo, W., Carvahlo, C., Santos, F., Abreu, I., Campos, W. (2008). Recovery polyploid papaya in vitro regenerants as screened by flow cytometry. Plant Cell Tiss. Organ Cult, 92, 207-214. [ Links ]
Damiano, C., Monticelli, S., La Starza, S. R., Gentile, A., Frattarelli, A. (2002, August). Temperate fruit plant propagation through temporary immersion. In, XXVI International Horticultural Congress: Biotechnology in Horticultural Crop Improvement: Achievements, Opportunities and Limitations pp. 193-200. [ Links ]
Drew, R., Simpson, B., Osborne, W. (1991). Degradation of exogenous indole-3-butyric acid and riboflavin and their influence on rooting response of papaya in vitro. Plant Cell. Tissue and Organ Culture, 26, 29-34. [ Links ]
FAO. Food and Agriculture Organization of the United Nations. Production. (2013). Disponible en: faostat3.fao.org/download/Q/ QC/E. [ Links ]
Fitch, M. (1993). High-frequency somatic embryogenesis and plant regeneration from papaya hypocotyl callus. Plant Cell, Tissue and Organ Culture, 32, 205-212. [ Links ]
Fitch, M., Leong, T., Akashi, L., Yeh, A., White, S., De la Cruz, A., Santo, L., Ferreira, S., Moore, P. (2005). Growth and yield of clonally propagated and seedling-derived papayas. i. growth. ii. yield. Journal of Horticultural Science and Biotechnology, 40, 1283-1290. [ Links ]
Gallardo, J., Posada, L., Gómez, R.(2002). Micropropagación del híbrido cubano de Papaya IBP 42-99. Biotecnología Vegetal, 2, 211-215. [ Links ]
Greenacre, M., Hastie, T. (1987). The Geometric Interpretation of Correspondence Analysis. Journal of the American Statistical Association, 82, 437-447. [ Links ]
Guevara, Y., Rondón, A., Maselli, A., Salcedo, F., Betancourt, J. (1993). Marchitez bacteriana del lechosero Carica papaya L. en Venezuela. Agronomía Tropical, 43,107-116. [ Links ]
Homhuan, S., Kijwijan, B., Wangosomnuk, P., Bodhipadma, K. (2008). Variation of plant derived from indirect somatic em-bryogenesis in cotyledon explants of papaya. Science Asia, 34, 347-352. [ Links ]
InfoStat (2002). InfoStat, versión 1.1. Manual del Usuario. Grupo InfoStat, FCA, Universidad Nacional de Córdoba. Primera Edición, Editorial Brujas Argentina. [ Links ]
Jiménez, E. (1995). Mass propagation of tropical crops in temporary immersion systems. In: Liquid Culture for in vitro plant propagation. A.K. Hvoslef-Eide, W. Preil (eds). pp.165-195. [ Links ]
Lai, C., Dewi, P., Su, T., Lee, W. (2003). Rooting and acclimatization of micropropagated tropical fruits trees. Proc. 1st IS on Acclim. and Establt. of Micropropagated Plants. Acta Hort, 616(ISHS), 199-206. [ Links ]
López, A., Ardisana, E., Cornide, M., Coto, O., Vargas, D., Arencibia, A. (2006). Estabilidad genética de plantas de papaya (Carica papaya L., cv Maradol Roja) propagadas in vitro. Revista Innovación tecnológica, Septiembre 2006 Vol. 12 No 3. ISSN 1025-6504 - RNPS 1813 Disponible en: http://innovacion.lastunas.cu/Vol12No3/No3.htm [ Links ]
Marys, E., Carballo, J., Izaguirre-Mayoral, M. (2000). Ocurrence and relatives incidences of viruses infecting papaya in Venezuela. Annals Applied Biology, 136, 121-134. [ Links ]
May, C., Gil, F., Contreras, F., Santamaría, J. (2007). Field performance of 100% hermaphrodite micropropagated papaya plants. Acta Horticulturae, 1, 219-222. [ Links ]
Murashige, T., Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco cultures. Physiologia Plantarum, 15, 473-497. [ Links ]
Niemenak, N., Saare-Surminski, K., Rohsius, C., Omokolo, D., Lieberei, R. (2008). Regeneration of somatic embryos in Theobroma cacao L. in temporary immersion bioreactor and analyses of free amino acids in different tissues. Plant Cell Report, 27, 667-676. [ Links ]
Noa-Carranza, J., Gonzalez-de-León, D., Silva-Rosalez, L. (2007). Molecular of severe isolates of papaya ringspot virus in Mexico and its relationship with other isolates. Virus Cenes, 35,109-117. [ Links ]
Posada, L., Gómez, R., Reyes, M. (2003). Empleo Sistemas de Inmersión Temporal en la multiplicación y germinación de embriones somáticos de banano cultivar Gran Enano (AAA) y papaya var. Maradol Rojo. Biotecnología Vegetal, 3, 143 - 147. [ Links ]
Posada, L. (2005). Aplicaciones de la biotecnología a la propagación de la papaya. Biotecnologia Vegetal, 5, 67-79. [ Links ]
Rigato, S., González, A., Huarte, M. (2001). Producción de plántulas de papa a partir de técnicas combinadas de micropropagación e hidroponía para la obtención de semilla prebásica. Revista Latinoamericana de la papa, 12, 110-120. [ Links ]
Rohman, M., Islam, N., Alam, S., Rashid, M., Kumar, T. (2007). Lateral bud culture of papaya (Carica papaya) for clonal propagation. Biotechnology, 6, 339-343. [ Links ]
Solis, R., Olivera, J., La Rosa, R. (2011). Propagación in vitro de Carica papaya var. PTM-331 a partir de meristemos apicales. Rev. Peru. Biol ., 18, 343-347. [ Links ]
Talavera, C., Espadas, F., Contreras, F., Fuentes, G., Santamaría, J. (2009). Acclimatization, rooting and field establishment of micro-propagated papaya plants. In, Proc. III rd IS on Acclim. and Establt. of Micropropagated Plants. Acta Hort (ISHS), 812, 373-378. [ Links ]
Tetsushi, H., Sadao, K., Masahiko, Y., Hiroshi, F. (2008). Mass-production of papaya (Carica papaya L.) saplings using shoot-tip culture for commercial use. South Pacific Studies, 28, 87-95. [ Links ]
Recibido: 16 de Mayo de 2014; Aprobado: 21 de Mayo de 2015











 texto em
texto em