Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.1 Bogotá jan./jun. 2015 Epub 13-Jul-2021
https://doi.org/10.15446/rev.colomb.biote.v17n1.50710
Artículos/Investigación
Obtención de semilla biotecnológica de caña de azúcar (Saccharum spp. híbrido) de alta calidad genética y fitosanitaria en el Ecuador
* Research and Development Center, Unión Nacional de Cañicultores del Ecuador (UNCE). Cantón El Triunfo, vía Durán- Tambo km 53, Guayas, Ecuador.
** Biotechnology Research Center of Ecuador (CIBE, for the Spanish original). Escuela Superior Politécnica del Litoral (ESPOL), Guayaquil, Ecuador.†. Deceased on September 7, 2013.
*** Biotechnology Laboratory, Microbiology and Virology Dept., School of Biology, Universidad de La Habana (UH), Cuba Current address: Instituto de Investigaciones en Fruticultura Tropical (IIFT). Ave. 7ma. No. 3005 e/30 y 32, Miramar, La Habana, Cuba. Tel. (53-7)2025526 fitopatologia18@iift.cu.
**** President of the UNCE, to whom correspondence should be addressed: uncecanicultoresecuador@hotmail.com.
Los métodos de saneamiento de plantas se basan fundamentalmente en el empleo combinado de cultivo in vitro de meristemos con tratamientos mediante hidrotermoterapia. Este trabajo se realizó con el objetivo de obtener plantas para usar como semilla libre de patógenos sistémicos, con énfasis en la enfermedad raquitismo de los retoños de la caña de azúcar (RSD). El trabajo se llevó a cabo con diferentes cultivares de caña de azúcar, los cuales fueron previamente identificados mediante marcadores bioquímicos basados en los patrones electroforéticos de isoenzimas peroxidasas. El saneamiento se realizó en tres etapas sucesivas mediante tratamiento hidrotérmico a 52 oC durante 2h y uso del fungicida vitavax, un segundo tratamiento hidrotérmico a los meristemos a 51 oC durante 10 min y una tercera etapa donde las vitroplántulas se propagaron en presencia del antibiótico gentamicina. La detección de RSD se efectuó mediante el empleo de la técnica de tinción de haces vasculares funcionales. Los resultados permitieron la creación de un banco de germoplasma de plantas libres de los principales patógenos bacterianos sistémicos y con alta calidad genética, lo que aportó semilla básica de excelente calidad para establecer semilleros. La conservación incluyó el mantenimiento de plántulas in vitro y la creación de un "banco de ADN" que permite conservar el genofondo en condiciones de laboratorio. Se propone finalmente una metodología para la obtención de plantas saneadas a partir de yemas y meristemos.
Abreviaturas: BAP: 6-benzyl-aminopurina; LSD: Escaldadura foliar; RSD: Raquitismo de los retoños; VMCA: Virus del mosaico de la caña de azúcar; THV: tinción de los haces vasculares;
Palabras clave: Saccharum spp.; saneamiento; cultivo de yemas; meristemo
Methods for obtaining healthy plants are mainly based on the combined use of meristem in vitro culture and hydrothermo-therapy. This work was carried out in order to obtain free- pathogen plants for using as seeds, emphasizing ratoon stunting disease (RSD) of sugarcane. The work was performed using a group of sugarcane cultivars, which was confirmed the variety identification by means of peroxidases isozymes electrophoretic patterns. Plant sanitation was performed in three success sive steps by means of hydrothermal treatment at 52 °C during 2h and using the fungicide vitavax, a second hydrothermal treatment at 51 °C during 10 min to the meristem and a third step in which vitroplantlets were propagated in presence of the antibiotic gentamicin. RSD detection was done by using the staining transpiration methods (STM) of functional bundles. Results allowed the creation of a germoplasm bank of sugarcane plants free of the most important systemic bacterial pathogens, with high genetic quality, which provided basic seed of excellent quality for establishing seedlings. Conservation included an in vitro-plantlets bank and the creation of a "DNA bank" which allows preserving the genetic fond in laboratory conditions. Finally a methodology for obtaining free-pathogens plants from buds and meristems is included.
Key words: Saccharum spp.; plant sanitation; culture of buds; meristem
A la memoria de Sofía B. Korneva, quien entregó parte de su esfuerzo al desarrollo de la Biotecnología de la caña de azúcar en el Dpto. BioPlantas del Centro Nacional de Investigaciones Científicas (CNIC) en La Habana, Cuba, así como en el Centro de Investigaciones Biotecnológicas del Ecuador (CIBE) perteneciente a la Escuela Superior Politécnica del Litoral (ESPOL) y en el Centro de Investigación y Desarrollo de la Unión Nacional de Cañicultores del Ecuador (UNCE).
Introducción
La conservación y el mantenimiento de los recursos genéticos de un país, además de ser un derecho soberano, es una necesidad que permite la manipulación sobre el germoplasma de un cultivo en cuestión.
El término germoplasma se refiere al material que se conserva como semillas, cultivo de tejido o plantas establecidas en colecciones de campo que reúne la variabilidad genética intra-específica de los materiales genéticos que pueden perpetuar una especie o una población de un organismo. Existen diferentes formas de conservar el germoplasma de un cultivo. Se destacan entre ellas, la conservación in situ en bancos, colecciones o jardines, la conservación de tejidos y plantas en medios de cultivos in vitro y la crio-conservación, técnica que cobró desarrollo con el advenimiento de las técnicas de cultivo de tejido vegetal in vitro. De estos métodos, la conservación in situ en bancos es la forma más común, extendida y fácil de llevar a cabo (Demey, 2008).
En aras de resolver las necesidades crecientes de alimento, el hombre ha logrado incrementar las producciones de los diferentes cultivos agrícolas de interés. En este afán, el mejoramiento de las especies vegetales para casi todos los cultivos de interés económico ha conllevado el uso reiterado de las mejores variedades, cepas o líneas en trabajos de mejora genética. Esto ha causado que muchas de las variedades obtenidas estén emparentadas entre sí, lo que provoca una estrecha base genética. Una forma de resolver esta situación es el empleo de diversas formas genéticas cercanas a la especie en cuestión, que aportan rusticidad en dicho proceso de mejora genética.
En la caña de azúcar (Saccharum spp. híbrido) como en la mayoría de las especies comerciales cultivadas, los híbridos modernos poseen una estrecha base genética (Costet etal., 2012). Uno de los objetivos de todo programa de mejoramiento genético es precisamente ampliar esa base genética. En tal sentido, la conservación del fondo genético (genofondo) es tarea de primer orden (Min Agricultura España, 2014).
El establecimiento de un banco de semilla biotecnológica certificada es una necesidad para disponer de plantas genéticamente identificadas y libres de enfermedades para su posterior multiplicación con fines comerciales, de investigación y mejoramiento genético. Por el contrario, la propagación de plantas no tratadas, favorece la aparición de otros focos de infección, lo cual puede provocar epifitias y daño ambiental. Para el caso del Ecuador, la enfermedad "raquitismo de los retoños" (RSD) causada por la bacteria Leifsonia xili ssp. xili Davis resulta una de las principales enfermedades sistémicas de interés para la caña de azúcar.
El objetivo de este trabajo fue determinar la efectividad de los tratamientos que permitan obtener un material inicial de caña de azúcar bien identificado y libre de enfermedades sistémicas para su posterior propagación acelerada, que permita el montaje de un pequeño banco de germoplasma sano en un plazo relativamente breve.
Materiales y métodos
El trabajo se desarrolló en el Centro de Investigación y Desarrollo perteneciente a la Unión Nacional de Cañicultores del Ecuador (UNCE), ubicado en el Cantón El Triunfo km. 53 Vía Duran Tambo, cuenca baja de la Provincia del Guayas, sector Agua Santa, con una temperatura promedio anual de 25°C, precipitación media anual de 1202,2 mm, humedad relativa del 80,1% y una altura de 60 msnm, la más importante región azucarera del país.
Identificación de cultivares
Se emplearon un total de ocho cultivares de caña de azúcar de 7-9 meses de edad, de los más empleados en el Ecuador. Estos fueron previamente identificados mediante caracteres morfológicos: Ragnar, CC85-92, RD75-11, CR74-250, BJ70-46, C87-51, SP70-1143 y Mex64-1487. En este trabajo se confirmó la identificación mediante el empleo de isoenzimas peroxidasas, como describen Arellano et al. (2012). Se escogieron hojas +3 de plantas adultas de cada cultivar empleada empleado y se maceraron en Nitrógeno líquido. Luego se añadió una solución que contenía sacarosa 20% y 0,025% dietil-ditiocarbamato de sodio (DECA). La electroforesis en condiciones nativas se realizó empleando un sistema de corrida vertical, usando un gel de separación de poliacrilamida de 8,5 %, con un tampón de corrida de Tris-Glicina 0,04 M a pH 8,3. El método de tinción se basó en el empleo de o-dianisidina, en presencia del sustrato peróxido de hidrógeno.
Primera etapa de saneamiento del material vegetal
El material vegetal procedente de los cultivares de la caña de azúcar empleados en este trabajo estaba vigoroso y sin síntomas visibles de las principales enfermedades. Las estacas, con yemas laterales del tercio medio del tallo, se cortaron empleando herramientas desinfectadas con alcohol etílico al 70% y se lavaron cuidadosamente con agua corriente y detergente, sin afectar la integridad de las yemas laterales. Estas yemas se colocaron en un baño de agua caliente a 52 °C por 2 h. Después de realizar la hidrotermoterapia, las yemas se colocaron esta vez en un baño de agua helada para detener el tratamiento y puestas en una solución del fungicida vitavax® 2 g.L-1 para su desinfección. Luego de 20-25 min las yemas se incubaron a 37 °C por 12-15 días para su germinación, cubiertas con gasa y algodón humedecidos. El mantenimiento se realizó cada 48 h. Las yemas germinadas se sembraron en pequeñas fundas plásticas negras que contenían un sustrato estéril compuesto por tierra- cascarilla de arroz (tamo)-cachaza- arena en las proporciones 2:1:1:1. Luego se aplicó formol al 2% durante 15 días, aplicando posteriormente el riego diario a este material. Estas yemas germinadas en condiciones controladas se trataron con el fungicida oxicloruro de cobre 2,5 g.L-1 junto al bactericida sulfato de cobre 0,5 mg.L-1 una vez por semana.
Segunda etapa de saneamiento de plantas de caña de azúcar y establecimiento del cultivo in vitro
A los 3-4 meses después de haber sembrado las yemas saneadas en el invernadero, los verticilos apicales de las plantas que poseían 2-3 nudos visibles, se emplearon para la obtención de los meristemos apicales. Para ello se realizó la desinfección del cogollo y los meristemos apicales cubiertos con 2-3 hojas primordiales inmaduras (generalmente de color amarillento), de un tamaño de hasta 4 mm de altura y 1-2 mm de base, se extrajeron y colocaron en tubos de ensayo que contenían 10 ml de agua estéril calentada a 51 °C. Diez minutos después, la hidrotermoterapia de los meristemos se interrumpió bruscamente y se colocaron los tubos con los meristemos en agua fría a 4 °C con agitación. Las condiciones asépticas en el medio de establecimiento se mantuvieron en presencia de 0,2 mg.L-1 de 6-benzyl-aminopurina (BAP), donde permanecieron de 15 a 20 días a temperatura de 26-28 °C y 6000 lux de iluminación. Posteriormente, los cultivos se re-sembraron en el medio de multiplicación en presencia de BAP hasta lograr su establecimiento. Esta hormona solamente se añadió en la etapa de multiplicación.
Tercera etapa de saneamiento de diferentes cultivares de caña de azúcar
Una vez establecido el cultivo, las vitroplántulas se resembraron en el medio de propagación en presencia del antibiótico gentamicina 50 mg.L-1, donde permanecieron durante 7 días. Luego las plantas se resembraron en el medio de enraizamiento en presencia de altas concentraciones (20-30 g.L-1) de sacarosa y ácido 3-indol acético (AIA) (1-6 mg.L-1), eliminando las que mostraron hojas amarillentas provocadas por efecto del antibiótico y que no presentaban buenas características después del tratamiento. Las vitroplantas propagadas después de la segunda etapa de tratamiento se utilizaron para la extracción de micromeristemos, los cuales tenían dimensiones entre 0,5 a 0,8 mm bajo el microscopio estereoscópico. Una vez obtenida la cantidad de plantas necesarias, se procedió al enraizamiento y pase a fase I de aclimatización (invernadero). En todos los casos, los medios de cultivo sintéticos empleados tuvieron como base el medio descrito por Murashige y Skoog (1962), con las modificaciones descritas por Korneva et al. (1986).
Aunque se partió de plantas sanas sin síntomas evidentes de enfermedad, en cada etapa de saneamiento se evaluó la presencia de la enfermedad "raquitismo de los retoños" (RSD), en las plantas usadas como material de partida de las yemas y posteriormente en las plantas adultas obtenidas por meristemos derivadas de estos tratamientos. El análisis de confirmación empleado para el diagnóstico de la enfermedad "raquitismo de los retoños" fue el método presuntivo previamente descrito en la literatura, basado en la transpiración del tejido vegetal y el conteo de haces vasculares funcionales y no funcionales (Chagas y Tokeshi, 1994). Para ello se tomaron al azar 10 tallos adultos por réplica de cada plantón seleccionado del cultivar en estudio y se cortaron a nivel del suelo, dejando las hojas fisiológicamente activas de cada variedad a evaluar. Para la tinción de los haces vasculares los tallos se sumergieron en una solución de safranina (1,25% p/v) durante una hora y después se retiraron y dejaron secar. A partir del segundo entrenudo basal se sacaron láminas (rodajas) de 10 mm de diámetro, que se dejaron secar a temperatura ambiente. Luego se observaron en un estéreo-microscopio marca Boeco para el conteo de los haces funcionales y no funcionales, los cuales se identificaron por la presencia de una coloración rojiza o parda, respectivamente. También se usó un microscopio óptico Fischer Scientific modelo Micromaster con cámara acoplada y un objetivo con 40 aumentos para el conteo de los haces vasculares funcionales y no funcionales. Con esos resultados se calculó el porcentaje de vasos funcionales (VF) y no funcionales (VNF) según Harrison y Davis (1988), según la ecuación: % VF= VF/VT x 100% y VNF= VNF/VT x 100%, donde VT es el total de vasos evaluados.
Adicionalmente, se determinó la presencia de síntomas correspondientes a la enfermedad sistémica escaldadura foliar, causada por la bacteria Xanthomonas albilineans Ashby (Dowson).
Para la creación del banco de ADN, se llevó a cabo la extracción del material genético de acuerdo a lo descrito por Doyle y Doyle en 1983.
Resultados y discusión
La identificación de los cultivares utilizados mediante los patrones de isoenzimas peroxidasas se muestra en la figura 1. El patrón electroforético de cada cultivar resultó único, como había sido descrito anteriormente (Arellano et al., 2012). La importancia de la identificación de los cultivares obedece al hecho de evitar la presencia de mezclas varietales en los campos, situación que puede producir disminución en los rendimientos o la posibilidad de ataques inesperados por patógenos en cultivares que son resistentes, pero mezclados con otro que puede ser susceptible.
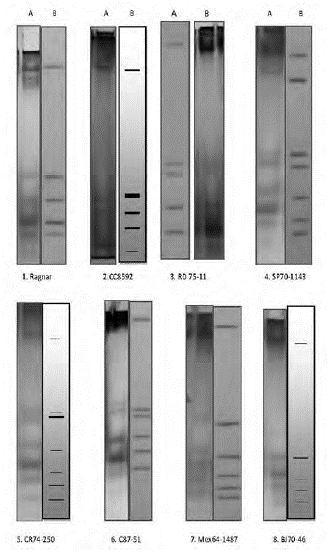
Figura 1 Patrones de electroforesis de isoenzimas peroxidasas de los cultivares de caña de azúcar empleados en este trabajo. A) patrón de electroforesis de isoenzimas peroxidasas; B) zimograma correspondiente al patrón electroforético obtenido. Cultivar: 1: Ragmar; 2: CC85-92; 3: RD75-11; 4: SP70-1143; 5: CR74-250; 6: C87-51; 7: Mex64-1487; 8: BJ70-46
Los caracteres agro-morfológicos descritos anteriormente están conformados por características fenotípicas de fácil identificación visual o medición tales como: color y altura del tallo, forma de la yema y de los entrenudos, rendimiento, susceptibilidad o resistencia a stress hídrico, plagas o enfermedades. Estos caracteres se definen como "descriptores" para cada cultivo y son aprobados por los organismos internacionales encargados de ello.
En el caso de los caracteres bioquímicos y moleculares, los descriptores estarán conformados por la expresión genotípica a través del patrón multi-banda observado para cada individuo después de su visualización mediante electroforesis de proteínas o de productos de amplificación de la molécula de ADN. Debe señalarse que en términos de bancos de germoplasma, los marcadores bioquímicos y moleculares se han convertido en uno de los descriptores más útiles y más empleados de los últimos tiempos. En este sentido, la figura 1 constituye el descriptor bioquímico empleado para el manejo de las variedades en estudio y que fue el empleado en este trabajo. Puede apreciarse que todos los patrones isoenzimáticos distinguen a cada cultivar en estudio.
Saneamiento y multiplicación de variedades de caña de azúcar destinadas para el establecimiento del banco germoplasma certificado
Con relación al saneamiento, durante el mantenimiento de las yemas tratadas, éstas se observaron detenidamente y se eliminaron los hongos que crecieron sobre la superficie, mediante el uso de algodón humedecido con alcohol. La gasa húmeda usada como soporte de las yemas, permitió mantener la humedad relativa del sistema. El lavado de las yemas laterales del tercio medio del tallo presente en las estacas, permitió un elevado nivel de desinfección sin afectar la integridad de dichas yemas. Los tratamientos semanales con el fungicida oxicloruro de cobre junto al bactericida sulfato de cobre, permitieron también estos altos índices de desinfección.
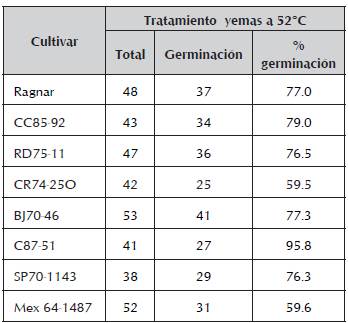
Las yemas sembradas en el sustrato estéril, mostraron diferentes porcentajes de germinación (tabla 1). Se observa que los porcentajes de germinación van desde 59,6% para el cultivar Mex64-1487 hasta 79% para CC85-92 y 95,8% para C87-51. Se conoce que los aumentos de la temperatura de tratamiento provocan disminución de la germinación de las yemas y la supervivencia de las plantas, pero trabajar a temperaturas inferiores no favorece el proceso de desinfección y saneamiento. Varios autores no lograron germinación de las yemas a los tratamientos de 50,5 °C durante 3 h (Chagas y Tokeshi, 1994). Pérez et al., (1998) informaron entre 30-44 % de germinación utilizando un tratamiento de 50,5 °C por 2 h sobre propágulos de una yema de diferentes tamaños y en diversos cultivares. Chinea y Pérez (1997) obtuvieron 30% de germinación después de aplicar similar tratamiento a yemas individuales. Pérez y Mauri (1986) solo alcanzaron un 20% de brotación de yemas tratadas a 50 °C durante 2 h. En ese sentido, los resultados de este trabajo mostraron valores de mortalidad mucho más bajos que los informados con anterioridad. Con respecto al saneamiento, no se observó la presencia de síntomas de RSD.
Tabla1. Porcentaje de germinación de los cultivares de caña de azúcar en estudio luego del tratamiento térmico a 52 oC
El principal objeto de saneamiento en la caña de azúcar en el Ecuador es la eliminación de la bacteria L. xyli ssp. xyli, aunque se ha descrito una disminución de esta enfermedad en el país (CINCAE, 2011). El diagnóstico, basado en el método presuntivo de tinción de los haces vasculares, descrito previamente por Chagas y Tokeshi (1994), es menos efectivo que otros informados, pero es de fácil desarrollo para un diagnóstico rápido. Aunque en muchos de los trabajos citados se partió de material enfermo para confirmar el saneamiento, en nuestro caso las plantas empleadas se encontraban vigorosas y libres de síntomas (figura 2). Es necesario mencionar que la metodología empleada no es la más moderna ni sensible para la detección de la bacteria. Por ello, puede haber falsos negativos dados por ejemplo por las bajas concentraciones bacterianas

Figura 2 Haces vasculares funcionales (sanos) del cultivar de caña de azúcar CC85-92. Obsérvese la coloración rojiza correspondiente a la tinción empleada. En la parte inferior izquierda la flecha indica un vaso dañado.
Varios trabajos sobre esta temática realizaron el diagnóstico basado en el análisis dotblot y por inmuno-fluorescencia indirecta (IFI). Hernández et al., (1997) detectaron presencia de RSD, por lo que el tratamiento térmico no resultó efectivo en ningún caso para la eliminación de L. xyli. Ramallo y de Ramallo (2001) coincidieron con esos informes, donde no lograron saneamiento a RSD con el tratamiento hidrotérmico a 50,5°C durante 2h, aplicado a propágulos de una yema, aunque lograron la atenuación de la bacteria. Resultados similares obtuvieron Pérez et al., (1998), quienes no consiguieron erradicar el patógeno empleando igual tratamiento, aunque si se disminuyó la concentración de células de la bacteria. Algunos de estos tratamientos no resultaron efectivos debido a diversas causas. Iglesia et al. (2007a) observaron dispersión en los datos de las diferentes determinaciones de cada variedad lo que podía atribuirse a la respuesta individual de cada planta y según el genotipo empleado. Esto obliga a que las evaluaciones abarquen un número superior de muestras, que las establecidas. Otra causa podía ser el número insuficiente de tratamientos. Algunos autores han planteado la necesidad de realizar como mínimo tres tratamientos sucesivos de hidrotermoterapia a semilla comercial, además de aplicar las medidas de control adecuadas, para poder controlar eficientemente el RSD. Se ha determinado también que un solo tratamiento no logra la inactivación total del organismo causal de la enfermedad (Chinea y Pérez, 1997; Piñón, 2001). Sin embargo, debe tenerse en cuenta que tratamientos sucesivos también disminuyen el porcentaje de germinación de las yemas.
En el presente trabajo, aunque no fue un objetivo esencial, tampoco se detectaron síntomas de la enfermedad sistémica Escaldadura foliar, causada por la bacteria Xanthomonas albilineans Ashby (Dowson). Hay que destacar que el cultivar CC85-92, uno de los de más rápido crecimiento entre los cañicultores en el Ecuador, es susceptible a esta enfermedad. Por tanto, la aplicación de estas técnicas de saneamiento, en combinación con la aplicación de la micropropagación acelerada mediante cultivo in vitro de meristemos, Arellano et al., (2009) evidencian una disminución de la incidencia de estas dos enfermedades bacterianas sistémicas.
Segunda etapa de saneamiento de plantas de caña de azúcar y establecimiento de cultivo in vitro
El saneamiento de los verticilos apicales de plantas de 3- 4 meses provenientes de las yemas saneadas en el invernadero, se muestra en la tabla 2. La tabla muestra el número de meristemos a los que se les realizó termoterapia, de estos los que sobrevivieron al salir de P0 y su porcentaje, luego los que pasaron a P1 y sobrevivieron y finalmente en P2 el total de brotes obtenidos. Puede apreciarse que los porcentajes de supervivencia van desde 65,6% para el cultivar Mex64-1467 hasta 96% para C87-51 en el primer pase. Este comportamiento evidencia la dependencia del cultivar con relación a la supervivencia.
Tabla 2 Tratamiento térmico a meristemos de los cultivares de caña de azúcar en estudio provenientes de las yemas tratadas.
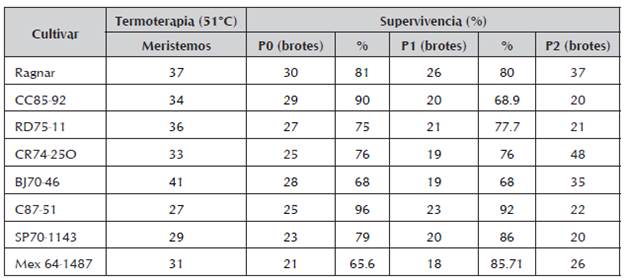
En las técnicas de cultivo in vitro de tejido, la mayor pérdida del material vegetal ocurre en los primeros pases P0 y P1 por el establecimiento del cultivo. A partir de P2 esto disminuye, pues la planta se ha formado completamente. Por esa razón se evaluó el porcentaje de sobrevivencia en P0 y P1.
A pesar de los controles en las condiciones experimentales, no fue posible disminuir las pérdidas ocasionadas en esta etapa. Las excesivas manipulaciones del material vegetal (manejo de instrumentos, calor excesivo, corte inadecuado del meristemo) pudieran ser algunas de las causas de las pérdidas. Estas pérdidas en la supervivencia no pueden vincularse a una reducción de la masa seca, la cual está asociada a la presencia de brotes hiperhídricos. Según Kevers et al. (2004), la hiperhidricidad implica problemas de diferenciación celular, por lo que los brotes no pueden tener un desarrollo morfo-fisiológico normal. Este fenómeno que no ha sido dilucidado completamente ha sido descrito como un desorden multicausal (Quiala et al., 2012).
El cultivar Mex64-1467, que durante el tratamiento prolongado a 51 °C resultó el de más bajo porcentaje de germinación, mostró también los menores porcentajes de supervivencia.
Debe señalarse que la utilización de 6-BAP en el medio de establecimiento facilitó el incremento del número de brotes a pesar de la aplicación del tratamiento térmico prolongado. El 6-BAP ha sido utilizado con éxito para estimular la proliferación de brotes en diferentes protocolos de cultivo in vitro de otros cereales (Martínez-Medina et al., 2012; Medina et al., 2012; Syamala y Devi, 2003).
Tercera etapa de saneamiento de diferentes cultivares de caña de azúcar
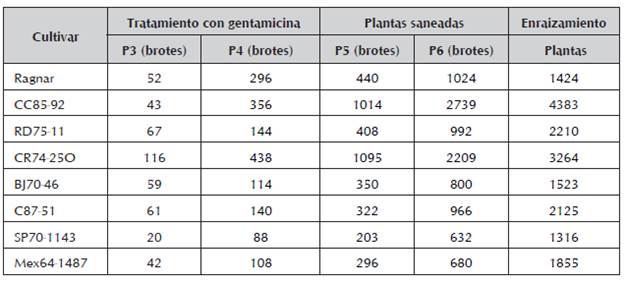
El siguiente paso de resiembra de las plantas en el medio de propagación en presencia de 50 mg.L-1 del antibiótico gentamicina, permitió incrementar el número de brotes, el número de plantas saneadas y consecuentemente, el número de plantas en fase de enraizamiento (tabla 3). La inclusión de este antibiótico de amplio espectro, facilitó la disminución de la contaminación exógena. En estas condiciones de trabajo, este paso conlleva el empleo de antibióticos y el uso de micromeristemos como un tercer tratamiento. La tabla muestra el incremento en el número de plantas en los sucesivos pases, desde P3 hasta P6, que alcanzaron hasta miles de plantas saneadas y enraizadas.
Tabla 3 Tratamiento con antibiótico y número de plantas saneadas de los cultivares de caña de azúcar en estudio
Como ya se ha referido antes, en estos experimentos se partió de material libre de enfermedades, o al menos sin síntomas visuales de las mismas. En estas circunstancias resulta difícil referirse a saneamiento si se parte de plantas de apariencia sana y vigorosa, pero la idea inicial era garantizar la creación de un banco de germoplasma listo para utilizarse como semilla básica de forma inmediata.
El empleo de ápices meristemáticos ha sido empleado para la micropropagación de la caña de azúcar. Victoria et al. (1998) lograron eliminar a la bacteria causante del Raquitismo al utilizar tratamientos combinados de hidrotermoterapia previo al cultivo de meristemos. Similares resultados obtuvieron Peteira et al. (1992) quienes alcanzaron entre 96-100% de saneamiento al combinar el cultivo de ápices con termoterapia (50º C durante 10 minutos). El empleo de sistemas combinados ha logrado la eliminación del RSD y también de otros patógenos sistémicos de la caña de azúcar, como la bacteria causante de la escaldadura foliar y el Virus del mosaico de la caña de azúcar (Matsuoka et al., 1988; Sordi y Tokeshi, 1988; Matos, 2002; McGuire et al., 2009).
Con respecto al diagnóstico, aunque el método empleado fue el de tinción de los haces vasculares (STM) descrito por Chagas y Tokeshi (1994), hay que señalar que su carácter presuntivo permite facilitar el análisis y elevar los volúmenes de muestras por su relativa simplicidad, pero puede provocar confusión con otras patologías. El método ha sido previamente empleado como una alternativa inicial a los trabajos de diagnóstico (Iglesia et al., 2007a) y a pesar de la falta de precisión dada por la inespecificidad de los síntomas de esta enfermedad, lo simple del método facilita su realización, ejecución directa en el campo, así como la poca necesidad de equipamiento para el conteo de los haces funcionales y no funcionales. A la vez permite disponer de una escala para interpretar los resultados.
Una posibilidad que brindan los bancos de germoplasma es conservar y mover material de alta calidad fitosanitaria. La utilización de termoterapia junto a la desinfección del material de trabajo, es una práctica antigua pero muy eficiente para erradicar patógenos que se mueven de forma sistémica a través del vegetal. En el caso de trabajar con meristemos in vitro, su pequeño tamaño y su velocidad de propagación disminuyen extraordinariamente la probabilidad de desarrollo de esos patógenos sistémicos, bacterias o virus principalmente. Unido a esto, se conoce de la existencia de sustancias que actúan impidiendo el desarrollo de patógenos, en particular la presencia de guanina, que según estudios realizados, parece tener una acción antimicrobiana (Shuravlev, 1979).
La preservación de los recursos fitogenéticos entendidos éstos como el material hereditario con valor económico, científico o social contenido en las especies, es de importancia capital en la lucha contra diferentes calamidades, como el hambre, la malnutrición mundial, pero también el decaimiento genético de los cultivos y la pérdida de diversidad genética. Es aquí donde juegan un papel importante los bancos de germoplasma y de genes. Los bancos de germoplasma resguardan la fuente de variabilidad requerida por los mejoradores de plantas para el desarrollo de cultivares que permitan al agricultor superar las limitaciones naturales a fin de obtener mayores beneficios de su actividad, así como asegurar la fuente contra la erosión genética (Demey, 2008). Los estudios de la diversidad genética dentro de estos bancos de genes son una de las herramientas que ayudan a tener un control más efectivo sobre la erosión genética. Permiten definir los patrones de variación que determinan la incorporación de individuos a programas de mejoramiento genético, ya sea por sus características promisorias o por susceptibilidad a condiciones bióticas o abióticas, facilitando la incorporación de genes y el establecimiento de la mejor estrategia reproductiva. Esto garantiza la elevada calidad genética.
Un importante aspecto que se debe también señalar como resultado de este trabajo es el mantenimiento de un Banco de germoplasma in vitro con las variedades que hay en el banco in situ en el campo. Aunque no se muestran detalles en este trabajo, como complemento de ésto, el genofondo se conservó a través del mantenimiento del ADN a temperaturas de -20 oC durante tiempos prolongados. Esta creación de los bancos in vitro y del "banco de ADN" permite conservar el material genético en espacios muy reducidos, durante largos periodos con independencia de las condiciones ambientales.
Finalmente, se propone una metodología de obtención de material agámico de caña de azúcar, donde se combinan el tratamiento hidrotérmico con el cultivo de yemas mediante la micropropagación de meristemos en diferentes etapas. Esta propuesta de metodología esta fundamentalmente dirigida a la enfermedad bacteriana sistémica de la caña de azúcar RSD (Leifsonia xyli ssp. xyli Davis), aunque puede favorecer la disminución de otras enfermedades sistémicas del cultivo como la LSD (Xanthomonas albilineans Ashby Dowson), que se está presentando con frecuencia en un cultivar en crecimiento en el Ecuador como es CC85-92, así como la enfermedad viral Mosaico de la caña de azúcar (VMCA). Con relación al método de confirmación del saneamiento, éste constituye el primer acercamiento, pues debe completarse con el análisis basado en los métodos moleculares (PCR) para ambas enfermedades bacterianas. Estos resultados están en fase de complementación con el método molecular basado en la reacción en cadena de la polimerasa (PCR), con el empleo de cebadores específicos de la bacteria Leifsonia xyli spp. xyli y con el método inmunoquímico ELISA. En la actualidad estos métodos son los más empleados y poseen una alta eficiencia de detección (Iglesia et al., 2007b; Taher-Khani, 2010). Partir de un material vigoroso y al parecer libre de la enfermedad, dificultó la certeza de si efectivamente el saneamiento se llevó a cabo. Sin embargo, la no aparición de los síntomas confirmó la limpieza del material, aun cuando se empleó el método presuntivo de tinción de los vasos no funcionales.
Con relación a la micropropagación, es conocida la condición de rejuvenecimiento fisiológico que introduce y que ha sido descrita desde los primeros trabajos de propagación in vitro de meristemos.
Todos estos datos constituyen importante información para lograr un manejo adecuado en la utilización de los recursos fitogenéticos de la caña de azúcar.
Además de lo anterior, este trabajo puede constituir una estrategia para prevenir o disminuir la diseminación de estas enfermedades sistémicas, mediante la entrega a los Cañicultores de semilla de alta calidad fitosanitaria y genéticamente bien identificada, como la obtenida por estos procedimientos. De igual forma, esta semilla puede constituir un material idóneo para el intercambio genético entre países.
Conclusiones
Se propone una metodología para obtención de semilla de alta calidad genética, que combina los tratamientos hidrotérmicos con las manipulaciones de los meristemos, los cuales favorecen el proceso de saneamiento.
Se estableció un banco de donantes que sirve como material para plantar semilleros de semilla básica, que permita controlar la diseminación de algunas enfermedades sistémicas como el RSD.
Agradecimientos
Los autores desean agradecer a la Asistencia Oficial para el Desarrollo de Japón y al Ministerio de Agricultura, Ganadería, Acuacultura y Pesca (MAGAP) por el financiamiento a partir del Proyecto 2KR; también a la Unión Nacional de Cañicultores del Ecuador (UNCE), por el apoyo financiero y las facilidades para el desarrollo de este trabajo. Agradecemos igualmente al Ing. Rodolfo Samaniego, al Ing. Carlos A. Ochoa y a Jorge Franco por su ayuda invaluable en diferentes etapas del trabajo. M. Ramos-Leal agradece al acuerdo de colaboración "Biotecnología de la caña de azúcar y empleo de residuos de la agro-industria azucarera", entre el Laboratorio de Biotecnología del Dpto. Microbiología y Virología de la Facultad de Biología de la Universidad de La Habana, la UNCE y las Facultades de Ciencias Agrarias y Ciencias Naturales de la Universidad de Guayaquil, Ecuador, que ha permitido realizar parte de este trabajo.
REFERENCIAS
Arellano, A.C., Korneva, S.B., Fischer, F.C., Cabanilla, L., Tola, N., Ochoa, L.A., Ramos- Leal, M. y Pincay, A. (2009). Micropropagación de caña de azúcar en Ecuador. Revista Biotecnología Vegetal, 9(4), 235-238 [ Links ]
Arellano, A.C., Ramos-Leal, M., Korneva, S., Pilco, J., Chávez, G., Cabrera, C. y Pincay, A. (2011). Evaluación de la resistencia a la roya parda (Puccinia melanocephala Syd.) de somaclones de caña de azúcar (Saccharum spp. híbrido) obtenidos en el Ecuador. Rev. Fitosanidad, 15(4), 245-250 [ Links ]
Arellano, A.C., Ramos-Leal, M., Loor, Z., Cabanilla, L., Korneva, S.B. y Pincay, A. (2012). Identificación de cultivares comerciales de caña de azúcar (Saccharum spp. híbrido) mediante el empleo de isoenzimas peroxidasas. Revista CENIC Ciencias biológicas, 43(3). [ Links ]
CINCAE. (2011). Informe Anual del Centro de Investigaciones de la Caña de Azúcar del Ecuador. Manejo de Enfermedades, 12-17. [ Links ]
Chagas, P.R.R., Tokeshi, H. (1994). Staining by transpiration method for the diagnosis of ratoon stunting disease in sugarcane. In Rao GP, Gillespie A, Upadhyaya P, Filho B, Agnihotri V, (eds.) Current Trends in Sugarcane Pathology, New Delhi, India, 159-162 [ Links ]
Chinea, A. y Pérez, J.R. (1997). Secuencia y manejo de la hidrotermoterapia para el control de enfermedades de la caña de azúcar. Rev. Asociación de Técnicos Azucareros de Cuba (ATAC), 1, 31-34. [ Links ]
Costet, L., Le Cunff, L., Royaert, S., Raboin, L.M., Hervouet, C., Toubi, L., Telismart, H., Garsmeur, O., Rousselle, Y., Pauquet, J., Nibouche, S., Glaszmann, J.C., Hoarau, J.Y. and D'Hont, A. (2012). Haplotype structure around Bru1 reveals a narrow genetic basis for brown rust resistance in modern sugarcane cultivars. Theoretical and applied genetics, 125(5), 825-36. [ Links ]
Demey, J.R. (2008). Diversidad genética en bancos de germoplasma: un enfoque biplot. Disertación de Tesis doctoral. Univ. Salamanca, España, 244 p. [ Links ]
Graur, D. and Wen-Hsiung, R.I. (2000). Fundamentals of Molecular Evolution. Sinauer Associates Inc. USA, 481p. [ Links ]
Harrison, N.A. and Davis, M.J. (1988). Colonization of vascular tissues by Clavibacter xyli subsp. xyli in stalks of sugarcane cultivars differing in susceptibility to ratoon stunting disease. Phytopathol, 78(6), 722-727. [ Links ]
Hernández, R., Igarza, C.Y., González, Y., Peralta, E.L., Fontanella, R.J., Noa, C.J., Pichardo, T., Alonso, E., García, L. y Rodríguez, M. (1997). Nuevo método para el saneamiento a bacterias y virus en caña de azúcar (Saccharum officinarum. híbrido). Cuaderno de Fitopatología, 3, 153-157. [ Links ]
Iglesia, A., Peralta, E.L., Álvarez, E., Milián, J. y Matos, M. (2007a). Nueva escala de evaluación de la resistencia varietal frente al raquitismo de los retoños de la caña de azúcar en Cuba. Revista Protección Vegetal, 22 (1), 34-40 [ Links ]
Iglesia, A., González, R., Martín, D., Díaz, M. y Álvarez, E. (2007b). Aislamiento e identificación morfológica, bioquímica y molecular de Leifsonia xyli ssp. xyli en Cuba. Revista Protección Vegetal, 22 (1), 29-33 [ Links ]
Kevers, C., Franck, T., Strasser, R.J., Dommes, J. and Gaspar, T. (2004). Hyperhydricity of micropropagated shoots: a typically stress-induced change of physiological state. Plant Cell, Tissue and Organ Culture, 77(2), 181-191 [ Links ]
Korneva, S.B., Maribona, R.H. and Ruiz, A. (1986). In vitro cultures of sugarcane Proc. XIX ISSCT Congress, Commission Biotechnology. Jakarta, Indonesia. [ Links ]
Martín, A. (2002). Los marcadores genéticos en la Mejora Vegetal. En: Genómica y Mejora Vegetal. Nuez, F.; Carrillo, J.M.; Lozano, R. (Eds). Mundi-Prensa. Sevilla, 37-64 [ Links ]
Martínez- Medina, S.J., Gómez- Koski, R., Posada, L., Barbón, R., Acosta, M., Reyes, M., Pérez, M., Torres, D., Pons, M., La O, M., Aguilera, A. y Tejeda, M. (2012). Efecto de dos citoquininas, ácido ascórbico y sacarosa en la obtención de plantas in vitro de Sorghum bicolor para la formación de callos. Revista Colombiana de Biotecnología, 14(2), 101-110. [ Links ]
Matos, M. (2002). Escaldadura foliar: Evaluación de métodos para el saneamiento y comportamiento de variedades comerciales de caña de azúcar. Tesis de Maestría. Facultad de Biología, Universidad de La Habana, Cuba., 60 pp. [ Links ]
McGuire, P., Bambach, G., Aiteken, R., Beattie R. and Lokes, S. (2009). RSD control in the NSW industry. Proceedings of the Australian Society of Sugarcane Technologists. 31, 195-203. [ Links ]
Matsuoka, S., Lee, T.S.G. and Masuda, Y. (1988). Proposal for international exchanges of sugarcane clones using meristem tip culture plantlets. Brazil National Program of sugarcane breeding, 1-7. [ Links ]
Medina, R., Faloci, M., Marassi, M.A. and Mroginski, L.A. (2004). Genetic stability in rice micropropagation. Biocell , 28 (1), 13-20 [ Links ]
Ministerio de Agricultura, Conservación y Medio Ambiente de España. (2014). Estrategia Española de conservación vegetal 2014-2020. Principios y orientaciones para la conservación de la diversidad vegetal silvestre en España. Edic. Minist. Agricultura, Conservación y Medio Ambiente de España. 77 p. [ Links ]
Murashige, T. and Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum, 15, 443-497 [ Links ]
Pérez, J.R., Montalbán, J., Figueredo, Y., Matos, M., Abrantes, I., Barroso, G. y Delgado, G. (1998). Evaluación del sistema tradicional de producción de semilla empleado en Cuba para el control de enfermedades de la caña de azúcar. Informe Final de Proyecto CITMA. Cod: 00101043. INICA. Cuba. 32 pp [ Links ]
Pérez-Vicente, L. y Mauri, F. (1986). Efectividad del tratamiento con agua caliente a la semilla de caña de azúcar sobre las infecciones de Ustilago scitaminea. Agrotecnia de Cuba, 18 (2), 81-82. [ Links ]
Peteira, B., González, T., Orta, C., Lagomasino, I. y Maribona, R.H. (1992). Saneamiento de RSD por cultivo de meristemo. Revista Protección Vegetal, 7 (2-3), 97-101. [ Links ]
Piñón, D. (2001). Hacia una fitoprotección ecológica de plagas en el SEFIT. En: Curso de actualización en temáticas de sanidad vegetal (SEFIT). Piñón D. (ed.). Edit. Instituto de Investigaciones de la Caña de Azúcar (INICA), 1-10. Cuba [ Links ]
Quiala, E., Cañal, M.J., Meijón, M., Rodríguez, R., Chávez, M., Valledor, L., de Feria, M. and Barbón, R. (2012). Morphological and physiological responses of proliferating shoots of teak to temporary immersion and BA treatments. Plant Cell, Tissue and Organ Culture (PCTOC), 109(2), 223-234 [ Links ]
Ramallo, J. y Ramallo, N.E.V. (2001). Aplicación de la hidrotermoterapia para la obtención de caña semilla de sanidad controlada. Avance Agroindustrial (Argentina). Junio, 22(2), 16-18. [ Links ]
Shuravlev, Y.U.H. (1979). Fitoviruses en las plantas y sistemas de modelaje. En Cultivo de tejidos de plantas. Edit. Nauka, Moscú, 28-41. [ Links ]
Sordi, R. and Tokeshi, H. (1988). Cleaning leaf scald-infected sugarcane plants using in vivo thermotherapy plus meristem tip culture. Brazil National Program of sugarcane breeding, 1-9. [ Links ]
Syamalay, D. and Devi, P. (2003). Efficient regeneration of sorghum (Sorghum bicolor L. Moench) from shoot tip explants. Indian Journal Experimental Botany, 41 (12), 1482-1486 [ Links ]
Taher-Khani, K. (2010). Bases metodológicas para el desarrollo de un programa de manejo integrado contra la enfermedad raquitismo de los retoños en Irán. Disertación de Tesis doctoral. Instituto de Investigaciones de la Caña de Azúcar (INICA), Cuba. 100 pp. [ Links ]
Victoria, J.I., Guzmán, M.L, and Jaramillo, A.D. (1998). Disease-free nurseries in sugarcane. Ratoon Stunting Disease Workshop. 7th Internat. Cong. Plant Pathol. Edinburgh, Scotland. 1998. [ Links ]
Recibido: 28 de Noviembre de 2014; Aprobado: 24 de Abril de 2015











 texto em
texto em 


