Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.1 Bogotá Jan./June 2015 Epub July 13, 2021
https://doi.org/10.15446/rev.colomb.biote.v17n1.50741
Artículos cortos
Efecto de un bioinoculante a partir de consorcios microbianos nativos fosfato solubilizadores, en el desarrollo de pastos Angleton (Dichantium aristatum)
* PhD in Chemistry, GRUBIODEQ (Biotechnology Research Group), School of Basic Sciences, Universidad de Córdoba, Cra 6 Nº 74-103, Apartado aéreo 354. Montería, Córdoba-Colombia. Tel.: +57 (094)7861018 Ext.: 305. (Email: *lara_mantilla_cecilia@hotmail.com; lara.mantilla.cecilia@gmail.com; clara@unicordoba.edu.co)
** MSc. in Biotechnology. GRUBIODEQ (Biotechnology Research Group), School of Basic Sciences, Universidad de Córdoba, Cra 6 Nº 74-103, Apartado aéreo 354. Montería, Córdoba-Colombia. Email: Jorkaett@hotmail.com; Jorkaett14@gmail.com
El objetivo fue evaluar la capacidad solubilizadora de fosfatos de consorcios formados por bacterias nativas de los géneros Burkholderia cepacia, Pseudomonas sp, Pseudomonas luteola y Pantoea sp, con el fin de encontrar el más eficiente. Se realizaron pruebas de antagonismo entre las cepas y se formaron consorcios probando todas las combinaciones posibles en las concentraciones de 106, 107, 108 UFC/mL. Se realizaron evaluaciones cualitativas y cuantitativas de la solubilización de fosfatos y teniendo en cuenta éstos resultados, se preparó un bioinoculante el cual fue evaluado en semillas de plantas de pasto angleton (Dichantium aristatum) a escala de laboratorio, utilizando un diseño estadístico completamente al azar (DCA) con 3 tratamientos y 5 repeticiones: Tratamiento 1 semillas (control), Tratamiento 2, semillas tratadas con el consorcio de microorganismos seleccionado y Tratamiento 3, semillas tratadas con fertilizantes comerciales DAP y Urea. Se evaluaron las variables número de hojas, área foliar, longitud de la planta, longitud de la raíz y peso seco de todas las plantas. Los resultados de la prueba de antagonismo indicaron que no existe inhibición en el crecimiento de las cepas evaluadas, por lo tanto se formaron consorcios los cuales mostraron mayor eficiencia en la solubilización del fósforo, destacándose el consorcio formado por Pantoea sp + Pseudomonas sp a una concentración de 108 UFC/mL y con índices de solubilización de 5,3 y 842 ppm. En las plantas se evidenció un incremento significativo en los parámetros peso seco y área foliar usando el consorcio microbiano, indicando mayor beneficio en comparación con el control.
Palabras clave: Burkholderia cepacia; Pseudomonas sp; Pseudomonas luteola; Pantoea sp; bioinoculante
The objective was to evaluate the ability of phosphate solubilizing consortium of native bacteria of the genus Burkhold-eria cepacia, Pseudomonas sp, Pseudomonas luteola and Pantoea sp, in order to find the most efficient. Antagonism tests were conducted between strains and consortia were formed using all possible combinations in the concentrations of 106, 107, 108 CFU / mL. Qualitative and quantitative determinations of the solubilization of phosphates were performed and considering these results, was prepared a bio-inoculant which was evaluated in plant seeds of grass angleton (Dichantium aristatum) laboratory scale, using a statistical completely randomized design (CRD) with 3 treatments and 5 repetitions: control Treatment 1 seeds; Treatment 2, seeds treated with the consortium of microorganisms selected and Treatment 3, seeds treated with commercial fertilizers DAP and Urea. The parameters, number of leaves, leaf area, plant length, root length and dry weights of all plants, were evaluated. The test results indicated that there is no antagonism inhibition in the growth of the strains tested thus formed consortia which showed greater efficiency phosphorus solubilization, highlighting the consortium of Pantoea sp + Pseudomonas sp at a concentration 108 CFU / mL and 5.3 solubilization rates and 842 ppm. In plants showed a significant increase in dry weight and leaf area parameters, indicating greater benefit with respect to the control treatment.
Key words: Burkholderia cepacia; Pseudomonas sp; Pseudomonas luteola; Pantoea sp; bio-inoculant
Introducción
El fósforo (P) es después del nitrógeno (N) el nutriente esencial para el desarrollo y crecimiento de las plantas (Coyne, 2000). Desempeña un gran papel en la síntesis de proteínas, biosíntesis de lípidos, síntesis de clorofila, compuestos carotenoides y metabolismos de los ácidos orgánicos; interviene en la biogénesis de los glúcidos en la cual aporta energía en forma de ATP o ADP en la reacción de fotosíntesis importante para muchos procesos (Navarro y Navarro, 2003). Sin embargo, el fósforo soluble es un nutriente limitado para producción de biomasa en un ecosistema natural (Hameeda et al., 2006).
La deficiencia del fósforo en el suelo influye en el tiempo de la cosecha y madurez del desarrollo de la planta, disminuyendo el rendimiento de los cultivos; hecho que conlleva a la implementación de fertilizantes químicos fosforados, fósforo que se acumula en formas no solubles ni asimilables, debido a que, al adicionarlo al suelo el fósforo soluble reacciona con iones como el calcio, hierro o aluminio que provoca su precipitación o fijación, disminuyendo su disponibilidad para los vegetales (Fernández et al., 2005).
Algunas especies microbianas del suelo tienen la capacidad de convertir las formas insolubles del fósforo en formas asimilables para las plantas; la acción de solubilización puede generarse a través de procesos como producción de ácidos orgánicos, quelación e intercambio de reacciones (Begonia et al., 2004). Los biofertilizantes son insumos biológicos basados en microorganismos que viven en el suelo o en la planta y que cumplen funciones directas o indirectas en la nutrición de ésta, bien sea, supliendo, captando o haciendo disponible elementos esenciales para los cultivos, así como, suministrándole sustancia promotoras de crecimiento vegetal e inductoras de resistencia sistémica ante condiciones de estrés biótico o abiótico (López, 2010). Los biofertilizantes o inoculantes microbianos se constituyen en un componente vital para los agroecosistemas, al movilizar o hacer más asimilable, elementos esenciales como el caso del fósforo. Dentro de los microorganismos que han demostrado tener eficiencia en la solubilizacón de fosfatos se encuentran varios géneros destacándose Burkholderia cepacia, Pseudomonas sp, Aeromonahy drophilia, Pseudomonas luteola, Pseudomonas putida, Enterobacter sakasaki, Pantoea sp y Enterobacter cloacae (Lara et al., 2011).
Los biofertilizantes basados en microorganismos rizosféricos son una alternativa emergente a los fertilizantes químicos inorgánicos para incrementar la fertilidad y producción de cultivo en agroecosistemas sustentables, debido a que son productos basados en microorganismos con funciones importantes en la nutrición vegetal, ha mostrado efecto benéficos para los cultivos reduciendo el uso indiscriminado de sustancias químicas y de mejorar la cantidad y calidad de los recursos internos (Echeverri y Castilla, 2008; Wu et al., 2005). Por lo anteriormente mencionado, es de gran interés el estudio de los microorganismos solubilizadores de fosfato y los posibles consorcios que se pueden dar entre ellos para aumentar la disponibilidad del elemento, de esta forma se reducen los costos en el sector agrícola unas de las principales bases de la economía del departamento de Córdoba al igual que otros departamentos de Colombia.
La región de Córdoba además de ser agrícola es considerado una importante zona ganadera que sustenta la alimentación de los animales principalmente en las especies forrajeras existentes como la gramínea Dichantium aristatum (pastos Angleton). Esta planta es muy apetecible por el ganado y es utilizado en la fabricación de heno, para suplir las necesidades alimenticias de los animales en procesos de producción de carne o leche, a un costo mucho menor que los concentrados (Cuadrado et al, 2003). Sin embargo las áreas de cultivo del pasto Angleton han sido sometidas al uso excesivo de fertilizantes químicos lo cual ha influido en la desestabilización ecológica del suelo afectando negativamente la actividad microbiana comprometida en la nutrición vegetal; como consecuencias se ha limitado los nutrientes disponibles para las plantas (dentro de ellos el fósforo) siendo necesario la búsqueda de alternativas que puedan mejorar este panorama.
Conociendo la importancia del fósforo para el óptimo desarrollo de las plantas y teniendo en cuenta la problemática que conlleva una baja disponibilidad de P en el cultivo de pastos Angleton, se evaluó la capacidad solubilizadora de fosfato de consorcios formados por bacterias nativas de los géneros Burkholderia cepacia, Pseudomonas sp, Pseudomonas luteola y Pantoea sp, con el fin de buscar el más eficiente, para ser empleados en la producción de biofertilizantes aplicados a plantas de pastos Angleton.
Materiales y métodos
Pruebas de antagonismo
Se utilizaron las cepas nativas Burkholderia cepacia, Pseudomonas sp, Pseudomonas luteola y Pantoea sp. aisladas de suelos rizosféricos de zonas cultivables del departamento de Córdoba - Colombia, que demostraron ser eficientes en su capacidad de solubilizar fosfato y que pertenecen al Banco de cepas del laboratorio de Biotecnología GRUBIODEQ (Universidad de Córdoba) (Lara et al., 2011). Las cepas fueron sometidas a pruebas de antagonismo con el fin de verificar que no existiera inhibición entre ellas y así poder formar los consorcios; las pruebas de antagonismo se realizaron en el agar Mueller Hinton, mediante la técnica de difusión en agar (Beltrán et al., 2005). El criterio de eliminación de cepas se determinó por la presencia de halos de inhibición de crecimiento con diámetros mayores a 5 mm entre la cepa sembrada masivamente y la cepa enfrentada (Barragán et al., 2003).
Pruebas cualitativas y cuantitativas
Para la realización de las pruebas cualitativas y cuantitativas se fabricaron biopreparados de cada cepa, empleando Erlenmeyers de 100 mL que contenían 45 mL de medio de cultivo estéril y teniendo en cuenta las condiciones de crecimiento microbiano: temperatura ambiente (28±2°C), tiempo de incubación de 12 -18 horas y agitación constante de 150 rpm. Se produjeron biopreparados de concentraciones de 108,107 y 106 UFC/mL, las cuales fueron cuantificadas a través de diluciones seriadas por la técnica de microgota (Moreno et al., 2000). Posteriormente se procedió a realizar la evaluación cualitativa y cuantitativa de la capacidad solubilizadora de fosfato de las cepas nativas individual, como en consorcio, a concentraciones 108, 107 y 106 UFC/mL; los consorcios se formaron con las cepas aisladas que no presentaron ningún efecto antagonista a concentraciones iguales.
Evaluación cualitativa de la solubilización de fosfato
A los biopreparados elaborados con cepas puras por individual y en consorcios, se les determinó en medio NBRIP (Nautiyal, 1999), la capacidad cualitativa de solubilización de fosfatos que presentaban los microorganismos a concentraciones de 108,107 y 106 UFC/mL. Las cajas de NBRIP luego de ser inoculadas por la técnica de pozos, con cada una de las cepas puras y con el consorcio bacteriano, se incubaron a 28 °C durante 14 días hasta la aparición de halos claros alrededor de las UFC solubilizadoras de fosfato. El tamaño de los halos se calculó según el índice de solubilización: IS=A/B (A: diámetro de la colonia + diámetro del halo y B: diámetro de la colonia) (Kumar y Narula, 1999) las mediciones se realizaron a los 7 y 14 días respectivamente después de la inoculación con el fin de evaluar el comportamiento de las cepas a través del tiempo. Todos los ensayos se realizaron por triplicado.
Evaluación cuantitativa de la solubilización de fosfato
La capacidad cuantitativa de solubilización de fosfato se determinó en medio NBRIP (Liquido), se utilizó el método colorimétrico ácido vanadomolibdofosforico (Kitson y Mellon, 1944) basado en una solución diluida de ortofosfato, el molibdato amónico reacciona en condiciones ácidas para formar un heteropoliácido, ácido molibdofosfórico. En presencia de vanadio forma ácido vanadomolibdofosfórico amarillo, la intensidad del color amarillo es proporcional a la concentración de fosfatos. Por éste método se evalúan bacterias que poseen capacidad de solubilizar componentes fosfatados inorgánicos insolubles, como el fosfato tricalcico, fosfato dicalcico y hidroxiapatitas. Para esta prueba se tomó 1 mL de biopreparado y se adiciono a 9 mL de medio NBRIP estéril, se incubó por 72 h a temperatura ambiente (28±2 °C), en agitación constante a 150 rpm; trascurrido este tiempo, se tomó el sobrenadante, se aplicó el reactivo (vanadomolibdato) y se leyó la absorbancia a la longitud de onda de 440nm utilizando un espectrofotómetro Genesys 20 Vis (Thermo Fisher Scientific Inc.) y empleando la curva de calibrado y = 0,0059x + 0,0037, R2 = 0,9912, estandarizada por el equipo de investigación del Laboratorio GRUBIODEQ. Se determinaron las concentraciones en ppm. Como blanco se tomó únicamente el medio NBRIP y se realizó todo el proceso Todos los ensayos se realizaron por triplicado.
Evaluación del efecto de los bioinoculantes en plantas de pasto Angleton (Dichantium aristatum)
Una vez seleccionados los microorganismos o consorcios eficientes, se sembraron por la técnica de estría masiva en agar nutritivo y se incubaron durante 24 h a 36 °C. Los bioinoculantes se produjeron en Erlenmeyer de 100 mL con 30 mL de caldo nutritivo estéril, cada Erlenmeyer se inoculó con los microrganismo eficientes y se incubo a temperatura ambiente (28±2 °C), manteniendo una agitación constante de 150 rpm en un shaker por un período de 24 h; con el fin confirmar la concentración celular en cada bioinoculante se evaluó el crecimiento por el método de diluciones seriadas, al final del proceso; todos los ensayos se realizaron por triplicado (Seeley et al., 1973). De esta forma se ajustaron los inoculantes a la concentración que presentaron mayor rendimiento en la solubilización de fosfato.
Para realizar el experimento se utilizó semillas de pasto Angleton (Dichantium aristatum) desinfectadas con etanol al 70% durante 5 min. y luego con solución de hipoclorito de sodio 3% durante 5 min.; las semillas fueron inmersas en los bioinoculantes durante 60 min. y fueron evaluadas bajo condiciones controladas de vivero, para esto se utilizó un diseño completamente al azar (DCA) con tres tratamientos y cinco repeticiones, que consistieron en:
Tratamiento 1 (control): Semillas sin ningún tipo de tratamiento.
Tratamiento 2: Semillas tratadas con el bioinoculante en la concentración más eficaz y sin fertilización química.
Tratamiento 3: Semillas tratadas con fertilizantes químicos comerciales Fosfato diamonico (DAP) y Urea.
El suelo utilizado presentó las siguientes características: MO= 1.38%; P= 7,5 ppm, DA= 1.5 g/cm3 y K= 0.88 meq/ 100g) y la fertilización química se realizó de acuerdo al análisis de suelo y los requerimientos nutricionales para el pasto angletón (N: 230; P: 53; K: 252 ha/año). De acuerdo a lo anterior al tratamiento con fertilizante químico se le aplico 0,9 g/recp de urea y 0,0144g/recp de DAP a los 8 días después de la siembra (DDS). El experimento se desarrolló en macetas de 0.045 m2 de área.
Se utilizaron 2 g de semillas para cada maceta, las cuales fueron sembradas al voleo a 1 cm de profundidad y esparcidas aleatoriamente por toda la superficie de la maceta. El ensayo se desarrolló en predios de la Universidad de Córdoba, (3 Km. vía Montería-Cereté), en un vivero del departamento de Ingeniería Agronómica, con una temperatura promedio de 29 °C, presión atmosférica de 756.96 mm y humedad relativa de 79 %; el suelo utilizado fue de textura arcillosa tomado de zonas sin cultivar de previos de la Universidad de Córdoba (Degiovanni et al., 2004). No se utilizó ningún tipo de plaguicida. Se realizaron mediciones a los 21 y 35 días después de la germinación, en cada muestreo se recogieron 3 plantas al azar de cada repetición, las variables a tener en cuenta fueron los siguientes parámetros biométricos (Hernandez, 2002 y Ramirez y Perez, 2006): a) número de hojas (No.): conteo de las hojas cotiledonales y verdaderas fotosintéticamente activas en las diferentes plantas; b) área foliar (cm2): se midió tomando como referencia las cuadrículas de hojas de papel milimetrado en cada una de las hojas cotiledonales de las plantas muestreadas; c) longitud de la planta (cm): se tomó en cuenta la medida desde la raíz hasta la hoja más larga de cada una de las plantas muestreadas; d) longitud de la raíz (cm): medición de la raíz principal de cada planta muestreada; e) peso seco (g): se llevaron a secado en estufa a 60 °C hasta alcanzar peso seco constante, una vez secas se determinó su peso. Todos los ensayos se realizaron por triplicado.
Análisis estadístico
Se realizó la evaluación de los datos obtenidos de los parámetros biométricos de las plantas de pasto Angleton en el paquete estadístico SAS 9.2 (SAS, 2010), se empleó un diseño completamente al azar y las medias se compararon mediante contrastes ortogonales en el mismo software; se consideró P<0.05 y P<0.01 como diferencias significativa y altamente significativa, respectivamente. También se aplicó la prueba de Tukey.
Resultados y discusión
Prueba de Antagonismo
Al realizar la lectura no se evidenció antagonismo por parte de ninguna de las cepas, ya que se desarrollaron sin inhibir el crecimiento entre ellas. Lo anterior indica que no existe ningún tipo de antibiosis, competencia por espacio o por nutrientes, interacciones directas con el patógeno (Lisis enzimática) que impidan el libre desarrollo de los microorganismos.
Evaluación cualitativa de la capacidad solubilizadora de fosfato
Las mediciones de la capacidad cualitativa de solubilización de fosfato realizada a los 7 y 14 días de forma individual y en consorcios, se muestran en la tabla 1 y tabla 2.
Tabla 1 Promedio de índices de solubilización a los 7 días.
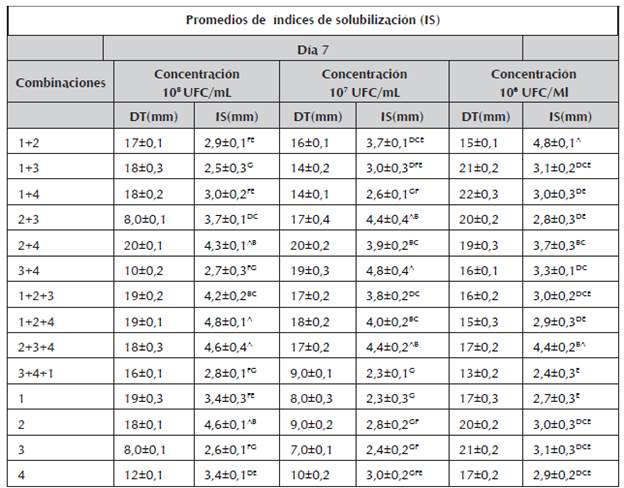
1.Burkholderia cepacia, 2. Pantoea sp, 3.Pseudomona luteola, 4. Pseudomona sp, Índices de solubilización (IS), Diámetros totales promedios de las colonias (DT), a. Medias aritméticas ± desviación estándar de experimentos por triplicado. Los valores seguidos con letras superíndices distintas indican diferencias significativas (p < 0,05) según tukey.
Tabla 2 Valores promedio de índices de solubilización a los 14 días.
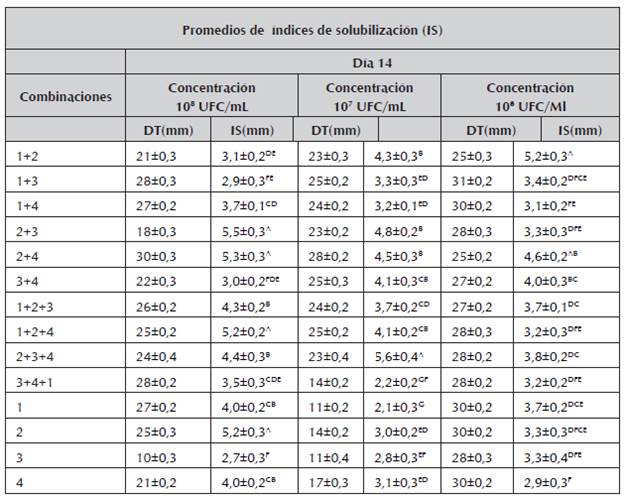
1.Burkholderia cepacia, 2. Pantoea sp, 3.Pseudomona luteola, 4. Pseudomona sp, Índices de solubilización (IS), Diámetros totales promedios de las colonias (DT), a. Medias aritméticas ± desviación estándar de experimentos por triplicado. Los valores seguidos con letras superíndices distintas indican diferencias significativas (p < 0,05) según tukey.
A los 7 días del ensayo se observaron que los valores promedios de los índices de solubilización oscilaron entre 2,3 a 4,8 mm (tabla 1). En esta etapa se destacaron los consorcio Burkholderia cepacia + Pantoea sp + Pseudomona sp a la concentración 108 UFC/mL, Pseudomona luteola + Pseudomona sp a la concentración 107 UFC/mL y Burkholderia cepacia + Pantoea sp a la concentración 106 UFC/mL; lo anterior demuestra que la formación de consorcio representa una mayor solubilización que de forma individual, superando a lo encontrado por Lara et al. (2011a) con IS de 4,0 mm y similares a los encontrados por Bobadilla y Rincón (2008) con IS entre 3,3 - 5 mm.
En la tabla 2 se resumen los valores promedio de los índices de solubilización de las cepas individual y en consorcio a los 14 días de ensayo; los valores oscilaron entre 5,6 a 2,1 mm.
A los 14 días se observó una tendencia similar de las cepas individuales y en combinación, al obtenido durante los 7 días; se destacaron nuevamente los consorcios y, entre ellos, Pantoea sp + Pseudomona luteola, Pantoea sp + Pseudomona sp y Pantoea sp + Pseudomona luteola + Pseudomona sp; este último presentó los valores más altos en los índices de solubilización con 5,6 mm, resultados que superan a los encontrados por Guzmán (2012) en donde el mayor índice de solubilización a los 14 días fue de 5,05.
Los resultados de la prueba demostraron que los índices de solubilización de fosfato de algunos consorcios fue mayor en comparación con los IS de las cepas individuales, demostrándose un efecto sinérgico favorable.
Evaluación cuantitativa de la capacidad solubilizadora de fosfato
Los datos obtenidos de la evaluación cuantitativa de la capacidad solubilizadora de fosfato de las cepas nativas, utilizando el método colorimétrico vanadomolibdofosforico se resumen en la tabla 3; se observan valores entre 117 y 842 ppm.
Tabla 3 Promedios de concentraciones en partes por millón (ppm) de solubilización de fosfato.
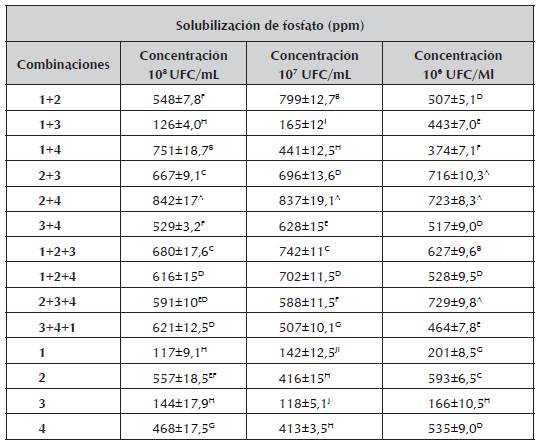
1. Burkholderia cepacia, 2. Pantoea sp, 3.Pseudomona luteola, 4. Pseudomona sp, Concentración en partes por millón ([] en PPM), a. Medias aritméticas ± desviación estándar de experimentos por triplicado. Los valores seguidos con letras superíndices distintas indican diferencias significativas (p < 0,05) según tukey.
Los microorganismos en consorcios presentaron mayor solubilización de fosfato que aquellos que se encontraban por individual debido a que los consorcios microbianos en muchos casos interactúan de manera sinérgica estimulando algunas actividades físicas o bioquímicas de las bacterias involucradas en las mezclas; la concentración a la cual presentaron mayor eficiencia fue a 108 UFC/ml, destacándose el consorcio conformado por Pantoea sp + Pseudomona sp, además este mismo mostró buenos resultados en las concentraciones de 107 y 106 UFC/ml; también en esta etapa se destacó el consorcio formado por Burkholderia cepacia, + Pantoea sp a la concentración de 107 UFC/ml.
Los anteriores resultados superan a los encontrados por Cordero et al., (2008) en la evaluación de una cepa de Pantoea sp. (9C) la cual presentó solubilización de aproximadamente 400 μg P mL-1 entre las 40 - 60 horas. Igualmente superaron a estudios realizados por Osorio y Lara (2013) que evaluaron consorcios formados por Pantoea sp y Azotobacter sp obteniendo resultados 602.60 ppm a la concentración de 106 UFC/ml.
Los resultados de la evaluación cuantitativa confirmaron que el consorcio formado por Pantoea sp + Pseudomona sp a la concentración 108 UFC/mL fue el mejor corroborando los resultados obtenidos en la evaluación cualitativa. Por lo anterior el consorcio fue escogido para el ensayo siguiente.
Ensayos en semillas de pastos angleton (Dichantium aristatum)
La tabla 4 muestra los resultados promedios de los parámetros biométricos medidos, correspondientes a, cantidad de hojas, longitud de la planta, área foliar, longitud de raíz principal y peso seco para los diferentes tratamientos:
Tabla 4 Efecto de los bioinoculantes en el crecimiento y desarrollo de plantas de pasto angletón (Dichantium aristatum).
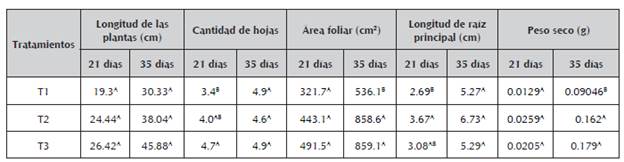
A,B Letras iguales no presentan diferencias significativas, con un alfa de 0.05. Los datos representan el promedio de 5 repeticiones. Las comparaciones estadísticas fueron realizadas de forma independiente para cada tiempo en las diferentes variables. Tratamiento 1 (control): Semillas sin ningún tipo de tratamiento; Tratamiento 2: Semillas tratadas con el consocio Pantoea sp + Pseudomona sp a la concentración 108 UFC/mL; Tratamiento 3: Semillas tratadas con fertilizantes comerciales fosfato diamonico (DAP) y Urea.
Longitud de la planta (cm). Estadísticamente no se presentaron diferencias significativas entre los tratamientos, durante los días 21 y 35; sin embargo se evidenció mayor longitud para T3 y T2 (45y 38 cm respectivamente) en comparación con T1. El tratamiento T2 ( consorcio) mostró un valor más alto que el testigo (T1) lo cual puede ser debido a la disponibilidad del fósforo proporcionado por el consorcio teniendo en cuenta que éste nutriente es esencial para el desarrollo y crecimiento de las plantas (Coyne, 2000); también es posible que las cepas puedan producir fitohormonas de crecimiento vegetal favoreciendo el crecimiento de la planta puesto que dentro de los géneros bacterianos que han sido reportados como productores de AIA, se encuentra Pseudomonas sp. (Ahmad et al,. 2006). Los datos obtenidos están en concordancia con las investigaciones realizadas por Rajkumar et al. (2006) quienes reportan incremento en la longitud de las plantas de mostaza inoculadas con Pseudomonas sp y Bacillus sp en comparación con las plantas no inoculadas; similares resultados se obtuvieron en el trabajo de Galvis y Lara (2013) utilizando plantas de pasto Angleton.
Cantidad de hojas (No.). Para esta variable biométrica a los 21 dias, se observaron los mejores resultados promedios para el T3 mostrando diferencias significativas (P<0,05); estos datos pueden atribuirse a una mayor disponibilidad de nutrientes proporcionada por la fertilización química. A los 35 dias no se presentó diferencias significativas entre los resultados promedios de los tratamientos lo que concuerda con estudios realizados por Pastor y Lara (2013) quienes, para la variable número de hojas en pasto Angleton no encontraron diferencias significativas en ninguna de las mediciones realizadas.
Área Foliar (cm2). Se evidenció mayor área foliar en los tratamientos T3 y T2 en comparación con el tratamiento T1, obteniéndose una diferencia altamente significativa (P<0.01) a los 35 días; ésta característica incide en una mejor capacidad fotosintética de las plantas, que redunda en un mayor crecimiento y mayor desarrollo de su parte aérea (Mayak et al., 2004; Santillana, 2006). Investigaciones realizadas por Ahmad et al. (2013) han encontrado correlación entre el incremento del área foliar por la co-inoculación de rizobacterias de los géneros Rhizobium y Pseudomonas y el aumento del contenido de clorofila en plantas de fríjol chino (Vigna radiata L.).
Es importante resaltar que el efecto del tratamiento inoculado (T2) sobre el área foliar fue similar al tratamiento con fertilizante químico (T3), demostrándose los beneficios del consorcio nativo.
Longitud de la raíz (cm): Los resultados para este parámetro a los 21 días, evidencian una diferencia significativa (P<0.05) en la longitud de la raíz debido a que mostró diferencia entre los tratamiento T2 (semillas inoculadas) al compararse con T1 (testigo, semillas sin ningún tipo de tratamiento); el tratamiento T3 (semillas tratadas con fertilizantes comercial) fue similar a dos tratamientos. A los 35 días, el tratamiento T2 logró una mayor longitud de raíz, con un valor superior a 6 cm, mientras que el tratamiento T1y T3 mostró una longitud alrededor 5,27 cm; no se presentó diferencia significativa. El consorcio demostró efectos positivos sobre la longitud de la raíz que pueden ser atribuidos a la disponibilidad de Fósforo y también a la posible presencia de fitohormonas producidas por una o las dos cepas que forman el consorcio; la promoción del crecimiento ha sido atribuida a factores tales como la síntesis de ciertas hormonas vegetales que estimula la densidad y longitud de los pelos radicales aumentando así la cantidad de raíces en las plantas; se incrementa la capacidad de absorción de agua y nutrientes, y permite que las plantas sean más vigorosas, productivas y tolerantes a condiciones climáticas adversas ( Lara et al, 2011b; Kloepper et al., 1991).
Peso seco (g): Los pesos secos más altos se evidenciaron en los tratamientos T3 y T2, alcanzando un peso máximo de 0,179 g, un valor inferior se mostró en el tratamiento T1 con un peso entre 0,09 g. A los 35 días se observó diferencia altamente significativa (P<0.01) entre los tratamientos T2 y T3 frente al tratamiento testigo (T1) que presentó bajo peso seco. La asimilación de fosfatos por parte de los vegetales contribuye al aumento de su metabolismo, lo cual se refleja en mayor contenido de materia orgánica, crecimiento de las raíces en estado de plántula, acelera la maduración, estimula la coloración de los frutos, ayuda a la formación de semillas y de las moléculas de transferencia de energía como el ATP (Madigan et al., 2003; Iañez, 2010).
La presencia de órganos de la planta con una demanda neta por asimilados, puede influenciar fuertemente los patrones de producción y distribución de materia seca (Tekalign y Hammes, 2005). La acumulación de materia seca, comúnmente se utiliza como parámetro para caracterizar el crecimiento, porque usualmente tiene un gran significado económico.
Conclusiones
Los microorganismos en consorcios microbianos demostraron mayor capacidad de solubilizar fosfatos.
La aplicación de bioinoculantes a base de consorcios microbianos nativos solubilizadores de fosfatos en plantas de pastos angletón (Dichantium aristatum), representa un beneficio notable en diversos parámetros biométricos área foliar, longitud de la raíz y peso seco.
Los resultados obtenidos representan una gran alternativa para la sustitución parcial de fertilización química con buenos resultados para el crecimiento de las plantas de pastos Angleton, a bajo costo y de forma amigable con el ambiente para una producción más limpia.
Agradecimientos
A la Universidad de Córdoba y COLCIENCIAS por financiar la ejecución del presente proyecto de investigación.
REFERENCIAS
Ahmad, M., Zahir, Z. A., Khalid, M., Nazli, F., y Arshad, M. (2013). Efficacy of Rhizobium and Pseudomonas strains to improve physiology, ionic balance and quality of mung bean under salt-affected conditions on farmer's fields. Plant Physiology and Biochemistry, 63, 170-176. [ Links ]
Ahmad, F., Ahmad, I., y Khan M. (2008). Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities. Microbiological research, 163 (2), 173-181. [ Links ]
Barragán, C., Zambrano, D., Pedroza, A., y Bobadilla, R. (2003). Producción de bacterias fosfato Solubilizadoras mediante fermentación discontinua en caldo de Pikovskaya modificado (Tesis de pregrado en Microbiología Industrial). Pontificia Universidad Javeriana, Bogotá, Colombia. [ Links ]
Begonia, M., Begonia, G., Miller, G., Gilliard, D., y Young, C. (2004). La actividad fosfatasa y las poblaciones de microorganismos de cadmio y suelos contaminados con plomo. Boletín de la contaminación ambiental y toxicologia, 73 (6), 1025-1032. [ Links ]
Bobadilla, C y Rincon, S. (2008). Aislamiento y producción de bacterias fosfato solubilizadoras a partir de compost obtenido de residuos de la plaza (Tesis de pregrado en Microbiología Industrial). Pontificia Universidad Javeriana, Bogotá, Colombia. [ Links ]
Beltrán, S., Torrado, Y., Martínez, M., y Matiz, A. (2005). Aislamiento de bacterias con actividad fosfato solubilizadora a partir de suelos ácidos del norte de Boyacá y producción de un inoculo mixto en fermentación discontinua (Tesis de pregrado en Microbiología Industrial). Pontificia Universidad Javeriana, Bogotá, Colombia. [ Links ]
Cordero, P., Ortega, P., y Ortega, E. (2008). La inoculacion de plantas con Pantoea sp., bacteria solubilizadora de fosfatos, incrementa la concentración de P en los tejidos foliares. Revista Colombiana de Biotecnología, 10(1), 111 - 121. [ Links ]
Cuadrado, H., Mejía, S., Contreras, A., Romero, A., y García, J. (2003). Manejo agronómico de algunos cultivos forrajeros y técnicas para su conservación en la región Caribe colombiana. Corpoica, Bogotá. [ Links ]
Coyne, M., (2000). Microbiología del Suelo: Un enfoque exploratorio. Barcelona, España: Editorial Paraninfo. [ Links ]
Degiovanni, V., Gómez, J., y Sierra, J. (2004). Análisis de crecimiento y etapas de desarrollo de tres variedades de arroz (Oryza sativa L.) en Montería, Córdoba. Temas Agrarios, 9(1), 21-29. [ Links ]
Echeverri, R., y Castilla, A. (2008). Biofertilizantes como mejoradores del proceso de nutrición del arroz. Revista Arroz, 56(474), 1227. [ Links ]
Fernandez, L., Zalba, P., Gomez, M., y Sagardoy, M. (2005). Bacterias solubilizadoras de fosfato inorgánico aisladas de suelos de la región sojera. Ciencia del suelo, 23(1), 31-37. [ Links ]
Galvis, G y Lara, C. (2013). Evaluación del contenido de nitrógeno y parámetros biométricos en pastos Angleton inoculados con una cepa nativa del género Azotobacter sp. secretora de ácido indolacético (AIA) y fijadora de nitrógeno (Tesis de pregrado Programa de Química). Universidad de Córdoba, Montería, Colombia. [ Links ]
Guzmán, E. (2012). Aislamiento y caracterización de bacterias solubilizadoras de fósforo a partir de cuatro suelos de la provincia de Chimborazo (Tesis Ingeniería agronómica). Escuela Superior Politécnica De Chimborazo, Riobamba, Ecuador. [ Links ]
Hameeda, B., Harini, G., Rupela, O., Wani, P., y Reddy, G. (2006). Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna. Microbiological research, 163(2), 234-242. [ Links ]
Hernández, A. (2002). Obtención de un biopreparado a partir de rizobacterias asociadas al cultivo del maíz (Zea Mays L.) (Tesis de doctorado). Universidad de La Habana, La Habana, Cuba. [ Links ]
lañez, E. (2010). Microbiología General. Recuperado de http://www.ugr.es/~eianez/Microbiologia/index.htm. [ Links ]
Kitson, R., y Mellon, M. (1944). Colorimetric determination of phos-farus as molybdovanado phososphoric acid. Ind Eng Chem Anal, 16, 379- 384. [ Links ]
Kumar, V., y Narula, N. (1999). Solubilization of organicphosphates and growthemergence of wheat as affectedby Azotobacterch-roococum mutans. Boil Fertile Soils, 28, 301-305. [ Links ]
Kloepper, J., Zablotowicz, R., Tipping, E., y Lifshitz, R. (1991). Plant growth promotion mediated by bacterial rhizosphere colonizers. The Rhizosphere and Plant Growth, 30, 315-326. [ Links ]
Lara, C., Esquivel, L., y Negrete, J. (2011). Bacterias nativas solubilizadores de fosfatos para incrementar los cultivos en el departamento de Córdoba-Colombia. Biotecnología en el sector agropecuario y agroindustrial, 9(2), 114-120. [ Links ]
Lara, C., García, L., y Oviedo, L. (2011). Efecto biofertilizante del preparado: Residuos vegetales-bacteria nativa diazótrofa sobre las variables biométricas de plántulas de Rhapanussativus. Revista Colombiana de Biotecnología, 13(1), 156-162. [ Links ]
López, M. (2010). Manejo agroecológico del sistema sorgo-frijol, efecto sobre la fertilidad del suelo y microorganismos con potencial para biofertilizar agroecosistemas venezolanos (Tesis de doctorado en Ciencia del Suelo). Universidad Central de Venezuela. Maracay, Venezuela. [ Links ]
Madigan, M., Martinko, J., y Parker, J. (ed.). (2003). Brock, Biología de los microorganismos. Madrid, España: Editorial Prentice Hall-Pearson Education Inc. [ Links ]
Mayak, S., Tirosh, T., y Glick, B. (2004). Plant growth-promoting bacteria confer resistance in tomato plants to salt stress. Plant Physiology and Biochemistry, 42(6), 565-572. [ Links ]
Moreno, B; Diez, V; García, M; Menes, L; Gutiérrez, M; Polledo, F. (2000). Comisión internacional de especificaciones microbiológicas alimentarias. Zaragoza, España: Editorial Acribia. [ Links ]
Nautiyal, C. (1999). An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS microbiology Letters, 170 (1), 265-270. [ Links ]
Navarro, S., y Navarro, G. (2003). Química Agrícola. Madrid, España: Editorial Mundi-prensa. [ Links ]
Pastor, K., y Lara, C. (2013). Evaluación de biopreparados a base de una cepa nativa del género azotobacter sp, a diferentes concentraciones, sobre las variables biométricas en pasto angletón (dichantiun aristatum benthj (Tesis de grado de Maestría en Biotecnología). Universidad de Córdoba, Montería, Colombia. [ Links ]
Osorio, A., y Lara, C. (2013). Evaluación del potencial biofertilizante de tres cepas de los géneros panthoea y azotobacter, aisladas de los suelos de córdoba, sobre el crecimiento de plántulas de rábano (raphanus sativus l.) (Tesis de grado de Maestría en Biotecnología). Universidad de Córdoba, Montería, Colombia. [ Links ]
Rajkumar, M., Nagendran, R., Jae, K., Hyu, W., y Zoo, S. (2006). Influence of plant growth promoting bacteria and Cr 6+ on the growth of Indian mustard. Chemosphere, 62 (5), 741-748. [ Links ]
Ramirez, R., y Perez, A. (2006). Evaluación del potencial de los biosólidos procedentes del tratamiento de aguas residuales para uso agrícola y su efecto sobre el cultivo de rábano rojo (Rahanus sativas L). Revista Facultad Nacional de Agronomía, Medellín, 59 (2):3543-3556. [ Links ]
Santillana, N. (2006). Producción de biofertilizantes utilizando Pseudomonas sp. Ecología aplicada, 5(1-2), 87-91. [ Links ]
Seeley, H., y Van demark, P. (1973). Microbios en acción: Manual de Laboratorio para Microbiología. Madrid, España: Editorial Blume. [ Links ]
Tekalign, T., y Hammes, P. S. (2005). Growth and productivity of potato as influenced by cultivar and reproductive growth: II. Growth analysis, tuber yield and quality. Scientia Horticulturae, 105 (1), 29-44. [ Links ]
Wu, S., Cao, Z., Li, Z., Cheung, M., Wong, W. (2005). Wu, Effects of biofertilizer containing N-fixer, P and K solubilizers and AM fungi on maize growth: a greenhouse trial. Geoderma, 125(1), 155-166. [ Links ]
Recibido: 15 de Marzo de 2014; Aprobado: 15 de Abril de 2015











 text in
text in 


