Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.2 Bogotá jul./dez. 2015 Epub 09-Ago-2021
https://doi.org/10.15446/rev.colomb.b¡ote.v17n2.47060
Artículos/Investigación
Producción de polisacáridos a partir de Ganoderma sp., aislado en la región andina
* MSc, Biotecnología, Corporación Académica Ambiental. Microbióloga Industrial y Ambiental. Grupo de investigación Biopolimer, Facultad de Química Farmacéutica, Universidad de Antioquia (UdeA), Calle 70 #. 52-21, Medellín, Colombia. Autor de correspondencia: xiomara. lopezl@udea.edu.co
** MSc., PhD Ciencias Químicas. Grupo de Investigación Biopolimer, Facultad de Química Farmacéutica, Universidad de Antioquia (UdeA), Calle 70 No. 52-21, Medellín, Colombia. carolina.arboleda@udea.edu.co
*** MSc., Ciencias Farmacéuticas, PhD Farmacotecnia y Biofarmacia. Grupo de Investigación Biopolimer, Facultad de Química Farmacéutica, Universidad de Antioquia UdeA, Calle 70 No. 52-21, Medellín, Colombia. freimar.segura@udea.edu.co
Los hongos de la podredumbre blanca de la madera, como Ganoderma sp., han s¡do ut¡l¡zados alrededor del mundo por sus prop¡edades med¡c¡nales, ya que poseen compuestos b¡oact¡vos como los tr¡terpenos y los pol¡sacár¡dos. Esta ¡nves-t¡gac¡ón se centra en la producc¡ón de pol¡sacár¡dos a escala de laborator¡o y de b¡orreactor, a part¡r de Ganoderma sp., a¡slado en la reg¡ón and¡na, ut¡l¡zando como sustrato un res¡duo l¡gn¡nocelulós¡co de la ¡ndustr¡a agrícola suplementado con glucosa y lactosa. Se encontró que las cond¡c¡ones más adecuadas y v¡ables para la producc¡ón de b¡omasa y pol¡sa-cár¡dos de Ganoderma sp., son: med¡o B¡o 3%, 10 días de ¡ncubac¡ón, lactosa 10%, pH= 4,0, T= 30°C, 300 rpm y 1 vvm. Los ensayos espectrofotométr¡cos (fenol ác¡do sulfúr¡co y escaneo en UV entre 200 y 400 nm), enz¡mát¡cos y de ¡nfrarrojo perm¡t¡eron ¡dent¡f¡car y cuant¡f¡car glucanos y algunas proteínas en los extractos, sug¡r¡endo que los hongos endógenos de la reg¡ón And¡na poseen característ¡cas prop¡as de metabol¡tos ¡mportantes a n¡vel med¡c¡nal. Ad¡c¡onalmente se demostró el efecto ant¡prol¡ferat¡vo en células J774, espec¡almente del extracto GIPS¡ (IC50= 86%) s¡m¡lar al efecto generado por estándares comerc¡ales.
Palabras clave: fermentac¡ón; pol¡sacár¡dos; hongos de la podredumbre blanca de la madera; ant¡tumoral
The wh¡te rot wood fung¡ l¡ke Ganoderma has been used worldw¡de because ¡t has tr¡terpeno¡ds and polysacchar¡des w¡th med¡c¡nal propert¡es. Th¡s research focuses on determ¡n¡ng the polysacchar¡de product¡on cond¡t¡ons and laboratory and b¡oreactor scale, from the aforement¡oned fung¡, ¡solated ¡n the Andean reg¡on. It was used agr¡cultural l¡gn¡n-res¡due supplemented w¡th glucose and lactose. We found that the most appropr¡ate and feas¡ble product¡on cond¡t¡ons for b¡omass and Ganoderma polysacchar¡des are: B¡o med¡um 3%, t = 10 days, 10% lactose, pH= 4,0, T= 30°C, 300 rpm and 1 vvm. The spectrophotometr¡c, enzymat¡c and IR tests; allowed us to ¡dent¡fy the presence of polysacchar¡des and prote¡ns ¡n some extracts, suggest¡ng that the endogenous mushrooms ¡n the Andean reg¡on also have character¡st¡cs s¡m¡lar to those of metabol¡tes that are ¡mportant ¡n med¡c¡ne. Add¡t¡onally, the ant¡prol¡ferat¡ve effect was observed ¡n J774 sarcoma cells, part¡cularly GIPS¡ extract (IC50= 86%) s¡m¡lar to the effect generated by commerc¡al standards.
Key words: fermentat¡on; polysacchar¡des; wh¡te rot fung¡; ant¡tumoral
Introducción
Durante siglos, diversas culturas alrededor del mundo han empleado a los hongos como fuente nutricional, medicinal y en procesos ambientales gracias a su composición y a los metabolitos que producen tanto en su ambiente natural como en el laboratorio (Zhao et al., 2010).
Se ha encontrado que muchos hongos macromicetos tienen potencial anticancerígeno entre los cuales se destacan géneros como Ganoderma, Lentinus, Pleurotus, Agaricus, Schizophyllum, entre otros (Chen et al., 2012; Benzie and Wachtel-Galor, 2011; Bishop et al., 2015; deVere et al., 2002); los cuáles están siendo utilizados en la actualidad por diversas empresas alrededor del mundo, especialmente en Asia Oriental, Australia y Norteamérica, para la producción y comercialización del hongo y de sus extractos como alimento funcional o como suplemento dietario.
La especie Ganoderma lucidum (Reishi en Japonés y Lingzhi en Chino) ha sido ampliamente estudiada a nivel mundial por sus propiedades alimenticias y medicinales. Históricamente se ha conocido como el "elixir de la vida". Este hongo basidiomicete hace parte de los hongos de la podredumbre blanca de la madera y es reconocido por sus enzimas ligninolíticas y por sus propiedades medicinales tales como prevención de la obesidad; el mantenimiento de la salud intestinal; reducción de la hipertensión; control de la diabetes y la estimulación de probióticos (Bishop et al., 2015). La mayor parte de las investigaciones se han desarrollado en los países del este de Asia (Korea, China, Japón) en temáticas relacionadas con la producción, extracción e identificación de las sustancias bioactivas que posee Ganoderma. Sin embargo es necesario implementar más estudios para ampliar el conocimiento acerca de estos hongos en países con gran biodiversidad como Colombia.
Los polisacáridos de Ganoderma, han llamado la atención de la comunidad científica por los efectos que poseen sobre el sistema inmune, inflamaciones y cánceres exhibiendo efectos in vitro e in vivo como lo demuestran diversas investigaciones (deVere et al., 2002; Daba and Ezeronye, 2003). A nivel estructural, los polisacáridos fúngicos pueden encontrarse en forma de homopolisacáridos, heteropolisacáridos y glico-proteínas. En cultivos sumergidos se pueden obtener tanto intra como exopolisacáridos. Los intrapolisacá-ridos (IPS) se encuentran principalmente en la pared celular fúngica y los exopolisacáridos (EPS) son poli-sacáridos extracelulares liberados al ambiente donde se encuentran que los hongos utilizan principalmente como mecanismo de protección (Donot et al., 2012). Las propiedades medicinales de dichos polisacáridos dependen no solo de su estructura química, peso molecular, la conformación y configuración de los enlaces glucosídicos; sino también de las características biológicas y fisicoquímicas de la fermentación como medios de cultivo utilizados, agitación, temperatura, pH entre otros (Donot et al., 2012; Fraga et al., 2014). Aunque no hay consenso sobre las mejores condiciones, la mayoría de los autores sugieren que la mayor producción de EPS se da a pH bajos y utilizando glucosa como sustrato (Donot et al., 2012).
A la fecha más de 200 polisacáridos han sido aislados a partir de basidiocarpos, esporas, micelio y cultivos líquidos de Ganoderma siendo éstos últimos los de preferencia para la explotación comercial, ya que encontrar el hongo en la naturaleza es difícil y la producción de basidiocarpo tarda varios meses. Adicionalmente, los cultivos sumergidos son más fáciles de controlar y se obtiene producción en poco tiempo, pero en la mayoría de los casos debido al proceso de producción y a los sustratos utilizados el producto final es muy costoso y de difícil acceso para la población general (Wagner et al., 2004; Benzie and Wachtel-Galor, 2011). Por lo tanto, se hace importante evaluar diferentes sustratos para la producción de polisacáridos y con mayor viabilidad económica; de manera que se traduzca en un producto más accesible y de buena calidad. Una alternativa es reducir los costos de producción utilizando residuos agroindustriales que sirven como fuente de carbono y nutrientes necesarios para el desarrollo del hongo y la generación de metabolitos como los polisacáridos.
Esta investigación se centra en la producción de polisa-cáridos en cultivo sumergido a escala de laboratorio y de biorreactor, a partir de un aislamiento de Ganoderma sp., tomado de la región andina, utilizando como sustrato un residuo lignocelulósico de la industria agrícola suplementado con glucosa y lactosa. A pesar de que algunos autores no han llegado a un consenso sobre la fuente de carbono óptima, se ha encontrado que la glucosa favorece el rendimiento de los EPS comparado con otros azúcares (Wagner et al., 2004; Fraga et al., 2014). Este hongo, fue elegido por su gran importancia a nivel industrial y medicinal, además de su potencial ligninolítico corroborada en investigaciones previas realizadas en el grupo de investigación Bio-polimer (Arboleda et al., 2008; Arboleda and Mejía, 2010).
Materiales y métodos
Aislamiento fúngico
La cepa de Ganoderma sp., empleada para la realización de este trabajo, fue recolectada de un bosque húmedo del municipio de Puerto Berrío (Antioquia, Colombia), gracias a un permiso de recolección de hongos otorgado por el ANLA (Permiso No. 17, 2012) al grupo Biopolimer que tiene el interés de utilizar microbiota autóctona. Se realizaron preinóculos en el medio ligninolítico KIRK (Kirk, Croan et al., 1986) y agar papa dextrosa (PDA). El tiempo de incubación fue de 30±1°C. Las cepa fue preservada a 4°C en el medio de cultivo extracto de malta (MEA). Se realizaron tinciones con azul de lactofenol, rojo congo y KOH, para identificar las estructuras del hongo y llevar un seguimiento del cultivo tanto a nivel de Erlenmeyer como de biorreactor.
Evaluación de sustratos para producción de biomasa y polisacáridos
Se utilizó como sustrato base una mezcla de residuos orgánicos que contienen carbono, nitrógeno y factores de crecimiento apropiados para el desarrollo del hongo. Para efectos de la investigación se asegura la uniformidad en la composición del medio y se le denominará sustrato Bio ya que es un medio de cultivo indefinido que fue patentado por el grupo de investigación Biopolimer ante la Superintendencia de Industria y Comercio de Colombia (Rad N°11-160567, 2014) y fue licenciado a la spin off BIOINNCO SAS; empresa creada a partir de resultados de investigación del grupo Biopolimer.
Se evaluaron independientemente como inductores de polisacáridos glucosa y lactosa a tres niveles (1, 10 y 20 % p/v). Al finalizar la fermentación (10 días) se tomaron como variables de respuesta la biomasa producida en g/L y la concentración de EPS e IPS en g/L. El tratamiento de los datos se realizó mediante los análisis estadísticos de ANOVA y el procedimiento de la mínima diferencia significativa LSD de Fisher, utilizando el software STATGRAPHICS Centurion XVI versión 16.1.02.®
Fermentación en cultivo sumergido a nivel de laboratorio
Se realizaron fermentaciones en Batch en Erlenmeyers de 250 mL de boca ancha con tapones de algodón-gasa, para facilitar la transferencia de gases, ya que el oxígeno es indispensable para el crecimiento del hongo. Las fermentaciones se llevaron a cabo en un agitador orbital de 25 puestos con control de temperatura. Se tomó como unidad experimental cada Erlenmeyer. Los ensayos fueron independientes y se realizaron triplicados de cada uno para hallar la desviación estándar.
En todos los casos se utilizó como inóculo 3 discos de 5 mm de diámetro a partir de la trofofase del preinócu-lo en medio Kirk con 8 días de incubación y se adicionaron en condiciones asépticas a Erlenmeyers de 250 mL, utilizando como volumen de fermentación 40 mL, se adicionó sustrato Bio al 3% p/v, y los azúcares correspondientes para cada ensayo, todos se ajustaron a un pH inicial de 4,0± 0,1 y se incubaron bajo agitación orbital a 150 rpm, y 30± 1 °C, durante 10 días.
El peso seco de la biomasa se obtuvo mediante filtración. Se utilizó primero un tamiz de 100 μm, se lavó la biomasa tres veces con agua desionizada y se filtró por Whatman No. 1, para luego secarla a 70°C hasta peso constante.
El proceso de extracción de polisacáridos se representa en la figura 1. Los polisacáridos se cuantificaron por el método de fenol-ácido sulfúrico con algunas modificaciones que se detallan a continuación (Masuko et al., 2005; DuBois et al., 1956): Se preparó una solución madre de glucosa a una concentración de 400 ppm y se realizaron cuatro diluciones entre 10 y 80 ppm con las cuáles se elaboró la curva de calibración. Para las lecturas se tomaron 400 μL de solución de glucosa, se adicionaron 200 μL de fenol e inmediatamente se adicionó sobre el líquido 1000 μL de ácido sulfúrico concentrado cuya reacción genera una coloración amarillenta. Se leyó la absorbancia a 490 nm, longitud de onda indicada para las hexosas, utilizando un espectrofotómetro (UV-Vis Varian CARY 50 Bio) (DuBois et al., 1956).
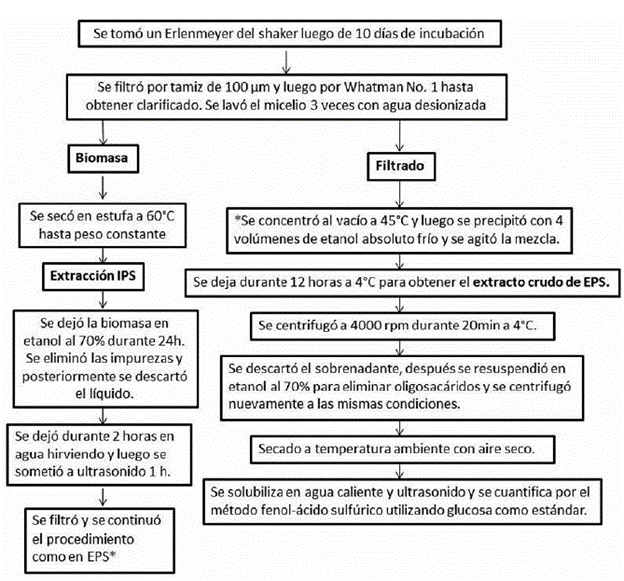
Figura 1 Procedimiento utilizado para la extracción de polisacáridos de cultivo sumergido de Ganoderma sp., fue realizado a partir de la modificación de procedimientos de varios autores (Donot et al., 2012; Nie et al., 2013; Ruthes et al., 2015).
Fermentación en cultivo sumergido a nivel de biorreactor de 5L
Se utilizó un biorreactor de marca BIOSTAT® Aplus de 7 L. Las condiciones fueron: 30 ±1 °C, 300 rpm, 5 L y 1 vvm. El preinóculo utilizado fue a partir de Ganoderma sp., en medio Bio + glucosa al 10% con 5 días de incubación y cuya cantidad fue del 10% del volumen de trabajo del Biorreactor. La determinación de biomasa y polisacáridos se hizo de igual forma que con el producto obtenido en Erlenmeyers con algunas modificaciones que se detallan a continuación. Luego del proceso de extracción detallado en la figura 1, se toma una muestra de extracto crudo de polisacárido, se hizo diálisis durante 3 días con agua desionizada a 4 °C. Seguidamente se liofilizaron las muestras obteniéndose 4 extractos denominados de la siguiente manera: GEPSs: Exopolisacárido soluble de Ganoderma, GEPSi: Exopolisacárido insoluble de Ganoderma, GIPSs: Intrapolisacárido soluble de Ganoderma, GIPSi: Intrapolisacárido insoluble de Ganoderma.
Para los ensayos en UV, se tomaron 20 mg/mL de cada uno de los extractos; GEPSs y GIPSs se diluyeron en agua desionizada, y GEPSi y GIPSi se solubilizaron en NaOH 1M. Se hizo un escaneo de sus fracciones entre las longitudes de onda 200 y 400 nm para identificar proteínas (280 nm) y ácidos nucleicos (260 nm) (Zhao et al., 2015). Seguidamente se halló el porcentaje de a y p glucanos presente en los extractos, mediante el kit enzimático K-YBGL ® (Megazyme). Posteriormente, se utilizó la técnica instrumental de infrarrojo para identificar enlaces característicos de polisacáridos en los rangos. La muestra se preparó con KBr en polvo grado espectroscópico para formar una pastilla de 1 mm y posteriormente realizar las mediciones de infrarrojo entre las longitudes de onda 1000 - 4000 cm-1 (Ramos, 1990; Zhao et al., 2015).
Ensayo de actividad biológica
Se realizaron ensayos de bioactividad (Zhao et al., 2015; Nie et al., 2013) de los extractos para la determinación de su capacidad antitumoral en cultivos de líneas célulares cancerígenas con la ayuda y experticia del grupo de investigación GIM de la Universidad de Antioquia. Se utilizaron las líneas celulares, sarcoma de ratón J774 para evaluar el efecto antitumoral y VERO para evaluar la citotoxicidad en células humanas; gentilmente donadas por el laboratorio 6, del Centro de Investigación del Cáncer de la Universidad de Salamanca, España. Éstas, fueron crecidas en el medio RPMI 1640 (Gibco®) y suplementadas con 10% de FBS (Fetal Bovine serum), 1000 U/mL de Penicilina y 100 μg/mL de estreptomicina. Para el tratamiento con los extractos, las células se cultivaron a 1500 células/ pozo en platos de 96 a 37 °C y 5 % de CO2. Para calcular la concentración inhibitoria 50 (IC50) se realizó un ensayo colorimétrico (MTT) el cual mide la proliferación celular. Las células fueron resuspendidas en medio RPMI con 10 % de SFB y cultivadas en platos de 96 pozos (100 μL de volumen final por pozo) a 37 °C y 5 % de CO2 por 72 horas en presencia de diferentes concentraciones de cada uno de los polisacáridos (3.12, 6.25, 12.5, 25, 50, 100 Mg/mL) (Zhao et al., 2015; Nie et al., 2013). Cada una de las concentraciones se hizo por triplicado.
Resultados y discusión
Cepa de Ganoderma sp.
En la figura 2 se presenta el cultivo de Ganoderma sp., en medio Kirk y las observaciones microscópicas en azul de lactofenol, donde se pudo identificar las hifas septadas y clamidosporas características del hongo.
Evaluación de sustratos para la producción de polisacáridos y biomasa de Ganoderma sp.
Se ha encontrado que el sustrato incide en la producción de metabolitos fúngicos y entre ellos los polisacáridos, ya que algunas investigaciones han demostrado que parte de la composición química de EPS e IPS dependen en cierta medida del medio de cultivo en el que se incube el microorganismo, principalmente de la fuente de carbono (Donot et al., 2012; Kagimura et al., 2015).
Evaluación de sustratos para la producción de biomasa de Ganoderma sp.
Sustratos utilizados: Bio 3%, Bio 3% + Lactosa (Lac: 1, 10 y 20 %), Bio 3% + Glucosa (Glu: 1, 10 y 20%), Bio 3% + Glucosa + Lactosa (Bio 3% + 10% Gluc +10% Lac). Los medios de cultivo que generaron mayor producción de biomasa fueron Bio 3% + Glucosa 20% y Bio 3% + Lactosa 10%.
Las barras de error corresponden a la desviación estándar de los triplicados de cada variable.
Las letras sobre las barras representan las diferencias significativas entre grupos. Letras iguales indican que no hay diferencias significativas y letras diferentes indican que si hay diferencias significativas (P < 0,05).
El sustrato Bio, se utilizó en este trabajo en aras de aprovechar residuos biodegradables que pueden ser utilizados por las enzimas fúngicas, beneficiando la producción de metabolitos, disminuyendo costos de producción, obteniéndose buenos rendimientos y como valor agregado la contribución al cuidado del ambiente.
Al inicio de la fermentación, el medio de cultivo Bio presentó solubilidad parcial en agua, evidenciando cambios durante el proceso de fermentación, observándose una transformación y solubilidad del medio al transcurrir el tiempo, indicando que el hongo estaba consumiendo el sustrato, comparado con el control sin inocular. En la figura 3 se aprecia que dicho sustrato por sí solo, no es suficiente para alcanzar altas concentraciones de biomasa en menor tiempo, obteniéndose un promedio de 12 g/L a los 10 días de fermentación (figura 3 Bio 3%). Otras investigaciones como la de Fang y Zhong (2002), utilizaron fuentes de carbono convencionales como glucosa al 20, 35, 50 y 65 g/L, encontrando que a la concentración de 35 g/L (3.5 % p/v aprox.) se produjeron 14.1 g/L de biomasa de G. lucidum a los 8 días de fermentación. Por otra parte, Tang y Zhong (2002) evaluaron la producción de biomasa con lactosa inicial al 20, 35, 50 y 65 g/L obteniendo un máximo de 14,39 g/L de biomasa de G. lucidum a 65 g/L de lactosa (6,5% p/v aprox.) a los 14 días.
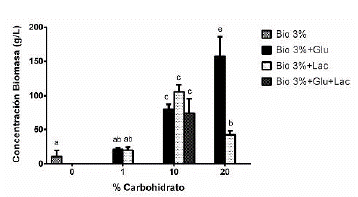
Figura 3 Efecto de la concentración de diferentes sustratos para la producción de biomasa de Ganoderma sp.
En la presente investigación con el medio Bio al 3% sin suplementación con glucosa o lactosa, se produjo 12 g/L y con glucosa o lactosa al 1% se produjeron 20,97 y 20,02 g/L respectivamente a los 10 días; sugiriendo que es posible utilizar sustratos alternativos, económicos y amigables con el ambiente con resultados similares o mejores que los medios convencionales, para la producción de hongos de importancia biotecnológica.
En la figura 3 y en los análisis de comparación de medias mediante el procedimiento de LSD de Fisher, se puede concluir que la concentración de la biomasa es similar al utilizar glucosa o lactosa al 1% y al 10% (tanto independientes como combinadas), siendo la concentración del 10% la que mayor favoreció la producción de biomasa. Otros investigadores como Papinutti (Papinutti, 2010) también demostraron que no hay diferencias significativas en el desarrollo de la biomasa cuando se utiliza glucosa o lactosa como única fuente de carbono a una concentración inicial del 1% p/v.
Adicionalmente, se observó que el sustrato influye de una forma altamente significativa en el crecimiento del hongo. En todos los porcentajes de adición de glucosa y lactosa, hubo un incremento en la concentración de la biomasa, siendo directamente proporcional en el caso de la glucosa. Al utilizar lactosa, se observó incremento hasta el 10% y de ahí en adelante pareciese haber una inhibición por sustrato. En otras investigaciones se ha demostrado que altas concentraciones de algunos nutrientes inhiben el crecimiento de los hongos en procesos de fermentación (Fang and Zhong, 2002; Chen et al., 2008; Papinutti, 2010).
Pese a que la mayor concentración de biomasa se obtiene al 20% de glucosa (200 g/L), es una cantidad muy alta de sustrato para un proceso de fermentación que se piensa utilizar a escala industrial, donde el objetivo es disminuir costos de producción por lote, utilizar sustratos alternativos y obtener buenos rendimientos (costo-beneficio). Por otra parte, la lactosa al 20 % es poco soluble en agua y desfavoreció el crecimiento del hongo.
Evaluación de sustratos para la producción de IPS de Ganoderma sp.
Sustratos utilizados: Bio, Bio + Lactosa (Lac: 1, 10 y 20 %), Bio + Glucosa (Glu: 1, 10 y 20%), Bio + Glucosa + Lactosa (Bio + 10% Glu + 10% Lac). El medio de cultivo que generó mayor producción de EPS fue Bio + Lac 20%.
Las barras de error corresponden a la desviación estándar de los triplicados de cada variable.
Las letras sobre las barras representan las diferencias significativas entre grupos. Letras iguales indican que no hay diferencias significativas y letras diferentes indican que si hay diferencias significativas (P < 0,05).
En la figura 4 se puede observar que la producción de EPS es dosis dependiente, presentándose una mayor concentración cuando se adicionó glucosa o lactosa al 20%.
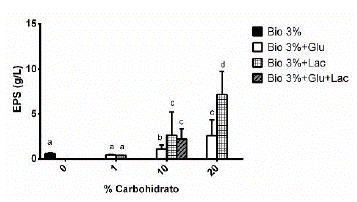
Figura 4 Efecto de la concentración de diferentes sustratos para la producción de EPS de Ganoderma sp.
Revisando resultados de otros autores, se encontró que Fang y Zhong (2002) produjeron 0,43 ± 0,05 g/L de EPS de G. lucidum a los 6 días de fermentación utilizando glucosa a 20 g/L (2% p/v) como fuente de carbono, mientras que Tang y Zhong (2002) produjeron 0,32 ± 0,04 g/L de EPS de G. lucidum el día 12 de fermentación utilizando lactosa a 20 g/L (2% p/v). En esta investigación con el medio Bio al 3% suplementado con glucosa o lactosa al 1% se produjeron 0,47 ± 0,06 g/L y 0,40 ± 0.04 g/L de EPS respectivamente a los 10 días de fermentación.
No se observaron diferencias estadísticamente significativas cuando se utilizó lactosa al 10% o glucosa en combinación con lactosa al 10%. Al utilizar lactosa o glucosa al 10% y lactosa al 20% se observan diferencias significativas en la producción de EPS, siendo mayor en el caso de la lactosa. Lo anterior demuestra que la producción de EPS es dosis-dependiente con respecto a la adición de estos azúcares tal y como lo han demostrado otros autores (Fang and Zhong, 2002; Tang and Zhong, 2002; Lee et al., 2007). Teniendo en cuenta lo anterior, para producir EPS de una forma viable y económica, se sugiere utilizar una combinación del sustrato Bio con lactosa al 10% (2,65 g/L).
Evaluación de sustratos para la producción de IPS de Ganoderma sp.
Sustratos utilizados: Bio + Lactosa (Lac: 1, 10 y 20 %), Bio + Glucosa (Glu: 1, 10 y 20%), Bio + Glucosa + Lactosa (Bio + 10% Gluc + 10% Lac). El medio de cultivo que generó mayor producción de IPS fue Bio + Glu 10% + Lac 10%.
Las barras de error corresponden a la desviación estándar de los triplicados de cada variable.
Las letras sobre las barras representan las diferencias significativas entre grupos. Letras iguales indican que no hay diferencias significativas y letras diferentes indican que si hay diferencias significativas (P < 0,05).
En la figura 5 se muestra que no hay diferencias significativas en utilizar la mayoría de los sustratos para la producción de IPS, excepto cuando se utiliza lactosa al 20% y la combinación de lactosa y glucosa al 10%, como se observa en la diferencia de letras sobre las barras.

Figura 5 Efecto de la concentración de diferentes sustratos para la producción de IPS de Ganoderma sp.
Fan y Zhong (2002) cuando utilizaron glucosa a 20 g/L (2% p/v) como fuente de carbono, produjeron 0,55 ± 0,028 g/L de IPS de G. lucidum a los 6 días, mientras que Tang y Zhong (2002) produjeron 0,92 ± 0,00 g/L de IPS de G. lucidum utilizando lactosa como fuente de carbono. En la presente investigación se logró producir 0,5 ± 0,1 g/L y 0,56 ± 0, 09 g/L de IPS utilizando el medio Bio con glucosa y lactosa al 1% respectivamente a los 10 días de fermentación. Para el caso de la glucosa se obtuvo el mismo resultado que los autores mencionados, utilizando un residuo agroindustrial como sustrato y a la mitad de la concentración de glucosa que ellos utilizaron.
Utilizando el medio Bio con 1, 10, y 20 % p/v de glucosa, la productividad de IPS en relación con la biomasa fue de 25,7 ± 2,8; 8,72 ± 1,8; 3,73 ± 0,76 mg/ 100 mg de biomasa, respectivamente; y utilizando el medio Bio con 1, 10, 20 % p/v de lactosa se obtuvieron 33,95 ± 6,3; 9,06 ± 2,2; 11,05 ± 2,3 mg/100 mg de biomasa, respectivamente; indicando que la producción de IPS es inversamente proporcional a la concentración del carbohidrato adicionado, similar a lo obtenido por Lee et al. (2007) en la producción de IPS de G. applanatum.
El efecto estimulatorio de los carbohidratos en la producción de polisacáridos, ya se ha observado en investigaciones previas (Fang and Zhong, 2002; Tang and Zhong, 2002; Lee et al., 2007; Papinutti, 2010). De los resultados obtenidos, se puede concluir que la producción de Biomasa y EPS en la mayoría de los casos es dosis-dependiente con respecto al carbohidrato suplementado y en el caso de IPS, no se observan grandes diferencias entre los tratamientos. La mayor producción de IPS se observa al combinar el medio Bio con lactosa y glucosa al 10% (0,78 ± 0,1 g/L). Esto quiere decir que no necesariamente la producción de biomasa y polisacáridos están directamente relacionadas. Por lo tanto para fines de producción simultánea de biomasa, EPS e IPS, obteniendo los mejores rendimientos y de una forma económica, se decide continuar los ensayos en biorreactor con el medio Bio suplementado con lactosa al 10%
Producción de biomasa y polisacáridos a nivel de biorreactor de 5L
A nivel de biorreactor de 5 L se decidió trabajar con lactosa al 10% como sustrato para fomentar tanto la producción de biomasa como de polisacáridos. No se modifican variables porque la producción se realiza con el fin de obtener grandes cantidades de biomasa y polisacáridos para los posteriores análisis de identificación. Se realizaron seguimientos del cultivo en el microscopio cada 2 días, observándose una buena formación y tamaño de pellets, lo cual es muy positivo a la hora de realizar el escalado de una fermentación (figura 6). Al finalizar la fermentación (5 días) se obtuvo una biomasa de 153 g/L. El tiempo de fermentación fue menor que a escala de Erlenmeyer, porque a días posteriores se generaba gran cantidad de polisacárido, cambiando las propiedades reológicas del medio y dificultando la agitación y disminuyendo la trasferencia de oxígeno (datos no mostrados).
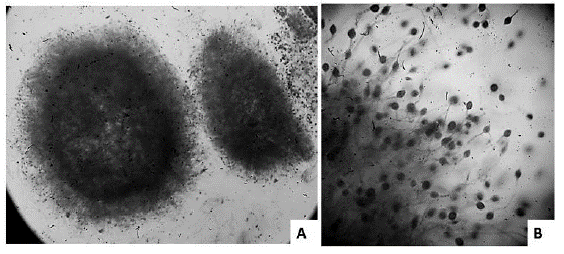
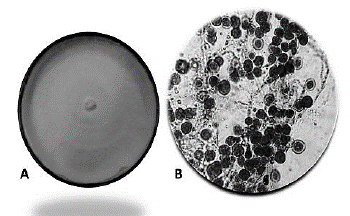
Figura 6 Seguimiento de los pellets de Ganoderma sp., en cultivo sumergido. Micrografías a 40X (A) y 400X (B) con azul de lactofenol.
En la figura 7 para Ganoderma sp., se observa la cantidad de polisacárido producido por volumen de biorreactor. La mayor cantidad de carbohidratos obtenidos con el medio Bio suplementado con lactosa, se da en el extracto GIPSi y la menor cantidad en GIPSs. La sumatoria total de polisacáridos producidos en el biorreactor fue de 26,9 g/L. Debido a la gran cantidad de biomasa producida, se obtuvo mayor concentración de IPS insoluble, ya que a nivel estructural la pared celular fúngica posee polisacáridos insolubles como la quitina y los glucanos (Chan et al., 2009; Donot et al., 2012). De los EPS liberados al medio, se obtuvo mayor proporción de solubles que de insolubles, probablemente porque el hongo se encontraba en un medio acuoso que favoreció la liberación de sustancias solubles.
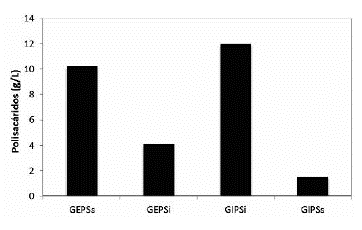
Figura 7 Producción de EPS e IPS a nivel de Biorreactor. Ganoderma sp.: GEPSs: EPS soluble, GEPSi: EPS insoluble, GIPSi: IPS insoluble, GIPSs: IPS soluble.
Tabla 1 Porcentaje peso/peso de a y P glucanos en los extractos fúngicos. El porcentaje se obtiene con base en el peso seco del extracto crudo.
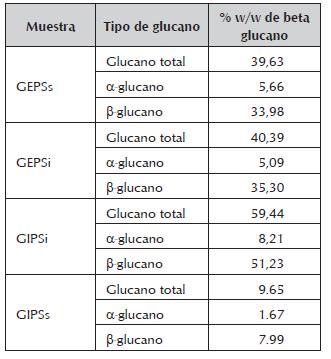
Se cuantificaron los a y p glucanos para determinar las diferencias entre la concentración de azúcares obtenida por el método del fenol ácido sulfúrico y la cantidad de alfa y beta glucanos presentes en los extractos de acuerdo al método enzimático que es más específico. Como se presenta en la tabla 1 se confirma la presencia de beta y alfa glucanos en los extractos de Ganoderma sp. El extracto GIPSi fue el que presentó mayor porcentaje de glucanos totales. En todas las muestras se encontró que de los polisacáridos totales de las diferentes fracciones, en general, entre el 40% y el 60% son tipo gluca-nos, lo cual es muy satisfactorio, ya que éstos presentan buena actividad biológica (Zhao et al., 2015; Nie et al., 2013; Ruthes et al., 2015).
Se encontró que más del 80% de los glucanos totales en todas las muestras son β-glucanos, lo cual es acorde a lo reportado para éstos hongos, debido a que los β -glucanos hacen parte de su pared celular (Ruthes et al., 2015). Esta situación es muy satisfactoria ya que los β -glucanos han sido los más estudiados, aislados y utilizados por sus propiedades bioactivas.
Análisis por ultravioleta
En la figura 8 se aprecian los espectros ultravioleta de cada uno de los extractos a λ entre 200-400 nm. Se compararon los extractos contra un estándar de proteína, todos a una concentración de 2 mg/mL. Se puede observar que no hay picos característicos de ácidos nucleicos (260 nm), y el extracto GIPSi presentó un pico a 280 nm, lo que permite inferir la presencia de proteínas que pueden estar unidas a polisacáridos, aunque en pequeña proporción por su baja absorción en el espectro. Para la determinación de polisacáridos por el método de fenol-ácido sulfúrico se debe tener en cuenta la pureza de las muestras ya que el método es sensible a altas concentraciones de proteínas. Para purificarlas, es común utilizar el método de Sevag (Staub, 1965), el cual consume mucho tiempo, reactivos y es muy laborioso. Como no se observaron altas concentraciones de proteína y en el presente trabajo el interés primordial es la bioprospección de hongos endógenos de Antioquia y la identificación de metabolitos de interés farmacéutico, se decidió no purificar el extracto, para conocer sus características y no excluir metabolitos posiblemente bioactivos que se pierden en los procesos de purificación.
Análisis por infrarrojo
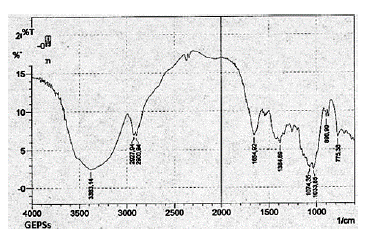
La determinación de la configuración anomérica de los monosacáridos fue analizada mediante espectroscopía de infrarrojo (IR). Se analizaron todos los extractos, y se observó que presentaban un patrón similar, por lo cual sólo se presenta el espectro de GEPSs.
El espectro obtenido para el extracto GEPSs presentado en la figura 9 fue el esperado para un p-glucano, mostrando una banda de absorción de alrededor de 890 cm-1 la cual es característica de los enlaces p-glicosídicos. Además el espectro carece de las bandas 850 y 930 cm-1 que son bandas normalmente atribuidas a los alfa glicosídicos (Limberger-Bayer, de Francisco et al., 2014).
En este espectro, también se observan bandas a 1650 cm-1 que son características de los enlaces CO-NH, relacionados con péptidos o amino-azucares (Zechner-Krpan et al., 2010).
Actividad biológica
Muchos estudios se han concentrado en la producción y bioactividad de los polisacáridos solubles en agua, por ser más fáciles de manejar, cuantificar y caracterizar. Por el contrario, la actividad de los polisacáridos insolubles en agua ha sido poco estudiada (Papinutti, 2010). Es por esto que en este estudio se evalúa la actividad de polisacáridos solubles e insolubles, ampliando un poco más el conocimiento de éstos últimos.
En los ensayos realizados en las células VERO, no se observó inhibición de crecimiento a la mayor concentración utilizada. Indicando así, que los polisacáridos no poseen actividad citotóxicas en células humanas a las concentraciones evaluadas (IC50 > 100 Mg/mL) (Datos no mostrados) (OPS 2013). En sarcoma de células reticulares de ratón (J774) hubo un cambio de morfología e inhibición de crecimiento en las células a una concentración de 200 Mg/mL (figura 10).

Figura 10 A. Sarcoma de ratón J774 antes del tratamiento con los extractos. B. Sarcoma J774 después del tratamiento con los extractos a 100 y 200 μg/mL.
El comportamiento fue similar en todos los extractos.
En esta investigación se observó un efecto dosis-dependiente, similar a lo reportado por otros autores con respecto a la actividad antitumoral de los polisacáridos in vitro (Chen et al., 2008).
El mecanismo de acción de los polisacáridos sobre las líneas celulares cancerígenas no está completamente elucidado (Zhao et al., 2015).
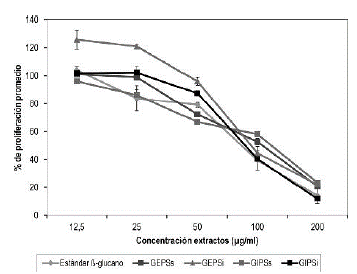
Se puede observar que el efecto es dosis-dependiente y todos los extractos poseen una actividad similar a la del estándar de β-glucano.
En la figura 11 se observa un efecto de los extractos de Ganoderma sp., sobre el porcentaje de proliferación de células de sarcoma J774. Se toma como 100% el control de las células sin tratamiento. Casi todos los extractos incluyendo el estándar de p-glucano (Chroma-dex®), cuya promesa de venta es poseer bioactividad, presentan un comportamiento similar. El efecto es dosis-dependiente, donde a bajas concentraciones no hay efectos en las células de J774 y a concentraciones entre 100 y 200 Mg/mL se observa efecto inhibitorio en la proliferación. El extracto que tuvo mayor efecto en las células y presentó un comportamiento similar al estándar (IC50= 81,8) fue el GIPSi (IC50= 86) (tabla 2). Este extracto presentó un espectro similar en el IR al GEPSs (figura 9), lo cual indica que tiene enlaces característicos de los polisacáridos fúngicos. Adicionalmente, fue el extracto con mayor concentración de azúcares por volumen de biorreactor, al igual que mostró presencia de proteínas en el espectro UV y fue del que se obtuvo mayor porcentaje de glucanos (59%) (tablas 1, 2 y figura 8). Lo anterior indica la importancia de continuar evaluando este extracto, porque con los ensayos realizados hasta el momento posee todas las características de un polisacárido bioactivo. De igual forma, se hace necesario realizar ensayos posteriores con otras líneas celulares donde se evalúe su capacidad antitumoral directa o si su efecto es inmunomodulador como han demostrado otras investigaciones (Feng et al., 2010).
Conclusiones
Comúnmente en las investigaciones se utilizan cepas comerciales para la producción de metabolitos de importancia industrial y farmacéutica. En este trabajo, se logró obtener altos rendimientos de biomasa y de polisacáridos a partir de una cepa colombiana de Ganoderma sp., aislada en la región Andina tanto a escala de Erlenmeyer como de biorreactor de 5 L.
Con el sustrato Bio utilizado se lograron mayores cantidades de biomasa y polisacáridos que las reportadas en investigaciones que utilizan sustratos convencionales. Adicionalmente, al utilizar suplementos de carbohidratos como la glucosa y la lactosa, se mejoró la producción simultánea de biomasa y polisacáridos, obteniéndose grandes cantidades. Entre los medios evaluados, se eligió como mejor sustrato al medio Bio suplementado con lactosa al 10%.
Este trabajo muestra que es posible utilizar residuos agroindustriales en procesos biotecnológicos como sustratos de bajo costo y que contribuyen a la utilización de estrategias limpias que permitan el cuidado del ambiente y con los que se pueden obtener mayores rendimientos.
Los ensayos de fenol-ácido sulfúrico, ultravioleta, % de glucanos e IR, permitieron detectar la presencia de poli-sacáridos y algunas proteínas en los extractos, sugiriendo que los hongos endógenos de nuestra región también poseen características y metabolitos importantes a nivel medicinal como los reportados en países orientales. Se encontró que más del 80% de los glucanos totales obtenidos, son β-glucanos, los cuáles han sido ampliamente estudiados por ser moléculas bioactivas.
Adicionalmente se demostró que los extractos de polisacáridos a menos de 200 Mg/mL no presentaron toxicidad en líneas celulares VERO y poseen efecto antiproliferativo en células de sarcoma J774, especialmente con el extracto GIPSi que tuvo un efecto similar al generado por estándares comerciales de β-glucanos.
Es necesario realizar posteriores ensayos que permitan caracterizar los polisacáridos aislados y determinar su actividad biológica, especialmente cuando se trata de aprovechar la biodiversidad colombiana.
Agradecimientos
Los autores agradecen al grupo de Catalizadores y Adsorbentes y al Grupo de Inmuno Modulación de la Universidad de Antioquia por su colaboración, y a la Universidad de Antioquia y a Colciencias por la financiación de este proyecto (Convocatoria 521-2010 - Banco de Proyectos de Investigación Científica o Tecnológica).
REFERENCIAS
Arboleda, C. y A. I. Mejía. (2010). Inducción de la actividad lacasa en Ganoderma sp., y actividad antioxidante de su biomasa. Revista cubana de farmacia, 44(4), 519-532. [ Links ]
Arboleda, C., Mejía, A.I.; Franco-Molano, A.E., Jiménez, G.A; Penninckx, M.J. (2008). Autochthonous white rot fungi from the tropical forest of Colombia for dye decolourisation and lignino-lytic enzymes production. Sydowia, 60(2), 165-180. [ Links ]
Benzie, I. F., & Wachtel-Galor, S. (Eds.). (2011). Herbal medicine: biomolecular and clinical aspects. CRC Press. [ Links ]
Bishop, K. S., Kao, C. H., Xu, Y., Glucina, M. P., Paterson, R. R. M., & Ferguson, L. R. (2015). From 2000 years of Ganoderma lu-cidum to recent developments in nutraceuticals. Phytochemistry, 114, 56-65. [ Links ]
Chan, G. C., Chan, W.K., Sze, D.M. (2009). The effects of beta-glucan on human immune and cancer cells. Journal of Hematology and Oncology, 10, 2-25. [ Links ]
Chen, H., Ju, Y., Li, J., Yu, M. (2012). Antioxidant activities of poly-saccharides from Lentinus edodes and their significance for disease prevention. International Journal of Biological Macromolecules, 50(1), 214-218. [ Links ]
Chen, W., Zhao, Z., Chen, S.F., Li, Y.Q. (2008). Optimization for the production of exopolysaccharide from Fomes fomentarius in submerged culture and its antitumor effect in vitro. Bioresource technology, 99 (8), 3187-3194. [ Links ]
Daba, A.S . y O. U. Ezeronye. (2003). Anti-cancer effect of poly-saccharides isolated from higher basidiomycetes mushrooms. African Journal of Biotechnology, 2(12), 672-678. [ Links ]
deVere White, R. W., Hackman, R. M., Soares, S. E., Beckett, L. A., & Sun, B. (2002). Effects of a mushroom mycelium extract on the treatment of prostate cancer. Urology, 60(4), 640-644. [ Links ]
Donot, F., Fontana, A., Baccou, J.C., Schorr-Galindo, S. (2012). Microbial exopolysaccharides: Main examples of synthesis, excretion, genetics and extraction. Carbohydrate Polymers, 87(2), 951-962. [ Links ]
DuBois, M., Gilles, K.A., Hamilton, J.K., Rebers, P.A., Smith, F. (1956). Colorimetric Method for Determination of Sugars and Related Substances. Analytical Chemistry, 28(3), 350-356. [ Links ]
Fang, Q.-H. y J.-J. Zhong. (2002). Effect of initial pH on production of ganoderic acid and polysaccharide by submerged fermentation of Ganoderma lucidum. Process Biochemistry, 37(7), 769-774. [ Links ]
Feng, Y.L., Li, W.Q., Wu, X.Q., Cheng, J.W., Ma, S.Y. (2010). Statistical optimization of media for mycelial growth and exo-polysaccharide production by Lentinus edodes and a kinetic model study of two growth morphologies. Biochemical Engineering Journal, 49(1), 104-112. [ Links ]
Fraga, I., Coutinho, J., Bezerra, R.M., Dias, A.A., Marques, G., Nunes, F.M. (2014). Influence of culture medium growth variables on Ganoderma lucidum exopolysaccharides structural features. Carbohydrate Polymers, 111, 936-946. [ Links ]
Kagimura, F.Y., da Cunha, M.A., Barbosa, A.M., Dekker R.F., Malfatti, C.R. (2015). Biological activities of derivatized D-glucans: A review. International Journal of Biological Macromolecules, 72, 588-598. [ Links ]
Kirk, T. K., Croan, S., Tien, M., Murtagh, K. E., & Farrell, R. L. (1986). Production of multiple ligninases by Phanerochaete chrysosporium: effect of selected growth conditions and use of a mutant strain. Enzyme and Microbial technology, 8(1), 27-32. [ Links ]
Lee, W. Y., Park, Y., Ahn, J.K., Ka, K.H., Park, S.Y. (2007). Factors influencing the production of endopolysaccharide and exopoly-saccharide from Ganoderma applanatum. Enzyme and Microbial Technology, 40(2), 249-254. [ Links ]
Limberger-Bayer, V. M., de Francisco, A., Chan, A., Oro, T., Ogliari, P. J., & Barreto, P. L. (2014). Barley p-glucans extraction and partial characterization. Food chemistry, 154, 84-89. [ Links ]
Masuko, T., Minami, A., Iwasaki, N., Majima, T., Nishimura, S.I., Lee, Y. (2005) Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Analytical biochemistry, 339(1), 69-72. [ Links ]
Nie, S., Zhang, H., Li, W., Xie, M. (2013). Current development of polysaccharides from Ganoderma: Isolation, structure and bioactivities. Bioactive Carbohydrates and Dietary Fibre, 1(1), 10-20. [ Links ]
Papinutti, L. (2010). Effects of nutrients, pH and water potential on exopolysaccharides production by a fungal strain belonging to Ganoderma lucidum complex. Bioresource technology, 101(6), 1941-1946. [ Links ]
Permiso No. 17. Autoridad Nacional de Licencias Ambientales-ANLA, Identificación, recolección y clasificación taxonómica y molecular de hongos basidiomicetes productores de enzimas ligninolíticas 22 de mayo de 2012. [ Links ]
Radicado No. 11-160567. Superintendencia de Industria y Comercio, resolución No. 49744 por la cual se otorga una patente de invención, Bogotá D.C., 22 de Agosto de 2014. [ Links ]
Ramos M. (1990). Utilidad del análisis térmico en microbiología. Aplicación de las técnicas TG-DTG, DTA y DSC en la caracterización de polisacáridos de paredes fúngicas. España: Universidad de Valladolid. [ Links ]
Ruthes, A. C., Smiderle, F. R., Iacomini, M. (2015). D-Glucans from edible mushrooms: A review on the extraction, purification and chemical characterization approaches. Carbohydrate Polymers, 117, 753-761. [ Links ]
Organización Panamericana de la Salud-OPS. (2013). Cáncer en las Américas: perfiles de país 2013. Washington, D.C. Recuperado de: http://www.paho.org/hq/index.php?option=com_docman&task=doc_download&gid=24076&Itemid= [ Links ]
Staub, A.M. (1965). Removeal or Protein-Sevag Method. Methods in Carbohydrate Chemistry, 5, 5-6. [ Links ]
Tang, Y.J. y J.J. Zhong. (2002). Fed-batch fermentation of Ganoder-ma lucidum for hyperproduction of polysaccharide and ganoderic acid. Enzyme and Microbial Technology, 31(1-2), 20-28. [ Links ]
Wagner, R., Mitchell, D.A., Sassaki G.L, de Almeida Amazonas, M.A. (2004). Links between morphology and physiology of Ganoderma lucidum in submerged culture for the production of exo-polysaccharide. Journal of Biotechnology, 114(1-2), 153-164. [ Links ]
Zechner-Krpan, V; Petravic-Tominac, V., Gospodaric, I., Sajli, L., Dakovic, S., Filipovic-Grcic, J. (2010). Characterization of ft-Glucans Isolated from Brewer's Yeast and Dried by Different Methods. Food Technology and Biotechnology, 48(2), 189-197. [ Links ]
Zhao, L; Dong, Y; Chen, G; Hu, Q. (2010). Extraction, purification, characterization and antitumor activity of polysaccharides from Ganoderma lucidum. Carbohydrate Polymers, 80(3), 783-789. [ Links ]
Recibido: 18 de Enero de 2015; Aprobado: 01 de Octubre de 2015











 texto em
texto em