Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.2 Bogotá July/Dec. 2015 Epub Aug 09, 2021
https://doi.org/10.15446/rev.colomb.biote.v17n2.54277
Artículos/Investigación
Estandarización del protocolo de desinfección para la micropropagación de Aspidosperma polyneuron
* Bióloga, Universidad del Tolima, AA 546. dianagarcia88@gmail.com
** Docente de Planta Facultad de Ciencias. Director Grupo de Investigación en Genética y Biotecnología Vegetal y Microbiana. GEBIUT. Universidad del Tolima. AA 546 nmesa@ut.edu.co
*** Docente de Planta Facultad de Ciencias. Investigadora Grupo de Investigación en Genética y Biotecnología Vegetal y Microbiana. GEBIUT. Universidad del Tolima. AA 546 mlocampo@ut.edu.co
Aspidosperma polyneuron es un especie nativa de la región neotropical, en países como Colombia, Venezuela, Perú, Brasil, Argentina y Paraguay, propio de bosques semideciduos, catalogada desde 1998 por la UICN como "En Peligro (EN)", debido a que sus poblaciones naturales fueron sometidas a una intensa explotación con fines madereros y su hábitat se vio seriamente degradado por actividades agrícolas y silvopastoriles. Las dificultades para su regeneración natural y el enraizamiento de las estacas, hace que el cultivo in vitro sea una eficaz herramienta para contrarrestar las dificultades reproductivas que presenta. Sin embargo, la presencia de contaminantes que afectan la viabilidad de los explantes, precisa el desarrollo de protocolos que permitan el establecimiento in vitro de la especie. El objetivo de la presente investigación fue lograr el establecimiento aséptico y la inducción de la callogénesis en explantes de A. polyneuron, mediante la evaluación de diferentes tratamientos de desinfección. Los explantes se obtuvieron de individuos de regeneración natural, en el municipio de Armero, departamento del Tolima, los cuales se sumergieron en agua destilada con una gota de Tween® 80 por cada 100 ml, durante 10 minutos y lavados con agua destilada estéril. Se utilizaron como agentes desinfectantes, el hipoclorito de sodio y el dicloruro de mercurio a distintas concentraciones y tiempos de inmersión. De los explantes utilizados: ápices, segmentos nodales y láminas foliares, este último fue seleccionado por su capacidad de producir callos friables de color verde, para lo cual una desinfección con dicloruro de mercurio (HgCl2) al 0.125% durante 10 minutos fue suficiente para el control de la contaminación y bajos índices de oxidación.
Palabras clave: in vitro; dicloruro de mercurio; contaminación endógena y exógena. especie forestal
Aspidosperma polyneuron is a species native to the Neotropics, in countries like Colombia, Venezuela, Peru, Brazil, Argentina and Paraguay, typical of semi-deciduous forests, catalogued since 1998 by the IUCN as "Endangered (EN)", because its natural populations were subjected to an intense exploitation for timber and its habitat was seriously degraded by agricultural and silvopastoral activities. The difficulties for its natural regeneration and the rooting of cuttings, make the in vitro culture an efficient tool to counteract the reproductive difficulties that it presents. However, the presence of pollutants that affect the viability of the explants needs the development of protocols that allow the in vitro establishment of this species. The objective of this research was to achieve aseptic establishment and the induction of callogenesis in explants of A. polyneuron, by evaluating different disinfection treatments. The expants were obtained from individuals of natural regeneration, in the Municipality of Armero in the Department of Tolima, which were immersed in distilled water with a drop of Tween® 80 for each 100 ml, for 10 minutes and then rinsed with sterile distilled water. There were used as disinfectant agents, sodium hypochlorite and mercury dichloride in different concentrations and times of immersion. Among the used explants: buds, nodal segments and leaf blades, the last one was selected for its capacity of producing friable and green callosity, for which a disinfection with mercury dichloride (HgCl2) 0.125% for 10 minutes was enough for contamination control and low indexes of oxidation.
Key words: in vitro; mercury dichloride; endogen and exogen contamination; forestal species
Introducción
Aspidosperma polyneuron es una especie que presenta serios problemas de regeneración natural; por ser un árbol de crecimiento lento, tarda casi 50 años en llegar a su etapa fértil, con alternancia en la floración por periodos de hasta cuatro años y aunque produce abundantes semillas, las tasas de germinación son muy heterogéneas (35-70%), además, son de difícil recolección debido a la altura de los árboles que pueden alcanzar hasta 40 m en condiciones naturales. Sumado a esto el difícil enraizamiento de las estacas hace que la propagación vegetativa de esta especie no tenga el éxito esperado (Damasceno et al., 2011; Del Valle, 1972; Ezcurra, et al., 1992; Mozo, 1972; PROEXPO, 1970; Ribas et al., 2005; Sakita et al., 2007; Valeiro et al., 2008).
Esta especie se encuentra en el Libro rojo de plantas de Colombia bajo la categoría global y nacional "En Peligro (EN)", debido a que su hábitat se ha visto severamente degradado, además la intensa explotación a la que fué sometido dio como resultado que las poblaciones naturales se vieran drásticamente reducidas. En Colombia entidades como la Corporación para la Defensa de la Meseta de Bucaramanga (CDMG), prohibe el aprovechamiento de A. polyneuron y ha vedado su comercialización bajo cualquier modalidad. Otra entidad que vela por la conservación de esta especie es el Sistema de Parques Nacionales Naturales, ya que protege las poblaciones naturales de cualquier explotación (Salinas & Cárdenas López, 2007).
La biotecnología es una alternativa para la producción y mejoramiento de especies forestales si se tiene en cuenta que la producción de material seleccionado requiere un alto conocimiento de la biología reproductiva, así como de los mecanismos fisiológicos que influyen en la capacidad morfogenética, según Hodson de Jaramillo (2004). Siendo entonces, el cultivo de tejidos vegetales una herramienta biotecnológica que puede ser una solución a problemas naturales e inducidos que presentan algunas especies.
Una de las dificultades para el establecimiento de cultivos in vitro, es la presencia de microorganismos contaminantes tanto endógenos como exógenos que afectan la viabilidad y el desarrollo de los explantes una vez que se han establecido in vitro, por lo tanto se requiere establecer protocolos que conlleven a minimizar o eliminar dichos microorganismos sin afectar la viabilidad de los explantes.
El objetivo de la presente investigación fue lograr el establecimiento aséptico y la inducción de la callogénesis en explantes de A. polyneuron, mediante la evaluación de diferentes tratamientos de desinfección.
Materiales y métodos
Colecta de material vegetal: se establecieron dos áreas de muestreo, la primera en el Centro Universitario Regional del Norte de la Universidad del Tolima (CURNUT), en el municipio de Armero-Guayabal en un bosque de regeneración natural de A. polyneuron, a una altitud de 320 m s.n.m. y una temperatura ambiente de 29,5°C; la segunda en el municipio de Coello en el corregimiento de Chucualí, lote sembrado con individuos de la especie, ubicada a 270 m s.n.m. y una temperatura ambiente de 29°C. Se seleccionaron tejidos de ramas juveniles y sin daño mecánico, en las dos áreas se realizó colecta de yemas apicales y para el área de CURNUT, se extrajeron algunas plántulas juveniles para adaptarlas a condiciones de invernadero y establecerlas como plantas madre.
Fase de laboratorio: la presente investigación se desarrolló en las instalaciones del Laboratorio de Protección de Plantas y Cultivo de Tejidos Vegetales de la Universidad del Tolima. Las plántulas juveniles una vez ubicadas en el invernadero, fueron sometidas a tratamientos con Benomil 5g/l, ocho días antes de la toma de los explantes y para los casos en los que se presentó ataque de insectos se realizó tratamientos con insecticida. Se realizó procesos de juvenilización mediante constantes podas para inducir rebrotes, de los cuales se tomaron los explantes (ápices, segmentos nodales y láminas foliares).
Preparación de los medios de cultivo: para todos los tratamientos de desinfección empleados se uso medio de cultivo MS (Murashige & Skoog, 1962), suplementado con 30 g/ l de sacarosa como fuente de carbono, se ajustó el pH a 5,7 antes de la adición de agar 7g/l; se sirvieron 20 ml de la solución en recipientes de vidrio, debidamente rotulados según los tratamientos, para luego ser esterilizados en autoclave durante 20 minutos a 121°C y 15 libras de presión.
Para inducir la formación de callos se tomaron explantes de hojas jóvenes, las cuales fueron cultivadas en medios MS (Murashige & Skoog, 1962) y WPM (Lloyd & McCown, 1980), adicionados con 30 g/l de sacarosa, 7 g/l de agar y un pH ajustado a 5,7. Se realizaron los siguientes tratamientos de reguladores de crecimiento vegetal: con 2,4 -D (1 y 2 mg/l) y sus respectivas combinaciones con BAP (1 mg/l).
Las láminas foliares fueron divididas en tercios (ápice, medio y base) de aproximadamente 1cm2 y cada uno sembrados en frascos diferentes, las siembras se hicieron colocando las hojas por la haz o por el envés, para un total de 16 tratamientos con 10 réplicas. Las observaciones se realizaron por 45 días, tiempo durante el cual se realizaron dos subcultivos, el primero a los 20 días y el segundo a los 40 días.
Todos los tratamientos resultantes fueron incubados bajo condiciones de fotoperiodo de 12 horas luz, temperatura de 23-25°C. Durante el periodo de observación se midieron variables como la coloración (verde claro o marrón), consistencia del callo (friable o compacto) y la formación parcial o completa de los callos.
Desinfección del material vegetal: una vez seleccionados los explantes, se lavaron con agua de la llave para retirar cualquier partícula que pudiera estar presente; luego el material se sumergió en 100 ml de agua destilada con una gota de Tween®80, en agitación constante durante 10 minutos. Se continuó con tres lavados con agua destilada para retirar el detergente; posteriormente se sumergieron, a diferentes concentraciones y tiempos de exposición según el explante, en la solución desinfectante. Finalmente se hicieron tres lavados con agua destilada esterilizada con el fin de eliminar cualquier traza de desinfectante. Para ápices se realizó un total de 21 tratamientos, para segmentos nodales 19 y para hojas se evaluó un total de 13 tratamientos de desinfección. Para cada uno de los tratamientos de desinfección empleados se realizaron 10 réplicas.
1. Tratamientos de desinfección para ápices. La investigación se realizó en yemas apicales escogidas por su mayor tamaño en relación con las laterales y por ende mayor facilidad para la extracción de meristemos, sin embargo se observó que cuando estos quedaban totalmente descubiertos se oxidaban completamente, por lo tanto se trabajó con ápices a los que sólo se les retiró los primordios foliares más externos. Se realizaron tratamientos de desinfección con NaClO y otro de doble desinfección con HgCl2.
Tabla 1 Tratamientos de desinfección empleados en ápices de A. polyneuron.
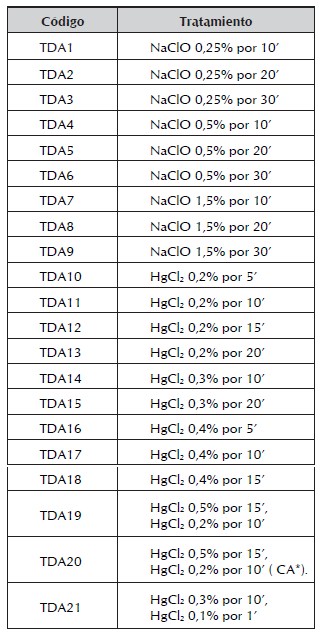
* CA: Carbón activado
Fuente: Autores
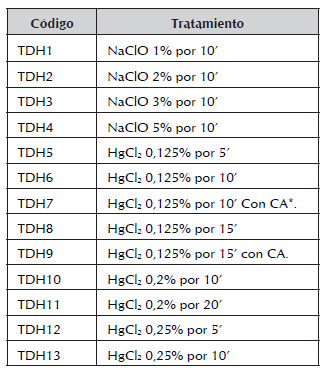
3. Tratamientos de desinfección para segmentos nodales. Se tomaron segmentos de un centímetro de longitud por 3-4 milímetros de diámetro con un nudo completo. Se usaron soluciones desinfectantes de NaClO y HgCl2 en varias concentraciones y tiempos de exposición. Una vez finalizada la desinfección, se hicieron cortes transversales en la base del explante con el fin de eliminar los extremos que se observan afectados por el desinfectante, además se procuró dejar una yema por nudo con el fin de que el explante presente el tejido meristemático apto para su brotación. En este tipo de explante también se realizaron tratamientos de doble desinfección con HgCl2. Se realizaron 10 repeticiones para cada tratamiento. Los tratamientos propuestos se observan en la tabla 2.
Tabla 2 Tratamientos de desinfección empleados en segmentos nodales de A. polyneuron.
* CA: Carbón activado
Fuente: Autores
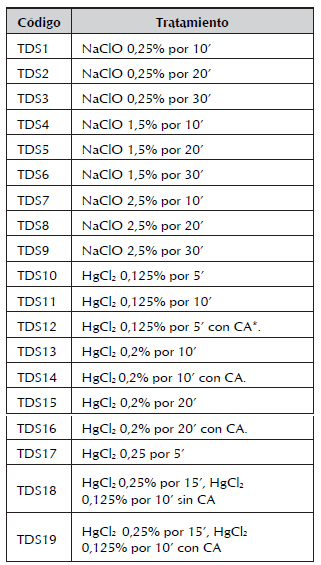
4. Tratamientos de desinfección para láminas foliares. Se seleccionaron las hojas más cercanas al ápice para someterlas a los tratamientos de desinfección, en los cuales también se emplearon soluciones de NaClO y HgCl2. Una vez desinfectadas y en condiciones de asepsia se realizaron cortes por todo el margen de la hoja, con el fin de eliminar el tejido que pudo haberse necrosado después de la desinfección. Los tratamientos se resumen en la tabla 3.
Tabla 3.Tratamientos de desinfección empleados en explantes foliares de A. polyneuron.
* CA: Carbón activado
Fuente: Autores
Una vez inoculadas en el medio de cultivo MS, fueron incubadas bajo fotoperiodo de 12 horas luz (lámparas fluorescentes de 1000 lux) a una temperatura de 23-25 °C, durante tres semanas, al cabo de las cuales se determinó el número de explantes contaminados por hongos y/o bacterias mediante observaciones diarias, los primeros días después de la siembra, luego semanalmente. También se estableció el número de explantes oxidados, mediante observaciones semanales, finalmente se determinó el número de explantes sanos y viables.
Fase estadística: la evaluación de resultados para esta etapa se realizó mediante el análisis factorial de correspondencia múltiple, mediante la herramienta de mapas perceptuales. La información fue procesada con el software estadístico multivariado SPAD 4.5. El análisis de correspondencias es un método estadístico exploratorio que se aplica con base en el análisis de tablas de contingencia que reflejan unos mapas perceptuales conformados por dos factores principales: F1 sobre el eje de las X, que es el que absorbe mayor información en variabilidad con respecto a los tratamientos originales, que estén más próximas al punto de inercia u origen (promedio) y F2, sobre el eje de las Y, que es el segundo factor en la escala de captación de información sobre el resto de los tratamientos originales. En dicho gráfico se representan conjuntamente las distintas modalidades de la tabla de contingencia (se contaminó 1, no se contaminó 2 y se oxidó 3), de forma que la proximidad entre los puntos representados por estas modalidades, reflejan un nivel de asociación entre ellas y además las que estén más próximas al punto de origen son las que más se caracterizan con base en el contexto.
Resultados y discusión
En la evaluación de la contaminación, se observó que en los tres explantes propuestos, los porcentajes más altos de contaminación se alcanzaron cuando el agente desinfectante fue el NaClO; pérdidas, en la mayoría de los casos, de hasta el 100% de las muestras, principalmente por la aparición de hongos. Cuando se trabaja con material de campo, este es uno de los principales factores que afecta el establecimiento de los explantes (Abdelnour et al., 2011).
Como se puede observar, en la figura 1 el mapa perceptual para la desinfección de ápices de A. polyneuron, los tratamientos más cercanos al punto de inercia son aquellos en los que se usó el NaClO, pero estos no controlaron (100% de contaminación), por lo que se denominó como "contaminado"; se confirma así, que este desinfectante fue ineficiente para el control de la contaminación; más distantes se encuentran los tratamientos con HgCl2, aunque estos tampoco controlaron la contaminación. Ante estos ensayos poco exitosos, se emplearon tratamientos de doble desinfección con HgCl2, los cuales se observan muy cerca del origen; sin embargo, los tratamientos TDA19 y TDA20, presentaron una oxidación cercana al 80% de los explantes; tan solo el tratamiento HgCl2 0,3% por 10' y HgCl2 0,1% por 1' (TDA21), mostró ser efectivo, pues su respuesta "no contaminado" se encuentra cerca del punto de inercia, con un control de la contaminación del 80 al 100%, igualmente este tratamiento no presentó problemas de oxidación, lo que se traduce en el mejor tratamiento de desinfección empleado en ápices de A. polyneuron.
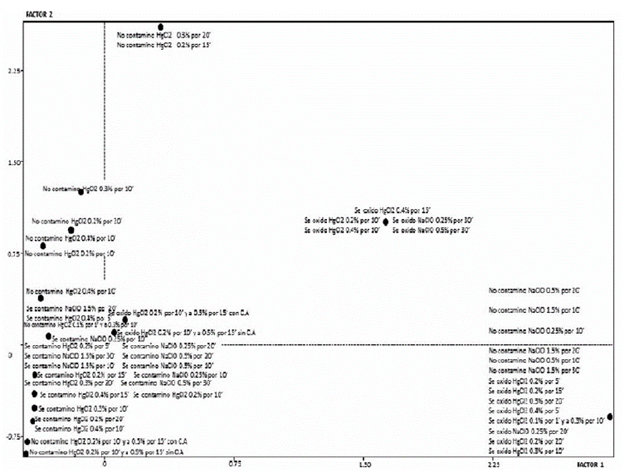
Figura 1 Mapa perceptual que refleja la asociación de los 21 tratamientos de desinfección empleados en ápices de A. polyneuron.
El HgCl2 viene siendo utilizado con éxito en forma de solución desinfectante, en muchas especies forestales y leñosas, con serios problemas de contaminación, como lo mencionan Zibbu & Batra (2010).
La edad fisiológica del tejido que se utiliza para iniciar el establecimiento de los cultivos, también tiene gran influencia en el proceso de desinfección, ya que el material tomado de plantas en crecimiento es más fácil de desinfectar en comparación con el obtenido de plantas maduras, en donde los depósitos de ceras y ligninas son mayores, y a su vez se convierten en una barrera para la acción del agente desinfectante sobre los microorganismos endógenos (López et al., 2010; Pedroza et al., 2007; Toro, 2004).
Según Abdelwahd et al. (2008) y Pedroza et al. (2007), la obtención de explantes para iniciar actividades de cultivo in vitro, necesariamente implica causar cortes o heridas en los tejidos, los cuales facilitan la entrada de nutrientes y fitohormonas, pero favorecen también la exudación de compuestos relacionados con la cicatrización y defensa contra agentes externos (principalmente patógenos), estos compuestos generalmente de estructura fenólica, son rápidamente oxidados, causando el oscurecimiento del medio de cultivo y de los tejidos, haciendo que estos se necrosen y mueran.
En el gráfico también se puede percibir, como en todos los tratamientos de desinfección empleados, que la oxidación fue baja (menor al 20%) y los puntos graficados para esta modalidad se encuentran alejados del origen, a excepción de los tratamientos TDA19 y TDA20, en la que este fenómeno predominó.
La figura 2, muestra el mapa perceptual para los tratamientos de desinfección empleados en segmentos nodales. Cerca del origen se ubican aquellos tratamientos que presentaron contaminación y oxidación (valores superiores al 70%). Los tratamientos con NaClO presentan más contaminación en relación con los que se utilizó el HgCl2, pero en éste, la oxidación es más frecuente. Sin embargo, Seneviratne & Wijesekara (1996), encontraron que diferentes concentraciones de hipoclorito de sodio, promovían más el oscurecimiento de brotes de Hevea brasiliensis, con relación al dicloruro de mercurio.
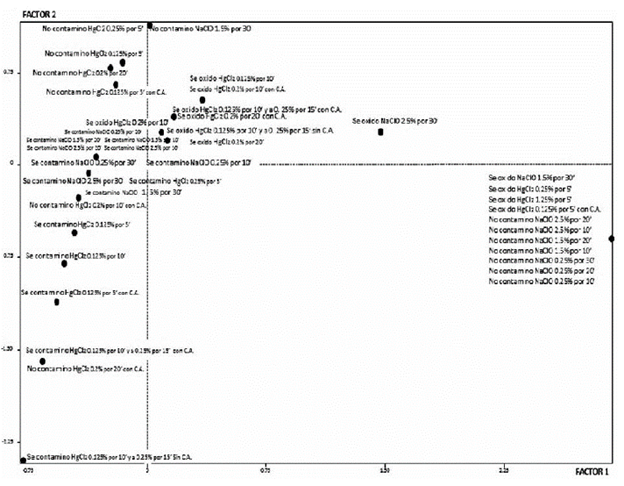
Fuente: Autores
Figura 2 Mapa perceptual que refleja la asociación de los tratamientos de desinfección empleados en segmentos nodales de A. polyneuron.
El gráfico también señala dos tratamientos con HgCl2 cercanos al punto de inercia, en los que la desinfección fue superior al 80%; fueron los tratamientos HgCl2 0,1 25% por 5' y HgCl2 0,2% por 10', ambos en presencia de carbón activado (TDS12 y TDS14 respectivamente), aunque en este último, el valor de su contribución para la modalidad "oxidado", es inferior con relación al valor obtenido en el tratamiento TDH12 como se observa en la tabla 4.
Tabla 4 Valor de las contribuciones para los tratamientos TDS12 y TDS14 en las modalidades "no contaminado" y "oxidado" sus respectivos porcentajes de contaminación y oxidación.
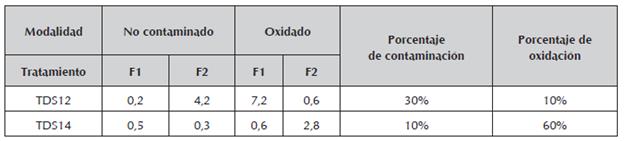
Fuente: Autores
Como se observa en la tabla anterior el tratamiento TDS14 es más efectivo para controlar la contaminación por estar más cerca al origen sin embargo, la oxidación es mucho más alta (60%) con relación al tratamiento TDS12 (10%), en el que a pesar de tener una tasa de contaminación mayor, el número de explantes necrosados es menor.
Dobránszki & Teixeira (2010), en su revisión, mencionan lo eficaz que es suplementar inicialmente el medio de cultivo con carbón activado para evitar el oscurecimiento de los explantes, ya que este proporciona un ambiente oscuro e inactiva las peroxidasas y polifenol oxidasas, lo que se traduce en el aumento de material sobreviviente. Esto se pudo demostrar en el trabajo cuando se adicionaron 3 g/l de CA, al medio de cultivo, con lo cual se redujo considerablemente la oxidación y posterior muerte de los explantes. De esta forma se aconseja desinfectar los segmentos nodales de A. polyneuron, con HgCl2 a una concentración de 0,125% por 5 minutos y suplementar el medio de cultivo con carbón activado.
En el explante láminas foliares no se requirió realizar tratamientos de doble desinfección y las concentraciones y tiempos de exposición al dicloruro de mercurio fueron una de las más bajas; por lo que se concluye que las hojas responden positivamente a los tratamientos de desinfección, minimizando los efectos de la oxidación y contaminación microbiana.
En la figura 3, el mapa perceptual muestra la relación de los tratamientos de desinfección empleados en láminas foliares de A. polyneuron, el cual presenta una composición diferente a los obtenidos anteriormente, ya que se contempla un mapa más despejado pues no se registran grandes agrupaciones alrededor del origen, reflejando de esta forma que en las hojas, la contaminación y oxidación no fueron tan marcadas como en los otros explantes evaluados.
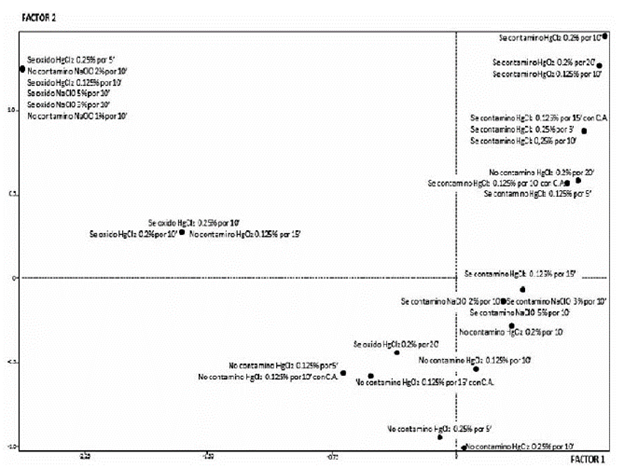
Fuente: Autores
Figura 3 Mapa perceptual que refleja la asociación de los tratamientos de desinfección empleados en láminas foliares de A. polyneuron.
El mapa confirma nuevamente lo sucedido con los otros explantes, en donde las tasas más altas (mayor a 80%) de desinfección y oxidación, se observaron cuando el desinfectante fue el dicloruro de mercurio. Sin embargo, el NaClO, funciona mejor que otros desinfectantes, como lo estudió Montes (2004), cuando compara el uso de NaClO en hojas de Anthurium andreanum, con el CaClO.
Se observa también que dos tratamientos en los que se usó dicloruro de mercurio, son los más próximos al origen con la modalidad "no contaminado", HgCl2 al 0,125% por 10' (TDH6) y HgCl2 al 0,2% por 10' (TDH10), aunque este último, mostró una mayor oxidación, lo que se reconoce en el mapa perceptual al colocarse en un punto más cercano al origen.
Como muestra la tabla 5, el tratamiento TDH10 es más eficaz en el control de la contaminación de láminas foliares sin embargo, se aumenta la oxidación, la cual es menor en el tratamiento TDH6, en el que este fenómeno no es tan marcado.
Tabla 5 Valor de las contribuciones para los factores F1 y F2, en las modalidades "no contaminado" y "oxidado", para los tratamientos TDH6 y TDH10 y sus respectivos porcentajes de contaminación y oxidación.
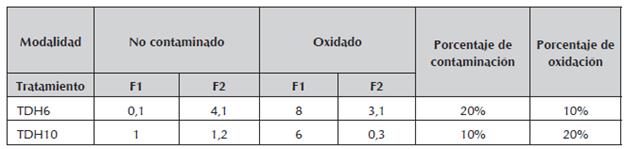
Fuente: Autores
En concordancia con lo afirmado por Torres et al. (1998) citado por Alves Dos Santos et al. (2010), una desinfección eficaz es aquella en la que los explantes que han sido expuestos a una baja concentración desinfectante, presentan tasas reducidas de contaminación microbiana y oxidación. Los tratamientos TDH10 y TDH6, presentaron resultados muy similares, pero se escoge, para los posteriores ensayos de desinfección de lámina foliares de A. Polyneuron, el tratamiento TDH6 por presentar una concentración más baja de HgCl2 y producir una menor oxidación en el explantes, lo que finalmente se traduce en menor posibilidad de daños al explante como quemaduras, toxicidad o falta de vigor.
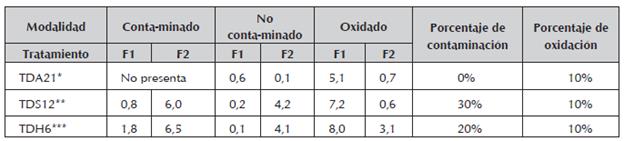
En la tabla 6, se resumen las contribuciones para las modalidades "contaminado", "no contaminado" y "oxidado", para los mejores tratamientos empleados en los tres tipos de explantes evaluados.
Tabla 6 Valor de las contribuciones para las modalidades "contaminado", "no contaminado" y "oxidado", para los tratamientos TDA21, TDS12, TDH6.
Fuente: Autores
* Tratamiento de desinfección empleado en ápices
** Tratamiento de desinfección empleado en segmentos nodales
*** Tratamiento de desinfección empleado en láminas foliares
Como se observa en la tabla anterior, el explante que mejor respondió a los tratamientos propuestos de desinfección, fue el de los ápices, ya que no se presentaron réplicas contaminadas, seguido por las hojas y por últimos los segmentos nodales que fue el explante que más inconvenientes presentó en el proceso de desinfección. En cuanto a los procesos de oxidación, los tres explantes utilizados en el estudio, presentaron el mismo porcentaje (10%) considerado bajo y no limitante para el establecimiento del cultivo.
Si se tiene en cuenta que la lámina foliar presentó una contaminación moderada respecto a los otros dos explantes, la menor oxidación y la mayor producción de callo, situación que se buscaba como un resultado positivo para continuar los estudios de embriogénesis indirecta en A. polyneuron, se escoge, por esta razón, la lámina foliar como explante ideal.
El dicloruro de mercurio fue más eficiente que el hipo-clorito de sodio en el control de la contaminación en explantes de A. polyneuron, resultados que concuerdan con los realizados por Ribas et al. (2003) sin embargo, este es un producto muy tóxico y activo a bajas concentraciones, presenta acción carcinogénica, afecta principlamente las glándulas mamarias y el sistema reproductor femenino, así mismo daños a nivel del sistema nervioso central. Puede causar quemaduras cuando está en contacto con la piel y es corrosivo para los ojos, además puede llegar a ocasionar serios problemas en el sistema respiratorio cuando este producto es inhalado. (Smith, 2013). Se recomienda evitar su eliminación por el drenaje, ya que este compuesto se biocumulan a lo largo de la cadena alimentaria y tiene efectos prolongados en el medio ambiente.
Conclusiones
El explante seleccionado por su capacidad de producir callos friables y de color verde fue la lámina foliar, para la cual, una desinfección con dicloruro de mercurio (HgCl2) al 0,125% durante 10 minutos, fue suficiente para el control de la contaminación y bajos índices de oxidación.
En caso de utilizarse como explante el ápice caulinar se debe implementar una doble desinfección, así: a las yemas completas una vez tomadas de la planta madre, se sumergen en HgCl2 al 0,3% por 10 minutos y posteriormente, luego de la eliminación de pérulas y primordios foliares más externos, en HgCl2 al 0,1% por 1 minuto.
Agradecimientos
Al Departamento Administrativo de Ciencia, Tecnología e Innovación, COLCIENCIAS y al Comité Central de Investigaciones de la Universidad del Tolima, por la financiación de este proyecto.
REFERENCIAS
Abdelnour, A., Aguilar, M. E., & Valverde, L. (2011). Micropropagación de Pilón (Hieronyma alchorneoides). Agronomía Costarricense, 35(2), 9-19. [ Links ]
Abdelwahd, R., Hakam, N., Labhilili, M., & Udupa, S. M. (2008). Use of an adsorbent and antioxidants to reduce the effects of leached phenolics in in vitro plantlet regeneration of faba bean. African Journal of Biotecnology, 7(8), 997-1002. [ Links ]
Alves Dos Santos, M. R., Rodrigues Ferreira, M. D. G., De Oliveira Correia, A., & Félix Da Rocha, J. (2010). In vitro establishment and callogenesis in shoot tips of Peach Palm. Revista Caatinga, 23(1), 40-44. [ Links ]
Damasceno, J. O., Ruas, E. A., Rodrigues, L. A., Ruas, C. F., & Bianchini, E. (2011). Genetic differentiation in Aspidosperma poly-neuron (Apocynaceae) over a short geographic distance as assessed by AFLP markers. Genetics and Molecular Research, 10(2), 1180-1187. doi:10.4238/vol10-2gmr1126. [ Links ]
Del Valle, J. I. (1972). Introducción a la dendrología de Colombia. Medellín: Centro de Publicaciones, Universidad Nacional de Colombia. p. 351. [ Links ]
Dobránszki, J., & Teixeira, J. A. (2010). Micropropagation of apple A review. Biotechnology Advances, 28(4), 462-488. doi:10.1016/j.biotechadv.2010.02.008. [ Links ]
Ezcurra, C., Endress, M., & Leeuwenberg, A. (1992). Flora del Paraguay No. 17, Apocynaceae. Geneve, Switzerland: Conservatoire et Jardin Botaniques. p. 121. [ Links ]
Hodson de Jaramillo, E., Ramírez, C., Schuler, I. (2004). Biotecnología y producción forestal sostenible. En: Conferencia Internacional de Bosques, Colombia: País de Bosques y Vida, Santa Marta. Memorias. Bogotá D. C. Saile, P. y M. Torres (eds). pp. 251-256. [ Links ]
López-Gómez, P., Iracheta-Donjuan, L., Castellanos-Juárez, M., Méndez-López, I., Sandoval-Esquivez, A., Aguirre-Medina, J. F., ... & Gutiérrez-Díez, A. (2010). Influencia del explante y medio de cultivo en la embriogénesis somática en hojas de café. Revista fitotecnia mexicana, 33(3), 205-213. [ Links ]
Lloyd, G., & McCown, B. (1980). Commercially feasible micropropagation of mountain laurel, Kalmia latifolia by use of shoot-tip culture. International Plant Propagators' Society, 30, 421-427. [ Links ]
Montes, S; Morales, C.; Bell, E. (2004). Regeneración de plantas de Anthurium andreanum Lind mediane el empleo del cultivo in vitro. Cultivos Tropicales, num. Sin mes, pp. 5-7. [ Links ]
Mozo Morron, T. (1972). Algunas especies aptas para la reforestación en Colombia. Editorial A.B.C. Bogotá, D.C. p. 297 [ Links ]
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum, 15, 473-497. [ Links ]
Pedroza-Manrique, J. A., González-Molina, S. R., & Téllez-Ortiz, D. C. (2007). Micropropagación de Dodonea viscosa (L) Jacq: una especie en vías de extinción. Revista Colombiana de Biotecnología, 9(2), 33-44. [ Links ]
PROEXPO. (1970). Maderas de Colombia. Editorial Fondo de promoción de exportaciones. Bogotá, D.C. p. 117. [ Links ]
Ribas, L. L, Zanette, F., Kulchetscki, L, & Guerra, M. P. (2005). Micropropagação de Aspidosperma polyneuron (perobarosa) a partir de segmentos nodais de mudas juvenis. Revista Árvore, Viçosa-MG, 29(4), 517-524. [ Links ]
Ribas, L. L., Zanette, F., Kulchetscki, L., & Guerra, P. M. (2003). Establecimiento de culturas assépticas de Aspidosperma polyneuron. Ciência Florestal, 13(1), 115-122 . [ Links ]
Sakita, A. E., Silva, A., & Paula, R. C. De. (2007). Germinação de sementes de Aspidosperma polyneuron Müll. Arg. (peroba-rosa) sob diferentes condições de qualidades de luz e temperatura. IF Sér. Reg. (31), 203-207. [ Links ]
Salinas, N., & Cárdenas López, D. (2007). CARRETO: Aspidosperma polyneuron Müll. Arg. In D. L. Cárdenas, Salinas, & N. R. (Eds.), Libro rojo de plantas de Colombia. Especies maderables amenazadas: primera parte. Bogotá, D.C.: Instituto Amazónico de Investigaciones Científicas SINCHI - Ministerio de Ambiente, Vivienda y Desarrollo Territorial. pp. 118-121. [ Links ]
Seneviratne, P., & Wijesekara, G. (1996). The problem of phenolic exudates in in vitro culture of mature Hevea brasiliensis. journal of Plantation Crops, 24(1), 54-62. [ Links ]
Smith, R. (2013). Contamination. Plant Tissue Culture. Techniques and Experiments. Third Edition. United States of America: Elsevier. pp. 53-61. Retrieved Retrieved from books.google.com.co/books.isbn=0124159850 . Fecha de consulta: Noviembre, 2012. [ Links ]
Toro Carcamo, M. E. (2004). Establecimiento de protocolos para regeneración in vitro de cerezo dulce (Prunus avium L.) var. Lambert. Tesis Ph.D. Ingeniería Agrícola, Facultad de Ciencias Agropecuarias y Forestales. Escuela de Agronomía. Universidad Católica de Temuco. Chile. [ Links ]
Torres, C. A.; Caldas, S. C.; Buso, A. B. (1998). Meios nutritivos. In: Caldas, L. S.; Haridasan, P.; Ferreira, M. E. (Ed.). Cultura de tecidos e transformação genética de plantas. Brasília: EMBRAPA-CNPH/EMBRAPA-SPI, p. 102- 106. [ Links ]
Valeiro, A. F., Farinha Watzlawick, L., Tabolka dos Santos, R., Silvestre, R., & Soares Koehler, H. (2008). Determinação da densidade básica da madeira de peroba (Aspidosperma polyneuron müll. Arg.) ao longo do fuste. Revista Caatinga, 21(3), 54-58. [ Links ]
Zibbu, G., & Batra, A. (2010). Effect of adeninesulphate on organogenesis via leaf culture in an ornamental plant: thevetia peruviana (pers) schum. International journal of Pharmacy and Biological Sciences, 1(2), 1-9. [ Links ]
Recibido: 16 de Enero de 2015; Aprobado: 25 de Septiembre de 2015











 text in
text in 


