Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.2 Bogotá July/Dec. 2015 Epub Aug 12, 2021
https://doi.org/10.15446/rev.colomb.biote.v17n2.54280
Artículos/Investigación
Efecto de Dicamba y de ácido 2,4 diclorofenoxiacético sobre la embriogénesis somática en caña de azúcar
* Doctora en Ciencias. Laboratorio de Fisiología y Genética de Microorganismos, Centro de Biología Celular. Instituto de Biología Experimental (IBE), Facultad de Ciencias, Universidad Central de Venezuela (UCV). Calle Suapure, Colinas de Bello Monte. Caracas - Venezuela. Apartado 47114, Los Chaguaramos, Caracas 1041A, VENEZUELA. beatriz.alvez@ciens.ucv.ve
** Doctora en Ciencias. Laboratorio de Mejoramiento Vegetal, Centro de Botánica Tropical. Instituto de Biología Experimental (IBE), Facultad de Ciencias, Universidad Central de Venezuela (UCV). Calle Suapure, Colinas de Bello Monte. Caracas - Venezuela. Apartado 47114, Los Chaguaramos, Caracas 1041A, VENEZUELA. maira.oropeza@ciens.ucv.ve
El cultivo in vitro de la caña de azúcar ha sido establecido en muchas variedades comerciales con el propósito de producir material libre de enfermedades microbianas, conservar germoplasma, detectar resistencia a enfermedades y plagas, etc. En este sentido, el objetivo de este trabajo fue analizar la efectividad de las auxinas sintéticas ácido 2,4-diclorofenoxiacético (2,4D) y ácido 3,6-dicloro-2-metoxibenzoico (Dicamba), en la inducción del proceso de embriogénesis somática y la regeneración de vitroplántulas de distintas variedades de caña de azúcar (C26670, RB855546, V99245, V756, V781, V0050, CC8592, CC8475). Para esto se cultivaron discos de hojas en fase de macollamiento, de 1 cm de diámetro y 2 mm de grosor, en medio Murashige-Skoog, 1962 (MS) suplementado con 50 ml.l-1 agua de coco, 30 g.l-1 sacarosa y dos tratamientos diferentes: 3 mg.l-1 2,4-D ó 6.63 mg.l-1 Dicamba, ambos en completa oscuridad a 25°C, durante 1 mes. Los callos obtenidos se colocaron en medio de regeneración, conteniendo ½ sales MS, 200 ml.l-1 agua de coco y 60 g.L-1 sacarosa, incubándose bajo luz continua, 25°C, por 2 meses. El mayor porcentaje de callo embriogénico se obtuvo en medios suplementados con Dicamba un promedio de 70,83 % de callo embriogénico por variedad ; mientras que en los medios con 2,4D se obtuvo 62,08 % de callo embriogénico por variedad. Se obtuvo un promedio de 89,00 % de plantas regeneradas a partir de los callos obtenidos en medios con Dicamba y 66,12 % de plantas a partir de callos obtenidos en medios con 2,4D. Con el uso de Dicamba se estableció un sistema eficiente de embriogénesis somática para estas variedades de caña de azúcar.
Palabras clave: cultivo in vitro; auxinas; vitroplántulas; Sacharum spp.; embriogénesis somática
In order to conserve sugarcane germplasm, produce microbial disease-free material, detect resistance to diseases and pests, etc., in vitro propagation of sugarcane has been established in many commercial varieties. In this sense, the aim of this work was to analyze the efficiency of 2,4-dichlorophenoxyacetic acid (2,4D) and 3,6-dichloro -2- methoxybenzoic acid (Dicamba) to induce somatic embryogenesis and regeneration of plantlets from sugarcane varieties C26670, RB855546, V99245, V756, V781, V0050, CC8592, CC8475. For induction of embryogenic callus, leaf discs in tillering stage of 1 cm diameter and 2 mm thick, were inoculated on Murashige-Skoog, 1962 medium (MS), supplemented with 50 ml.l-1 coconut water, 30 g.l-1sucrose and two different treatments: 3 mg.l-1 2,4D or 6.63 mg.l-1 Dicamba, both of them in total darkness at 25 °C, during 1 month. For plant regeneration, embryogenic calli were transferred to ½ MS salts supplemented with coconut water 200 ml.l-1 and sucrose 60 g.l-1 and incubated under continuous light, 25 °C, for 2 months. The highest percent of embryogenic callus induction was obtained in media supplemented with Dicamba, an average of 70.83 % of embryogenic callus by variety, while in media with 2,4-D, 62.08 % of embryogenic callus was obtained by variety. An average of 89,00 % of plantlets was obtained from calli induced on media with Dicamba and an average of 66.12% of plantlets was obtained from calli induced on media supplemented with 2,4D. Using Dicamba it was possible to establish an efficient somatic embryogenesis protocol for these sugarcane varieties.
Key words: in vitro culture; auxins; vitroplantlets; Sacharum spp; somatic embryos
Introducción
La caña de azúcar (Saccharum spp.) es una fuente nutricional de carbohidratos (Cova et al., 2006). y uno de los principales rubros agrícolas en Venezuela, en los estados Aragua, Barinas, Carabobo, Lara, Mona-gas, Portuguesa, Sucre, Tachira, Trujillo, Yaracuy y Zulia Este cultivo es usado principalmente como materia prima en la producción de azúcar y alcohol (Silva et al., 2005). La caña de azúcar es el cultivo con el mayor volumen de producción a nivel mundial, según lo corroboran los datos reportados hasta el año 2012 por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO, según sus siglas en inglés), en comparación con otros rubros de alta importancia económica.
Las variedades más cultivadas en el país son V7139, V7151, V6410, CC8325, B64129, B8084, PR692176, PR1013, CP721210, CP722086, CP742005, SP711408, SP701284, CL73239, MZC74275, MZC8-25, C32368, C37167, RAGNAR, MY5514, según los datos del central azucarero El Palmar ubicado en estado Aragua, además de las variedades C26670, RB855546, V99245, V756, V781, V0050, CC8592, CC8475 empleadas en esta investigación.
El mejoramiento de este cultivo se ve limitado por la longitud de tiempo requerido para liberar una nueva variedad al comercio (10 a 14 años); y se ha enfocado en lograr la resistencia a plagas y enfermedades y en aumentar los rendimientos de sacarosa y biomasa. Con el fin de acelerar la mejora de este importante rubro, las investigaciones sobre el cultivo in vitro de la caña de azúcar comenzaron en los años sesenta, y desde ese momento han sido establecidos diferentes sistemas de regeneración in vitro para muchas variedades comerciales (Gnanapragasam y Vasil, 1990; Suprasanna et al., 2011).
Cuarenta años de investigación en el cultivo in vitro de caña de azúcar han generado muchos sistemas bien desarrollados que se aplican rutinariamente a las actividades de investigación y comercio, a saber: (a) micropropagación de genotipos, (b) la producción de material libre de enfermedades a partir de meristemas apicales; (c) intercambio internacional de germoplas-ma, (d) la generación de somaclones, (e) la detección rápida de la resistencia a enfermedades y a las plagas, y (f) la conservación de germoplasma. Hay una amplia gama de protocolos empleados y establecidos para la manipulación in vitro de la morfogénesis de la caña de azúcar y las técnicas para la producción masiva de material libre de patógenos ya se han integrado en muchos programas de propagación de caña de azúcar (Snyman et al., 2011; Raza et al., 2012).
En la embriogénesis somática una única célula o un pequeño número de células somáticas son los precursores de la formación de un embrión somático (Silveira et al., 2013). Las hormonas vegetales juegan un papel crítico en el establecimiento de la embriogénesis somática; durante este proceso las células vegetales revierten su estado de diferenciación adquiriendo pluripotencialidad y determinando un nuevo programa de desarrollo. Un aspecto crítico, es el modo de acción de las hormonas vegetales en el proceso; los estudios señalan que las hormonas vegetales participan en la reprogramación de las células somáticas hacia el destino embriogénico y demuestran una relación entre las hormonas vegetales y las vías moleculares que controlan el proceso: remodelación de la cromatina, cambios en el patrón de expresión génica, reactivación del ciclo de división celular y regulación y modificación de la síntesis proteica (Thomas y Jiménez, 2005).
Para inducir la embriogénesis somática es necesario que en el medio exista cierta concentración de auxinas y citoquininas. Las auxinas pueden inducir la formación de células embriogénicas y promover la división celular repetitiva, mientras que las citoquininas son necesarias para la inducción de la embriogénesis en muchas especies de dicotiledóneas (Abdi y Hedayat, 2011). En general, las auxinas se definen como compuestos con actividad biológica similar al ácido indol acético, incluyendo la habilidad de promover el alargamiento celular en secciones de coleoptilos y tallos, la división celular en cultivos de callos en presencia de citoquininas, formación de raíces adventicias en hojas y tallos separados, entre otras. Aunque son químicamente diversas, una característica común de las auxinas activas, es una distancia molecular de 0.5 nm entre una carga positiva fraccional en el anillo aromático y un grupo carboxilo negativamente cargado (Taiz y Zeiger, 2010). La respuesta del explante a la adición exógena de auxinas y citoquininas es variable y depende de la especie de planta, estado de desarrollo del explante (nivel endógeno de estas hormonas) y el tipo y cantidad de auxina y/o citoquinina.
El proceso de embriogénesis somática en diferentes variedades de caña de azúcar ha sido estudiado con el propósito de mejorar la frecuencia en la formación de embriones somáticos de manera directa o a través de una fase de callo (Gallo et al., 2000). Oropeza et al. (2001), evaluaron el potencial de la auxina sintética ácido 2,4-diclorofenoxiacético (2,4D), sobre la producción de callo embriogénico y no embriogénico de la variedad PR62258 de caña de azúcar y analizaron las proteínas relacionadas con el potencial embriogénico en callos y suspensiones celulares de este cultivo. Posteriormente, Marcano et al. (2002) demostraron que dos variedades venezolanas de caña de azúcar respondían mejor hacia la embriogénesis somática cuando los callos eran inducidos en medios suplementados con ácido 3,6 dicloro-2-metoxibenzoico (Dicamba); mientras que la mayoría de los autores reportan que las gramíneas responden mejor hacia la formación de callo embriogénico con 2,4D, ya que es la auxina sintética más empleada, debido a que afecta el crecimiento de las plantas en forma similar y en los mismos órganos que compuestos auxínicos de origen natural.
En este sentido, el objetivo de esta investigación fue analizar la efectividad del 2,4D y del Dicamba en la inducción del proceso de embriogénesis somática y la regeneración de vitroplántulas de distintas variedades de caña de azúcar, tanto venezolanas como extranjeras a fin de evaluar si la respuesta se debe al genotipo de la planta o a la acción de las auxinas consideradas en la investigación.
Materiales y Métodos
Material vegetal
Se emplearon plantas de caña de azúcar de las variedades C26670 (Cuba), RB855546 (Brasil), V99245 (Venezuela), donadas por la estación experimental INIA (Instituto Nacional de Investigaciones Agropecuarias) ubicada en Yaritagua, Edo. Yaracuy, Venezuela; además de las variedades V756, V781 y V0050 (Venezuela), CC8592 y CC8475 (Colombia), donadas por FUNDACAÑA (Fundación Azucarera para el Desarrollo, la Producción y la Investigación) ubicada en Chivacoa, Edo. Yaracuy, Venezuela. Las carácterísticas agronómicas más resaltantes que permitieron seleccionar estas variedades para nuestra investigación son: desarrollo fenológico adecuadao, germinación, encepamiento y tolerancia a enfermedades.
Cultivo in vivo de caña de azúcar
Los tallos de cada variedad se seccionaron en esquejes con una o dos yemas, que se incubaron en cámara húmeda durante 24 horas y luego se sembraron de forma individual en bolsas con suelo abonado, en condiciones de vivero con humedad relativa promedio de 70%, temperatura promedio de 25 °C. Cuando las plántulas alcanzaron un tamaño apropiado, entre los 25 y 30 días de crecimiento después del momento de la siembra, se procedió a la escisión de los explantes para el establecimiento del cultivo in vitro de todas las variedades.
Cultivo in vitro de la caña de azúcar
a) Obtención de callos embriogénicos
Se emplearon tallos jóvenes de plantas de 25 a 30 días de edad, provenientes del vivero, a las cuales se les eliminaron las hojas externas y maduras hasta quedar una sección de aproximadamente 5 cm de largo a partir del último nudo, envuelta con las hojas más jóvenes. Este material se lavó con solución jabonosa al 20 %, y se sometió a desinfección con hipoclorito de sodio al 1 % durante 20 minutos (Marcano et al., 2002). En cámara de flujo laminar, se realizaron dos lavados de 10 minutos cada uno con agua destilada estéril, luego se retiró una última capa de hojas hasta obtener un tallo de aproximadamente 1 cm de diámetro y se seccionaron los explantes a una distancia del ápice caulinar entre 2 cm hasta 5 cm en forma de discos con 2 mm de grosor, para un total de 30 discos por variedad que se sembraron a razón de 6 explantes por frasco con medio de inducción , compuesto por: sales Murashige y Skoog (1962) completas, inositol 100 mg. l-1, tiamina 1 mg.l-1 piridoxina 0,5 mg.l-1, ácido nicotínico 0,5 mg.l-1, glicina 2 mg.l-1, arginina 50 mg.l-1, cisteína 50 mg.l-1, ácido cítrico 0,15 mg.l-1, sacarosa 30 g.l-1, agua de coco 50 ml.l-1 y agar 8 g.l-1, suplementado con ácido 3,6 dicloro-2-metoxibenzoico (Dicamba) 6,63 mg.l-1 ó ácido 2,4 diclorofenoxiacético (2,4D) 3 mg.l-1, con ajuste a pH 5,7 con soluciones de NaOH 0,1 N y HCl 1 N, y se cultivaron en una habitación bajo condiciones de completa oscuridad a 25°C durante 1 mes (Marcano et al., 2002).
b) Regeneración de vitroplántulas
Para el desarrollo de plántulas, los callos embriogéni-cos fueron subcultivados en medio de regeneración, cuya composición es la siguiente: sales Murashige y Skoog (1962) a la mitad, inositol 100 mg.l-1, tiamina 1 mg.l-1, sacarosa 60 g.l-1, agua de coco 200 ml.l-1, agar 8 g.l-1y ajustándose el pH a 5,7 con soluciones de NaOH 0,1 N y HCl 1 N, y se incubaron bajo condiciones de luz continua en una habitación a 25 °C durante 2 meses (Marcano et al., 2002). Se sembraron 5 frascos con 6 callos cada uno, para un total de 30 callos para cada variedad.
c) Análisis estadístico
Se realizó el análisis de varianza multifactorial de la interacción entre las variedades de caña de azúcar y las hormonas aplicadas con el programa estadístico Statgraphics Centurion 12®. con variables dependientes (% de formación de callo y % de formación de vitroplántulas) e independientes (hormonas, variedades y réplicas), a fin de evaluar si existen diferencias significativas entre los porcentajes de formación de callos embriogénicos y entre los porcentajes de desarrollo de vitroplántulas a partir de los embriones somáticos obtenidos. Para identificar cuáles de las variedades de caña de azúcar y cuál de los tratamientos hormonales muestran diferencias significativas, se procedió a aplicar la comparación de medias con el procedimiento de diferencia honestamente significativa (HSD) de Tukey, con un 95 % de confianza.
Resultados y discusión
Cultivo in vitro de caña de azúcar
El protocolo de desinfección resultó 100% eficiente, dado que no se observó contaminación en ninguna de las fases de cultivo. Los procedimientos de cultivo y propagación in vitro se realizaron en una habitación con las condiciones de asepsia adecuadas, equipada con una cabina de flujo laminar, incinerador, instrumentación estéril y medios de cultivo debidamente esterilizados. Este logro es sumamente importante si por ejemplo comparamos este resultado con los obtenidos por Mittal et al. (2009), quienes reportan la necesidad de usar cefotaxima 500 mg.l-1, un antibiótico perteneciente a la familia de las cefalosporinas de tercera generación, como un promotor de la embriogénesis somática y la posterior regeneración de brotes en distintas variedades de caña de azúcar de India y para mantener la asepsia durante el proceso morfogenético. Kour y Kapoor (2015) encontraron que este antibiótico no promovía la embriogénesis somática en las variedades de caña de azúcar CoJg4, CoJ83 y CoJ86. En esta investigación, no hubo necesidad de usar ningún tipo de antibiótico, cuyo uso puede interferir con la morfogénesis de los embriones somáticos además de la incidencia en los costos del establecimiento del cultivo.
a) Obtención de callos embriogénicos
Distintos factores genéticos y fisiológicos influyen en la inducción de la embriogénesis somática,, desencadenando la sustitución del patrón de expresión génica existente en el tejido del explante, con una nueva expresión de genes embriogénicos. Este proceso sólo es posible si las células son competentes y reciben los estímulos inductores apropiados. Entre los factores que intervienen, las hormonas vegetales, especialmente las auxinas, son componentes clave, ya que su aplicación exógena recapitula el potencial embriogénico de las células somáticas mitóticamente inactivas. Varios estudios han indicado que la señalización por auxinas, así como el estrés pueden ser eventos clave en la reprogramación genética de células somáticas durante la embriogénesis temprana, lo cual es necesario para la indiferenciación y para adquirir la condición embriogénica (Silveira et al., 2013).
En la figura 1, se observan las diferentes etapas del proceso de embriogénesis somática en la variedad de caña de azúcar V99245, en representación de todas las estudiadas en este trabajo. En la parte A de la figura, se observan los discos foliares inoculados en el medio de inducción de callos. Una vez transcurridos 25 días, se puede observar en la parte B de la figura, la formación de callo de aspecto compacto con una coloración blanquecina, características típicas del callo embriogénico de caña de azúcar (Oropeza et al., 2001). Taylor et al., (1992) proveen una descripción precisa de los diferentes tipos de callo que se originan a partir de segmentos de hojas jóvenes de caña de azúcar: El Tipo I, aparece primero, luego de 5 días de cultivo en los extremos de corte y se caracteriza por ser semi-traslúcido y consistente de células grandes y alargadas; el Tipo II se desarrolla dentro del tejido del Tipo I luego de 13 días de cultivo y es suave, mucilaginoso, amarillento y contiene células redondeadas, vacuoladas altamente disociadas. El Tipo III aparece después de los 13 a 21 días en los extremos de los explantes y alrededor del tejido vascular, consistiendo de un callo compacto, duro, con nódulos globulares superficiales, amarillento al principio pero después se torna blanquecino y está compuesto de células pequeñas, redondeadas y de citoplasma denso. El Tipo IV es amarillo, friable, presenta aglomerados de estructuras semi-organizadas y consiste de células pequeñas, redondeadas, de citoplasma denso. Los callos del Tipo I y Tipo II son no-morfogénicos mientras que los callos Tipo III y IV pueden regenerar plantas con una alta frecuencia a través de la embriogénesis somática y con una baja frecuencia a través de la organogénesis, respectivamente. El callo Tipo III es el referido como callo embriogénico y la heterogeneidad se debe a que el explante proviene de la sección transversal de varias hojas con diferentes grados de madurez. Guiderdoni y Demarly (1988) describieron sólo dos tipos de callo: el callo friable y el callo compacto, los cuales aparentemente concuerdan con los Tipos I y III de Taylor et al., (1992). Resultados similares fueron obtenidos por Oropeza et al., (2001) y por Marcano et al., (2002); observando únicamente los callos compacto y friable, de acuerdo a lo descrito por Guiderdoni y Demarly (1988). Silveira et al. (2013) estudiaron las diferencias en la adquisición de competencias y la posterior maduración del embrión somático en callos em-briogénicos y no embriogénicos de caña de azúcar de la variedad SP791011; mediante análisis histológico, curvas de crecimiento, número de embriones somáticos y contenido de poliaminas. Los callos embriogéni-cos fueron distinguibles de los no embriogénicos por presentar tejidos con forma redondeada, aspecto seco y compacto, de color blanquecino opaco con menor oxidación, además de la aparición de puntos verdes luego de varios días; mientras que los callos no em-briogénicos presentaban células alargadas, aspecto suave y friable, mucilaginosos, de color pardo traslúcido por la oxidación en presencia de luz.
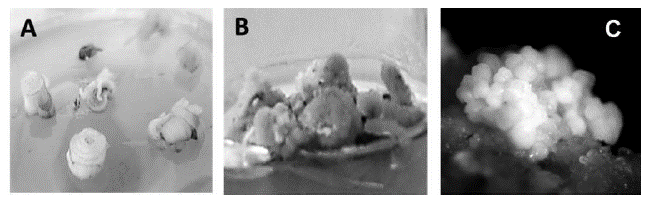
Figura 1 Inducción de la embriogénesis sometica de la variedad de caña de azúcar V99245 con Dicamba. A) Discos de hojas envolventes al inicio de la inducción. B) Callo generado luego de 25 días de cultivo en medio de inducción. C) Callos mostrando agregados embriogénicos a los 32 días de incubación en medio de inducción (110X).
En la figura 1C se observan los agregados de embriones formados a partir de los callos embriogénicos, a los 32 días después de la siembra, mostrando el color blanquecino característico. La poca cantidad de callo no embriogénico obtenida presentaba aspecto suave y friable, evidenciando oxidación celular debido a la coloración marrón traslúcida , mientras que los callos embriogénicos mostraban un aspecto más compacto, una coloración opaca y blanquecina, con numerosos embriones somáticos en su periferia, que al transcurrir cinco días comenzaron a germinar observándose gran cantidad de vástagos y raíces. El resto de las variedades presentó el mismo tipo de crecimiento. Aunque no se realizó un estudio histológico para determinar el origen embriogénico de las vitroplántulas, las condiciones de cultivo y la morfología del callo obtenido, fueron similares a las reportadas por Oropeza et al., (2001) y por Marcano et al., (2002) donde corroboraron mediante el estudio anatómico lo observado a nivel morfológico en los callos embriogénicos. Así, dadas las características morfológicas de los callos obtenidos en este trabajo y la alta frecuencia de regeneración de plántulas a partir de estos callos, es muy probable que el principal proceso de regeneración in vitro que está ocurriendo sea el embriogénico.
En la tabla 1 se observan los porcentajes de formación de callo embriogénico, para cada variedad, con ambos tratamientos hormonales, los cuales evidencian diferencias significativas entre 2,4D y Dicamba. En cuanto a la respuesta por variedad, se observa una respuesta particularmente baja para la variedad RB855546, con ambos tratamientos, lo cual corrobora el hecho de que toda respuesta embriogénica depende del genotipo. En general, para la variedad V0050 la formación de callo embriogénico es mayor con 2,4D; se observó una respuesta muy similar entre las variedades CC8475, V756 y V781, pero la respuesta oscila entre 40 y 90 %, todas con mayor respuesta con Dicamba; al igual que entre las variedades CC8592 y V99245, estas últimas con la respuesta más alta para formación de callo embriogénico con ambos tratamientos.
Tabla 1 Porcentajes de formación de callos embriogénicos de cada variedad de caña de azúcar.
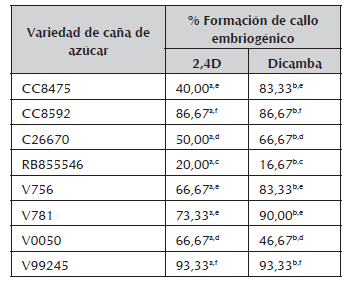
Comparación de medias con el procedimiento de diferencia significativa (HSD) de Tukey con un nivel de confianza de 95%. Las letras a y b denotan diferencias altamente significativas entre los tratamientos hormonales. Las letras c, d, e, f, representan diferencias altamente significativas entre la respuesta de las variedades ante la formación de callo. Variedades con la misma letra no presentan diferencias significativas entre ellas.
El inicio y el mantenimiento de callo embriogénico es un paso importante para el desarrollo de embriones somáticos y la regeneración de plántulas (Silveira et al., 2013). Tradicionalmente y en la actualidad, la embriogénesis somática en muchas especies de gramíneas, es inducida con 2,4D. Ho y Vasil (1983), reportaron por primera vez que en los extremos cortados de explantes de monocotiledóneas cultivados en medio Murashige y Skoog (1962) suplementado con 2,4D, se formaban callos (Guiderdoni y Demarli, 1988; Guiderdoni et al., 1995; Suprasanna et al., 2005; Lakshmanan et al., 2005; Raza et al., 2012; Taparia et al., 2012; Kaur y Kapoor, 2015). En nuestra investigación, la inducción del callo embriogénico y de embriones somáticos fue ligeramente mayor en los explantes cultivados en medios suplementados con Dicamba (70,83 % de callo embriogénico por variedad), aunque la mayoría de las variedades respondieron al 2,4D (62,08 % de callo embriogénico por variedad), el porcentaje de formación de callo embriogénico de cada variedad para cada tratamiento se observa detalladamente en la tabla 1. Se observó un rápido desarrollo de callo embriogénico durante la fase de inducción, bajo las condiciones del ensayo, en medios de cultivo suplementados con Dicamba, compuesto que es empleado en condiciones de campo como un herbicida selectivo, su modo de acción es modificar el transporte del ácido indolacético, destruyendo el cámbium y el parénquima a nivel de los nudos o por encima de ellos; pero su estructura química es la de una auxina artificial, la cual empleada en cultivos in vitro de caña de azúcar, permite laanaplasia del tejido de discos de hojas envolventes.
El uso de explantes de hojas jóvenes en nuestra investigación, ha sido validado en distintos protocolos establecidos para la morfogénesis in vitro de la caña de azúcar utilizando explantes de diferentes partes de la planta, como por ejemplo meristemas, verticilos de hojas internas, segmentos de inflorescencias, inflorescencias inmaduras, segmentos de hojas jóvenes, discos de hojas inmaduras, entre otros; sin embargo, el más empleado es el disco de hojas envolventes inmaduras cercanas al meristemo apical, inoculado en sentido horizontal, con sus extremos distales en contacto con el medio, ya que con el uso de este tipo de explante, se han obtenido los mejores resultados en la producción de embriones somáticos (Guiderdoni et al., 1995; Oropeza et al., 2001; Marcano et al., 2002; Suprasanna et al., 2011; Joshi et al., 2013). Kaur y Sandhu (2015) establecieron un sistema eficiente de producción directa de yemas adventicias, también a partir de discos de hojas jóvenes; demostrando el potencial de este explante para la producción masiva a nivel industrial, de plantas de caña de azúcar.
Manchanda y Gosal (2012), estudiaron el efecto del carbón activado, las fuentes de carbono y los agentes gelificantes sobre la embriogénesis somática de caña de azúcar, y recomiendan ampliamente la adición de carbón activado al medio de cultivo, para disminuir el ennegrecimiento de los tejidos por la exudación de compuestos fenólicos y así incrementar el potencial embriogénico de los tejidos. Además, recomiendan suplementar el medio con maltosa, aunque el uso de sacarosa sigue rindiendo buenos resultados. Finalmente recomiendan gelificar los medios de cultivo con agar ya que observaron que con su uso aumentaba el porcentaje de formación de embriones somáticos, así como la frecuencia de regeneración de la caña de azúcar, en comparación con el gelrite. En nuestras manos, no se observó ennegrecimiento por lo que no hizo falta el uso de carbón activado. La poca oxidación observada fue controlada con la adición de cisteína al medio de cultivo.
Suprasanna et al. (2005), encontraron que la eficiencia de formación de callo embriogénico fue más alta con la combinación de 2,4D y zeatina en la variedad Co91010, mientras que para la variedad CoC671, esta combinación resultó eficiente añadiendo prolina al medio de cultivo. Analizando la respuesta particularmente baja de la variedad RB855546, obtenida en nuestra investigación, se podría recomendar suplementar el medio MS (1962) usado para la inducción de callos embriogénicos (que contiene los aminoácidos arginina y cisteína), con prolina a fin de mejorar la respuesta de esta variedad. Por otra parte, en nuestro trabajo no se utilizaron citoquininas sintéticas en combinación con las auxinas probadas para la inducción del proceso de embriogénesis somática; aparentemente, la cantidad de zeatina que contiene el agua de coco, es suficiente para inducir los procesos de división y alargamiento celular, que en combinación con las auxinas, propician las citoquininas durante este proceso.
Marcano et al. (2002), optimizaron el proceso de embriogénesis somática en variedades venezolanas de caña de azúcar, empleando las auxinas sintéticas 2,4D y Dicamba, ambas sustancias empleadas en campo como herbicidas, ya que afectan el transporte de auxinas naturales y el alargamiento celular. Demostraron que después de 45 días en el medio suplementado con Dicamba, se observó el mayor porcentaje de callo embriogénico para las variedades venezolanas ensayadas, V756 y V781.
Como mencionamos antes, numerosos autores han reportado que la embriogénesis somática en caña de azúcar es inducida por la auxina 2,4D (Ho y Vasil, 1983; Brisibe et al., 1994; Falco et al., 1996; Oropeza y García, 1996; Oropeza et al., 2001; Watt et al., 2009; Snyman et al., 2011); sin embargo, en la mayoría de las variedades analizadas en esta investigación, el porcentaje de callo embriogénico obtenido es mayor cuando se emplea Dicamba, este hecho puede adjudicarse a la diferencia estructural de las moléculas de 2,4D y Dicamba siendo esta última la que puede ser absorbida y degradada por los tejidos vegetales más rápido.
b) Regeneración de vitroplántulas
La regeneración eficiente de plantas a partir de un sistema de cultivo in vitro, es una de las etapas más importante del proceso, que determina la eficiencia del mismo. Además, es el prerrequisito esencial para un protocolo completo de transformación genética (Suprasanna et al., 2011; Manchanda y Gosal, 2012).
En la figura 3, se muestra el desarrollo de las plántulas de caña de azúcar de la variedad V99245, una vez que los callos fueron transferidos a medio de regeneración, el cual no contiene hormonas vegetales. En la figura A, se puede ver la formación de vástagos a los 5 días, luego de haber sido transferidos a medio de regeneración, donde se pudo cuantificar aproximadamente un 80% promedio de regeneración de plantas a partir de los callos obtenidos (tabla 2). En la figura B 3, se puede ver el progreso del cultivo, mediante observación de la elongación de los vástagos y la emergencia de las primeras raíces a los 15 días de cultivo en medio de regeneración y luego el incremento en la cantidad de vástagos y raíces formadas a los 20 días, lo cual se puede apreciar en la figura C.
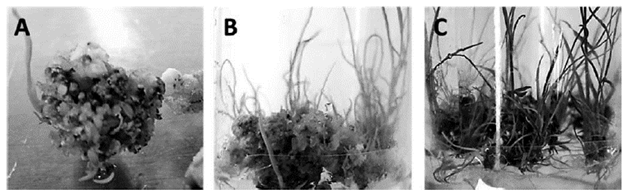
Figura 3 Formación de plantas de caña de azúcar, variedad V99245 en medio de regeneración. A) Formación de vástagos a los 5 días de cultivo. B) Elongación de vástagos y formación de raíces a los 15 días de cultivo. C) Elongación de vástagos y raíces a los 20 días de cultivo en medio de regeneración.
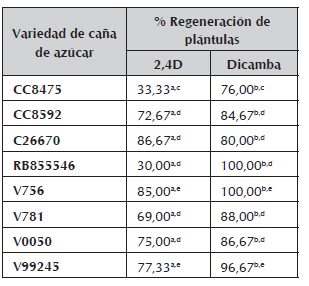
Comparación de medias con el procedimiento de diferencia honestamente significativa (HSD) de Tukey con un nivel de confianza de 95%. Las letras a y b denotan diferencias altamente significativas entre los tratamientos hormonales. Las letras c, d, e, representan diferencias altamente significativas entre la respuesta de las variedades ante la regeneración de plántulas completas. No existen diferencias significativas entre las variedades que presentan la misma letra.
En la tabla 2 se muestran los valores obtenidos de regeneración de plántulas, con los callos embriogénicos provenientes de los tratamientos hormonales con 2,4D y Dicamba, donde el Dicamba figura como la hormona más eficiente, ya que los callos generados bajo este tratamiento, presentan un alto porcentaje de regeneración de plántulas completas. En cuanto a las diferencias entre variedades, se pueden distinguir 3 grupos con diferencias altamente significativas; el primer grupo está compuesto sólo por la variedad CC8475, la cual presenta una respuesta muy alta con el tratamiento con Dicamba y muy baja con el tratamiento con 2,4D; el segundo grupo, compuesto por las variedades CC8592, C26670, RB855546, V781 y V0050, no presentan diferencias significativas entre ellas, destacando que todas responden mejor a Dicamba. El último grupo, representado por las variedades V756 y V99245, presentan igualmente una mejor respuesta a Dicamba, sin embargo la respuesta a 2,4D no es despreciable.
La variedad RB855546, no presentó diferencias significativas en cuanto a la formación de callo, con los tratamientos hormonales con 2,4D y Dicamba y los valores de respuesta ante estos tratamientos fue la más baja con respecto a las otras variedades. Sin embargo, al transferir los callos embriogénicos de esta variedad al medio de regeneración de plantas, la respuesta en cuanto a formación de plántulas completas, fue significativamente alta con Dicamba. Esta variedad de caña de azúcar originaria de Brasil debe ser estudiada con más detalle para poder establecer un sistema eficiente de embriogénesis somática.
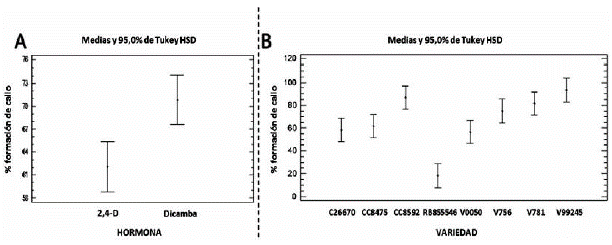
La respuesta diferencial de cada variedad, por cada tratamiento hormonal, para la regeneración de plántulas completas de caña de azúcar, se puede evidenciar en la figura 4. donde observa claramente el mayor porcentaje de regeneración de plántulas a partir de los callos inducidos con Dicamba y la agrupación de las variedades antes descrita.
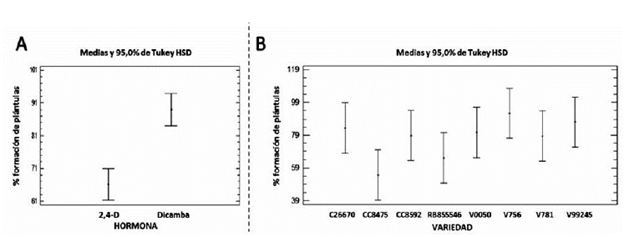
Figura 4 Gráfico de análisis de homogeneidad de varianza con 95 % de confianza, mediante comparación de medias por diferencia honestamente significativa (HSD) de Tukey, para la regeneración de plántulas completas de caña de azúcar. A. tratamientos hormonales; B. variedades de caña de azúcar.
Un análisis en conjunto de la fase de inducción del proceso de formación de callo y la fase de desarrollo de los embriones somáticos y regeneración de vitro-plántulas, podemos concluir que el tratamiento con Dicamba es 90 % más eficiente. Se pueden observar diferencias altamente significativas entre los tratamientos hormonales; sin embargo, también se puede observar que de acuerdo a su genotipo, cada variedad presenta una respuesta particular, a pesar que en general, con Dicamba se obtienen los mejores resultados. Marcano et al. (2002), demostraron la alta capacidad de regeneración de los callos obtenidos en medio de inducción con Dicamba, al transferirlos a medio de regeneración (sin hormonas), donde a los 4 días ya se observaban los primeros vástagos y al transcurrir 45 días regeneraron plantas completas de caña de azúcar de las variedades V756 y V781. En nuestra investigación, obtuvimos resultados similares, observando los primeros vástagos a los 5 días y la regeneración de plantas completas a los 45 días.
De acuerdo con nuestros resultados, el tratamiento "Dicamba" fue más efectivo que 2,4D para inducir los callos embriogénicos y la regeneración de plántulas en seis de las ocho variedades estudiadas. Resultados similares fueron obtenidos por Filippov et al. (2006) con diferentes cultivares de trigo, donde la exposición con Dicamba resultó en un desarrollo más rápido de los embriones somáticos a partir de callo, en comparación con el 2,4D o el picloram. Algunos autores han reportado este efecto del Dicamba en gramíneas, y en específico en cereales y explican que este regulador de crecimiento sintético tiene un metabolismo rápido en los tejidos mientras que el 2,4D; es una auxina muy estable que muestra una fuerte resistencia a la degradación y conjugación enzimática en las células vegetales. Las auxinas exógenas son necesarias para inducir divisiones mitóticas y alargamiento celular durante la fase de inducción de callo, pero se deben eliminar del medio de cultivo, una vez que han ocurrido dichas divisiones celulares, para que proceda la morfogénesis embriogénica, es entonces cuando Dicamba presumiblemente se degrada más rápido en el tejido del callo que el 2,4D, por lo que la germinación de los embriones somáticos ocurre más temprano y de manera más eficiente, en los medios suplementados con Dicamba (Filippov et al., 2006). Se ha observado una fuerte influencia del genotipo entre muchos tipos de explantes y muchas especies. Estas diferencias han sido asociadas con las variaciones en susceptibilidad a la programación y reprogramación genética de las células embriogénicamente competentes, entre los diferentes genotipos (Filippov et al., 2006). Igualmente Kaur y Kapoor (2015) demostraron la influencia del genotipo para la formación de embriones somáticos en las variedades de caña de azúcar CoJ64, CoJ83 y CoJ86.
Finalmente, los resultados de esta investigación permiten recomendar el uso de Dicamba para la inducción del proceso de embriogénesis somática en diferentes variedades de caña de azúcar, y la regeneración de vitroplántulas en medios de cultivo sin reguladores de crecimiento. El protocolo establecido garantiza la disponibilidad de material suficiente y lo más importante, libre de patógenos, bajo condiciones ambientales totalmente controladas, para conservar el germoplasma de variedades de caña de azúcar de diferentes orígenes geográficos y para aplicar técnicas de avanzada para el mejoramiento de este importante cultivo.
Conclusiones
El análisis estadístico demostró que existen diferencias altamente significativas entre los tratamientos hormonales, siendo Dicamba, el regulador de crecimiento más eficiente para la inducción de la embriogénesis somática en caña de azúcar.
La respuesta de las variedades de caña de azúcar a los tratamientos hormonales, es genotipo dependiente. Las variedades V99245, CC8592, V781 y V756, presentaron la mejor respuesta ante el proceso de inducción de embriogénesis somática con Dicamba.
Las variedades V756, C26670, V99245 y V0050, alcanzaron los mayores porcentajes de regeneración de vitroplántulas.
Con esta investigación se estableció un sistema eficiente de embriogénesis somática en variedades de caña de azúcar provenientes de programas de mejoramiento de diferentes países.
Perspectivas sobre investigaciones futuras
Validar el uso de Dicamba como la auxina sintética de mayor eficiencia al establecer la embriogénesis somática en todas las variedades venezolanas de caña de azúcar.
Incluir todas las variedades venezolanas de caña de azúcar en un banco de germoplasma a fin de crear un programa de certificación de semillas nacional, sacando el máximo provecho del sistema de cultivo in vitro.
Agradecimientos
Proyecto de Grupo PEII N° 20121357"Identificació-nmolecular de patógenos y propagación masiva de plantas como herramientas útiles para el programa de certificación de semillas en Venezuela".
REFERENCIAS
Abdi, G., Hedayat, M. (2011). Induction of somatic embryogenesis from immature zygotic embryo and immature seed of royal Poinciana (Delonixregia). World Applied Science Journal, 13, 391-395. [ Links ]
Brisibe, E., Miyake, H., Tanaguchi, T., Maeda, E. (1994). Regulation of somatic embryogenesis in long-terms callus cultures of sugarcane (Saccharum officinarum L.) New Phytology, 126, 301-307. [ Links ]
Cova, J., Nass, H., Orozco, A. (2006). Enfermedades de la caña de azúcar (Saccharum spp.) presentes en el estado Portuguesa durante el período 2003-2005. CENIAP HOY. N° 10. Disponible on line en: Disponible on line en: www.ceniap.inia.gov.ve (20/04/2007). [ Links ]
Falco, M., Janussi, B., Neto, T. (1996). Cell suspension culture of sugarcane: Growth, management and plant regeneration. Revista Brasilera de Fisiología Vegetal, 8,1-6. [ Links ]
FAO. (2014). Estadísticas de los cultivos más importantes del mundo. Disponible on line en: Disponible on line en: http://www.fao.org (10/03/2014). [ Links ]
Filippov, M., Miroshnichenko, D., Vernikovskaya, D., Dolgov, S. (2006). The effect of auxins,time exposure to auxin and genotypes on somatic embryogenesis from mature embryos of wheat. Plant Cell, Tissue and Organ Culture, 84, 213-222. [ Links ]
Gallo, M., English, R., Abouzid, A. (2000). Thidiazuron stimulates shoot regeneration of sugarcane embryogenic callus. In Vitro Cellular and Developmental Biology Plant, 36, 37-40. [ Links ]
Guiderdoni, E., Demarly, Y. (1988). Histology of somatic embryo-genesis in cultured leaf segments of sugarcane plantlets. Plant Cell, Tissue and Organ Culture, 14,71-88. [ Links ]
Guiderdoni, E., Merot, B., Eksomtramage, T., Paulet, F., Feldmann, T., Glaszmann, J. E. (1995). Somatic embryogenesis in sugarcane (Saccharum species). En: Biotechnology in Agriculture and Forestry, Vol. 31. Somatic Embryogenesis and Synthetic Seed II (Ed. by Y.P.S. Bajaj). ©Springer-Verlag Berlin Heidelberg. 92-113. [ Links ]
Gnanapragasam, S., Vasil, I. (1990). Plant regeneration from a cryo-preserved embryogenic cell suspension of a commercial sugarcane hybrid (Saccharum sp.). Plant Cell Report, 9,419-423. [ Links ]
Ho, W., Vasil, I. (1983). Somatic embryogenesis in sugarcane (Saccharum officinarum L.): the morphology and physiology of callus formation and the ontogeny of somatic embryos. Protoplasma, 118,169-184. [ Links ]
Joshi, S., Jain, M., Tillman, B., Altpeter, F., Gallo, M. (2013). Comparative analysis of direct plant regeneration from immature leaf whorl and floral explants for three elite US sugarcane (Saccharum spp. hybrids) genotypes. In Vitro Cellular and Developmental Biology, 49, 674-681. [ Links ]
Kaur, R., Kapoor, M. (2015). Plant regeneration through somatic embryogenesis in sugarcane. Sugar Tech. Disponible on line en: Disponible on line en: http://www.researchgate.net (10/05/2015). [ Links ]
Kaur, A., Sandhu, J. S. (2015). High throughput in vitro micropropagation of sugarcane (Saccharum officinarum L.) from spindle leaf roll segments: Cost analysis for agri-business industry. Plant Cell, Tissue and Organ Culture, 120, 339-350. [ Links ]
Lakshmanan, P., Geijskes, J., Aitken, K., Grof, C., Bonnett, G., Smith, G. (2005). Invited Review: Sugarcane Biotechnology: The challenges and opportunities. In Vitro Cellular and Developmental Biology Plant, 41, 345-363. [ Links ]
Manchanda, P., Gosal, S. (2012). Effect of activated charcoal, carbono sources and gelling agents on direct somatic embryo-genesis and regeneration in sugarcane via leaf roll segments. SugarTechnology, 14, 168-173. [ Links ]
Marcano, A., Molina, P., Oropeza, M., de García, E. (2002). Optimización del proceso de embriogénesis somática en variedades venezolanas de caña de azúcar. Acta Científica Venezolana, 53, 251-257. [ Links ]
Mittal, P., Gosal, S., Senger, A., Kumar, P. (2009). Impact of cefotaxime on somatic embryogenesis and shoot regeneration in sugarcane. Physiology Molecular and Biology Plants, 15, 257-265. [ Links ]
Murashigue, T., Skoog, F. (1962). A revised medium for rapid growth and biossays with tobacco tissue culture. Plant Physiology, 15, 173-197. [ Links ]
Oropeza, M., García, E. (1996). Somaclonal variants resistant to sugarcane mosaic virus and their agronomic characterization. In Vitro Cellular and Developmental Biology Plant, 32, 26-30. [ Links ]
Oropeza, M., Marcano, A., García, E. (2001). Proteins related with embryogenic potential in callus and cell suspensions of sugarcane (Saccharum sp.). In Vitro Cellular and Developmental Biology Plant, 37, 211-216. [ Links ]
Raza, S., Qamarunisa, S., Hussain, M., Jamil, I., Anjum, S., Azhar, A., Ahmed, J. (2012). Regeneration in sugarcane via somatic embryogenesis and genomic instability in regenerated plants. Journal Crop Science Biotechnology, 15, 131-136. [ Links ]
Silva, M., Bedendo, I., Casagrande, M. (2005). Caracterização molecular e patogêncica de isolados de Xanthomonas albilineans (Ashby) Dowson agente causal escaldadura da cana de açúcar. Summa Phytopathology, 33, 341-347. [ Links ]
Silveira, V., Martins, A., Ferreira, A., Ribeiro, M., Segal, E., Santa, C. (2013). Morphological and polyamine content changes in embryogenic and non-embryogenic callus of sugarcane. Plant Cell, Tissue and Organ Culture, 114, 351-364. [ Links ]
Snyman, S., Gwethlyn, M., Aimee, C., Marzena, B., Paula, M. (2011). Applications of in vitro culture systems for commercial sugarcane production and improvement. In Vitro Cellular and Developmental Biology Plant, 47, 234-249. [ Links ]
Suprasanna, P., Choudhary, R., Desai, N., Bapat, V. (2005). Regulation of somatic embryogenesis by plant growth regulators in sugarcane. Sugar Technology, 7, 123-128. [ Links ]
Suprasanna, P., Patade, V. Y., Desai, N. S., Devarumath, R. M., Kawolr, P. G., Pagariya, M. C. & Babu, K. H. (2011). Biotechnological developments in sugarcane improvement: an overview. Sugar Technology, 13(4), 322-335. [ Links ]
Taylor, PWJ, Ko, HL, Adkins, SW, Rathus, C, Birch, RG (1992). Establishment of embryogenic callus and high protoplast yielding suspension cultures of sugarcane (Saccharum spp. hybrids). Plant Cell, Tissue and Organ Culture, 28, 69-78. [ Links ]
Taiz, L., Zeiger, E. (2010). Plant Physiology. Fifth edition. Sinauer Associates, Inc. U.S.A. p 782. [ Links ]
Taparia, Y., Gallo, M., Altpeter, F. (2012). Comparison of direct and indirect embryogenesis protocols, biolistic gene transfer and selection parameters for efficient genetic transformation of sugarcane. Plant Cell, Tissue and Organ Culture, 111, 131-141. [ Links ]
Thomas, C., Jiménez, V. (2005). Mode of action of plant hormones and plant growth regulators during induction of somatic embryogenesis: Molecular aspects. Plant Cell Monographs, 2, 157-175. [ Links ]
Watt, M., Banasiak, M., Reddy, D., Albertse, E., Snyman, S. (2009). In vitro minimal growth storage of Saccharum spp. hybrid (genotype 88H0019) at two stages of direct somatic embryogenic regeneration. Plant Cell, Tissue and Organ Culture, 96,263-271. [ Links ]
Recibido: 26 de Enero de 2015; Aprobado: 26 de Octubre de 2015











 text in
text in