Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.2 Bogotá July/Dec. 2015 Epub Aug 09, 2021
https://doi.org/10.15446/rev.colomb.biote.v17n2.54282
Artículos/Investigación
Prototipo de formulación y atmósfera de empaque para la cepa antagonista Pseudomonas fluorescens Ps006
* Microbióloga Industrial, Investigador Profesional, Laboratorio de Control Biológico, Corporación Colombiana de investigación agropecuaria CORPOICA, Km 14 vía Mosquera, Cundinamarca, Colombia. jcruiz@corpoica.org.co
** PhD, Directora Planta de Bioproductos, Corporación Colombiana de investigación agropecuaria CORPOICA, Km 14 vía Mosquera, Cundinamarca, Colombia. mgomeza@corpoica.org.co
*** PhD, Investigador PhD, Laboratorio de Control Biológico, Corporación Colombiana de investigación agropecuaria CORPOICA, Km 14 vía Mosquera, Cundinamarca, Colombia. lvillamizar@corpoica.org.co
El aislamiento Pseudomonas fluorescens Ps006 demostró alto potencial para ser usado como principio activo de un bioinsumo, por su capacidad para producir biosurfactantes, actividad solubilizadora de fósforo y antagonista ante diferentes fitopatógenos. Por tal razón, el presente trabajo tuvo como objetivos desarrollar y caracterizar un prototipo de formulación a base de P. fluorescens Ps006, estable bajo condiciones de almacenamiento. Inicialmente se caracterizó el principio activo y se seleccionaron los auxiliares de formulación compatibles con el mismo, evaluándose la estabilidad de su mezcla con tres soportes sólidos, a dos humedades diferentes (10% y 20%) durante tres meses de almacenamiento a temperaturas de 8, 18 y 28 ± 2 °C. El principio activo demostró actividad antagonista in vitro sobre cuatro fitopatógenos y la temperatura y la humedad afectaron su estabilidad durante el almacenamiento. A los prototipos de formulación más estables en cuanto a viabilidad y actividad biocontroladora se les evaluó su estabilidad en presencia y ausencia de oxígeno y de protectores de membrana. Se seleccionó el soporte S1 al 20% de humedad mezclado con el principio activo sin adición de protectores de membrana y almacenado en presencia de oxígeno, por ser el tratamiento más estable durante seis meses de alamacenamiento a tres temperaturas, con pérdidas de viabilidad inferiores al 5%.
Palabras clave: control biológico; formulación; Pseudomonas spp; vida útil
The isolation Pseudomonas fluorescens PS006 demonstrated high potential to be used as an active ingredient of a bio-produt, because its capacity to produce biosurfactants, its phosphorus solubilizing activity and its antagonistic activity over different phytopathogens. For this reason, the present work had as objectives to develop and characterize a formulation prototype based on P. fluorescens PS006, stable under storage conditions. Initially the active ingredient was characterize and compatible formulation auxiliaries, were selected evaluating the stability of its mixture with three solid diluents at two different moistures (10% and 20 %) during three months of storage at temperatures of 8, 18 and 28 ± 2 °C. The active ingredient showed in vitro biocontrol activity over four phytopathogens and temperature and humidity affected its stability during storage. Stability of the most stable formulation prototypes in terms of viability and biocontrol activity was evaluated in presence and absence of oxygen and membrane protectors. Support S1 with 20% of moisture mixed with the active ingredient without addition of membrane protectors and stored in presence of oxygen, was selected as the most stable treatment during six months of storage at three temperatures, with viability losses lower than 5%.
Key words: biological control agent; biocontrol; formulation; Pseudomonas spp; shelf-life
Introducción
Pseudomonas fluorescens es una bacteria con alto potencial para el control biológico de diversos microorganismos fitopatógenos, debido a sus múltiples mecanismos de acción, tales como la inducción de resistencia sistémica, la producción de sideróforos, la competencia por espacio y nutrientes y la producción de diversos metabolitos entre los que se destacan la pioluteorina, el 2,4-diacetilfloroglucinol (DAPG), la pirrolnitrina, el ácido cianhídrico y otras metaloenzimas, (Loper & Gross, 2007; Anjaiah, 2006; Manikandan et al., 2010; Siddiqui, & Shaukat, 2003). Algunas de las enfermedades sobre las cuales P. fluorescens ejerce control son el añublo de la vaina del arroz (Oryza sativa L.) causada por Rhizoctonia solani (Commare et al., 2002; Rabrindran & Vidhyasekaran, 1996), el marchitamiento del tomate (Solanum lycopersicum L.) causado por Fusarium oxysporum (Manikandan et al., 2010; Valencia et al., 2005), la mancha bacteriana en tomate causada por Xanthomonas campestris pv. Vesicatoria (Kamal et al., 2008), la podredumbre de la fruta y el moho del chile causados por Colletotrichum capsici y Leveillula taurica respectivamente (Anand et al., 2010) y la marchitez causada por el hongo del suelo Verticillium dahliae, enfermedad responsable de grandes pérdidas económicas en cultivos como el algodón (Gossypium sp. L) (Erdogan, & Benlioglu, 2010).
P. fluorescens como otros microorganismos es susceptible a diferentes condiciones ambientales, en particular la temperatura y el pH (O'Callaghan et al., 2006). Por tales razones para su implementación eficiente como herramienta de control biológico, es necesario desarrollar productos cuya formulación asegure su eficacia y estabilidad en almacenamiento (Burges, 1998).
A nivel mundial existen múltiples productos con P. fluorescens como principio activo, los cuales están formulados para el control biológico de diferentes fitopatógenos (Hernández-Rodríguez et al., 2008; Hernández-Rodríguez et al., 2014). Entre estos productos se encuentran BioCure-B® recomendado para el control de Mycosphaerella grasicola, Pythium spp., Rhizoctonia solani, Fusarium spp., Botrytis cinerea, Sclerotium rolfsii, y Sclerotinia homoeocarpa (T-Stanes & Company Limited, s.f) y BlightBanA506® formulado como polvo mojable efectivo para el control de Erwinia amylovora en cultivos de papa (Solanum tuberosum L.) y tomate (Copping, 2009), entre otros tantos productos.
La cepa autóctona P. fluorescens Ps006 tiene la capacidad de producir biosurfactantes, actividad solubilizadora de fósforo, actividad zoosporicida y potencial para el control biológico de patógenos al evidenciarse una reducción en el índice de severidad (IS) de O. virulentus (IS de 0,6) en plantas de lechuga (Lactuca sativa L.) en comparación con el testigo patógeno (IS de 4,7). Además, esta bacteria aplicada a una concentración de 1x107 células.mL-1 favoreció e incrementó significativamente la longitud y ancho de las hojas, la biomasa seca de la parte aérea, al igual que el desarrollo en longitud y la biomasa seca de la raíz de plantas de fique, demostrando un efecto promotor del crecimiento vegetal (Smith et al., 2013). Teniendo en cuenta dichas características, este trabajo tuvo como objetivos desarrollar un prototipo de formulación polvo mojable (WP) usando P. fluorescens Ps006 como ingrediente activo y seleccionar la atmósfera de empaque más favorable para mantener la viabilidad del microorganismo.
Materiales y métodos
Microorganismo y conservación
Se utilizó el aislamiento de P. fluorescens Ps006, obtenido a partir de la rizosfera de fique Furcraea andina (Trelease 1808) en el municipio de Totoró (2° 38' N y 2°15' W, a 2,750 m.s.n.m, y 14 °C), en el departamento del Cauca, Colombia (Sastoque, 2010). El microorganismo fue conservado en solución salina (0,85% de NaCl) con glicerol al 10% y peptona al 0,10%, a -70 ± 2 °C.
Producción y caracterización del principio activo de P. fluorescens Ps006
P. fluorescens Ps006 se sembró en medio agar Luria Bertani - LB (Oxoid CM1021) y se incubó por 48 horas a 28 ± 2 °C. A partir de este cultivo se preparó una suspensión celular en Tween 80 al 0,5% y se inoculó en un erlenmeyer de 250 mL con 100 mL de medio LB. La concentración de la suspensión se estimó leyendo la absorbancia a una longitud de onda de 300 nm y dicho valor se extrapoló en una curva patrón estandarizada previamente. La fermentación se realizó utilizando una agitación constante de 175 rpm a 28 ± 2 °C por 48 horas.
Se realizaron 3 lotes de fermentación que se caracterizaron determinando la concentración celular en unidades formadoras de colonia por mililitro (UFC/mL), el pH y la actividad biológica in vitro, por triplicado para cada lote.
La concentración bacteriana se determinó mediante recuento en placa, sembrando tres diluciones decimales del caldo de fermentación por triplicado, en cajas Petri con medio LB e incubando durante 24 horas a 28 ± 2 °C, momento en el cual se realizó el recuento de UFC/ mL. Una vez se verificó la normalidad (Shapiro Wilk 95%) y la homogeneidad de varianza (Prueba de Barlett 95%) de los datos, se realizó un análisis de varianza ANOVA y una comparación de medias de Tukey con un nivel de confianza del 95%. Se empleó el programa estadístico Statistix 8.0.
El pH de los tres lotes de fermentación se midió con un potenciómetro marca Hanna® Instruments previamente calibrado. Se determinó la desviación estándar y el coeficiente de variación de los datos.
La actividad biológica in vitro se estimó como la inhibición del crecimiento de cuatro reconocidos fitopatógenos (Raut et al., 2012) mediante la técnica de cultivo dual (Shi et al., 2014). Para ello se utilizaron las cepas F. oxysporum MAP5 aislado de uchuva (Physalis peruviana L.), R. solani Rh200 aislada de papa (Solanum tuberosum), B. cinerea Bc008 aislada de mora (Rubus sp. L.), y Sclerotinia sclerotiorum Sc021 aislada de papa (Solanum tuberosum). Para esta determinación se sembraron en superficie en medio agar PDA muestras de 100 μL de los tres lotes de fermentación y se colocó sobre el punto central del medio inoculado un disco de 5 mm de diámetro de medio de cultivo crecido con los hongos fitopatógenos de 8 días de edad. Se utilizaron tres unidades experimentales (cajas de Petri) para cada tratamiento. El tratamiento control consistió en medio agar PDA sin inóculo bacteriano, pero inoculado con los hongos fitopatógenos de la forma descrita previamente. Las cajas de Petri se incubaron 8 días a 25 ± 2 °C y transcurrido dicho tiempo, el valor de crecimiento diametral medio de cada colonia fue determinado calculando la longitud promedio de 4 líneas rectas que trazadas de un extremo a otro de la colonia, pasan por su centro y la dividen en octantes (Pradeep et al., 2013).
Selección de soportes sólidos compatibles
Se evaluaron tres soportes sólidos en polvo denominados S1 (arcilla), S2 (silicato) y S3 (estearato), cada uno a dos condiciones de humedad diferentes (10% y 20%) e inoculados con el principio activo a una concentración de 1x109 UFC/mL. La humedad de los soportes al 10% fue aportada por el principio activo mezclado, mientras que para ajustar el 20% y mantener la misma concentración celular se adicionó una solución tampón pH 7,5. Posteriormente se dispensaron muestras de 1 g de soporte inoculado con el principio activo en viales de vidrio previamente esterilizados, los cuales se sellaron con tapones de caucho y agrafes metálicos y se almacenaron a diferentes temperaturas (8 ± 2 °C, 18 ± 2 °C y 28 ± 2 °C). Antes de iniciar el almacenamiento y pasados uno, dos y tres meses, se evaluó la viabilidad de P. fluorescens Ps006 por el método de recuento en placa descrito previamente (resultados expresados en UFC/g). La muestra contenida en cada vial se mezcló con 9 mL de Tween 80 al 0,5 % y se agitó para su posterior siembra en medio de cultivo LB. Se siguió un diseño completamente al azar con medidas repetidas en el tiempo. En cada tiempo de medición se evaluaron dos muestras de cada tratamiento por triplicado. Se seleccionaron los tratamientos en los cuales se obtuvo una mayor viabilidad y estabilidad del principio activo en los tres meses de almacenamiento.
Evaluación de coadyuvantes y atmósfera de empaque
Una vez seleccionados los soportes compatibles con el principio activo, se evaluó el efecto de la presencia o ausencia de aire dentro del empaque y el efecto de la leche descremada y el glicerol (coadyuvantes), utilizados comúnmente como estabilizadores de la viabilidad de los microorganismos durante su conservación (Burges, 1998). Los soportes seleccionados se mezclaron con los coadyuvantes al 5% y se inocularon con el cultivo bacteriano ajustándolo a la humedad seleccionada. Los soportes inoculados sin adición de coadyuvantes se utilizaron como control. Las muestras se almacenaron bajo condiciones atmosféricas diferentes: al vacío y con presencia de oxígeno y a temperaturas de 8 ± 2 °C, 18 ± 2 °C y 28 ± 2 °C. El efecto de estas condiciones climáticas fue evaluado durante seis meses. Para los tratamientos almacenados con oxígeno se dispensaron muestras de 1g del soporte inoculado con el principio activo en viales de vidrio previamente esterilizados, los cuales se sellaron con tapones de caucho y agrafes metálicos. Para el almacenamiento al vacío se depositaron muestras de 1g del soporte inoculado con el principio activo en bolsas PET (Tereftalato de Polietileno) y se sellaron al vacío con una Selladora Van der stahl®. La viabilidad de la bacteria se determinó mediante recuento en placa sembrando en superficie tres diluciones decimales por triplicado en cajas de Petri con medio agar LB.
Se siguió un diseño completamente al azar con medidas repetidas en el tiempo, y en cada tiempo de evaluación se determinó la viabilidad de dos muestras de cada tratamiento por triplicado.
Análisis estadísticos
Se determinó la normalidad y homogenidad de varianza mediante las pruebas de Shapiro Wilks (95%) y Bartlett (95%), respectivamente. Una vez demostrados estos principios, se aplicó a un análisis de varianza ANOVA y una prueba de comparación de medias de Tukey (95%). Se utilizó el programa Statistix versión 8.1 (Analitycal Software, Florida, USA).
Resultados y discusión
Producción y caracterización del principio activo P. fluorescens Ps006
Para los tres lotes de principio activo se obtuvo un pH promedio de 8,63, con un coeficiente de variación de 0,2%. Las concentraciones celulares para cada uno de los lotes evaluados fueron 6.73x109, 8.07x109 y 8.93x109 UFC/mL. El coeficiente de variación de los resultados de evaluación fue del 0.6%, y no se evidenciaron diferencias significativas entre los resultados de los lotes (F=2,06; gl=2; p=0,2081), lo que indica baja variabilidad y alta repetibilidad en la producción del principio activo (Villamizar et al., 2005). En cuanto al pH, éste osciló entre 8,60 y 8,65 encontrándose que no hay diferencias significativas entre los resultados de los lotes evaluados (F=3,74; gl=2; p=0,0882).
Basado en los resultados obtenidos para cada parámetro, en este estudio se propusieron rangos o límites de aceptación para las características del principio activo a base de Ps006, los cuales serán utilizados como referencia para su control de calidad (tabla 1).
En la figura 1 se observa el efecto in vitro del principio activo sobre los cuatro patógenos evaluados, con inhibiciones del crecimiento diametral de R. solani Rh200, B. cinerea Bc008, S. sclerotiorum Sc021 y F. oxysporum MAP5 de entre el 93,64% y 36,80%. La actividad antagónica de P. fluorescens ante patógenos que afectan a cultivos de importancia económica ha sido demostrada por varios autores. Por ejemplo, para F. oxysporum se obtuvo un control del 81,21% en condiciones de campo (Manikandan et al., 2010), para R. solani se observaron disminuciones de la intensidad de la enfermedad del 42% (Rabrindran & Vidhyasekaran, 1996) y del 47,89% (Commare et al., 2002) en condiciones de invernadero. Asimismo, se obtuvo una disminución del crecimiento in vitro del 67,7% para Botrytis sp. (Mikani et al., 2008) y una reducción de la incidencia de la enfermedad del 26,3% para S. sclerotiorum en condiciones de campo (Fernando et al., 2007). Estos resultados confirman el potencial que tiene P. fluorescens como agente de control biológico y demuestran las potencialidades de uso de su principio activo como bioplaguicidas para el control de plagas que afectan a cultivos de importancia económica. Sin embargo, investigaciones a escala de macetas y campo son necesarias para demostrar esta hipótesis.
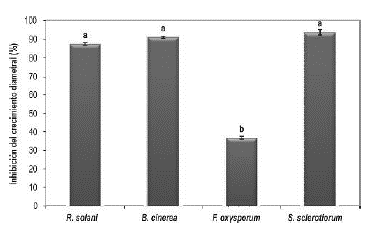
Figura 1 Actividad antagónica in vitro del principio activo a base de P. fluorecens Ps006, determinada como la inhibición del crecimiento diametral de cuatro hongos fitopatógenos. Tratamientos con letras comunes no presentan diferencias significativas según prueba de Tukey (95%).
El patógeno más resistente a la actividad antagónica de P. fluorescens Ps006 fue F. oxysporum MAP5 con una inhibición del crecimiento diametral de tan solo el 36,80%, valor significativamente menor (F=14,9; gl=3; p=0,0000) a los obtenidos con los otros patógenos evaluados, que presentaron porcentajes de inhibición superiores al 87%. Esto podría deberse a una mayor resistencia en la pared celular del micelio de F. oxysporum, microorganismo que posee polímeros de heteroglucuranos que no se encuentran en los demás patógenos evaluados y que han sido relacionados con la resistencia y el mantenimiento de la integridad celular (Nuero, 1995). Además es posible que el aislamiento de F. oxysporum MAP5 posea la capacidad para inhibir la biosíntesis del 2,4-diacetilfloroglucinol (2,4-DAPG), un antibiótico de amplio espectro reconocido como uno de los principales mecanismos de acción en un amplio rango de aislamientos de P. fluorescens (Showkat et al., 2012) . Este comportamiento fue demostrado por Schouten et al. (2004), quienes evaluaron la sensibilidad de 41 aislamientos de F. oxysporum frente a dicho antibiótico y encontraron un 17% de aislamientos resistentes, lo que atribuyeron a la capacidad de este patógeno de producir ácido fusárico, un potente inhibidor de la biosíntesis del 2,4-DAPG.
El modo de acción de P. fluorescens como antagonista de fitopatógenos se ha relacionado con la competencia por espacio y nutrientes. Este fenómeno fue observado por Commare et al. (2002) que determinaron la actividad antagónica de formulaciones de P. fluorescens en talco, evidenciándose un control de R. solani del 47,89% en condiciones de invernadero, resultados atribuidos a la competencia por espacio. En el estudio realizado por Valencia et al. (2005), se concluyó que la actividad de P. fluorescens ZUM80 sobre F. oxysporum se debió a la competencia por nutrientes, privando al hongo del hierro disponible en el medio mediante la producción de sideróforos, capacidad antagónica que se vio favorecida cuando la bacteria tuvo un tiempo de pre-exposición en el medio (Valencia et al., 2005). Además de estos mecanismos de competencia, en estudios realizados por Khanam, Ueno, Kihara, Honda, & Arase (2005) se encontró que el ácido salicílico que produce P. fluorescens inhibe la formación de estructuras de infección, tales como el tubo germinal y los apresorios en B. cinerea, lo que sugiere que esta bacteria también tiene la capacidad de producir otros metabolitos con actividad antagónica efectiva.
Selección de soportes sólidos compatibles
En la figura 2 se presenta la pérdida total de viabilidad del principio activo después de tres meses de almacenamiento a las tres temperaturas evaluadas. Se observó para el soporte S1 al 10% de humedad (S1-10%), porcentajes de pérdida entre el 14% y el 31,9% y para S1 al 20% de humedad (S1-20%) entre el 9,6% y el 33,2%. Para el soporte S2 al 10% de humedad (S2-10%) a las tres temperaturas se obtuvo una pérdida de viabilidad del 67,7% y para S2 al 20% de humedad (S2-20%), la reducción de la viabilidad osciló entre el 2,3% y el 9,4%. Finalmente, para el soporte S3 al 10% de humedad (S3-10%) en las tres temperaturas se obtuvo una pérdida del 78,1% y para dicho soporte al 20% de humedad la pérdida de viabilidad osciló entre el 25,7% y el 69,6%.
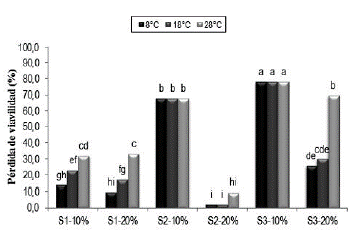
Figura 2 Pérdida total de viabilidad del principio activo de P. fluorescens Ps006 mezclado con los soportes sólidos, después de tres meses de almacenamiento a tres temperaturas. 51- 10%: Soporte 1 al 10% de humedad, S1-20%: Soporte 1 al 20% de humedad, S2-10%: Soporte 2 al 10% de humedad, 52- 20%: Soporte 2 al 20% de humedad, S3-10%: Soporte 3 al 10% de humedad, S3-20%: Soporte 3 al 20% de humedad. Tratamientos con la misma letra no presentan diferencias significativas según prueba de Tukey (95%).
Se evidenció que las humedades del 10% y del 20% a las cuales se ajustaron los sistemas para su almacenamiento, tuvieron un efecto en la estabilidad de la viabilidad de la bacteria Ps006, siendo la pérdida de viabilidad con los soportes S2 y S3 al 10%, significativamente mayor que para los sistemas con el 20% de humedad (F=402; gl=17; p=0,0000) (Fig. 2). Esto puede deberse a que los tratamientos con el 20% de humedad requirieron la adición de un volumen de solución tampón pH 7,5 para el ajuste de la humedad, el cual posiblemente ejerció un control en el estado iónico de la formulación, haciéndola menos susceptible a cambios bruscos de pH que pueden afectar la estabilidad e integridad de la membrana citoplasmática, causar la denaturalización de enzimas y alterar las interacciones iónicas que les permiten reconocer y unirse al sustrato (Calvo et al., 2004; Nelson & Cox, 2005).
Las mayores pérdidas de viabilidad obtenidas con los soportes S2 y S3 cuando la humedad se ajustó al 10%, podrían deberse a que con dicha humedad la concentración de solutos en el sistema es mayor en relación con el tratamiento al 20% de humedad. Esta atmósfera hipertónica en el medio al 10% de humedad pudo ocasionar fenómenos de plasmólisis obligando a la célula a perder agua, lo que aumenta la viscosidad del ambiente intracelular disminuyendo su volumen, llevando a una retracción de la membrana citoplasmática y posteriormente a la muerte celular (Rodríguez et al., 2005; Tortora et al., 2007).
Con el soporte S1 a las dos humedades y con los soportes S2 y S3 al 20% de humedad se observó que la pérdida de la viabilidad aumentó a medida que aumentó la temperatura de almacenamiento, efecto negativo que ha sido evidenciado por diferentes autores para diversos microorganismos (Chen et al., 2008; Costa et al., 2008; Guijarro et al., 2007; Santos et al., 2012). Este efecto podría deberse a que a mayor temperatura el metabolismo celular se mantiene activo, lo que causa que se almacenen metabolitos tóxicos que reducen drásticamente la viabilidad (Santos et al., 2012; Costa et al., 2002). Por ejemplo Kinay & Yildiz, (2008), evaluaron formulaciones de Pichia guilliermondii y observaron que las almacenadas a 4 °C fueron más estables que las almacenadas a 24 °C. Resultados similares a los del presente estudio fueron obtenidos por Santos et al. (2012) que evaluaron la estabilidad de la germinación de los conidios de los aislamientos colombianos Trichoderma koningiopsis Th003 y Trichoderma asperellum Th034 formulados como polvos secos para espolvoreo y granulados dispersables almacenados a temperaturas de 8, 18 y 28 °C. Dichos autores obtuvieron mayores vidas útiles cuando el almacenamiento fue a 8 y 18°C, concluyendo que las temperaturas más bajas redujeron la actividad metabólica de los conidios, evitando la producción de metabolitos tóxicos y el agotamiento de nutrientes, aspectos relacionados con la fisiología microbiana.
El principio activo mezclado con los soportes S1 y S2 al 20% de humedad se seleccionaron como los sistemas de entrega base para el desarrollo de un bioplaguicida, ya que fueron los sistemas más compatibles con el principio activo de P. fluorescens Ps006, manteniendo estable su viabilidad y actividad biocontroladora durante tres meses de almacenamiento a 8± 2 °C, 18± 2 °C y 28 ± 2 °C.
Evaluación de coadyuvantes y atmósfera de empaque
Una vez seleccionados los soportes más compatibles con el principio activo se procedió a evaluar el efecto de la presencia y ausencia de oxígeno en el empaque y de dos coadyuvantes protectores de la membrana celular (leche descremada y glicerol), sobre la viabilidad de P. fluorescens Ps006 bajo condiciones de al macenamiento. Los resultados de dichos ensayos se presentan en la figura 3.

Figura 3 Pérdida de viabilidad del principio activo de P. fluorescens Ps006 con los soportes A) S1-20% y B) S2-20% después de seis meses de almacenamiento. CV: almacenado al vacío, CO: almacenado con oxígeno, PPV: con protectores de membrana almacenado al vacío, PPO: con protectores de membrana almacenado con oxígeno. Tratamientos con la misma letra no presentan diferencias significativas según prueba de Tukey (95%).
Teniendo en cuenta la concentración de la suspensión celular utilizada como principio activo (1x109 UFC/mL) y la proporción de mezcla con los soportes, la concentración teórica de la mezcla se estimó en 1,3x108 UFC/ mL. Los datos experimentales mostraron que la viabilidad inicial del principio activo con el soporte S1 al 20% de humedad fue de 4,67x107 UFC/g y cuando fue mezclado con los protectores de membrana fue de 1,45x108 UFC/g. Esta disminución en la concentración celular cuando no se utilizó protector de membrana posiblemente se relaciona con un efecto tóxico ejercido por el soporte al entrar en contacto con las células de P. fluorescens Ps006, que redujo su viabilidad. Sin embargo, este efecto deletéreo se vio disminuido por los protectores de membrana.
Se observó que la pérdida de viabilidad después de seis meses de almacenamiento fue directamente proporcional a la temperatura, tendencia que se evidenció para las dos condiciones atmosféricas (con y sin O2). El tratamiento sin protector de membrana y almacenado con oxígeno fue el más estable para el soporte S1, ya que la pérdida de viabilidad máxima fue del 20% a 28 °C en comparación con los demás tratamientos con pérdidas significativamente mayores (F=1622,39; gl=10; p=0,0000), las cuales superaron el 70% bajo la misma condición de temperatura.
Para el soporte S2 se obtuvieron viabilidades iniciales de 1,79 x 107 UFC/g cuando no se utilizaron protectores de membrana y de 6,90 x 107 UFC/g cuando éste fue adicionado, evidenciándose nuevamente un efecto tóxico inicial al contacto con el soporte sólido. Pasados seis meses, en general se observó que la pérdida de viabilidad aumentó a medida que se incrementó la temperatura de almacenamiento. Dicha pérdida fue significativamente menor (F=233; gl=9; p=0,0000) para los tratamientos almacenados con oxígeno en comparación con los tratamientos almacenados al vacío, es decir que la ausencia de oxígeno en el empaque no mejoró la estabilidad de las formulaciones. Este comportamiento podría deberse al estrés causado por la atmósfera al vacío, sobre una bacteria aerobia obligada como P. fluorescens, que genera energía por un proceso de fosforilación oxidativa cuyo último aceptor de electrones es el oxígeno (Adams & Moss, 2008; Vásquez et al., 2009). El efecto negativo de la atmósfera de empaque al vacío sobre la viabilidad de Pseudomonas spp. evidenciado en el presente estudio, ha sido ampliamente estudiado en la industria alimenticia, donde el empaque al vacío es utilizado para inhibir el desarrollo de bacterias contaminantes (ICMSF, 2006). Evitar la implementación de sistemas de vacío es una ventaja evidente para la producción a nivel industrial, ya que se disminuyen los tiempos y costos en el proceso, aumentando así la rentabilidad del producto final.
En la mayoría de los casos la viabilidad fue significativamente mayor (F=233; gl=9; p=0,0000) para los tratamientos en los cuales se mezcló el principio activo unicamente con el soporte, en comparación con los tratamientos en los que además del soporte, el principio activo se mezcló con los potenciales protectores de membrana; a excepción del tratamiento S2-20% almacenado con oxígeno, el cual no evidenció diferencias significativas cuando se usaron o no los protectores. En este sentido, el glicerol es ampliamente usado como humectante y protector osmótico (Freitas et al., 2009; Rowe et al., 2009), así como crioprotectante y protector de secado al igual que la leche descremada (Cody et al., 2008; Morgan et al., 2006; Barbaree et al., 1982). Sin embargo, se ha encontrado que ciertas cepas de Pseudomonas spp. utilizan el glicerol como fuente de carbono para la producción de biosurfactantes (Freitas et al., 2009; Freitas et al., 2010; Silva et al., 2010; Stanghellini, & Miller, 1997), razón por la que se podría sugerir un posible consumo del glicerol y de la leche descremada durante el almacenamiento de los prototipos de formulación evaluados en el presente estudio, lo que pudo haber favorecido el crecimiento del microorganismo, el mantenimiento del metabolismo celular y la producción de metabolitos tóxicos, ocasionado pérdidas de viabilidad (Santos et al., 2012).
El desarrollo de formulación en polvo de bacterias antagonistas es especialmente importante para el tratamiento de semillas (Ramamoorthy et al., 2001). En el presente trabajo se desarrolló un prototipo de formulación a base de la bacteria P. fluorescens Ps006, la cual sobrevivió durante seis meses de almacenamiento a 28°C con una mínima pérdida de viabilidad, cuando se formuló en el soporte S1 que corresponde a un arcilla ajustada a una humedad del 20% y se utilizó una atmósfera de empaque no controlada en presencia de aire. En otros trabajos se han desarrollado prototipos de formulación similares pero con menor estabilidad y en la mayoría de los casos requiriendo condiciones de refrigeración. Tal es el caso de poblaciones de P. fluorescens formuladas en talco con un 20% de las goma Xantan que mantuvieron su viabilidad durante 2 meses de almacenamiento a 4°C (Kloepper & Schroth, 1981). Otra formulación que al igual que el presente trabajo utilizó como soporte una arcilla tipo vermiculita, obtuvo una viabilidad estable durante 6 meses a 4°C (Connick, 1988) y en otro trabajo donde el soporte fue talco, se mantuvo la viabilidad por un período de 90 días a 26°C (Sadi & Masoud, 2012).
Conclusiones
El prototipo de formulación en polvo mojable (WP) a base del principio activo de P. fluorescens Ps006 que demostró su actividad antagonista de los fitopatógenos Fusarium oxysporum, Rhizotocnia solani, Botrytis cinerea y Sclerotinia sclerotiorum, fue estable durante seis meses de almacenamiento en las tres temperaturas evaluadas, cuando se utilizó como soporte una arcilla ajustada a una humedad del 20%, sin adición de protectores de membrana y empleando una atmósfera de empaque con oxígeno. Las pérdidas de viabilidad fueron inferiores al 5 % durante el tiempo de almacenamiento sin refrigeración, por lo que este prototipo fue seleccionado para continuar con el desarrollo de un producto comercial con potencial para el control de enfermedades en diferentes cultivos.
Agradecimientos
Los autores agradecen al Ministerio de Agricultura y Desarrollo Rural de Colombia el apoyo financiero a este trabajo.
REFERENCIAS
Adams, M., & Moss, M. (2008). Food Microbiology. Third Edition, Reino Unido: Royal Society of Chemistry. Cambrige. [ Links ]
Anand, T., Chandrasekaran, A., Kuttalam, S., Senthilraja, G., & Samiyappan, R. (2010). Integrated control of fruit rot and powdery mildew of chilli using the biocontrol agent Pseudomonas fluorescens and a chemical fungicide. Biological Control, 52(1): 1-7. [ Links ]
Anjaiah, V. (2006). Biological control mechanisms of fluorescent Pseudomonas species involved in control of root diseases of vegetables/ fruits. En: Mukerji, K. (Ed). (2004). Disease management of fruits and vegetables. Vol 1. Fruit and Vegetable Diseases. Netherlands: Kluwer Academic Publishers. [ Links ]
Barbaree, J., Thompson, F., & Smith, S. (1982). Use of thermal stability studies to compare Bacteroides fragilis lyophilized in skim milk and polyvinylpyrrolidone solutions. Cryobloiogy, 19, 92-98. [ Links ]
Burges, HD. (Ed). (1998). Formulation ofmicrobial biopesticides, beneficial microorganisms, nematodes and seed treatment. Gran Bretaña: Kluwer Academic Publishers. [ Links ]
Calvo, P., Meneses, L., & Zúñiga, D. (2008). Estudio de las poblaciones microbianas de la rizósfera del cultivo de papa (Solanum tuberosum) en zonas altoandinas. Ecología Aplicada. 7(1,2), 141-148 [ Links ]
Chen, A., Zhangyan, S., & Zhang, L. (2008). The effects of some storage conditions on viability of Lecanicillium lecanii conidia to whitefly (Homoptera: Trialeurodes vaporariorum). Biocontrol Science Technology, 18(3), 267-278. [ Links ]
Cody, W., Wilson, J., Hendrixson, D., Mclver, K., Hagman, K., Ott, C., Nickerson, C., & Schurr, M. (2008). Skim milk enhances the preservation of thawed -80 °C bacterial stocks. Journal of Microbiological Methods, 75(1), 135-138. [ Links ]
Commare, R., Nandakumar, R., Kandan, A., Suresh, S., Bharathi, M., Raguchander, T., & Samiyappan R. (2002). Pseudomonas fluorescens based bio-formulation for the management of sheath blight disease and leaffolder insect in rice. Crop Protection, 21 (8), 671-677. [ Links ]
Connick, W. (1988). Formulation of living biological control agents with alginate. En Cross, B., Scher, H. (Ed). (1988). Pesticide formulations: Innovations and developments. ACS-Symposium Series 371, American chemical society, 241-250. [ Links ]
Copping, L. (Ed). (2009). The manual of biocontrol agents: A world compendium. 4 ed. Reino Unido: British crop protection council publications. [ Links ]
Costa, J., Teixido, U., Torres, R., & Viñas, I. (2002). Effect of package and storage conditions on viability and efficacy of the freeze-dried biocontrol agent Pantoea agglomerans strain CPA-2. Journal of Applied Microbiology, 92(5), 873-8. [ Links ]
Erdogan, O., & Benlioglu, K. (2010). Biological control of Verticillium wilt on cotton by the use of fluorescent Pseudomonas spp. under field conditions. Biological Control, 53(1), 39-45. [ Links ]
Fernando, W., Nakkeeran, S., Zhang, Y., & Savchuk, S. (2007). Biological control of Sclerotinia sclerotiorum (Lib.) de Bary by Pseudomonas and Bacillus species on canola petals. Crop Protection, 26(2), 100-107. [ Links ]
Freitas, F., Alves, V., Pais, J., Costa, N., Oliveira, C., Mafra, L.,... Reis, M. (2009). Characterization of an extracellular polysaccharide produced by a Pseudomonas strain grown on glycerol. Biore-source Technology, 100(2), 859-865. [ Links ]
Freitas, F., Alves, V., Pais, J., Carvalheira, M., Costa, N., Oliveira, R., & Reis, A. (2010). Production of a new exopolysaccharide (EPS) by Pseudomonas oleovorans NRRL B-14682 grown on glycerol. Process Biochemistry, 45(3), 297-305. [ Links ]
Guijarro, B., Melgarejo, P., & De Cal, A. (2007). Effect of stabilizers on the shelf-life of Penicillium frequentans conidia and their efficacy as a biological agent against peach brown rot. International Journal of Food Microbiology, 113(2), 117-124. [ Links ]
Hernández-Rodríguez, A., Heydrich-Pérez, M., Acebo-Guerrero, Y., Velazquez-del Valle, M.G., & Hernández-Lauzardo, A.N. (2008). Antagonistic activity of Cuban native rhizobacteria against Fusarium verticillioides (Sacc.) Nirenb. in maize (Zea mays L.). Applied soil ecology, 39, 180 - 186. [ Links ]
Hernández-Rodríguez, A., Rives-Rodríguez, N., Acebo-Guerrero, Y., Díaz-de la Osa, A., Heydrich-Pérez, M., & Divan-Baldani, VL. (2014). Potencialidades de las bacterias diazotróficas asociativas en la promoción del crecimiento vegetal y el control de Pyricularia oryzae (Sacc.) en el cultivo del arroz (Oryza sativa L.). Revista de Protección Vegetal, 29(1), 1-10. (2006). Microorganisms in foods 6: Microbial ecology of food commodities. Second Edition. New York: Springer Science & Business Media. [ Links ]
Kamal, A., Abo-elyousr, K., & El-hendawy, H. (2008). Integration of Pseudomonas fluorescens and acibenzolar-S-methyl to control bacterial spot disease of tomato. Crop Protection, 27(7), 1118-1124. [ Links ]
Khanam, N., Ueno, M., Kihara, J., Honda, Y., & Arase, S. (2005). Suppression of red light-induced resistance in broad beans to Botrytis cinerea by salicylic acid. Physiological and Molecular Plant Pathology, 66(1-2), 20-29. [ Links ]
Kinay, P., & Yildiz, M. (2008). The shelf life and effectiveness of granular formulations of Metschnikowia pulcherrima and Pichia guilliermondii yeast isolates that control postharvest decay of citrus fruit. Biological Control, 45(3), 433-440. [ Links ]
Kloepper, J., & Schroth, M. (1981). Development of a powder formulation of rhizobacteria for inoculation of potato seed pieces. Phytopathology, 71 , 590-592. [ Links ]
Loper, J., & Gross, H. (2007). Genomic analysis of antifungal metabolite production by Pseudomonas fluorescens Pf-5. European Journal of Plant Pathology, 119(3), 265-278. [ Links ]
Madigan, M., Martinko, J., & Parker J. (2004). Brock Biología de los microorganismos. 10 ed. Madrid, España: Prentice Hall. [ Links ]
Manikandan, R., Saravanakumar, D., Rajendran, L., Raguchander, T., & Samiyappan, R. (2010). Standardization of liquid formulation of Pseudomonas fluorescens Pf1 for its efficacy against Fusarium wilt of tomato. Biological control, 54(2), 83-89. [ Links ]
Mikani, A., Etebarian, H., Sholberg, P., O'gorman, D., Stokes, S., & Alizadeh, A. (2008). Biological control of apple gray mold caused by Botrytis mali with Pseudomonas fluorescens strains. Postharvest Biology and Technology, 48(1), 107-112. [ Links ]
Morgan, C., Herman, N., White, P., & Vesey, G. (2006). Preservation of micro-organisms by drying; A review. Journal of Microbiological Methods, 66(2), 183-193. [ Links ]
Nelson, D., & Cox, M. (2005). Lehninger principles of biochemistry. Fourth edition. New York: W. H. Freeman Publishers. [ Links ]
Nuero, O. (1995). Estudio bioquímico de $-1,3-glucanasas de Aspergillus nidulans para el control biológico de Fusarium oxysporum f.sp. lycopersici raza 2. Universidad Complutense de Madrid. Madrid, España. [ Links ]
O'callaghan, M., Swaminathan, J., Lottmann, J., Wright, D., & Jackson, T. (2006). Seed coating with biocontrol strain Pseudomonas fluorescens F113. New Zealand Plant Protection, 59, 80-85. [ Links ]
Pradeep, F., Begam, M., Palaniswamy, M., & Pradeep, B. (2013). Influence of culture media on growth and pigment production by Fusarium moniliforme KUMBF1201 isolated from paddy field soil. World Applied Sciences Journal, 22 (1), 70-77. [ Links ]
Rabrindran, R., & Vidhyasekaran, P. (1996). Development of a formulation of Pseudomonas fluorescens PfALR2 for management of rice sheat blight. Crop Protection, 15(8), 715-721. [ Links ]
Ramamoorthy, V., Viswanathan, R., Raguchander, T., Prakasam, V., & Saiyappan, R. (2001). Induction of systemic resistance by plant growth promoting rhizobacteria in crop plants against pests and diseases. Crop Protection, 20, 1-11. [ Links ]
Raut, I., Constantin, M., Vasilecu, G., Jecu, L., & Esan, T. (2012). Screening of antagonistic Trichoderma for biocontrol activities on phytopathogens. Scientific Bulletin, Series F, Biotechnologies, 16, 63-66. [ Links ]
Rodríguez, E., Gamboa, M., Hernández, F., & García, J. (2005). Bacteriología general: Principios y prácticas de laboratorio. Costa Rica: Editorial Universidad de Costa Rica. [ Links ]
Rowe, R., Sheskey, P., & Quinn, M. (Ed). (2009). Handbook of pharmaceutical excipients. 6 ed. Londres: Pharmaceutical Press. [ Links ]
Sadi, M., & Masoud, A. (2012). Effect of pH on stability, sunflower growth promotion and biocontrol potential of a talc-based formulation of Pseudomonas fluorescens UTPF61. Australian Journal of Crop Science, 6(3), 463-469. [ Links ]
Santos, A., García, M., Cotes, A., & Villamizar, L. (2012). Efecto de la formulación sobre la vida útil de bioplaguicidas a base de dos aislamientos colombianos de Trichoderma koningiopsis Th003 y Trichoderma asperellum Th034. Revista Iberoamericana de Micología, 29(3), 150-156. [ Links ]
Sastoque, E. (2010). Producción, caracterización y evaluación de la actividad biológica de biosurfactantes (Ramnolípidos) a partir rizobacterias de fique (Furcraea spp). Facultad de Ciencias. Pontificia Universidad Javeriana. Bogotá, Colombia. [ Links ]
Schouten A., van den Berg G., Edel-Hermann V., Steinberg C., Gautheron N., Alabouvette C., de Vos CH., Lemanceau P., Raaijmakers JM. (2004). Defense responses of Fusarium oxysporum to 2,4-diacetylphloroglucinol, a broad-spectrum antibiotic produced by Pseudomonas fluorescens. Mol Plant Microbe Interact. 17(11): 1201-1211. [ Links ]
Shi, C., Yan, P., Li, J., Wu, H., Li, Q., & Guan, S. (2014). Biocontrol of Fusarium graminearum growth and deoxynivalenol production in wheat kernels with bacterial antagonists. International Journal of Environmental Research and Public Health, 11 (1), 1094-1105. [ Links ]
Showkat, S., Murtaza, I., Laila, O., & Ali, A. (2012). Biological control of Fusarium oxysporum and Aspergillus sp. by Pseudomonas fluorescens isolated from wheat rhizosphere soil of Kashmir. Journal of Pharmacy and Biological Sciences, 1 (4), 24-32 [ Links ]
Siddiqui, I., & Shaukat, S. (2003). Suppression of root-knot disease by Pseudomonas fluorescens CHA0 in tomato: importance of bacterial secondary metabolite, 2,4-diacetylpholoroglucinol. Soil Biology & Biochemistry, 35(12), 1615-1623. [ Links ]
Silva, S., Farias, C., Rufino, R., Luna, J., & Sarubbo, L. (2010). Glycerol as substrate for the production of biosurfactant by Pseudomonas aeruginosa UCP0992. Colloids and Surfaces B: Biointerfaces, 79(1), 174-183. [ Links ]
Smith, A., Beltrán-Acosta, C., & Cotes, A. (2013). Rizobacterias con actividad biocontroladora de Olpidium virulentus, como posible vector del virus de la macana del fique (Furcraea spp.) En: Smith, A., Beltrán-Acosta, C., & Cotes, A. (Ed). (2013). Avances en el estudio del virus de la macana en el cultivo de fique (Furcraea spp.). Bogotá: Produmedios. [ Links ]
Stanghellini, M., & Miller, R. (1997). Biosurfactants: Their identity and potencial efficacy in the biological control of zoosporic plant pathogens. Phytopathology, 81(1), 1-12. [ Links ]
Tortora, G., Funke, B., & Case, C. (2007). Introducción a la microbiología. 9 ed. Buenos Aires: Editorial Médica Panamericana. [ Links ]
T-Stanes & Company Limited. (Sin fecha). Bio Cure-B. Recuperado de http://www.tstanes.com/products-bio-cure-b.html [ Links ]
Valencia, E., Villegas, J., Sánchez, J., Peña, J., & Farías, R. (2005). Inhibición de Fusarium oxysporum por cepas mutantes de Pseudomonas fluorescens ZUM80 incapaces de producir sideróforos. Terra Latinoamericana, 13(1), 81-88. [ Links ]
Vásquez, S., Suárez, M., & Montoya, O. (2009). Efecto del extracto crudo de bacteriocinas sobre las características microbiológicas y sensoriales de solomo redondo (Longissimus dorsi) empacado al vacío. VITAE, Revista de la Facultad de Química Farmacéutica, 16(2), 191-200. [ Links ]
Villamizar, L., Zeddam, J., Espinel, C., & Cotes, A. (2005). Implementación de técnicas de control de calidad para la producción de un bioplaguicida a base del granulovirus de Phthorimaea oper-culella PhopGV. Revista Colombiana de Entomología, 31 (2), 127-132. [ Links ]
Recibido: 18 de Noviembre de 2014; Aprobado: 20 de Octubre de 2015











 text in
text in 



