Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.17 no.2 Bogotá July/Dec. 2015 Epub Aug 12, 2021
https://doi.org/10.15446/rev.colomb.biote.v17n2.54293
Bionotas
Influencia de diferentes factores en el crecimiento de bacterias endófitas de caña de azúcar
* PhD, Profesora Titular, Departamento de Microbiología y Virología, Facultad de Biología, Universidad de La Habana, Cuba, Autor para correspondencia: marcia@fbio.uh.cu
** M.C., Departamento de Microbiología y Virología, Facultad de Biología, Universidad de La Habana, Cuba, anarodri@ulb.ac.be
*** Lic., Especialista, del Departamento de Microbiología y Virología, Facultad de Biología, Universidad de La Habana, Cuba. lester.glez@nauta.cu
**** PhD, Profesora Auxiliar Consultante, Departamento de Microbiología y Virología, Facultad de Biología, Universidad de La Habana, Cuba, mayra@fbio.uh.cu
En Cuba, entre los esfuerzos por lograr la sostenibilidad en la agricultura se han empleado biopreparados a gran escala, los cuales han tenido un gran impacto económico, ecológico y social. La caña de azúcar constituye uno de los principales cultivos agrícolas para nuestro país y tiene gran importancia desde los puntos de vista económico y ecológico a nivel mundial. En el presente trabajo se demostró el efecto de diferentes fuentes de carbono y nitrógeno en el crecimiento de 5 cepas endófitas de caña de azúcar, 3 de Gluconacetobacter diazotrophicus, una de Bacillus licheniformis y una de Enterobacter agglomerans. De igual forma, se estudió la influencia de jugos provenientes de cinco variedades, así como diferentes concentraciones de las fitohormonas ácido 3 indolacético (AIA) y ácido giberélico (GA) en el crecimiento. Se demostró que la asparagina y el sulfato de amonio como fuentes de nitrógeno adicionadas al medio LGI posibilitan un mayor crecimiento de las bacterias endófitas estudiadas. El medio LGI suplementado con jugo de caña de azúcar favorece significativamente (p<0,05) el crecimiento de los microorganismos endófitos y no existe relación directa entre el origen varietal del jugo y de las cepas. Por otra parte las fitohormonas en bajas concentraciones favorecieron el crecimiento, no ocurriendo así cuando se encuentran a elevadas concentraciones en el medio de cultivo. Es necesario estudiar todos los factores que pueden influir en la interacción entre la planta y los endófitos para poder utilizar sus potencialidades como promotores del crecimiento vegetal.
Palabras clave: PGPB; Saccharum sp. híbrido; jugo de caña
Among the efforts done in Cuba to the sustainability in the agricultural system, one of them is the use of bio-products, which have a relevant economic, ecological and social impact. The sugarcane is one of main crops in our country and it has a great importance at world level. In the present work is demonstrated the effect of different carbon and nitrogen sources in the growth of 5 entophytic bacteria (three of Gluconacetobacter diazo-trophicus, one of Bacillus licheniformis and one of Enterobacter agglomerans) were demonstrated. As the same form are studied the influence of juices from five varieties, as well as, different concentrations of fitohormones indole3acetic acid and giberelic acid on the growth. Was demonstrated that asparagine and ammonium sulfate as nitrogen sources added to LGI medium enhance the growth a major growth of the studied endophytic bacteria. The LGI medium supplied with juices of sugarcane enhance the growth of microorganisms (p≤0,05) and don't exist any relationships among the origin of the juice and the strains. On the other hand, the fitohormones at low concentrations don't affect the growth but at high levels of these hormones inhibit the growth. It's necessary to study the factors that have influence on the interaction between the plant and endophytes to use their potentialities as plant growth promoters.
Key words: PGPB; Saccharum sp. hybrid; juice of cane
Introducción
La caña de azúcar (Saccharum sp. híbrido) es una planta con altos contenidos de sacarosa, que actualmente representa una de las fuentes de azúcar más importante a nivel mundial, por lo que se cultiva en más de 50 países. El interés por mantener e incrementar la productividad de este cultivo, no solo se sustenta por su utilización en la alimentación humana, sino que también se utiliza en la alimentación animal (Correa et al., 2003; Martín et al., 2005), específicamente en Cuba, se trabaja en la diversificación de la industria azucarera, lo que confiere a este cultivo alto valor agregado.
La agrobiotecnología y la utilización de procesos naturales desempeñan un papel importante en la implementación de la agricultura sostenible, con este objetivo se estudian las Bacterias Promotoras del Crecimiento Vegetal (PGPB proveniente de las siglas en inglés plant growth promoting bacteria), en las que se incluyen tanto las bacterias que habitan en la rizosfera, como los rizobios y las bacterias endófitas, todos los cuales pueden beneficiar a los cultivos (Acemad y Kribet, 2014).
Velázquez et al. (2008) describieron la diversidad genética de la comunidad bacteriana endófita de la savia apoplástica del parénquima medular del tallo de la caña de azúcar cultivada en suelos cubanos. Los géneros Gluconacetobacter, Bacillus y Enterobacter se aislaron a partir de este cultivo, encontrándose los dos primeros entre los más abundantes dentro de la comunidad bacteriana.
El estudio del efecto de diferentes fuentes de carbono y nitrógeno, relacionadas con el medio natural, así como otros componentes del mismo permitirá explicar el comportamiento de los microorganismos endófitos en su hábitat natural, lo que contribuirá a conocer con mayor profundidad la interacción planta-bacteria y a sustentar su utilización en la biotecnología agrícola. Además, este estudio sienta las bases para la formulación de medios de cultivo eficientes basados en fuentes naturales, para el crecimiento de los endófitos.
El presente trabajo tiene como objetivos demostrar el efecto de diferentes fuentes de carbono y nitrógeno en el crecimiento de cinco cepas endófitas de caña de azúcar. De igual forma, se estudió la influencia de jugos provenientes de cinco variedades, así como diferentes concentraciones de las fitohormonas ácido 3 indolacético (AIA) y ácido giberélico (GA) en el crecimiento de estas bacterias.
Materiales y métodos
Cepas empleadas
Se emplearon las siguientes cepas bacterianas: Gluconacetobacter diazotrophicus cepa PAl5 (ATCC 49037) aislada a partir de raíces de caña de azúcar en Brasil (Cavalcante y Dobereiner, 1988), G. diazotrophicus cepas 1-05 y 4-02 aisladas de tallos de los cultivares de caña de azúcar Jaronú 60-5 y Media Luna 318, respectivamente (Rojas, 2005), Bacillus licheniformis aislada de tallos de la variedad de caña de azúcar Cuba 323-68 (Rojas et al., 2001) y Enterobacter agglomerans aislada de tallos de la variedad de caña de azúcar Media Luna 318 (Rojas et al., 2001).
Influencia de la fuente de carbono y nitrógeno en el crecimiento
Las cepas se cultivaron en medio LGI líquido (en g L-1 K2HPO4 0,2; KH2PO4 0,6; MgSO4 7H2O 0,2; CACL2 2H2O 0,02; NaMoO4 2H2O 0,02; FeCL3 6H2O 0,01; Bromotimol azul (solución al 0.05% en KOH 0,2N) 5 mL) con 10g L-1 de sacarosa como fuente de carbono (Cavalcante y Dobereiner, 1988) durante 48 horas, a 30 °C y a 150 rpm, y los inóculos se ajustaron a 108 UFC.mL-1, según la escala de Mc Farland (NCCLS, 2005) con solución salina al 0.8 % (NaCl 0,8 g en 100 mL de H2O). Se preparó medio LGI semisólido (2 g.L-1 de agar) con las siguientes fuentes de carbono en una concentración final del 1 %: xilosa, sacarosa, inositol, glucosa, fructosa, jugo de caña de azúcar.
Por otra parte, se prepararon medios de cultivo con sacarosa al 1% como fuente de carbono y las siguientes fuentes de nitrógeno en una concentración final de 5 mM: sulfato de amonio, nitrato de potasio, asparagina, triptófano, treonina, arginina y un control sin la adición de nitrógeno.
Se sembraron 100 μL de cada inóculo en 5 mL de medio y se incubaron por 72 horas a 30 °C. Se midió la absorbancia a 600 nm. Todas las determinaciones se realizaron por triplicado.
Influencia de jugos de diferentes variedades de caña de azúcar sobre el crecimiento
Se preparó un inóculo similar al descrito en el epígrafe anterior e igualmente se ajustó a 108 UFC. mL-1. De esta preparación se tomaron 100 |jL para inocular tubos de cultivo que contenían 5 mL de medio LGI líquido y jugo de caña de diferentes cultivares de caña de azúcar para una concentración final de 20 y 30 %, así como un control con azúcar comercial como fuente de carbono. Se utilizaron jugo de caña de cinco cultivares diferentes. Se incubaron las muestras a 150 rpm, 30 °C y se midió la absorbancia a 600 nm a las 24, 48 y 72 horas. Todas las determinaciones se realizaron por triplicado.
Influencia del ácido indolacético y el ácido giberélico en el crecimiento
Se procedió de forma similar a lo descrito en el epígrafe anterior, utilizando medio SYP: (en g L-1 sacarosa 10, extracto de levadura 3, K2HPO4 1, KH2PO4 3, pH=6,2) (Caballero-Mellado y Martínez-Romero, 1994) líquido con diferentes concentraciones finales de ácido 3 indolacético (AIA) y ácido giberélico (GA) de 0,025, 0,25 y 2,5 mg.L-1 y como control el medio sin hormonas. Se incubaron las muestras a 150 rpm, 30 °C y se midió la absorbancia a 600 nm a las 24, 48 y 72 horas. Todas las determinaciones se realizaron por triplicado.
Análisis biométricos
Los resultados de los estudios fisiológicos descritos se analizaron utilizando el paquete estadístico Tonystat (9). Se emplearon pruebas paramétricas y no paramétricas: análisis de varianza, prueba de Kruskal-Wallis, prueba de comparación de medias de Duncan y prueba de comparaciones múltiples no paramétricas.
Resultados y discusión
Inluencia de la fuente de carbono y nitrógeno en el crecimiento
En las cepas estudiadas se pueden observar diferencias significativas en el crecimiento entre los medios con diferentes fuentes de nitrógeno (tabla 1). Para las cepas de G. diazotrophicus se destacan los medios con sulfato de amonio y asparagina como fuentes de nitrógeno. Para B. licheniformis los medios con sulfato de amonio, nitrato de potasio, asparagina y arginina muestran los mayores valores de crecimiento. Se repiten las dos últimas fuentes de nitrógeno para E. agglomerans.
Tabla 1 Crecimiento de cepas de endófitos de caña de azúcar en medio LGI con diferentes fuentes de nitrógeno medida en cultivos de 5 mL a través de la absorbancia a 600 nm.
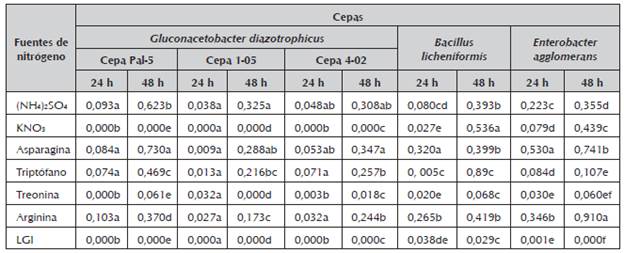
Las letras no comunes indican diferencias significativas (p≤0,05) para la Prueba de comparación de medias de Duncan. Media de 3 repeticiones.
Stephan et al. (1991) probaron la acción de varios aminoácidos sobre la actividad nitrogenasa de G. diazotrophicus,Rodríguez et al. (2005) demostraron que con treonina, triptófano, arginina y asparagina como fuentes de nitrógeno, se evidencia inhibición parcial de esta actividad, quizás consecuencia de mecanismos similares de desactivación de la fijación biológica del nitrógeno, posiblemente no tan eficientes, lo que concuerda con los resultados obtenidos en este trabajo en la inhibición del crecimiento.
Esta bacteria ha mostrado su efecto promotor del crecimiento en diferentes cultivos de importancia económica como malanga, yuca y papaya, estudios que se han realizado a nivel de campo y han permitido demostrar su efecto en el incremento de los rendimientos y calidad de los frutos o tubérculos (Dibut et al., 2009).
A las 24 horas de incubación en medios con diferentes fuentes de carbono, no existen diferencias significativas en el crecimiento de las cepas de G. diazotrophicus (tabla 2). Sin embargo, para B. licheniformis y E. agglomerans, se aprecian diferencias en el crecimiento desde las 24 horas, esto era de esperar ya que estas bacterias tienen una tasa de crecimiento mayor que G. diazotrophicus.
Tabla 2 Crecimiento de endófitos de caña de azúcar en medio LGI con diferentes fuentes de carbono medida en cultivos de 5 mL a través de la absorbancia a 600 nm.
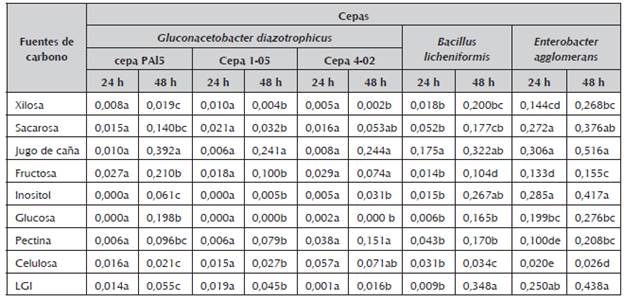
Media de 3 repeticiones. Las letras no comunes indican diferencias significativas (p≤0,05) para la prueba de comparación de medias de Duncan.
Los resultados obtenidos con las cepas de G. diazotrophicus concuerdan con los presentados por Ureta et al. (1995). Estos autores observaron que existen diferencias entre cepas de la misma especie en cuanto a la utilización de fuentes de carbono. En este trabajo se observan diferencias en el crecimiento en los medios con xilosa, fructosa, inositol, glucosa y pectina. Rojas et al. (2012) al identificar 46 aislados de esta especie a partir de varios cultivares de caña de azúcar, demostraron que hay cepas que no crecen en medio con glicerol, manitol, xilosa e inositol como fuentes de carbono, lo que se corresponde con nuestros resultados. En este trabajo se demuestra que existen comportamientos diferentes en el crecimiento para las cepas estudiadas si se analiza cuantitativamente, aún cuando las cepas crezcan en los medios analizados, lo que resulta importante para la futura utilización agrobiotecnológica de estas bacterias. Según han demostrado Dibut et al. (2011) se obtienen mejores resultados al asperjar el cultivo de G. diazotrophicus a las hojas y el suelo, por lo que la utilización de una amplia gama de fuentes de carbono podría sustentar la sobrevivencia de la bacteria.
Lery et al. (2008) mediante estudios de proteómica, identificaron numerosas proteínas involucradas en el metabolismo de aminoácidos, carbohidratos, y otras, en la cepa Pal5, lo que sustenta la utilización de los compuestos analizados en el presente trabajo, incluso Luna y Boiardi (2007) demostraron que la utilización de la glucosa depende del pH del medio.
Por otra parte, Galisa et al. (2012) empleando RT-qPCR demostraron la expresión diferenciada de genes de mantenimiento y otros relacionados con a biosíntesis y el catabolismo, en medio LGI suplementado con diferentes fuentes de carbono, lo que corrobora las diferencias en el crecimiento encontradas en este trabajo.
A las 48 horas de crecimiento para G. diazotrophicus y desde las 24 horas para B. licheniformis y E. agglomerans se aprecia la diferencia existente entre el medio que tiene jugo de caña como fuente de carbono y las otras fuentes de carbono utilizadas. El elevado crecimiento en medio LGI con jugo de caña pudiera deberse a la presencia de vitaminas, proteínas y otros compuestos que favorezcan el crecimiento de los microorganismos. Teniendo en cuenta los resultados obtenidos en el medio LGI con jugo de caña y que existen diferencias en la composición del jugo de los cultivares de caña, se decidió comprobar si la procedencia varietal del jugo ejerce influencia sobre el crecimiento de estas especies por la importancia que esto podría representar al formular un medio de cultivo para la aplicación biotecnológica de estas bacterias en la agricultura.
Influencia de jugos de diferentes cultivares de caña de azúcar sobre el crecimiento
A las 24 y 48 horas de cultivo en el medio LGI suplementado con jugo de caña de diferentes variedades a concentraciones de 20 y 30%, no hay diferencias en el crecimiento de las cepas analizadas.
A las 72 h, en el caso de la cepa 4-02 de G. diazotrophicus el crecimiento es significativamente mayor en el medio sin jugo utilizando azúcar comercial al 20 y al 30% (figura 1), lo cual pudiera sugerir que los compuestos presentes en el jugo de la caña de azúcar a determinadas concentraciones estimulan el crecimiento microbiano, pero a partir de una concentración determinada se pudieran producir sustancias que resultan tóxicas e inhiben el crecimiento de algunas cepas.
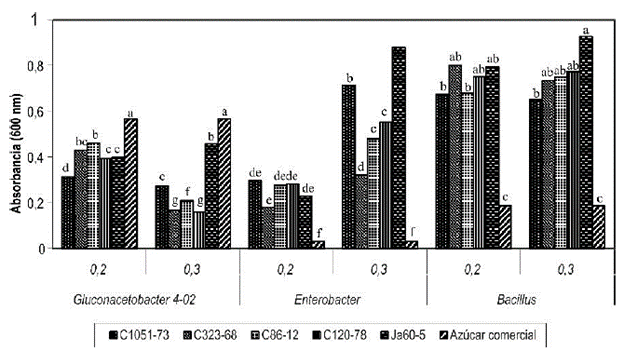
Figura 1 Crecimiento de cepas endófitas de caña de azúcar, en jugos de diferentes cultivares (C1051-73, C323-68, C86-12 y Ja605) añadidos al 20 y 30% al medio LGI, a las 72 horas de cultivo agitado a 150 rpm a 300C. Letras diferentes indican diferencias significativas dentro de una misma cepa bacteriana para la prueba de comparación de medias de Duncan (p≤0,05).
Enterobacter agglomerans y B. subtilis a las 72 horas de crecimiento en todos los medios con jugo, superaron en crecimiento al medio LGI con azúcar comercial. En este caso se pudiera pensar en que el jugo de caña ejerce una influencia positiva sobre el crecimiento de las bacterias ya que el jugo de caña contiene cantidades de glucosa y fructosa (0.2-0.6%), nitrógeno orgánico (0.020.04%) y vitaminas (Reis et al., 1994). Además, el pobre crecimiento de estos microorganismos en el medio con azúcar comercial, comparado con el crecimiento en el jugo de caña, pudiera indicar la presencia de residuos de la industria de la caña de azúcar que perjudiquen el crecimiento de las bacterias.
Es notable la diferencia del crecimiento en los medios con jugo de los cultivares C1051-73 y Ja605 al 30% para la cepa de E. agglomerans, las cuales tienen en común el indicador de sólidos solubles (Brix) y el Porcentaje de Pol (Pol: que está constituido fundamentalmente por sacarosa) (Naranjo, S.).
La presencia de grandes cantidades de iones como el K+ y ácidos orgánicos (Wealbun et al., 1990) entre los sólidos solubles pudieran estimular el crecimiento de E. agglomerans, pero es más lógico pensar que influya el porcentaje de Pol, donde fundamentalmente se tiene en cuenta el porcentaje de sacarosa pero también puede estar presentes carbohidratos de mediano peso molecular, que son sustancias ópticamente activas y se ha demostrado que desvían el plano de luz polarizada y pueden influir en las mediciones de sacarosa por polarimetría (De Armas et al., 1999). A su vez, estos carbohidratos pueden ser utilizados por el microorganismo porque son polímeros de fructosa y galactitol (Legaz et al., 1992). Resulta válido aclarar que no se han encontrado en la literatura trabajos que comparen el crecimiento de bacterias en diferentes jugos de caña de azúcar y estos estudios podrían sentar las bases para la formulación de medios de cultivo con fuentes económicas para la aplicación agrobiotecnológica de las bacterias promotoras del crecimiento vegetal.
Influencia del ácido indolacético y el ácido giberélico en el crecimiento
Son muy pocos los estudios realizados donde se analice la interrelación endófito-planta respecto a la influencia de las fitohormonas en la fisiología de las bacterias.
Para E. agglomerans se observa que las concentraciones de 0,025 y 0,25 mg.L1 de ambas fitohormonas estimulan el crecimiento comparando con el medio SYP sin hormonas a las 72 horas (figura 2). Esto permite inferir que a estas concentraciones de AIA y GA se produce una inducción del crecimiento igual que ocurre con Azospirillum brasilense en presencia de AIA, lo cual se explica por una regulación estimuladora de los genes que codifican para le enzima indol-3 piruvato descarboxilasa, que está involucrada en la vía de síntesis de AIA por el microorganismo (Vande Broek et al., 1999).
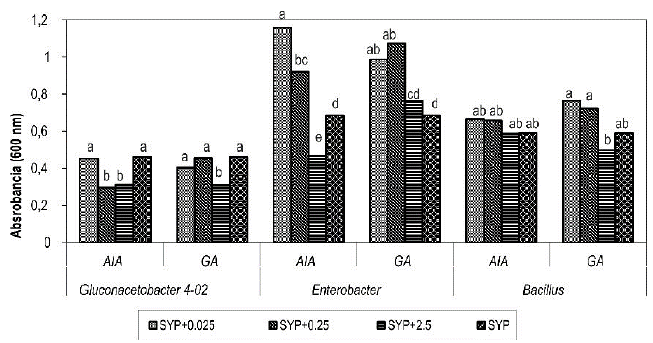
Figura 2 Influencia del ácido indolacético (AIA) y el ácido giberélico (GA) en el crecimiento de endófitos de caña de azúcar a las 72 horas de cultivo en medio SYP suplementado con diferentes concentraciones de hormonas (mg.L-1). Letras diferentes indican diferencias significativas dentro de una misma cepa bacteriana para la prueba de comparación de medias de Duncan (p≤0,05).
Por otra parte, el AIA en la planta estimula la síntesis de proteínas debido a que estabiliza el ARN mensajero, lo cual incrementa la tasa de transcripción y el GA3 potencia la presencia de polirribosomas y aumenta el número de ribosomas por célula (De Armas et al., 1988) y pudiera ejercer una acción similar sobre la célula microbiana.
Conclusiones
Se puede plantear que la utilización de asparagina y sulfato de amonio como fuentes de nitrógeno adicionadas al medio LGI posibilitan un mayor crecimiento de las bacterias endófitas en caña de azúcar.
El medio LGI suplementado con jugo de caña de azúcar favorece significativamente el crecimiento de los microorganismos endófitos y no existe relación directa entre el origen varietal del jugo y el crecimiento de las bacterias, por lo que se podría utilizar en un medio de cultivos para la producción biotecnológica de los endófitos.
El estudio de la ecología de la interacción entre los endófitos y las plantas es de gran importancia, y más específicamente las relaciones de los componentes de la planta, ya sean el jugo o las fitohormonas, pueden resultar sumamente interesantes y abre las puertas para analizar en trabajos futuros la interacción planta-endófito "in vivo".
References
Acemad, M., Kibret, M. (2014). Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective. Journal of King Saud University - Science. 26, 1-20. [ Links ]
Caballero-Mellado, J., Martínez-Romero, E. (1994). Limited genetic diversity in the endophytic sugarcane bacterium Acetobacter diazotrophicus. Applied and Environmental Microbiology. 60(5), 1532-1537. [ Links ]
Cavalcante, V. A., Dobereiner, J. (1998). A new acid tolerant nitrogen-fixing bacterium associated with sugar cane. Plant and Soil. 108(1), 23-31. [ Links ]
Sidnei Correa, C.E., Neves Pereira, M., Gisele de Oliveira, S.; Hentz Ramos, M. (2003). Performance of Holteins cows fed sugarcane or corn silages of different grain textures. Scienta Agricola. 60(4), 621-629. [ Links ]
De Armas, R., E. Ortega y R. Rodés. (1988). Metabolismo del nitrógeno en las plantas. En: Fisiología Vegetal, ed. Pueblo y Educación, pp.118-128. [ Links ]
De Armas, R., E. Ortega, R. Rodés, G. Galvez. (1999). La fisiología vegetal y su contribución al mejoramiento de la caña de azúcar. En: Biodiversidad y biotecnología de la caña de azúcar. A. Arencibia y M. T. Cornide (eds.), pp. 63-77. [ Links ]
Dibut, B., Martínez-Viera, R., Ortega, M., Ríos, Y., Tejeda, G., Planas, L. y Rodríguez, J. (2009). Situación actual y perspectiva de las relaciones endófitas planta-bacteria. Estudio de caso Gluconacetobacter diazotrophicus-cultivos de importancia económica. Cultivos Tropicales, 30(4), 16-23. [ Links ]
Dibut, B., Ríos Rocafull, Y. y Ortega García, M. (2011). Estudio de la asociación Gluconacetobacter diazotrophicus - viandas tropicales establecidas sobre suelo ferralítico rojo. II. Determinación del método de inoculación más eficiente para la incorporación de G. diazotrophicus en los cultivos de boniato, yuca y malanga. Cultivos Tropicales, 32 (4), 20-26. [ Links ]
Galisa, P. S., da Silva, H. A. P., Macedo, A. V. M., Reis, V. M., Vidal, M. S., Baldani, J. I. and Simóes-Araújo, J. L. (2012). Identification and validation of reference genes to study the gene expression in Gluconacetobacter diazotrophicus grown in different carbon sources using RT-qPCR. Journal of Microbiological Methods, 91, 1-7. [ Links ]
Luna, M. F. and Boiardi, J. L. (2007). Growth yields and glucose metabolism of N2-fixing Gluconacetobacter diazotrophicus at different culture pH values. World Journal Microbiology and Biotechnology, 24, 587-590. [ Links ]
Legaz, M. E., de Armas, R., Medina, I., Caffaro, C. V., Martínez, M., Mateo, M. (1992). An Approach to the chemical structure of sugarcane mid.molecular weight heterofructans. Plant Physiology, 11, 131-140. [ Links ]
Martín, P. C. (2005). El uso de la caña de azúcar para la producción de carne y leche. Revista Cubana de Ciencia Agrícola, 39, 427-439. [ Links ]
NCCLS. Natural Committee for Clinical laboratory standards. (2005). Performance standards for antimicrobial Disk. Susceptibility Test. Approved standard. p. 238. [ Links ]
Lery, L. M. S., Coelho, A., von Kruger, W. M. A., Goncalve, M. S. M., Santos, M. F., Valente, R. H., Santos, E. O., Rocha, S. L. G., Perales, J., Domont, G. B., Teixeira, K. R. S. and Bisch, P. M. (2008). Protein expression profile of Gluconacetobacter diazotrophicus PAL5, a sugarcane endophytic plant growth-promoting bacterium. Proteomics, 8, 1631-1644. [ Links ]
Reis, V. M., Olivares, F. L., Dobereiner, J. (1994). Improved methodology for isolation of Acetobacter diazotrophicus and confirmation of its endophytic habitat. World Journal of Microbioogy and Biotechnology, 10, 401-405. [ Links ]
Rodríguez, A. J., Trujillo, I. D., Felipe, Y., Rojas, M. M., Manzano, J., y Heydrich, M. (2005). Caracterización fisiológica de la comunidad microbiana endófita de la caña de azúcar. Revista Colombiana de Biotecnología, 7(1), 66-75. [ Links ]
Rojas, M. M. (2005). Caracterización de Gluconacetobacter diazotrophicus aislado de variedades caña de azúcar (Saccharum sp.) cultivadas en Cuba. Tesis presentada en opción al grado científico de Doctor en Ciencias Biológicas. Facultad de Biología, Universidad de la Habana, p. 99. [ Links ]
Rojas, M., Manzano, J., Heydrich, M. (2012). Aislamiento e identificación de Gluconacetobacter diazotrophicus a partir de variedades de caña de azúcar cultivadas en Cuba. Revista Cubana de Ciencias Biológicas, 1(1), 1-5. [ Links ]
Rojas, M. M., Manzano, J., Prieto A. y Heydrich M. (2001). Interrelaciones en la comunidad microbiana endófita de la caña de azúcar. En: Contribución a la Educación y la Protección Ambiental. VII Taller ISCTN, vol. 2, Soporte Magnético. [ Links ]
Sigarroa, A. Biometría y Diseño Experimental. (1985). La Habana. Pueblo y Educación, 734 pp. [ Links ]
Stephan, M. P., Oliveira, M., Texeira, S., Martínez-Drets, G., Dobereiner, J. (1991). Physiology and dinitrogen fixation of Acetobacter diazotrophicus. FEMS Microbiology Letters, 77, 67-72. [ Links ]
Ureta, A., Álvarez, B., Ramón, A., Vera, M. A., Martínez-Drets, G. (1995). Identification of Acetobacter diazotrophicus, Herbaspirillum seropedicae and Herbaspirillum rubrisubalbicans using biochemical and genetical criteria. Plant and Soil, 172, 271-277. [ Links ]
Vande Broek, A., Lambretch, Eggemont, E., Vanderleyden, J. (1999). Auxins uprefgulated expresión of the indole -3- pyruvate de-carboxilase gene in Azospirillum brasilense. Journal of Bacteriology, 181(4), 1338-1342. [ Links ]
Velázquez E., Rojas M., Lorite M. J., Rivas R., Zurdo-Piñeiro J. L., Heydrich M., Bedmar E. J. (2008). Genetic diversity of endophytic bacteria which could be find in the apoplastic sap of the medullary parenchym of the stem of healthy sugarcane plants. Journal of Basic Microbiology, 48(2), 118-124. [ Links ]
Wealbum, G. E. y F. C. Meinzer. (1990). Compartmentation of solutes and water in developing sugarcane stalk tissue. Plant Physiology, 93, 1147-1153. [ Links ]
Recibido: 18 de Diciembre de 2014; Aprobado: 23 de Septiembre de 2015











 text in
text in 


