Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Biotecnología
versão impressa ISSN 0123-3475
Rev. colomb. biotecnol vol.18 no.1 Bogotá jan./jun. 2016
https://doi.org/10.15446/rev.colomb.biote.v18n1.57717
DOI: http://dx.doi.org/10.15446/rev.colomb.biote.v18n1.57717
ARTÍCULO DE INVESTIGACIÓN
Desempeño del crecimiento y sobrevivencia de larvas de Oreochromis ssp. utilizando un probiótico en el alimento
Growth performance and survival of Oreochromis ssp. larvae using a probiotic in the feed
Lara Mantilla C.H*, J. Vellojín Furnieles**, D. García Peréz***, V. Pertúz Buelvas****
* (q.e.p.d) Ph.D., Grupo de investigación de Biotecnología (GRUBIODEQ). Departamento de Química. Universidad de Córdoba. Córdoba. Colombia. E-mail: lara_mantilla_cecilia@hotmail.com
** Profesional en Acuicultura. Grupo de investigación de Biotecnología (GRUBIODEQ). Programa de Acuicultura. Universidad de Córdoba. Córdoba. Colombia. E-mail: jurleyvellojin14@hotmail.com
*** Profesional en Acuicultura. Grupo de investigación de Biotecnología (GRUBIODEQ). Programa de Acuicultura. Universidad de Córdoba. Córdoba. Colombia. E-mail: dianagarcia2709@hotmail.com
**** MSc. Centro de Investigación Piscícola (CINPIC). Programa de Acuicultura. Universidad de Córdoba. Córdoba. Colombia. E-mail: vipertuz@hotmail.com
Recibido: diciembre 15 de 2015 Aprobado: mayo 16 de 2016
Resumen
Se evaluó la eficiencia de un bio-preparado con características probióticas como promotor del crecimiento y sobrevivencia de la tilapia roja Oreochromis ssp. durante la inversión sexual. A través de cuatro tratamientos, bajo un diseño completamente aleatorizado, fueron sembradas cuatro larvas L-1 en acuarios de 20 L, a las cuales se les suministró, durante 45 días, alimento comercial hormonado de 45% de PB, más la adición del bio-preparado compuesto por caldo extracto de malta y una levadura del género Saccharomyces en concentraciones de: 104 (T1), 106 (T2), 108 UFC ml-1 (T3) y un control (T4) sin la adición del bio-preparado. Al inicio y al final del experimento se pesaron (mg), midieron (cm) y contaron las larvas. Los parámetros físicos y químicos monitoreados del agua, se mantuvieron dentro de rangos considerados normales para la piscicultura de la especie. Los mayores valores para las variables de crecimiento de las larvas se registraron en el T2 y T3; Peso final (Pf) (305.9±113.2 y 326.1 ±79.5mg), Ganancia en peso (Gp) (299.2±113.2 y 319.4±79.5mg) Longitud final (Lf) (2.5±0.3 y 2.5±0.2cm), Ganancia en longitud (Gl) (1.7±0.3 y 1.7±0.2cm) y Tasa especifica de crecimiento (G) (12.5±0.7 y 12,7±0.5%/día), así mismo, los mayores valores de sobrevivencia (S) de las larvas se registraron en el T3 (68.1±6.8%) y T2 (59.4±20.2%). Por tanto los mejores resultados se presentaron en larvas de T2 y T3, a los cuáles se les suministró el bio-preparado, demostrando que las larvas de tilapia roja presentan mejor crecimiento y sobrevivencia con la implementación de un bio-preparado probiótico.
Palabras clave: cíclidos, probiótico, omnívoro, Saccharomyces sp.
Abstract
The efficiency of a bio-prepared with probiotic characteristics was evaluated for promoting growth and survival of red tilapia Oreochromis ssp during sexual inversion. Through four treatments, under a completely randomized design were seeded four larvae L-1 in aquariums of 20 L, to which they were delivered, for 45 days, with Hormone commercial food of 45% CP, plus the addition of bio -prepared composed for malt extract broth and a yeast of the genus Saccharomyces in concentrations: 104 (T1), 106 (T2), 108 CFU ml-1 (T3) and (T4) control without the addition of bio-prepared. At the beginning and end of the experiment the larvae were weighed (mg), measured (cm) and counted. The physical and chemical parameters monitored water remained within ranges considered normal for fish species. The highest values for the variables of larval growth were recorded in the T2 and T3; Final weight (Pf) (305.9 ± 113.2 and 326.1 ± 79.5mg), weight gain (Gp) (299.2 ± 113.2 and 319.4 ± 79.5mg) Final Length (Lf) (2.5 ± 0.3 and 2.5 ± 0.2cm), Gain length (Gl) (1.7 ± 0.3 and 1.7 ± 0.2cm) and specific growth rate (G) (12.5 ± 0.7 and 12.7 ± 0.5% / day), likewise, the highest values of survival (S) of the larvae were recorded in T3 (68.1 ± 6.8%) and T2 (59.4 ± 20.2%). Therefore the best results were presented in larvae of T2 and T3, to which were given the bio-prepared, showing that the larvae of red tilapia have better growth and survival with the implementation of a bio-prepared probiotic.
Key words: cichlid, probiotic, omnivore, Saccharomyces sp.
Introducción
Las tilapias son consideradas actualmente las especies de mayor importancia en los sistemas industriales de producción en el mundo, por sus características favorables de adaptación a un amplio rango de condiciones ambientales, habilidad para crecer en cautiverio con sistemas de alimentación artificiales, fácil reproducción, resistencia a enfermedades, tolerancia y desarrollo en condiciones de altas densidades (Agilar, 2010). Son clasificadas como omnívoro, por consumir diversidad de alimentos naturales, basados en algas y otros organismos acuáticos microscópico ricos en proteínas, minerales, lípidos y vitaminas necesarios para su desarrollo (Sauceda et al., 2009).
En los últimos años se han realizado investigaciones orientadas a mejorar la producción de las tilapias, en aspectos relacionados con inversión sexual, nutrición, sanidad y genética (Torres et al., 2010), esto ha permitido mejorar los rendimientos en sistemas de producción intensivos (DANE, 2014), sin embargo el manejo de altas densidades de siembra desequilibran y alteran la capacidad de resistencia y adaptación fisiológica de los organismos, provocando estados de estrés aprovechados por patógenos oportunistas, desencadenando enfermedades que ocasionan perdida económicas (Jiménez, 2010).
Esto es más evidente durante la inversión sexual, cuando las larvas de tilapia son más susceptibles a estos problemas, considerando que su flora intestinal es un ecosistema muy complejo que se encuentra en constante cambio desde el inicio de la alimentación exógena, cuando las especies empiezan a filtrar diversas partículas que se van adhiriendo al organismo formando una película protectora. La colonización de flora intestinal es un proceso gradual que está influenciado por la presencia de diferentes enzimas digestivas y por la dieta ingerida, sufriendo varias colonizaciones antes del establecimiento de una población "madura" capaz de proteger al hospedero de las agresiones de patógenos. Por lo tanto el control de la alimentación de las larvas empleando probióticos puede mejorar los procesos de digestión, inmunidad y resistencia a enfermedades (Monroy et al., 2012).
Los probióticos son microorganismos vivos que cuando se administra en cantidades adecuadas, confieren un beneficio al hospedero, modifican la comunidad microbiana relacionada con él o con el ambiente donde éste se desarrolla, a través del mejor uso del alimento, aprovechando su valor nutricional, incrementando la respuesta inmune a las enfermedades y mejorado la calidad del ambiente. (Kesacordi-Watson et al., 2008). Los probióticos en acuicultura son de gran importancia por que modifican y mejoran la microbiota intestinal, son fuente de energía y nutrientes, compiten con bacterias causante de enfermedades por sitio de adhesión y además, inhiben la presencia de microorganismos patógenos estimulando la respuesta inmune del sistémica local, celular y humoral, aumentando la resistencia a infecciones de lactococosis, streptococosis, vibriosis y furunculosis y aportando moléculas de importancia fisiológica para el hospedero, lo que permite obtener un mejor crecimiento, maduración del sistema digestivo, supervivencia y calidad larvaria (Tovar et al., 2008).
Las levaduras del género Saccharomyces son utilizadas como alimento suplementario para varios tipos de animales; contiene varios compuestos inmuno-estimulantes tales como β-glucanos, ácidos nucleicos, oligosacáridos mananos y otros compuestos celulares, convirtiéndolo en un género con características probióticas que mejoran las condiciones de cultivo, disminuyendo la presencia de agentes patógenos en los sistemas de producción, reduciendo la tasa de mortalidad, y estimulando la digestión y absorción de nutrientes (Hoseinifar et al., 2011). El objetivo de estudio fue evaluar la eficiencia de un bio-preparado con características probióticas como promotor del crecimiento y sobrevivencia de la tilapia roja Oreochromis ssp. durante la inversión sexual.
Materiales y métodos
Localización. La investigación se realizó en el laboratorio de Biotecnología, GRUBIODEQ y en el Centro de Investigación Piscícola CINPIC, (Universidad de Córdoba), ubicados en el municipio de Montería, departamento de Córdoba, Colombia.
Elaboración del bio-preparado. Se utilizócaldo extracto de malta yuna levadura nativa del género Saccharomyces con características probióticas. Esta fue aislada de novillos de raza criolla Romosinuano del hato de Corpoica Turipana - Córdoba, Colombia y pertenece al banco de cepas del Laboratorio GRUBIODEQ. La levadura fue multiplicada a pequeña escala hasta obtener concentraciones de 104, 106 y 108 UFC ml-1 teniendo en cuenta las condiciones de crecimiento, pH, temperatura y oxígeno.
Material biológico. En el Centro de Investigación Piscícola CINPIC, fueron instalados 16 acuarios de 20 L equipados con sistemas de aireación (aireadores y piedras difusoras) y filtros de esquina en los cuales se sembraron 4 larvas L-1 de tilapia roja recién eclosionadas con peso de 6.7± 0.9 mg y longitud de 0.7±0.1 cm (media±STD), las cuales fueron alimentadas (por inmersión) seis veces al día durante 45 días de ensayo.
Diseño experimental. Se evaluaron tres tratamientos con cuatro replicas, utilizando alimento comercial hormonado de 45% de proteína bruta (PB) con adición del bio-preparado nativo con características probióticas a diferentes concentraciones; tratamiento 1 (T1), 104 UFC mL-1, tratamiento 2 (T2), 106 UFC mL-1 y tratamiento 3 (T3), 108 UFC mL-1, además se evaluó un tratamiento control (T4) con el mismo alimento sin adición del bio-preparado.
Procedimiento de recopilación de datos
Variables de crecimiento. Se realizaron dos muestreos, al inicio y al final del ensayo, tomando el 25% de la población de cada unidad experimental. Las larvas fueron contadas y pesadas (mg) en una balanza analítica Adventure OHAUS®, medidas con la ayuda de un ictiómetro al milímetro más cercano. Con los valores promedio de peso y longitud se calculó; peso final (Pf), ganancia en peso (Gp), longitud final (Lf), ganancia en longitud (Gl) y tasa especifica de crecimiento (G %/día).
Sobrevivencia y prueba de resistencia al estrés. Al inicio y al final del ensayo las larvas fueron contadas para estimar la sobrevivencia (S). Para la prueba de resistencia al estrés, se tomaron 10 larvas por unidad experimental, se colocaron en papel absorbente por cuatro minutos y luego se devolvieron al agua, cinco minutos después fueron contadas para establecer la sobrevivencia.
Parámetros físico-químicos. La calidad del agua fue monitoreada, tomando registros diarios, de oxígeno disuelto, pH y temperatura, con ayuda de un Oxímetro YSI® 550A y un pHmetro YSI® Ph100. Mientras que semanalmente se midió amonio no ionizado (NH3), con ayuda de un espectrofotómetro Espectronic®, Genesys 5.
Análisis estadístico
Se utilizó un diseño completamente al azar, todos las variables analizadas fueron expresadas como media ± desviación estándar (Peso final, ganancia en peso, longitud total, ganancia en longitud, tasa de crecimiento específico, sobrevivencia y prueba de resistencia al estrés), se sometieron a pruebas de normalidad (test de Shapiro-Wilk) y homogeneidad de varianza (test de Bartlett), a las variables que cumplieron estos supuestos se les aplicó ANOVA a una vía y prueba de rangos Múltiple para expresar diferencias estadísticas, en todos los casos p<0.05 fue utilizando como criterio estadístico para establecer las diferencia significativa. Los datos fueron analizados con el programa Statgraphic plus for Windows (Statical Graphics Corp, 1996).
Resultados y discusión
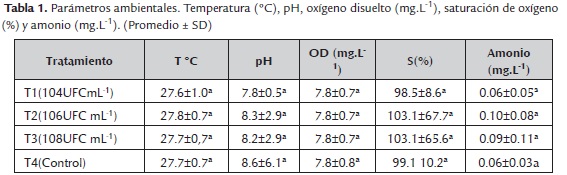
La temperatura promedio del agua del presente estudio (28 a 32 °C) se encontró ligeramente por debajo del rango reportado como adecuado para el cultivo de tilapia (Keller, 2007). Igualmente los valores de pH registrados (6.0 a 9.0) correspondieron al rango óptimo para el cultivo de la especie; considerando que valores por debajo de 4.5 y por encima de 10.5 afectan significativamente la sobrevivencia (González et al., 2010). Según Bautista & Ruiz, (2011) para cultivos de tilapia roja el oxígeno disuelto debe ser mayor de 5 mg L-1, esto sugiere que los registros obtenidos en el presente estudio (7.8 mg L-1) no incidieron en el desempeño del cultivo. Los valores promedio de amonio no ionizado (NH3) para cada tratamiento no sobre pasaron la concentración de 0.2 mg L-1, y no presentaron riesgo para los organismos según lo indicado por González et al. (2010), (tabla 1).
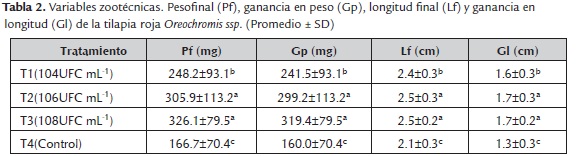
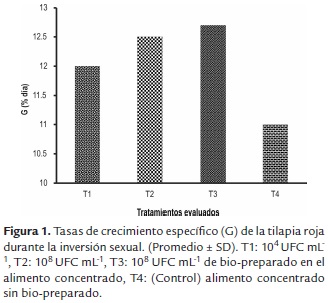
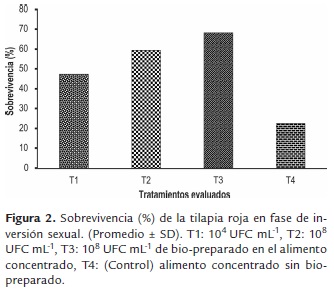
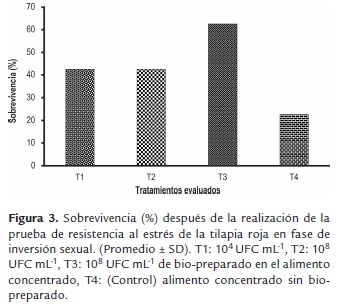
Los mayores valores para las variables de crecimiento: Pf (305.9±113.2 y 326.1 ±79.5mg), Gp (299.2±113.2 y 319.4±79.5mg) Lf (2.5±0.3 y 2.5±0.2cm), Gl (1.7±0.3 y 1.7±0.2cm) y G (12.5±0.7 y 12,7±0.5%/día) se registraron en larvas de T2 y T3 (tabla 2) (figura 1), así mismo, los valores más altos de sobrevivencia (S) se registraron en las larvas de T3 (68.1±6.8%) y T2 (59.4±20.2%); mientras que los menores valores de crecimiento y sobrevivencia se presentaron en las larvas de T1 y T4 (figura 2). Para la prueba de resistencia al estrés, los valores más altos de sobrevivencia se registraron en los tratamientos con la inclusión del bio-preparado: T1 (42.4±5.0%), T2 (42.4±5.0%), T3 (62.5±9.6%); mientras que el menor valor se registró en el T4 (figura 3).
Las tilapias alimentadas con la inclusión del bio-preparado con características probióticas en el alimento concentrado, presentaron mayor desempeño productivo y mayor sobrevivencia, comparado con el tratamiento control. Se observó que existió una relación proporcional entre la concentración de los microorganismos (104, 106 y 108 UFCmL-1) y el crecimiento de las larvas. Sin embargo, no se observó diferencias significativas entre T2 y T3 (p>0.05), indicando que los dos tratamientos son favorables como promotores de crecimiento en el inicio de la alimentación exógena de larvas de tilapia roja.
Estos resultados coinciden con los reportados por Abdel-Tawab et al. (2008), para larvas de tilapia nilótica (O. niloticus), utilizando niveles de inclusión 1 a 5 gr de levadura S. cerevisiae por Kg de dieta, tras un período de 12 semanas de cultivo, sometidas a desafío sanitario in vitro con Aeromona hydrophila, donde se observó mejores resultados en crecimiento, aprovechamiento del alimento y sus nutrientes.
También coincide con lo observado por Lara-Flores et al. (2010a), quienes para alevinos de tilapia nilótica, evaluaron dos tipos de probióticos mezclados en el alimento (S. cerevisiae y una mezcla de Streptococcus faecium y Lactobacillus acidophilus), concluyendo que S. cerevisiae proporciona mejor desempeño en ganancia en peso, tasa de crecimiento específico y mejor sobrevivencia después de nueve semanas de cultivo. De igual forma Hoseinifar et al. (2011), evaluaron los efectos de la levadura inactiva de cerveza (S. cerevisiae) sobre el crecimiento, respuesta fisiológica y microbiota intestinal de juveniles de Beluga (Huso huso) a niveles de inclusión de 1 y 2%, presentando mejores resultados en peso final, ganancia en peso, tasa específica de crecimiento y factor de conversión alimenticio en la dieta suplementada con 2% tras un período de seis semanas de cultivo.
Conclusión
Los resultados del presente estudio permiten concluir que concentraciones de 106 y 108 UFC ml-1 de bio-preparado con características probióticas puede influenciar positivamente en el desempeño productivo y la sobrevivencia de la tilapia roja durante la inversión sexual.
Agradecimientos
Dedicado a la memoria de la Dra. Cecilia Lara Mantilla, PhD., por su amistad, dedicación, entrega y el legado que hoy nos deja. Grupo de investigación de Biotecnología (GRUBIODEQ). Departamento de Química. Universidad de Córdoba. Córdoba. Colombia.
Agradecimiento especial al José Alonso Espinoza, MSc. por su valioso aporte en esta investigación.
Referencias bibliográficas
Abdel-Tawwab, M., Abdel-Rahman, A., Ismael, N. (2011). Evaluation of comercial live bakers' yeast, (Saccharomyces cerevisiae) as a growth and inmunity promoter for fry Nile tilapia, (Oreochromis niloticus) challenged in situ with Aeromonas hydrophila. Aquaculture, 280, 185-189. [ Links ]
Agilar, F. (2010). Modelos matemáticos no lineales como herramienta para evaluar el crecimiento de Tilapia roja (Oreochromis ssp.) y Tilapia nilótica (Oreochromis niloticus var. chitralada)" alimentadas con dietas peletizadas o extruidas. Tesis de Magister, Universidad Nacional de Colombia, Bogotá D.C, Colombia. [ Links ]
Bautista, J., Ruíz, J. (2011). Calidad de agua para el cultivo de Tilapia en tanques de geomembrana. Fuente, 8, 10 - 14. [ Links ]
González, R., Romero, O., y Valdivié, M. (2010). Evaluación de la calidad del agua y su influencia en el cultivo de la tilapia. Recuperado de http://www.panoramaacuicola.com/articulos_y_entrevistas/2009/03/20/evaluacion_de_la_calidad_del_agua_y_su_influencia_en_el_cultivo_de_la_tilapia_.html. [ Links ]
Hoseinifar, S., Mirvaghefi, A., Merrifield, D. (2011). The effect of dietary inactive brewer's yeast S. cerevisiae. Ellipsoideus on the growth, psycological responses and gut microbiota of juvenile beluga (Huso huso). Aquacult., 318, 90- 94. [ Links ]
Departamento Administrativo Nacional de Estadística (DANE). (2014). Cultivo de Tilapia roja (Oreochromis sp) en estanques de tierra, fuente de proteína animal de excelente calidad. Recuperado de http://docplayer.es/14621095-El-cultivo-de-la-tilapia-roja-orechromis-sp-en-estanques-de-tierra-fuente-de-proteina-animal-de-excelente-calidad.html. [ Links ]
Jimenez, A. (2010). Detección de Streptococcus agalactiae por PCR en Tejidos de Tilapias rojas (Oreochromis ssp.) menores de 20g. Tesis de maestría, Universidad Nacional de Colombia, Bogotá D.C, Colombia. [ Links ]
Keller, Y. (2007). Qualidade da agua em viveiro de tilapias (Oreochromis niloticus): caracterização diurna de variáveis físicas, químicas e biológicas. Dissertação de Mestrado em aqüicultura e pesca. Instituto de pesca. São Paulo, Brasil. [ Links ]
Kerguelén, E. (2001). Influencia de la primera alimentación en el desempeño de la larvicultura del bocachico (Prochilodus magdalenae). Tesis de pregrado. Universidad de Córdoba. Córdoba, Colombia. [ Links ]
Kesacordi-Watson, A., Kaspar, H., Lategan, M., Gibson, L. (2008). Probiotics in aquaculture: the need, principles and mechanisms of action and screening processes. Aquacult., 274, 1-14. [ Links ]
Lara-Flores, M., Olivera-Castillo, L., Olvera-Novoa, M. (2010a). Effect of the inclusion of a bacterial mix (Streptococcus faecium and Lactobacillus acidophilus), and the yeast (Saccharomyces cerevisiae) on growth, feed utilization and intestinal enzymatic activity of Nile tilapia (Oreochromis niloticus). International Journal of Fisheries and Aquaculture, 2(4), 93-101. [ Links ]
Monroy, C., Castro, T., Castro, J., Castro, G., Lara, R. (2012). Beneficios del uso de probióticos en la flora bacteriana intestinal de los organismos Acuáticos. Contacto S, 85, 11-18. [ Links ]
Sauceda, R., Rendón, P., Figueroa, E., Rendón, A., López, C. (2009). Modelo tecnológico de cultivo de Tilapia (Oreochromis sp). Recuperado de http://www.tilapiademexico.org/system/publicaciones/Modelo%20Tecnol%C3%B3gico%20de%20Tilapia%20en%20Jaulas.pdf. [ Links ]
Torres, J., Munoz, J., Cardenas, H., Alvarez, L., Palacio, J. (2010). Caracterización de tilapia roja (Oreochromis ssp.) con marcadores moleculares RAPD. Acta Agronómica, 59 (2), 236-246. [ Links ]
Tovar-Ramirez, D., Reyes-Becerril, M., Guzman-Villanueva, L., Gleavez-Lopez, V., Civere-Cerecedo, R. (2008). Probióticos en Acuicultura: Avances resientes del uso de le levaduras en peces marinos. Recuperado de http://www.uanl.mx/utilerias/nutricion_acuicola/IX/archivos/12-Tovar.pdf. [ Links ]