Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.18 no.1 Bogotá Jan./June 2016
https://doi.org/10.15446/rev.colomb.biote.v18n1.57723
DOI: http://dx.doi.org/10.15446/rev.colomb.biote.v18n1.57723
ARTÍCULO DE REVISIÓN
Tratamiento de cáncer de seno y farmacogenética
Treatment of breast cancer and pharmacogenetics
Yeimy Viviana Ariza Márquez*, Ignacio Briceño Balcázar**, Fabio Ancízar Aristizábal***
* cPh.D Biotecnología. Universidad Nacional de Colombia, Sede Bogotá, Colombia. yvarizam@unal.edu.co
** Profesor titular, Universidad de la Sabana y Pontificia Universidad Javeriana, Bogotá, Colombia. ignaciobb@unisabana.edu.co
*** Ph.D., Director Instituto de Biotecnología Universidad Nacional de Colombia, Sede Bogotá, Colombia. faaristizabalg@unal.edu.co
Recibido: septiembre 18 de 2015 Aprobado: abril 12 de 2016
Resumen
El cáncer de seno es un grupo de enfermedades con gran impacto a nivel mundial dado que es una de las patologías con mayor prevalencia en mujeres y el cáncer con mayor tasa de mortalidad en varios países (GLOBOCAN 2012). El uso de la farmacogenética y farmacogenómica, en pacientes con cáncer de seno tiene como fin, generar una salud personalizada que permita tratar a cada paciente como individuo y no como enfermedad, pues cada paciente tiene necesidades particulares a la hora de suministrarle un tratamiento. El propósito de esta revisión es identificar las variantes genéticas reportadas en la literatura científica, donde se evalúan diferentes poblaciones y su posible uso como herramienta para medicina de precisión. En población colombiana es poca la caracterización poblacional que existe y por tanto estudios poblacionales son necesarios para definir los perfiles genéticos que deberán implementarse en nuestra población.
Palabras clave: cáncer de seno, farmacocinética, tamoxifeno, hormonoterapia.
Abstract
Breast cancer is one of the most prevalent diseases in women with increasing mortality in several countries (GLOBOCAN 2012). The use of pharmacogenetics and pharmacogenomics in patients with breast cancer allows generating personalized health for treating each patient as an individual, as each patient has unique needs when supplying a treatment. The purpose of this review is to identify genetic variants reported in the scientific literature, where different populations are evaluated and for possible use as a tool for medical precision. Colombian population is unique and therefore population studies are needed to define the genetic profiles to be implemented.
Key words: breast cancer, pharmacokinetic, tamoxifen, hormone therapy.
Definición y conceptos generales de cáncer de seno
El cáncer de seno esta conformado por un grupo de neoplasias malignas que tiene su origen en la proliferación acelerada a causa de pérdida del control del ciclo celular por alteración en al menos uno de los siguientes genes: BRCA1, BRCA2, P53 y PTEN, y en otros casos por razones desconocidas (Dunning et al., 1999). Puede estar localizado a nivel de los ductos o los lobulillos siendo el ductal el más frecuente. El término «Carcinoma in situ» se refiere al tipo de cáncer que se encuentra confinado en la luz de los ductos o de los lobulillos glandulares, sin invadir los tejidos vecinos. Por su parte, el carcinoma invasivo prolifera hasta romper la llamada membrana basal y extenderse infiltrando los tejidos que rodean a los ductos y lobulillos mamarios, penetrando así el tejido circundante (McCafferty et al., 2009).
Epidemiologia
Se presenta tanto en hombres y mujeres, aunque el cáncer de mama femenino es más frecuente. Las cifras reportadas para mortalidad por cáncer de seno en el periodo del 2000- 2006 en Colombia fueron de 12.287 personas, con una tasa cruda de 8,3 anual y una tasa ajustada por edad de 9,2 anual (Piñeros et al., 2010), adicionalmente, de acuerdo a lo reportado por GLOBOCAN (2012) la tasa de incidencia de cáncer de seno en mujeres para Colombia fue del 23,4% (8.686 casos) y la tasa de mortalidad fue del 13,8% (2.649 defunciones) (Ferlay et al., 2012).
Clasificación cáncer de seno
Con el fin de clasificar los diferentes estadios de esta enfermedad se manejan diferentes esquemas, dentro de los que cabe mencionar, el sistema TNM que se basa en la clasificación por tamaño del tumor (T), si el tumor se ha diseminado a los ganglios linfáticos (N), en las axilas o aún no se ha diseminado, y si el tumor ha pasado a procesos metastásicos (M) y por otro lado la clasificación anatomopatológica, dentro de la que se evalúa; el estado de los receptores hormonales, grado histológico y tamaño. (Singletary et al., 2002).
Actualmente la clasificación molecular es la más usada y está basada en análisis de microarreglos, donde se estratifica el cáncer mamario en cuatro subtipos: 1) luminal; 2) similar a basal; 3) similar a normal y 4) HER2/ERBB2, (Perou et al., 2000; Sotiriou et al., 2003; Rodríguez et al., 2016).
Para los procesos de clasificación se emplean los receptores de superficie, que median procesos de transcripción celular. En la glándula mamaria se expresan tres receptores importantes: receptor de estrógeno (RE), receptor de progesterona (RP) y receptor de factor de crecimiento epidérmico humano 2 (HER2/neu). Estos receptores se encargan de llevar a cabo procesos de replicación que en condiciones fisiológicas normales mantienen el equilibrio celular, pero en procesos tumorales permiten la replicación de células tumorales que los sobre expresan y generan el rápido crecimiento del tumor. Aquellas células que no tengan ninguno de estos receptores se denominan basales o triple negativas (Dent et al., 2007).
Estado del receptor de estrógenos
Los cánceres de seno se clasifican sobre la base de las necesidades de crecimiento como dependiente de estrógeno y tumor independiente de estrógenos (Stoll BA., 1969; Furth J., 1975; Lacroix y Leclercq, 2004). Los RE hacen referencia a un grupo de receptores celulares que son activados por la hormona denominada 17β-estradiol o estrógeno. Los RE son proteínas intracelulares que al unirse a su ligando favorecen su translocación al núcleo e inducción de la expresión de genes específicos. (De vita et al., 1984). Al bloquear la actividad de estas hormonas con terapia hormonal, se detiene el crecimiento de las células del cáncer.
Estado de HER2. Se refiere a un oncogén que ayuda al crecimiento, división y reparación celular. Cuando las células tienen demasiadas copias de este gen, las células (incluyendo las cancerosas) se multiplican más rápidamente (Cabrera M. 2005; Piccart et al., 2005; Sánchez et al., 2008). Se sobre expresa en aproximadamente 25-30 % de las pacientes con cáncer de seno. Esto está asociado a un aumento en la actividad biológica del tumor. Las pacientes con cáncer de mama que presentan amplificación de HER2/neu presentan generalmente una forma más agresiva de cáncer, además de una mayor resistencia a tratamientos convencionales. Sin embargo, son pacientes que responden mejor al tratamiento combinado de quimioterapia con trastuzumab, un anticuerpo monoclonal humanizado que se dirige contra el dominio extracelular del receptor Her2/neu, aumentando la tasa de supervivencia de las pacientes (McCafferty et al., 2009).
Actualmente mediante la identificación de receptores hormonales se determina si las células cancerosas pueden reaccionar a un tratamiento en particular.
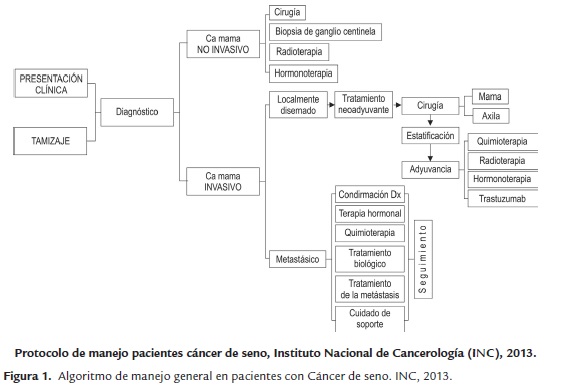
En la figura 1, se muestra la Guía de manejo de pacientes con cáncer de seno del INC del 2013 donde se indican las opciones de tratamiento para pacientes con cáncer de seno, estratificándolo en no invasivo, localmente diseminado y metastásico.
La terapia local tiene como objetivo tratar el tumor en un sitio específico, sin afectar el resto del cuerpo. La cirugía y la radioterapia son ejemplos de terapias locales (Rosenberg, S. A., 2000).
La terapia sistémica se administra por vía oral o directamente en el torrente sanguíneo para llegar a las células cancerosas que se hayan podido propagar más allá del seno. La quimioterapia, terapia hormonal y inmunoterapia son terapias sistémicas.
Dentro de las alternativas de tratamiento se encuentran medidas quirúrgicas que contemplan lumpectomía, cuadrantectomía, mastectomía y mastectomía bilateral, por otro lado la radioterapia, la quimioterapia y la hormonoterapia, son alternativas que suelen usarse de manera combinada.
Para el propósito de esta revisión nos centraremos en los polimorfismos identificados en respuesta a hormonoterapia y quimioterapéuticos.
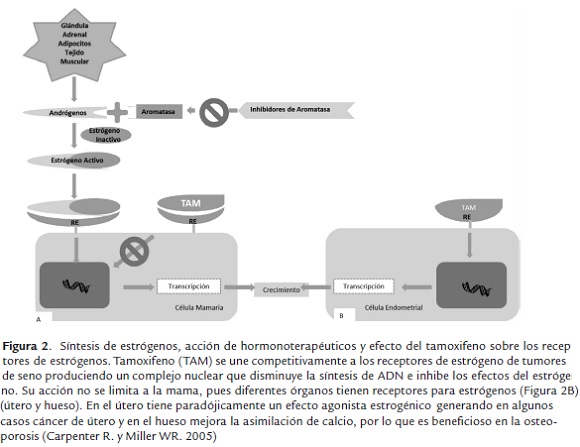
Descripción de los principales hormono terapéuticos: Los medicamentos de hormonoterapia que se usan para tratar el cáncer de seno con receptores de hormonas positivos actúan de dos formas (figura 2):
-
Reducción de la concentración de estrógeno en el cuerpo.
-
Bloqueo de la acción del estrógeno en las células del cáncer de seno.
Los medicamentos indicados para la hormonoterapia también pueden utilizarse para ayudar a reducir o desacelerar el crecimiento del cáncer de seno in situ, en estado avanzado o metastásico con receptores hormonales positivos.
Existen varios tipos de medicamentos de hormonoterapia, entre los que se incluyen: inhibidores de aromatasa (IA), moduladores selectivos de los receptores de estrógeno y antagonistas del receptor de estrógeno, (figura 2), a continuación se describen cada uno de ellos.
Inhibidores de aromatasa
Detienen la producción de estrógeno en mujeres postmenopáusicas, mediante el bloqueo de la enzima aromatasa (ver figura 2), que convierte el andrógeno en pequeñas concentraciones de estrógeno en el cuerpo. Los inhibidores de aromatasa no pueden impedir que los ovarios produzcan estrógeno, por lo que solamente son adecuados para mujeres postmenopáusicas.
Los agentes anti aromatasas se clasifican en 2 grupos:
Inhibidores e inactivadores de aromatasas. Los inhibidores se unen de forma transitoria a la aromatasa y los inactivadores se unen de forma permanente a la enzima. En la actualidad están aprobados 2 inhibidores:
-
Arimidex (nombre genérico: anastrozol)
-
Femara (nombre genérico: letrozol)
Y un inactivador de aromatasas:
- Aromasin (nombre genérico: exemestano)
Moduladores selectivos de los receptores de estrógeno (MSRE)
Son agentes que se unen al receptor de estrógeno donde simulan la actividad de los estrógenos en ciertos tejidos, mientras inhiben su acción en otros. Los MSRE tienen una variada actividad: compuestos con actividad totalmente agonista, como la hormona endógena estrógeno; compuestos con actividad agonista en algunos tejidos y antagonista en otros, como el tamoxifeno.
Tamoxifeno
Es un modulador selectivo de los receptores de estrógenos. Su mecanismo de acción se basa en su efecto antiestrogénico, bloquea la acción de esta hormona que estimula el desarrollo de las células tumorales (figura 2). Su acción no se limita a la mama, pues diferentes órganos tienen receptores para estrógenos. En el útero (figura 2) tiene un efecto agonista estrogénico y en el hueso mejora la asimilación de calcio, por lo que es beneficioso en la osteoporosis.
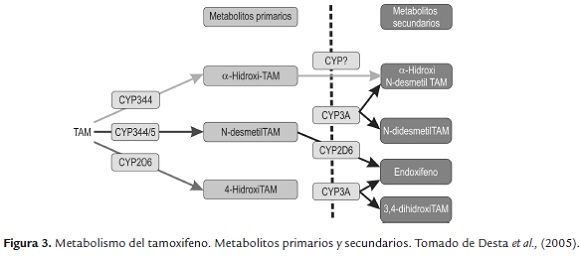
El tamoxifeno es considerado como un profármaco ya que necesita ser transformado a sus respectivos metabolitos, los cuales son los responsables de su actividad farmacológica. Este fármaco tiene metabolismo primario y secundario el cual se lleva a cabo en el hígado, principalmente por las enzimas del citocromo P450, (figura 3). (Higgins et al., 2009 y Goetz et al., 2005).Y dependiendo la integridad de los diversos citocromos los pacientes pueden ser caracterizados como metabolizador ultrarrápido (UM), metabolizador normal (EM), metabolizador intermedio (IM) y metabolizador lento (PM) (Rodriguez e Ingelman., 2006).
El N-desmetiltamoxifeno es el metabolito más abundante sin embargo no es el responsable de la actividad de tamoxifeno; el metabolito 4-hidroxitamoxifeno representa menos del 10 % de la oxidación primaria de tamoxifeno catalizada por las enzimas CYP3A4 y CYP3A5, (figura 3) sin embargo se considera que su papel en el efecto farmacológico es muy importante ya que tiene un efecto antiestrogénico 100 veces superior al del tamoxifeno. Estudios han demostrado que hay otro metabolito, el 4-hidroxi-N-desmetil tamoxifeno (endoxifeno) el cual es formado a partir de la oxidación de N-desmetiltamoxifeno catalizado por la enzima CYP2D6; endoxifeno es más importante que 4-hidroxitamoxifeno ya que contribuye de manera más significativa en el efecto total anticanceroso de tamoxifeno, por lo tanto es el responsable de la actividad de este fármaco. (Goetz et al., 2005).
Antagonistas del receptor de estrógeno (ARE)
Los antagonistas del receptor de estrógeno (ARE) bloquean los efectos del estrógeno en el tejido mamario. Los ARE funcionan de una forma similar a los (MSRE). Los ARE se unen a los receptores del estrógeno en las células mamarias. Si un ARE se une al receptor del estrógeno, no hay espacio suficiente para que el estrógeno se acople a la célula (figura 2). Si el estrógeno no está unido a la célula de la mama, la célula no recibe las señales del estrógeno que le indican que debe crecer y multiplicarse. Además, los ARE tienen otros beneficios:
-
Reducen la cantidad de receptores de estrógeno.
-
Cambian la forma de los receptores de estrógeno en las células mamarias
Hay un ARE disponible para tratar el cáncer de mama de receptores de hormonas positivos:
Faslodex (nombre genérico: fulvestrant)
Fulvestrant es un medicamento que actúa por efecto antagonista sobre los receptores de estrógeno y se encuentra indicado para tratar a mujeres en edad postmenopáusica que presenten cáncer de mama en fase avanzada, únicamente en caso de que el tumor tenga receptores hormonales positivos y la enfermedad no responda a otros medicamentos bloqueantes de estrógenos, como el tamoxifeno. El mecanismo de acción del fármaco se basa en inactivar la acción de los estrógenos. El medicamento se presenta en forma de solución para administrar por vía intramuscular, la dosis habitual es 500 mg una vez al mes. Los efectos secundarios más frecuentes que se han observado consisten en dolor de cabeza, sensación de sofoco, vómitos o diarrea, erupción cutánea, dolor de espalda, reacciones alérgicas, aumento de los niveles de bilirrubina en sangre, fallo hepático, sensación de cansancio y riesgo aumentado de tromboembolismo.
Por otra parte, trastuzumab (comercializado con la marca Herceptin®) es un anticuerpo monoclonal humanizado. El trastuzumab se une selectivamente al receptor HER2. El HER2 se sobre expresa en la superficie de algunas células cancerosas y estimula la proliferación de éstas células. Cuando el trastuzumab se une al HER2 inhibe la proliferación celular. Trastuzumab se emplea en el tratamiento de pacientes con cáncer de seno que tienen expresión positiva del oncogen HER2. El trastuzumab es un producto biotecnológico producido en células de ovario de hámster chino (CHO) en cultivo.
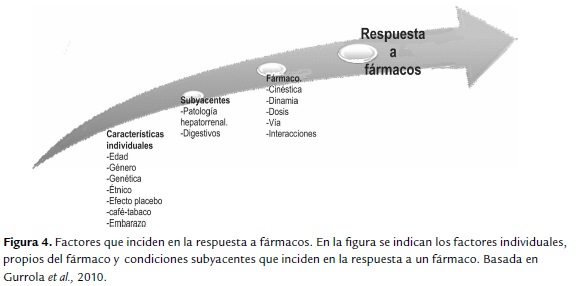
Luego de revisar las diferentes alternativas de tratamiento y evaluando el esquema de manejo propuesto por el INC en el 2013, el hormonoterapéutico de primera elección es tamoxifeno, como previamente se sugirió en un estudio de costo-efectividad, donde se estableció tamoxifeno como la mejor alternativa para Colombia (Chicaíza, 2008) por otra parte los regímenes de quimioterapia están basados en antraciclinas asociados o no con taxanos. De manera que en el contexto de respuesta a tratamiento es importante tener en cuenta todos los factores que pueden incidir en la respuesta a tratamiento en una paciente con cáncer de seno, para esto es preciso evaluar factores tales como condiciones subyacentes, características propias del fármaco y farmacogenéticos de cada paciente (figura 4).
Diversas condiciones pueden incidir en la respuesta a hormonoterapia, es el caso del estudio realizado por Simonsson et al., (2013) donde se encontró que un moderado y alto consumo de café se asocia con una disminución significativa del riesgo de los primeros eventos en los pacientes tratados con tamoxifeno y el estado de los receptores hormonales. Si se confirma, quizás se justifique nuevas recomendaciones en relación con el consumo de café durante el tratamiento con tamoxifeno. Igualmente diversas publicaciones indican que la epigenética también incide en la respuesta a hormonoterapéuticos como el tamoxifeno. (Eccles et al., 2013, Pathiraja, et al., 2010, Van't Veer et al., 2002).
En la tabla 1 se citan los principales polimorfismos asociados a respuesta en los diferentes tratamientos de hormonoterapia en pacientes con cáncer de seno.
Como se mencionó previamente las frecuencias alélicas de CYP2D6 varían entre poblaciones, muchas de las cuales están recopiladas en la base de datos "CYP2D6 allele nomenclature"pero algunas aún no han sido incluidas, por esta razón en la tabla 2 se indican las que se han reportado después del 9-Dec-2014 que no están incluidas en "CYP2D6 allele nomenclature". (PharmGKB CYP2D6 Allelic Variation Summary)
Por otra parte el tratamiento con quimioterapia en cáncer de seno incluye la combinación de diferentes medicamentos. Los protocolos basados en antraciclinas se han convertido en el estándar de quimioterapia adyuvante y neoadyuvante para la mayoría de pacientes, esto basados en las evidencias clínicas de eficacia en comparación con otros protocolos utilizados previamente (Hassan et al., 2010). Recientemente, taxanos, como docetaxel y paclitaxel, fueron incluidos en los protocolos basados en antraciclinas, mostrando reducción en el riesgo a recurrencia (De Laurentiis et al., 2008; Martin et al., 2010; Jacquin et al., 2012).
Quimioterapéuticos
Dentro de la clasificación de los quimioterapéuticos describiremos las características de los más usados: están los agentes alquilantes que tienen su efecto directamente sobre el ADN evitando la reproducción de las células cancerosas, no son específicos de la fase; en otras palabras, actúan en todas las fases del ciclo celular. Por ejemplo la ciclofosfamida (Cytoxan®), carboplatino y oxaliplatino.
Antimetabolitos, interfieren con el crecimiento del ADN y del ARN al sustituir la síntesis de purinas y pirimidinas. Estos agentes dañan las células durante la fase S. Por ejemplo 5-fluorouracilo (5-FU), metrotexato.
Antraciclinas son antibióticos contra el cáncer que interfieren con las topoisomerasas fundamentales en la replicación de ADN. Estos medicamentos ejercen su acción en todas las fases del ciclo celular. Por ejemplo Doxorrubicina (Adriamycin®) y Epirubicina (Ellence®).
Inhibidores de la mitosis, son alcaloides de origen vegetal y otros compuestos derivados de productos naturales. Pueden detener la mitosis mediante su acción en los microtubulos. Son ejemplo Taxenos: paclitaxel (Taxol®) y docetaxel (Taxotere®).
Los protocolos de quimioterapia para cáncer de seno que se emplean actualmente son:
-
CMF: ciclofosfamida , metotrexato, y 5-FU.
-
CAF (o FAC): ciclofosfamida, doxorrubicina y 5-FU.
-
AC: doxorrubicina y ciclofosfamida.
-
EC: epirrubicina y ciclofosfamida.
-
TAC: docetaxel , doxorrubicina y ciclofosfamida.
-
AC → T: doxorrubicina y ciclofosfamida seguida de paclitaxel o docetaxel.
Trastuzumab (Herceptin) se puede administrar con el paclitaxel o el docetaxel para tumores HER2/neu positivos.
-
A → CMF: doxorrubicina, seguida de CMF.
-
CEF (FEC): ciclofosfamida, epirrubicina y 5-FU (a esto le puede seguir docetaxel).
-
TC: docetaxel y ciclofosfamida.
-
TCH: docetaxel, carboplatino, y trastuzumab, para tumores HER2/neu positivos.
Algunos otros medicamentos de quimioterapia que se usan para tratar a pacientes con cáncer de seno incluyen cisplatino, vinorelbina (Navelbine®), capecitabina (Xeloda®), doxorrubicina liposomal (Doxil®), gemcitabina (Gemzar®), mitoxantrona, exabepilona (Ixempra®), paclitaxel basado en albúmina (Abraxane®) y eribulina (Halaven®). Los medicamentos de terapia dirigida trastuzumab y lapatinib (Tykerb®) se pueden usar con estos medicamentos de quimioterapia para tumores que son HER2/neu positivos (Marsha S. y Liu G., 2009).
Las variantes genéticas asociadas a respuesta a quimioterapéuticos son diversas y varian entre poblaciones (tabla 3).
Por otra parte, en la actualidad se encuentran test autorizados para ser practicados en mujeres con cáncer de seno; OncotypeDX®, MammaPrint®, AmpliChip CYP450®, Hercep Test™ y Endopredict®, (Rodríguez et al., 2016) que ayudan a tomar decisiones con respecto a tratamiento, pero que para población nacional presentan un costo alto y no existe una validación en población colombiana que permita garantizar, costo efectividad total.
Conclusiones
La variabilidad humana hace necesario caracterizar cada población, para obtener la descripción de los polimorfismos genéticos asociadas con diferentes desenlaces, en farmacogenética conocer la frecuencia de variantes propias de población colombiana en diversas enzimas asociadas a respuesta a medicamentos usados en el tratamiento de cáncer de seno permitirá identificar patrones para prescribir un tratamiento que realmente pueda ser asimilado, evitando de este modo la presentación de efectos adversos ocasionados por toxicidad fuera del blanco y en aquellos que se identifique un genotipo pobre metabolizador se podrán implementar ajustes de dosis u otros esquemas de tratamiento. Teniendo en cuenta que el tamoxifeno es el hormono terapéutico de primera elección, se hace necesario evaluar los polimorfismos presentes en CYP2D6, para realizar la categorización de las pacientes en metabolizadoras lentas, intermedias o ultra rápidas. Una vez identificado su fenotipo se podrá prescribir el tratamiento adecuado.
Una vez identificadas las variantes genéticas frecuentes en población colombiana, esta información permitirán generar "kits en casa" que incluyan las variantes clínicas más relevantes y frecuentes, a un costo más accesible que permita realizar un tamizaje previo a suministrar un determinado tratamiento, generando la posibilidad de efectuar direccionamiento terapéutico. Se requiere caracterizar nuestra población pues solo cuando conozcamos las particularidades de nuestra población podremos generar soluciones a medida que nos acercaran a una medicina de precisión.
Referencias bibliográficas
Baldwin, R. M., Owzar, K., Zembutsu, H., Chhibber, A., Kubo, M., Jiang, C., ... & Friedman, P. N. (2012). A genome-wide association study identifies novel loci for paclitaxel-induced sensory peripheral neuropathy in CALGB 40101. Clinical Cancer Research, 18(18), 5099-5109. [ Links ]
Bray, J., Sludden, J., Griffin, M. J., Cole, M., Verrill, M., Jamieson, D., & Boddy, A. V. (2010). Influence of pharmacogenetics on response and toxicity in breast cancer patients treated with doxorubicin and cyclophosphamide. British journal of cancer, 102(6), 1003-1009. [ Links ]
Cabrera Morales, C. Morales, C. (2005). Estudio comparativo de la amplificación de Her2/neu mediante FISH y PCR cuantitativa en tiempo real en tumores de mama. Oncología (Barcelona), 28(10), 26-30. [ Links ]
Carpenter, R., & Miller, W. R. (2005). Role of aromatase inhibitors in breast cancer. British Journal of Cancer, 93, S1-S5. [ Links ]
Céspedes-Garro, C., Jiménez-Arce, G., G Naranjo, M. E., Barrantes, R., & LLerena, A. (2014). Ethnic background and CYP2D6 genetic polymorphisms in Costa Ricans. Revista de Biología Tropical, 62(4), 1659-1671. [ Links ]
Chicaíza, L., García, M., & Gamboa, O. (2008). Tamoxifen vs inhibidores de aromatasa para cáncer de mama: análisis de costo efectividad para Colombia. Bogotá: Facultad de Ciencias Económicas, Universidad Nacional de Colombia. [ Links ]
Colomer, R., Monzo, M., Tusquets, I., Rifa, J., Baena, J. M., Barnadas, A., ... & Llombart, A. (2008). A single-nucleotide polymorphism in the aromatase gene is associated with the efficacy of the aromatase inhibitor letrozole in advanced breast carcinoma. Clinical Cancer Research, 14(3), 811-816. [ Links ]
CYP2D6 allele nomenclature. (2014). CYP2D6 allele nomenclature. Recuperado de http://www.cypalleles.ki.se/cyp2d6.htm. The Human Cytochrome P450 Allele Nomenclature Committee Web Site. [ Links ]
Dai, D., Zeldin, D. C., Blaisdell, J. A., Chanas, B., Coulter, S. J., Ghanayem, B. I., & Goldstein, J. A. (2001). Polymorphisms in human CYP2C8 decrease metabolism of the anticancer drug paclitaxel and arachidonic acid. Pharmacogenetics and Genomics, 11(7), 597-607. [ Links ]
De Dueñas, E. M., Aranda, E. O., Lopez-Barajas, I. B., Magdalena, T. F., Moya, F. B., García, L. M. C., ... & Albiach, C. F. (2014). Adjusting the dose of tamoxifen in patients with early breast cancer and CYP2D6 poor metabolizer phenotype. The Breast, 23(4), 400-406. [ Links ]
De Laurentiis, M., Cancello, G., D'Agostino, D., Giuliano, M., Giordano, A., Montagna, E., ... & Pennacchio, R. (2008). Taxane-based combinations as adjuvant chemotherapy of early breast cancer: a meta-analysis of randomized trials. Journal of Clinical Oncology, 26(1), 44-53. [ Links ]
Dent, R., Trudeau, M., Pritchard, K. I., Hanna, W. M., Kahn, H. K., Sawka, C. A., ... & Narod, S. A. (2007). Triple-negative breast cancer: clinical features and patterns of recurrence. Clinical Cancer Research, 13(15), 4429-4434. [ Links ]
De Vita, V. T., Rosenberg, S. A., & Hellman, S. (1984). Cáncer: principios y práctica de Oncología. Salvat editores. [ Links ]
Desta, Z., Ward, B. A., Soukhova, N. V., & Flockhart, D. A. (2004). Comprehensive evaluation of tamoxifen sequential biotransformation by the human cytochrome P450 system in vitro: prominent roles for CYP3A and CYP2D6. Journal of Pharmacology and Experimental Therapeutics, 310(3), 1062-1075. [ Links ]
Diergaarde, B., Potter, J. D., Jupe, E. R., Manjeshwar, S., Shimasaki, C. D., Pugh, T. W., ... & White, E. (2008). Polymorphisms in genes involved in sex hormone metabolism, estrogen plus progestin hormone therapy use, and risk of postmenopausal breast cancer. Cancer Epidemiology Biomarkers & Prevention, 17(7), 1751-1759. [ Links ]
Dong, N., Yu, J., Wang, C., Zheng, X., Wang, Z., Di, L., ... & Jiang, H. (2012). Pharmacogenetic assessment of clinical outcome in patients with metastatic breast cancer treated with docetaxel plus capecitabine. Journal of Cancer Research and Clinical Oncology, 138(7), 1197-1203. [ Links ]
Eccles, S. A., Aboagye, E. O., Ali, S., Anderson, A. S., Armes, J., Berditchevski, F., ... & Bundred, N. J. (2013). Critical research gaps and translational priorities for the successful prevention and treatment of breast cancer. Breast Cancer Research, 15(5), 1-37. [ Links ]
Fan, L., Goh, B. C., Wong, C. I., Sukri, N., Lim, S. E., Tan, S. H., ... & Iau, P. (2008). Genotype of human carbonyl reductase CBR3 correlates with doxorubicin disposition and toxicity. Pharmacogenetics and Genomics, 18(7), 623-631. [ Links ]
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., ... & Bray, F. (2015). Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer, 136(5), E359-E386. [ Links ]
Ferraldeschi, R., Arnedos, M., Hadfield, K. D., A'Hern, R., Drury, S., Wardley, A., ... & Newman, W. G. (2012). Polymorphisms of CYP19A1 and response to aromatase inhibitors in metastatic breast cancer patients. Breast Cancer Research and Treatment, 133(3), 1191-1198. [ Links ]
Fontein, D. B., Houtsma, D., Nortier, J. W., Baak-Pablo, R. F., Kranenbarg, E. M. K., van der Straaten, T. R., ... & Guchelaar, H. J. (2014). Germline variants in the CYP19A1 gene are related to specific adverse events in aromatase inhibitor users: a substudy of Dutch patients in the TEAM trial. Breast Cancer Research and Treatment, 144(3), 599-606. [ Links ]
Friedrich, D. C., Genro, J. P., Sortica, V. A., Suarez-Kurtz, G., de Moraes, M. E., Pena, S. D., ... & Hutz, M. H. (2014). Distribution of CYP2D6 alleles and phenotypes in the Brazilian population. PloS one, 9(10), e110691. [ Links ]
Furth, J. (1975). A comprehensive treatise, ed. Becker GF. Plenum New York, 1, 75-120. [ Links ]
GLOBOCAN. (2012). Cancer Incidence and Mortality Worldwide in 2012. Consultado el 11 de marzo de 2016, pagina web de International Agency for Research on cancer, World Health Organization, recuperado de: http://globocan.iarc.fr/factsheets/cancers/breast.asp. [ Links ]
Goetz, M. P., Rae, J. M., Suman, V. J., Safgren, S. L., Ames, M. M., Visscher, D. W., ... & Desta, Z. (2005). Pharmacogenetics of tamoxifen biotransformation is associated with clinical outcomes of efficacy and hot flashes. Journal of Clinical Oncology, 23(36), 9312-9318. [ Links ]
Guan, X., Liu, H., Ju, J., Li, Y., Li, P., Wang, L. E., ... & Liu, Z. (2015). Genetic variant rs16430 6bp> 0bp at the microRNA-binding site in TYMS and risk of sporadic breast cancer risk in non-hispanic white women aged≤ 55 years. Molecular carcinogenesis, 54(4), 281-290. [ Links ]
Gurrola, S. B., Guevara, E. J. T., & Ramírez, H. J. C. (2010). Farmacogenética y farmacogenómica: hacia una medicina personalizada. Rev Fac Med UNAM, 53(2). [ Links ]
Hassan, M. S. U., Ansari, J., Spooner, D., & Hussain, S. A. (2010). Chemotherapy for breast cancer (Review). Oncology reports, 24(5), 1121-1131. [ Links ]
Henríquez-Hernández, L. A., Murias-Rosales, A., González-Hernández, A., de León, A. C., Díaz-Chico, N., & Fernández-Pérez, L. (2010). Distribution of TYMS, MTHFR, p53 and MDR1 gene polymorphisms in patients with breast cancer treated with neoadjuvant chemotherapy. Cancer epidemiology, 34(5), 634-638. [ Links ]
Henry, N. L., Skaar, T. C., Dantzer, J., Li, L., Kidwell, K., Gersch, C., ... & Philips, S. (2013). Genetic associations with toxicity-related discontinuation of aromatase inhibitor therapy for breast cancer. Breast cancer research and treatment, 138(3), 807-816. [ Links ]
Hewett, M., Oliver, D. E., Rubin, D. L., Easton, K. L., Stuart, J. M., Altman, R. B., & Klein, T. E. (2002). PharmGKB: the pharmacogenetics knowledge base. Nucleic acids research, 30(1), 163-165. [ Links ]
Higgins, M. J., Rae, J. M., Flockhart, D. A., Hayes, D. F., & Stearns, V. (2009). Pharmacogenetics of tamoxifen: who should undergo CYP2D6 genetic testing?. Journal of the National Comprehensive Cancer Network, 7(2), 203-213. [ Links ]
Instituto Nacional de Cancerología ESE (2013). Ministerio de Salud y Protección Social, Colciencias, Instituto Nacional de Cancerología ESE-Fedesalud. Guía de Práctica Clínica para la detección temprana, tratamiento integral, seguimiento y rehabilitación de pacientes con diagnóstico de cáncer de mama. Versión completa, Colombia, 2013. Recuperado de http://gpc.minsalud.gov.co/Documents/Guias-PDF-Recursos/Mama/GPC_Prof_Sal_Mama.pdf. [ Links ]
Jacquin, J. P., Jones, S., Magné, N., Chapelle, C., Ellis, P., Janni, W., ... & Laporte, S. (2012). Docetaxel-containing adjuvant chemotherapy in patients with early stage breast cancer. Consistency of effect independent of nodal and biomarker status: a meta-analysis of 14 randomized clinical trials. Breast Cancer Research and Treatment, 134(3), 903-913. [ Links ]
Justenhoven, C., Hamann, U., Pierl, C. B., Baisch, C., Harth, V., Rabstein, S., ... & Ko, Y. D. (2009). CYP2C19* 17 is associated with decreased breast cancer risk. Breast Cancer Research and Treatment, 115(2), 391-396. [ Links ]
Karle, J., Bolbrinker, J., Vogl, S., Kreutz, R., Denkert, C., Eucker, J., ... & Regierer, A. C. (2013). Influence of CYP2D6-genotype on tamoxifen efficacy in advanced breast cancer. Breast Cancer Research and Treatment, 139(2), 553-560. [ Links ]
Kiyotani, K., Mushiroda, T., Imamura, C. K., Tanigawara, Y., Hosono, N., Kubo, M., ... & Zembutsu, H. (2012). Dose-adjustment study of tamoxifen based on CYP2D6 genotypes in Japanese breast cancer patients. Breast Cancer Research and Treatment, 131(1), 137-145. [ Links ]
Kiyotani, K., Mushiroda, T., Sasa, M., Bando, Y., Sumitomo, I., Hosono, N., ... & Zembutsu, H. (2008). Impact of CYP2D6* 10 on recurrence-free survival in breast cancer patients receiving adjuvant tamoxifen therapy. Cancer Science, 99(5), 995-999. [ Links ]
Lacroix, M., & Leclercq, G. (2004). About GATA3, HNF3A, and XBP1, three genes co-expressed with the oestrogen receptor-α gene (ESR1) in breast cancer. Molecular and Cellular Endocrinology, 219(1), 1-7. [ Links ]
Lal, S., Wong, Z. W., Sandanaraj, E., Xiang, X., Ang, P. C. S., Lee, E. J., & Chowbay, B. (2008). Influence of ABCB1 and ABCG2 polymorphisms on doxorubicin disposition in Asian breast cancer patients. Cancer Science, 99(4), 816-823. [ Links ]
Lee, A., Shi, Q., Pavey, E. S., Sargent, D. J., Alberts, S. R., Sinicrope, F. A., ... & Diasio, R. B. (2013, May). Validation of DPYD variants DPYD* 2A, I560S, and D949V as predictors of 5-fluorouracil (5-FU)-related toxicity in stage III colon cancer (CC) patients from adjuvant trial NCCTG N0147. In ASCO Annual Meeting Proceedings, 31(15) 3510. [ Links ]
Lee, S. Y., Im, S. A., Park, Y. H., Woo, S. Y., Kim, S., Choi, M. K., ... & Im, Y. H. (2014). Genetic polymorphisms of SLC28A3, SLC29A1 and RRM1 predict clinical outcome in patients with metastatic breast cancer receiving gemcitabine plus paclitaxel chemotherapy. European Journal of Cancer, 50(4), 698-705. [ Links ]
Leskelä, S., Jara, C., Leandro-Garcia, L. J., Martinez, A., Garcia-Donas, J., Hernando, S., ... & López-Jiménez, E. (2011). Polymorphisms in cytochromes P450 2C8 and 3A5 are associated with paclitaxel neurotoxicity. The pharmacogenomics journal, 11(2), 121-129. [ Links ]
Liu, M., Goss, P. E., Ingle, J. N., Kubo, M., Furukawa, Y., Batzler, A., ... & Chapman, J. A. W. (2014). Aromatase inhibitor-associated bone fractures: a case-cohort GWAS and functional genomics. Molecular Endocrinology, 28(10), 1740-1751. [ Links ]
Loganayagam, A., Hernandez, M. A., Corrigan, A., Fairbanks, L., Lewis, C. M., Harper, P., ... & Marinaki, A. M. (2013). Pharmacogenetic variants in the DPYD, TYMS, CDA and MTHFR genes are clinically significant predictors of fluoropyrimidine toxicity. British journal of cancer, 108(12), 2505-2515. [ Links ]
Marcucci, K. A., Pearce, R. E., Crespi, C., Steimel, D. T., Leeder, J. S., & Gaedigk, A. (2002). Characterization of cytochrome P450 2D6. 1 (CYP2D6. 1), CYP2D6. 2, and CYP2D6. 17 activities toward model CYP2D6 substrates dextromethorphan, bufuralol, and debrisoquine. Drug Metabolism and Disposition, 30(5), 595-601. [ Links ]
Marsh, S., & Liu, G. (2009). Pharmacokinetics and pharmacogenomics in breast cancer chemotherapy. Advanced drug delivery reviews, 61(5), 381-387. [ Links ]
McCafferty, M. P., Healy, N. A., & Kerin, M. J. (2009). Breast cancer subtypes and molecular biomarkers. Diagnostic Histopathology, 15(10), 485-489. [ Links ]
Mürdter, T. E., Schroth, W., Bacchus-Gerybadze, L., Winter, S., Heinkele, G., Simon, W., ... & Brauch, H. (2011). Activity levels of tamoxifen metabolites at the estrogen receptor and the impact of genetic polymorphisms of phase I and II enzymes on their concentration levels in plasma. Clinical Pharmacology & Therapeutics, 89(5), 708-717. [ Links ]
Muroi, Y., Saito, T., Takahashi, M., Sakuyama, K., Niinuma, Y., Ito, M., ... & Hirasawa, N. (2014). Functional characterization of wild-type and 49 CYP2D6 allelic variants for N-desmethyltamoxifen 4-hydroxylation activity. Drug metabolism and pharmacokinetics, 29(5), 360-366. [ Links ]
Nestorovska, K. A., Jakovski, K., Naumovska, Z., Bajro, H. M., Sterjev, Z., Eftimov, A., ... & Dimovski, A. J. (2014). Distribution of the Most Common Genetic Variants Associated with a Variable Drug Response in the Population of the Republic of Macedonia. Balkan Journal of Medical Genetics, 17(2), 5-14. [ Links ]
Ntukidem, N. I., Nguyen, A. T., Stearns, V., Rehman, M., Schott, A., Skaar, T., ... & Hayden, J. (2008). Estrogen receptor genotypes, menopausal status, and the lipid effects of tamoxifen. Clinical Pharmacology & Therapeutics, 83(5), 702-710. [ Links ]
Park, I. H., Lee, Y. S., Lee, K. S., Kim, S. Y., Hong, S. H., Jeong, J., ... & Nam, B. H. (2011). Single nucleotide polymorphisms of CYP19A1 predict clinical outcomes and adverse events associated with letrozole in patients with metastatic breast cancer. Cancer chemotherapy and pharmacology, 68(5), 1263-1271. [ Links ]
Perou, C. M., Sørlie, T., Eisen, M. B., van de Rijn, M., Jeffrey, S. S., Rees, C. A., ... & Fluge, Ø. (2000). Molecular portraits of human breast tumours. Nature, 406(6797), 747-752. [ Links ]
Sakuyama, K., Sasaki, T., Ujiie, S., Obata, K., Mizugaki, M., Ishikawa, M., & Hiratsuka, M. (2008). Functional Characterization of 17 CYP2D6 Allelic Variants (CYP2D6. 2, 10, 14A-B, 18, 27, 36, 39, 47-51, 53-55, and 57). Drug Metabolism and Disposition, 36(12), 2460-2467. [ Links ]
Sánchez-Muñoz, A., García-Tapiador, A. M., Martínez-Ortega, E., Dueñas-García, R., Jaén-Morago, A., Ortega-Granados, A. L., ... & Morales, F. (2008). Tumour molecular subtyping according to hormone receptors and HER2 status defines different pathological complete response to neoadjuvant chemotherapy in patients with locally advanced breast cancer. Clinical and Translational Oncology, 10(10), 646-653. [ Links ]
Sensorn, I., Sirachainan, E., Chamnanphon, M., Pasomsub, E., Trachu, N., Supavilai, P., ... & Pinthong, D. (2013). Association of CYP3A4/5, ABCB1 and ABCC2 polymorphisms and clinical outcomes of Thai breast cancer patients treated with tamoxifen. Pharmacogenomics and personalized medicine, 6, 93. [ Links ]
Serpe, L., Canaparo, R., Scordo, M. G., & Spina, E. (2015). Pharmacogenetics of drug-metabolizing enzymes in Italian populations. Drug metabolism and personalized therapy, 30(2), 107-120. [ Links ]
Singletary, S. E., Allred, C., Ashley, P., Bassett, L. W., Berry, D., Bland, K. I., ... & Hughes, L. L. (2002). Revision of the American Joint Committee on Cancer staging system for breast cancer. Journal of clinical oncology, 20(17), 3628-3636. [ Links ]
Sotiriou, C., Neo, S. Y., McShane, L. M., Korn, E. L., Long, P. M., Jazaeri, A., ... & Liu, E. T. (2003). Breast cancer classification and prognosis based on gene expression profiles from a population-based study. Proceedings of the National Academy of Sciences, 100(18), 10393-10398. [ Links ]
Straume, A. H., Knappskog, S., & Lønning, P. E. (2012). Effect of CYP19 rs6493497 and rs7176005 haplotype status on in vivo aromatase transcription, plasma and tissue estrogen levels in postmenopausal women. The Journal of steroid biochemistry and molecular biology, 128(1), 69-75. [ Links ]
Su, H. I., Sammel, M. D., Velders, L., Horn, M., Stankiewicz, C., Matro, J., ... & DeMichele, A. (2010). Association of cyclophosphamide drug-metabolizing enzyme polymorphisms and chemotherapy-related ovarian failure in breast cancer survivors. Fertility and sterility, 94(2), 645-654. [ Links ]
Oliveira, A. L., Rodrigues, F. F., Santos, R. E., Aoki, T., Rocha, M. N., Longui, C. A., & Melo, M. B. (2010). GSTT1, GSTM1, and GSTP1 polymorphisms and chemotherapy response in locally advanced breast cancer. Genet Mol Res, 9(2), 1045-1053. [ Links ]
Pathiraja, T. N., Stearns, V., & Oesterreich, S. (2010). Epigenetic regulation in estrogen receptor positive breast cancer-role in treatment response. Journal of mammary gland biology and neoplasia, 15(1), 35-47. [ Links ]
Pharmgkb Pharmacogenomics. Knowledge. Implementation. (2016). Recuperado de: https://www.pharmgkb.org/guideline/PA166104966. [ Links ]
Piccart-Gebhart, M. J., Procter, M., Leyland-Jones, B., Goldhirsch, A., Untch, M., Smith, I., ... & Cameron, D. (2005). Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. New England Journal of Medicine, 353(16), 1659-1672. [ Links ]
Piñeros Petersen, M., Hernández Suárez, G., & Murillo Moreno, R. (2003). Atlas de mortalidad por cáncer en Colombia. Instituto Nacional de Cancerología; Instituto Geográfico Agustín Codazzi. [ Links ]
Rodriguez-Antona, C., & Ingelman-Sundberg, M. (2006). Cytochrome P450 pharmacogenetics and cancer. Oncogene, 25(11), 1679-1691. [ Links ]
Rodríguez-Vicente, A. E., Lumbreras, E., Hernández, J. M., Martín, M., Calles, A., Otín, C. L., ... & Taron, M. (2016). Pharmacogenetics and pharmacogenomics as tools in cancer therapy. Drug metabolism and personalized therapy, 31(1), 25-34. [ Links ]
Rosenberg, S. A. (2000). Principios de tratamiento del cáncer: cirugía oncológica. Cáncer. Principios y Práctica de Oncología. 5ª ed. Madrid: Editorial Médica Panamericana, SA y Arán Ediciones, SA, 295-306. [ Links ]
Ruddy, K. J., Desantis, S. D., Gelman, R. S., Wu, A. H., Punglia, R. S., Mayer, E. L., ... & Burstein, H. J. (2013). Personalized medicine in breast cancer: tamoxifen, endoxifen, and CYP2D6 in clinical practice. Breast cancer research and treatment, 141(3), 421-427. [ Links ]
Saladores, P. H., Precht, J. C., Schroth, W., Brauch, H., & Schwab, M. (2013). Impact of metabolizing enzymes on drug response of endocrine therapy in breast cancer. Expert review of molecular diagnostics, 13(4), 349-365. [ Links ]
Schroth, W., Antoniadou, L., Fritz, P., Schwab, M., Muerdter, T., Zanger, U. M., ... & Brauch, H. (2007). Breast cancer treatment outcome with adjuvant tamoxifen relative to patient CYP2D6 and CYP2C19 genotypes. Journal of Clinical Oncology, 25(33), 5187-5193. [ Links ]
Stoll, B. A. (1969). Hormonal management in breast cancer. Lippincott. [ Links ]
Umamaheswaran, G., Dkhar, S. A., Kumar, A. S. A., Srinivasa, R. K., Kadambari, D., & Adithan, C. (2014). Genotype, allele and haplotype frequencies of four TCL1A gene polymorphisms associated with musculoskeletal toxicity in the South Indian descent. BioImpacts: BI, 4(2), 95. [ Links ]
Van't Veer, L. J., Dai, H., Van De Vijver, M. J., He, Y. D., Hart, A. A., Mao, M., ... & Schreiber, G. J. (2002). Gene expression profiling predicts clinical outcome of breast cancer. Nature, 415(6871), 530-536. [ Links ]
Vulsteke, C., Pfeil, A. M., Schwenkglenks, M., Pettengell, R., Szucs, T. D., Lambrechts, D., ... & Neven, P. (2014). Impact of genetic variability and treatment-related factors on outcome in early breast cancer patients receiving (neo-) adjuvant chemotherapy with 5-fluorouracil, epirubicin and cyclophosphamide, and docetaxel. Breast cancer research and treatment, 147(3), 557-570. [ Links ]
Weber, A., Szalai, R., Sipeky, C., Magyari, L., Melegh, M., Jaromi, L., ... & Melegh, B. (2015). Increased prevalence of functional minor allele variants of drug metabolizing CYP2B6 and CYP2D6 genes in Roma population samples. Pharmacological Reports, 67(3), 460-464. [ Links ]
Whirl-Carrillo, M., McDonagh, E. M., Hebert, J. M., Gong, L., Sangkuhl, K., Thorn, C. F., ... & Klein, T. E. (2012). Pharmacogenomics knowledge for personalized medicine. Clinical pharmacology and therapeutics, 92(4), 414. [ Links ]