Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.18 no.1 Bogotá Jan./June 2016
https://doi.org/10.15446/rev.colomb.biote.v18n1.49552
DOI: http://dx.doi.org/10.15446/rev.colomb.biote.v18n1.49552
ARTÍCULO DE REVISIÓN
Revisión del agave y el mezcal
Review of agave and mezcal
Elia Pérez Hernández*, Ma. del Carmen Chávez Parga*, Juan Carlos González Hernández**
* División de Estudios de Posgrado de la Facultad de Ingeniería Química, Universidad Michoacana de San Nicolás de Hidalgo, Avenida Francisco J. Mújica S/N, Ciudad Universitaria, C.P. 58030, Morelia, Michoacán, México, email: ely_ph@hotmail.com; carmen_pchavez@yahoo.com
** Laboratorio de Bioquímica del Departamento de Ing. Bioquímica del Instituto Tecnológico de Morelia, Av. Tecnológico # 1500, Colonia Lomas de Santiaguito, C. P. 58120, Morelia, Michoacán, México. email: jcgh1974@yahoo.com.
Recibido: octubre 16 de 2015 Aprobado: mayo 18 de 2016
Resumen
En el presente trabajo, se efectuó una compilación de investigaciones realizadas sobre las diferentes etapas del proceso productivo del mezcal a partir de agave en algunas regiones productoras de México; con el propósito de explicar las problemáticas que enfrenta la cadena productiva agave-mezcal y las estrategias científicas que se han desarrollado para solucionarlas. Con ello se pretende lograr su resistencia y persistencia productiva en el mercado, elaborando un producto que cumpla con las características químicas establecidas por las normas oficiales mexicanas de producción y certificación de calidad, además de ofrecer posibles medidas de control en los procesos para estandarizar el producto y finalmente lograr etapas más eficientes en el proceso de producción.
Palabras clave: mezcal, agave, levadura, fermentación.
Abstract
In this paper, a compilation of investigations of the different stages in the production process of mezcal from agave in some producers regions of Mexico is carried out; to explain some of the problems faced by the productive chain agave-mezcal and scientific strategies that are being developed in the country to solve them. This is intended to achieve its resistance and productive persistence in the market, producing a product that meets the chemical characteristics established by the Mexican official standards of production and quality certification, in addition to establishing more measures of control processes to standardize the product and finally to achieve more efficient steps in the production process.
Key words: mezcal, agave, yeast, fermentation.
Introducción
El mezcal es una bebida alcohólica, tradicional de México, la cual es obtenida por procesos artesanales en su mayoría, así como también por procesos tecnificados, que incluyen las siguientes etapas de producción: la selección y corte de la materia prima, la cocción del agave, la molienda del mosto, la fermentación del jugo fructosado, la destilación, la rectificación y la maduración del destilado. Eventos durante cualquiera de estas etapas tienen el potencial de afectar la calidad sensorial y química del producto final, así como sus rendimientos. Estas características son factores clave para una buena aceptación por el consumidor en función de las características organolépticas que percibe, como el sabor, el aroma y el cuerpo. Como se hará mención en las siguientes secciones, existen numerosas investigaciones basadas en el estudio y caracterización de las etapas de producción de bebidas alcohólicas destiladas como el bacanora, mezcal, sotol y tequila, que van desde la cocción adecuada de la materia prima, para hidrolizar los fructanos y liberar los azúcares fermentables, así como la identificación de compuestos químicos producidos durante la cocción. En el caso de la fermentación es de vital importancia la identificación de la cepa de levadura empleada y de otros microorganismos presentes, para identificar la dinámica poblacional en los mostos propios de un proceso artesanal, además de la identificación de los factores que afectan el proceso como el contenido de azúcares, pH, sales minerales y temperatura. En el caso de la destilación del mosto fermentado, los compuestos volátiles son comúnmente asociados con las propiedades sensoriales, aromáticas y al sabor de la bebida, su contenido y concentración en los destilados depende en gran medida de los microorganismos contenidos naturalmente o adicionadas en la fermentación, produciendo un número elevado de distintos compuestos, que en algunos casos pueden ser tóxicos para el organismo, motivo por el cual se debe cumplir con las especificaciones que establece la norma reguladora para poder producir y comercializar la bebida alcohólica destilada.
Producción de mezcal en México
Las bebidas fermentadas son casi universales entre las sociedades humanas antiguas, el etanol es el compuesto mayoritario y actúa como analgésico, desinfectante, ayuda a preservar e incrementar el valor nutritivo de los alimentos y además es alterador de la conciencia. Por todas estas razones la fermentación ha jugado un papel clave en el desarrollo cultural y tecnológico de la humanidad. En Mesoamérica, los códices y las fuentes de la época colonial describen una variedad de bebidas fermentadas producidas antes del contacto con los europeos. Las bebidas destiladas en contraste, no se habían inventado en todas las culturas y su producción en Mesoamérica pre-hispánica permanece controversial (Zizumbo-Villarreal et al., 20091). Zizumbo-Villarreal et al., (20092), probaron la hipótesis de Needham et al., (1980), la cual analiza las vasijas de Capacha tipo bule y trífidas descritas por Kelly, 1974, en el estado de Colima, occidente de México, las cuales pudieron haber sido utilizadas para producir bebidas destiladas. Ellos reprodujeron experimentos usando réplicas de las vasijas, de las técnicas y los materiales (incluyendo el fermento de agave), disponibles en esa región, con lo que obtuvieron resultados exitosos para producir destilados con concentraciones de etanol de entre 20.5 y 35.5 %v/v, simulando las condiciones antiguas de destilación. Con lo cual se observa que la producción de bebidas alcohólicas en México es un proceso que se ha venido desarrollando por miles de años, lo que lo hace ser reconocido por contar con bebidas nacionales por excelencia como el tequila y el mezcal.
México cuenta con la denominación de origen del mezcal, la cual protege la propiedad intelectual de 39 municipios de Durango, 1 de Guanajuato, 81 de Guerrero, 570 de Oaxaca, 58 de San Luis Potosí, 11 de Tamaulipas y 58 de Zacatecas. El estado más recientemente incorporado al plano nacional de productores reservados de mezcal es Michoacán con 29 municipios, incluido en el año 2012. Como ya se ha mencionado anteriormente, esta bebida se encuentra regulada por la Norma Oficial Mexicana: NOM-070-SCFI-94. El organismo encargado de promover y vigilar el cumplimiento de esta norma es el Consejo Mexicano Regulador de la Calidad del Mezcal (COMERCAM, 2015; Diario Oficial de la Federación, 2012).
Para cumplir los requisitos oficiales de calidad, se requiere realizar las operaciones higiénicamente en la envasadora y homogeneizadora, garantizar el origen del producto, cuidar su calidad química, lo que tiene que ver, con proteger al Mezcal de su posible adulteración y garantizar las características del tipo de Mezcal y de la marca, las cuales legalmente forman parte de una huella cromatográfica, con lo que se certifica la calidad del producto. De manera general, el proceso de certificación consiste en que el COMERCAM emite el certificado NOM con vigencia de seis meses. El organismo vigila el cumplimiento de la NOM, y si los reportes de verificación de pruebas de laboratorio indican el cumplimiento de la Norma, el certificado se renueva automáticamente por 6 meses más, cubriendo el pago respectivo (Dirección General Adjunta de Planeación Estratégica y Análisis Sectorial, Dirección Ejecutiva de Análisis Sectorial, 2011).
Producción y exportación de mezcal
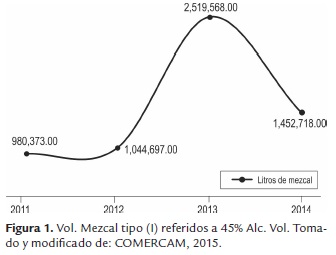
De acuerdo con cifras del COMERCAM, México cuenta con cerca de 330,000 hectáreas de agave en explotación, propiedad de 9,000 productores, esta actividad genera 29,000 empleos directos e indirectos. En el Maguey-Mezcal actualizado en 2006, se señala la existencia de 625 fábricas, 80 plantas envasadoras y 130 marcas de mezcal. Para 2014 el número de marcas registradas ascendió a 362 y la producción de mezcal aumentó un 48% en los últimos 3 años (figura 1). Existen 526 asociados a COMERCAM, siendo 494 productores de mezcal y 301 productores de agave (COEMRCAM, 2015). Oaxaca es el estado con mayor producción de mezcal, con un 93.7 % de la producción total en 2014 seguido por Zacatecas con una producción de 4.4 %. Siendo la mayor producción (77 %) elaborada con A. angustifolia. El total de litros de mezcal envasado para mercado nacional aumentó 242 % en 2014, presentando un total de 924, 686 litros de mezcal (97 % tipo (I) y 3 % tipo (II). Oaxaca también tiene la preponderancia con un 78.2 % del total de mezcal envasado en México. En cuanto a la tendencia de ventas a nivel nacional, esta se concentra mayormente en la región del Valle de México (Distrito Federal y 12 municipios del Estado de México), en los últimos 3 años , el mezcal se ubica en el primer lugar del promedio de crecimiento compuesto con un equivalente al 54.7 %.
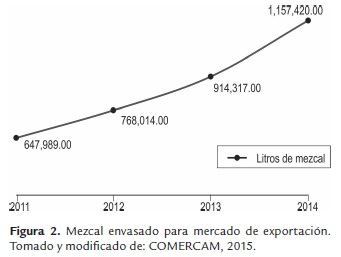
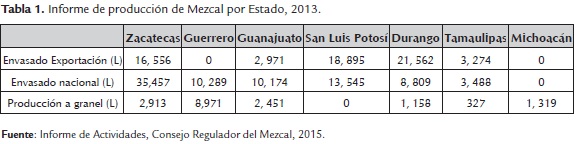
El Mezcal presenta un ascenso en las cumbres internacionales y sus estadísticas son prometedoras. En los próximos años se espera consolidarlas como tendencia y no sólo como una moda, para lograrlo es necesario prepararse en todos los ámbitos y estar a la altura de lo que el consumidor nacional e internacional exige: autenticidad, identidad, cultura, sustentabilidad y calidad (COMERCAM, 2015). En el año 2009, las exportaciones totales de la agroindustria en México ascendieron a 7.7 mil millones de dólares, la cerveza fue el producto con mayores ventas, representó el 8.7 % del total exportado, los productos que le siguieron en importancia fueron el tequila y mezcal, con el 7.1 % y 6.5 %, respectivamente (Plan Rector Maguey-Mezcal, 2006). Para 2015 el mercado de exportación de mezcal envasado aumentó 79 % con 116 marcas (figura 2), en su mayoría mezcal tipo (I) (90 % joven, 9 % reposado y 1 % añejo), las cuales se exportan a 42 países, siendo los principales: Estados Unidos, Chile, España, Australia, Inglaterra, Perú, Francia, Alemania, Canadá y Suecia. El 96.1 % de las exportaciones las realiza el estado de Oaxaca (tabla 1) (COMERCAM, 2015).
El mezcal
"Mezcal" es el nombre genérico que viene del náhuatl mexcalli que significa agave horneado, es el nombre aplicado a la bebida alcohólica destilada producida en muchas áreas rurales de México. Esta bebida es obtenida de los azúcares fermentados de las cabezas cocidas de más de 50 especies del género Agave comúnmente llamado maguey, la cual se produce en aproximadamente 26 estados de México (Aguirre y Eguiarte, 2013; Torres et al., 2015). El proceso de producción del mezcal comienza con la cosecha del agave maduro, entre los 10 y 25 años en especies grandes y entre 4 y 5 años en las especies pequeñas (García-Mendoza, 2007), en esta etapa las plantas son cortadas de su base y la mayor parte de sus hojas son retiradas por medio del jimado, obteniéndose las piñas de agave, las cuales son transportadas al proceso de cocción en hornos o autoclaves. En esta etapa, los polisacáridos, principalmente los de reserva (fructanos), son hidrolizados por la acción de la acidez del jugo y térmicamente para obtener un jarabe rico en fructosa que posteriormente se somete a fermentación alcohólica con levaduras nativas o cepas seleccionadas. Finalmente el mosto con un contenido aproximado de etanol de 2 a 13 % v/v (porcentaje volumen/volumen) se destila para obtener el mezcal blanco o joven.
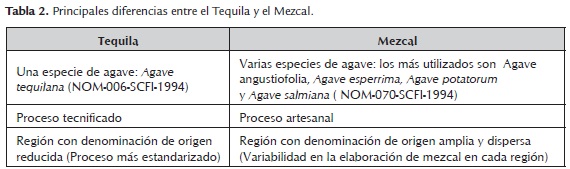
El mezcal es una bebida muy similar al tequila, de hecho se considera que el tequila es una variedad del mezcal, pero ningún mezcal puede ser un tequila, ya que éste último sólo se elabora de una única especie de agave y recibe exclusivamente este nombre, mientras que el mezcal puede ser elaborado con cualquier tipo de agave siempre y cuando no se encuentre dentro de la denominación de origen para otra bebida. El tequila adquiere su nombre por una de las localidades más productivas de ésta bebida (Tequila, Jalisco, México) y se encuentra industrializado casi en su totalidad, situación que impone la mayor diferencia respecto al mezcal (tabla 2).
Agave: la materia prima
En México, los agaves han tenido una gran importancia económica y cultural para numerosos pueblos indígenas y mestizos, siendo considerados especies clave en esas regiones, ya que los han aprovechado durante siglos como fuente de alimento, bebida, medicina, combustible, cobijo, ornato, fibras duras, textiles, abono, construcción, implementos agrícolas y principalmente en la producción de diferentes tipos de bebidas alcohólicas como el mezcal y el tequila. Estos pueblos hicieron de México su centro de domesticación y diversificación mediante la selección humana, ya que los seleccionaban por sus fibras, por el aguamiel o las elevadas concentraciones de azúcares. Por todo esto los agaves no sólo tienen su máxima expresión de diversidad morfológica, filogenética y evolutiva en México, sino también cultural, ya que los seres humanos que lo han poblado han sabido aprovechar al máximo los beneficios que producen estas especies (García-Mendoza, 2007; Gentry, 1982; Valenzuela, 1997; Nobel, 1998).
Distribución de los agaves en México
México es el centro de origen de la familia de las Agavaceas, a la cual pertenece el maguey, incluye 288 especies, 166 de las cuales son magueyes, agrupados en el género Agave. En el país se han encontrado 125 especies de agaves, lo que representa el 75 % del total mundial (Cervantes, 2002). Aunque el mayor número se concentra en Oaxaca (23%), Jalisco es el estado con más riqueza en el occidente de México (García-Mendoza et al., 2004). Otra área con mucha riqueza corresponde a la región ubicada en la provincia del Valle de Tehuacán-Cuicatlán con 15 especies, no sólo conserva una gran riqueza de grupos taxonómicos, sino también filogenéticos (García-Mendoza, 2007). Datos más recientes señalan que existen aproximadamente 200 especies de agave de las cuales 150 se encuentran en México, más 36 especies más que pertenecen a categorías infra específicas, lo cual constituye un total de 186 taxones (García-Mendoza, 2007).
La distribución del género abarca del sur de los Estados Unidos hasta Colombia y Venezuela. Los países con el mayor número de taxones son México, Estados Unidos, Cuba y Guatemala; los demás tienen menos de 8 especies (menos del 3 % del total). Como ya se mencionó en párrafos anteriores, en México se encuentran más del 75 % del género Agave, el cual tiene una amplia distribución, sin embargo ésta es altamente asimétrica, hay regiones que poseen más especies que otras. Son muy diversos en las provincias áridas y semiáridas del centro y norte, pero su número disminuye drásticamente hacía las provincias húmedas y cálidas del sur, por lo que su ausencia es notoria en estados como Tabasco, Campeche y Quintana Roo. Son abundantes en las provincias florísticas de las serranías meridionales del centro de México, Sierra Madre Occidental, Altiplano mexicano, península de Baja California y Sierra Madre Oriental (García-Mendoza, 2007).
El subgénero Agave está conformado por 103 especies, ocupa un área mayor en la república mexicana, y sus taxones tienen áreas de distribución más amplias. Una zona con mucha riqueza se ubica en el Valle de Tehuacán (García-Mendoza, 2007), más adelante se realizará un análisis sobre las investigaciones realizadas en éstas zonas. El subgénero Littaea, constituido por 47 especies, cubre una menor superficie de México y está ausente en las penínsulas de Baja California y Yucatán. El área con mayor diversidad corresponde a la barranca de Metztitlán, en el estado de Hidalgo. Los estados más diversos son Oaxaca, con 37 especies, Puebla con 31, Sonora con 30, Querétaro con 26 y Durango con 24 (García-Mendoza, 2007).
Hernández et al. (2007), realizó 20 exploraciones botánicas en zonas representativas del estado de Jalisco. Ellos registraron 23 especies de Agave, de las cuales cuatro resultaron ser especies nuevas para la ciencia, siete representaron nuevos registros para el Estado y dos fueron dudosamente identificadas. La mitad de las especies de Agave prosperan en bosque de pino y encino, un tercio ocurre en bosque tropical caducifolio. En el estado de Michoacán, la diversidad climática asociada a las características geográficas y morfológicas han favorecido también a la formación de diferentes ecosistemas en los que se desarrollan diversos tipos de vegetación, algunos de ellos permiten la presencia y proliferación de algunas especies del genero agave, sin embargo, los estudios acerca del mismo género en el estado son escasos y sólo a través de referencias bibliográficas y reportes de estudios botánicos, realizados por varios investigadores durante la primera mitad del siglo XX, entre ellos Lumholtz (1902), Bruman (1938), Foster (1945) y en años posteriores: Gentry (1982), Mc Vaugh (1989) y recientemente Cházaro (2009), quienes exploraron gran parte del territorio del país, particularmente la porción Occidental, comprueban la enorme diversidad y gran potencial de éste género, sin embargo, la información documentada es muy escasa acerca de los usos y aprovechamientos que de él se han hecho a través del tiempo en el territorio michoacano (Gallardo et al., 2008).
Así mismo, se pueden citar los estudios de Rodríguez y Espinosa, (1995), quienes inventariaron algunas especies de éste género y al respecto hacen referencia que en el estado de Michoacán, existen ocho especies de Agave: Agave angustifolia Haw, Agave cupreata Trel. y A. Berger, Agave filifera Salm-Dyck, Agave hookeri Jacobi, Agave inaquidens K. Koch, Agave salmiana Otto ex Salm-Dyck, Agave schidigera Lem y Agave tequilana Weber. De esas ocho especies, el Agave salmiana (maguey pulquero o verde) y el Agave tequilana Weber (maguey azul), que pese a encontrarse en casi la totalidad del territorio estatal no se pueden considerar como nativas, ya que fueron introducidas paulatinamente (Gallardo et al., 2008). En este mismo estado Torres et al., (2015), examinaron la diversidad de las condiciones de riesgo y prácticas de manejo de A. inaequidens, ellos estudiaron 5 comunidades a través de 41 entrevistas, mediante las cuales registraron 34 usos diferentes del A. inaequidens, la más importante fue la producción de mezcal (mencionado por el 76.1 % de los entrevistados). Aproximadamente el 12.5 % sólo lo cosecha pero también realizan prácticas de selección de agaves para producción de semillas, propagación de agaves en viveros, trasplante de las plantas entre otras. El A. inaequidens junto con Agave hookeri no son exclusivas para bebidas destiladas, antiguamente eran utilizadas el centro de México para la producción de la bebida fermentada pulque, para alimentación y para fibras. Figueredo et al., (2014) analizó los efectos y mecanismos de selección artificial y divergencias fenotípicas entre poblaciones silvestres y manipuladas de A. inaequidens y A. hookeri, de los cuales el primero se considera silvestre y el segundo solamente se produce mediante su cultivo. Las divergencias fenotípicas entre poblaciones silvestres y domesticadas de A. inaequidens, en caracteres asociados a la domesticación y en las de A. hookeri, son fenotípicamente similares con A. inaequidens cultivado. Ellos analizaron 5 poblaciones salvajes y 5 cultivadas de A. inaequidens y 3 poblaciones cultivadas de A. hookeri. Analizaron la similitud morfológica y la diferenciación entre plantas y poblaciones mediante métodos multivariables y ANOVAS. Algunas de las plantas cultivadas de A. inaequidens fueron clasificadas como A. hookeri, y casi el 10% de A. hookeri fue clasificado como A. inaequidens cultivado. Las poblaciones silvestres y cultivadas de A. inaequidens diferían en 13 caracteres, mientras que las de A. hookeri diferían en 23 caracteres respecto a las poblaciones silvestres y sólo 6 caracteres respecto a las poblaciones de A. inaequidens cultivadas.
García-Mendoza, (2007) señala que no existe hasta el momento ningún trabajo de clasificación que abarque todas las especies del género agave, afirma que el más reciente fue realizado a nivel infra-genético y lo elaboró Gentry en 1982; sin embargo sus análisis solo incluyen los agaves de Norteamérica. También afirma que Gentry presentó resultados de un intenso trabajo de campo que incluyó colecciones, caracteres morfológicos, variaciones en las poblaciones, complejos taxonómicos, áreas de distribución, hábitat, aspectos fenológicos, usos y presencia de compuestos secundarios y con base en esto, se han descrito 15 nuevas especies de varias partes de la república.
El agave y el mezcal
La producción de bebidas fermentadas y destiladas ha sido una práctica realizada desde la antigüedad por muchas culturas en México, lo cual ha despertado el interés para muchos investigadores, quienes han pretendido explicar sus posibles inicios. En el occidente de Mesoamérica prehispánica, se elaboraban alimentos y bebidas alcohólicas fermentadas de agave con alta relevancia cultural y social. Se ha hipotetizado que en el occidente de México la destilación de agave se originó en Colima en la época colonial temprana a través de la adaptación de las técnicas introducidas desde Filipinas (Zizumbo-Villarreal et al., 20092). Se han presentado evidencias arqueológicas que confirman la importancia cultural y social de los agaves en Colima en la época precolombina, uno de los fundamentos de los estudios realizados por Zizumbo-Villarreal et al., (2009)1, quienes analizaron estructuras de piedra circulares en centros residenciales y ceremoniales de ruinas arqueológicas y los compararon con hornos de piedra actuales utilizados para cocer los agaves en la elaboración de bebidas destiladas. Indican que estas estructuras fueron probablemente usadas para preparar alimentos, incluyendo los agaves. Ellos estudiaron además vasijas de cerámica con representaciones de agaves (fase Colima: 400-600 d. C). Exploraron 5 sitios arqueológicos inexplorados y 2 excavados cercanos a los asentamientos arqueológicos estudiados por Kelly, 1980 en los alrededores de la hacienda Capacha y la ciudad de Comala, Colima, México, encontrando evidencia arqueológica que indica un alto significado cultural y social de los agaves en Colima, antes del contacto europeo.
Encuestas realizados por Colunga-García-Marín et al. (2007), mostraron que 74 especies de agave se utilizan en México para producir alimentos, bebidas fermentadas o destiladas, fibras y forraje, de las cuales entre 42 y 53 especies se utilizan exclusivamente para la producción de mezcal en 26 estados de México, siendo recolectadas en su mayoría en los bosques (Torres et al., 2015). De las 14 especies de agave más utilizadas en la elaboración de mezcal, 2 son cultivadas en plantaciones agroindustriales monoespecíficas: Agave tequilana (para la producción de tequila) y Agave angustifolia (Aguirre y Eguiarte, 2013). Este último es extensamente cultivado en el estado de Oaxaca y es la fuente de producción de la mayoría del mezcal comercial elaborado en México (Conabio, 2006; Gentry, 1982). Las especies restantes son encontradas en diferentes contextos productivos, que van desde las poblaciones silvestres, hasta los agroecosistemas como son los campos de cultivo. Por lo tanto estos sistemas incorporan la mayor parte de la biodiversidad y el conocimiento tradicional asociado a las bebidas espirituosas de agave (Aguirre y Eguiarte, 2013).
El tequila se prepara de Agave tequilana Weber var. azul, el cual no se ha encontrado creciendo en forma silvestre y de hecho, taxonómicamente no es diferente de Agave angustifolia, excepto por el mayor tamaño de la hojas, tallos más gruesos y más pesados, panículas difusas con flores largas con tépalos largos en proporción al tubo relativamente corto y al color de las hojas azules en el primero y verde en el segundo (Gentry, 1982). En el caso del mezcal, la especie de agave cambia dependiendo de la región geográfica del país. Oaxaca es uno de los estados donde se trabaja en mayor escala la elaboración de mezcal, y se utiliza generalmente el "maguey espadín" (Agave angustifolia) y en menor medida el "maguey tobarische" (Agave potatorum) (Cházaro, 2007).
En las montañas de la Sierra Madre del Sur, en el estado de Guerrero, procesan el Agave cupreata para elaborar el mezcal. Como esta actividad se ha venido realizando por decenas de años a partir de plantas silvestres que crecen en el bosque de encino, la materia prima ha disminuido drásticamente en los últimos años. A raíz de esto ONG's (organismos no gubernamentales) iniciaron con la siembra de éste agave en viveros, ya que la especie sólo se reproduce sexualmente (por semillas), no produce hijuelos ni bulbillos y los quiotes generalmente son cortados por los campesinos para concentrar los azúcares en las piñas, por lo que no hay propagación natural (Cházaro, 2007). El Agave cupreata se cosecha en los bosques secos tropicales, bosques de robles y otros hábitats de las comunidades rurales en la región de Chilapa, Guerrero, México, para la elaboración de mezcal. Los sistemas de gestión locales, utilizan diversas técnicas para regular la cosecha del agave y estimular la generación, incluyendo la exclusión de ganado (Martin et al., 2011). Como es el caso de Martin et al. (2011), quienes estudiaron el impacto de la exclusión de ganado y de los diferentes hábitats respecto a la población y densidad de A. cupreata. Realizaron muestreos en pastizales, bosques de encino, bosque seco tropical y bosque mixto de roble-tropical seco, utilizando 54 transectos de 1000 m2, donde contaron el agave por tamaño de clase y las mediciones fueron tomadas de la vegetación y el entorno físico. Los transectos se dividieron en zonas con ganado y ganado excluido en los 4 hábitats. Encontraron que la densidad de agave por 1000 m2 fue más elevada en los pastizales, seguidos por los bosques de roble, bosque seco tropical y bosque mixto. Además demostraron que uno de las factores más importantes que influyen en las poblaciones de agave es la presencia de ganado, por el pisoteo o pastoreo de las plántulas y tallos de las flores, lo cual reduce significativamente la densidad de A. cupreata de menor tamaño, sin alterar la estructura del tamaño de la planta.
Para producir el mezcal, el agave debe ser cosechado antes de la floración para asegurar que las piñas de la planta tengan alta concentración de azúcares (Bahre & Bradbury, 1980; Illsley et al., 2005). Mientras que unas especies de agave pueden reproducirse por clones, otros no, y la cosecha para la producción de mezcal reduce drásticamente el número de plantas (Jiménez-Valdés et al., 2010). En un estudio de mezcal en Sonora, México, se ha documentado el agotamiento de las poblaciones silvestres de A. angustifolia, A. palmeri y A. shrevei debido a la sobreexplotación (Burwell, 1995). Por tales motivos, en varios estados de México se ha mostrado una creciente preocupación por la explotación desmedida algunas especies de agave, como lo han demostrado Aguirre y Eguiarte (2013). Ellos informan que tanto el Agave cupreata y Agave potatorum son especies que se distribuyen en los bosques tropicales secos en el sur de México y que la extracción de individuos reproductivos para la producción de bebidas espirituosas ha provocado una disminución de las poblaciones silvestres y han expresado preocupación por su conservación a largo plazo. Ellos evaluaron el grado de la erosión genética de las poblaciones explotadas para proporcionar bases de datos de la genética de poblaciones para el desarrollo sostenible de estrategias de uso de estas especies mediante ISSR (Intersecuencias Simples Repetidas, marcadores nucleares dominantes asociado a los microsatélites). Sus resultados se discuten en relación en el refuerzo in situ de poblaciones basadas en semillas de propagación, en contraste las prácticas de micro propagación pueden poner en peligro la diversidad genética de las especies estudiadas teniendo en cuenta los informes anteriores sobre la diversidad genética. Delgado-Lemus et al. (2014), también evaluaron la distribución y abundancia de A. potatorum pero en San Luis Potosí, México, ya que la recolección de esta especie en esa región se realiza antes de la reproducción sexual y la sobreexplotación tiene a esta especie en alto riesgo. Ellos evaluaron las tasas de extracción, las prácticas de manejo y la importancia económica para los hogares de San Luis Potosí, para lo cual utilizaron modelos bioclimáticos para proyectar un mapa de distribución potencial de la especie y un muestreo ecológico para estimar la disponibilidad total de agaves cosechables en el territorio. Además realizaron observación participe, encuestas y entrevistas con los productores de agave y mezcal en esa región, con lo cual documentaron los usos del agave, aspectos tecnológicos y socioeconómicos de la producción de mezcal y estimaron las tasas de extracción de agaves. Encontrando que en un área de distribución de casi 608 hectáreas se producen anualmente un promedio de 7, 296 plantas cosechables.
La diversidad del germoplasma actual utilizado en la producción de bebidas destiladas a partir de agave en el centro-oeste de México se encuentra en peligro de erosión debido a una expansión en el cultivo del clon de A. tequilana Weber var. azul, utilizado para la elaboración del famoso tequila (Colunga-Garcia-Marin, Zizumbo-Villarreal, 2006). Además en los últimos 30 años, el cultivo de esta especie de agave a generado contaminación química, desplazamiento de los cultivos alimentarios tradicionales y variedades tradicionales locales de agave son utilizadas para la preparación de mezcales en el área con denominación de origen para tequila (Zizumbo-Villarreal et al., 2012).
Es por ello que Colunga-Garcia-Marin; Zizumbo-Villarreal, (2006), llevaron a cabo una exploración etnobotánica en el centro y sur del estado de Jalisco, con el propósito de determinar las áreas críticas para la conservación in situ de agave y su protección legal, así como para determinar el papel de los cultivos nativos y mestizos locales en la generación y mantenimiento de la diversidad. Al igual que García-Mendoza et al. (2004), sus resultados coinciden en que el núcleo de mayor diversidad de agave en la actualidad se encuentra en el sur de Jalisco, e indican que esto es debido a un proceso continuo de selección iniciada por la población indígena para la producción de alimentos y bebidas fermentadas. Además encontraron más de 20 variantes que fueron cultivadas por agricultores tradicionales, la mayoría relacionadas a la especie Angustifolia Haw.
Por otra parte Zizumbo-Villarreal et al. (2012), examinaron las estrategias tradicionales de manejo de recursos genéticos de agave para elaborar mezcal y licores de tequila por comunidades del sur de Jalisco, analizando las bases de manejo sostenible comparado con el sistema industrial del tequila. Encontraron que los destilados del mezcal son preparados con diferentes variedades locales de A. angustifolia Haw y A. rhodacantlha Trel, los cuales son cultivados como cercas dentro de las milpa, el tradicional sistema de cultivos múltiples mesoamericano que permite simultáneamente la producción de agricultura, ganadería y recursos forestales, permitiendo también la producción de mezcal. Sus análisis genéticos y morfológicos indicaron que el manejo tradicional y la selección de variedades locales de A. angustifolia puede producir alta diversidad genética (HBT=0.438±0.003) y estructura (hB=0.408) en comparación con las poblaciones silvestres (HBT=0.428±0.015); MP=0.212).
Cada vez es más la demanda de mezcal en México y en otros países del mundo, lo cual ha influido en el riesgo tanto de poblaciones de agave como del mismo mezcal, además de otros factores sociales y ecológicos que también intervienen (Torres et al., 2015). Por ello, es de vital importancia que la cosecha del agave se realice de manera sostenible, permitiendo que las diversas especies de agave tanto silvestres como cultivadas continúen regenerándose para su conservación.
Hidrólisis térmica del Agave
Los fructanos son la principal reserva de polisacáridos de las pantas de agave y se concentran en el tallo y la base de las hojas. Son sintetizados por el metabolismo ácido de las crasuláceas (Cuello et al., 2008) y corresponden a los polímeros u oligómeros formados principalmente de unidades de fructosa unidas a una molécula de sacarosa (Waleckx et al., 2008). En el agave azul y otras especies de agave, mezclas complejas de fructanos grandes ramificados, donde los restos de fructosa están conectados por enlaces β (2→1) y β (2→6), han sido reportados (Waleckx et al., 2008; Waleckx et al., 2011). Las cabezas de agave, que son ricas en fructanos, se cuecen en hornos o autoclaves tradicionales para hidrolizarlos y liberar los azúcares fermentables (monómeros u oligosacáridos con menores grados de polimerización), principalmente fructosa, glucosa, xilosa y maltosa (Cuello et al., 2008). Después de completado el tratamiento térmico, las cabezas de agave son molidas para obtener los jarabes ricos en azúcares fermentables, para que sean susceptibles a la acción microbiana mediante el proceso de fermentación. Cuando las cabezas de agave se cuecen en hornos tradicionales por leña, el proceso tarda de 2 a 3 días. Alternativamente en hornos calentados por vapor de agua a temperaturas cercanas a 100 ºC, el proceso de cocción se completa dentro de 8 a 12 horas (Secretaría de economía, 2006). Nattorp et al. (1999), encontró que la despolimerización de los polisacáridos por hidrólisis comienza con la protonación del oxígeno glucosídico, seguido por la rotura del enlace glicosídico, lo que resulta en la formación de un carbocatión cíclico. El carbocatión se estabiliza por un par de electrones en una molécula de agua, y dos nuevas moléculas se forman durante el proceso de despolimerización.
Los furanos. Se han encontrado además una gran cantidad de compuestos químicos generados durante la cocción del agave. Mancilla y López, (2002), supervisaron la producción de compuestos volátiles durante la cocción del agave azul por cromatografía de gases y espectrometría de masas (GC-MS) y observaron una gran variedad de compuestos que incluyen alcoholes, aldehídos, ácidos aminados, furanos, ácidos orgánicos, piranos, compuestos de azufre, terpenos y furanonas, así como productos volátiles del tratamiento térmico de agave, tales como alcohol feniletílico, vainillina, α-damascenona y linalol, los cuales son una fuente de las características organolépticas de tequila (Benn y Peppard, 1996). También se ha estudiado la formación de furanos durante la cocción, estos son derivados de la degradación térmica de las hexosas y pentosas, y el furano más abundante formado durante la cocción de las cabezas de agave es el 5-(hidroximetil) furfural (HMF). Sárvári et al. (2003), sugirieron que la capacidad de las levaduras para conferir furanos en compuestos menos tóxicos es un criterio fundamental para la selección de los microorganismos utilizados en la producción de etanol. Además, el furfural, 2-furanmetanol, y ácido 2-furanocarboxílico también son comúnmente producidos durante el tratamiento térmico del agave (Mancilla y López, 2002). Modig et al. (2002), encontraron que altas concentraciones de furfural inhibían enzimas esenciales como la piruvato-deshidrogenasa y la aldehído-deshidrogenasa. Bajo condiciones anaeróbicas, las levaduras metabolizan el furfural a alcohol furfurílico; sin embargo, en condiciones aeróbicas, el ácido furanoico es producido y HMF es metabolizado para formar alcohol furfurílico 5-(hidroximetil) (Palmqvist y Hahn, 2000). El furfural y HMF tienen un efecto inhibidor sobre el crecimiento de las levaduras y la producción de etanol en el proceso fermentativo (Palmqvist y Hahn, 2000). Palmqvist et al., 1999, encontró que la adición de furfural a cultivos de Saccharomyces cerevisiae causa una disminución en la replicación celular sin inhibir la actividad celular (inactivación replicativa). La ausencia de producción de glicerol durante la reducción de furfural sugiere que el furfural actúa como un factor redox alternativo y se oxida el exceso de NADH formado durante la biosíntesis (Botello et al., 2011).
Por otra parte, los estudios realizados por Palmqvist y Hahn, (2000), revelan que la concentración de furfural de 1.922 g/L reduce la velocidad de crecimiento específico de S. cerevisiae en un 30 % y además reduce la producción de alcohol un 66 %. A pesar de que una concentración de furfural de 5.093 g/L inhibe completamente el crecimiento celular, concentraciones similares de alcohol furfurílico no afectan significativamente la fermentación. Alternativamente en un estudio llevado a cabo por Choteborská et al. (2004), una concentración de furfural de 6.27 g/L y una concentración de HMF de 0.2 g/L no dio lugar a una inhibición significativa.
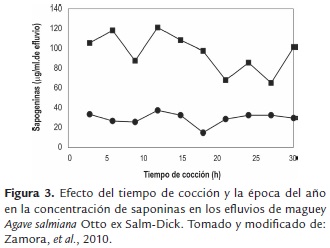
Las saponinas. La hidrólisis térmica de agave no solamente se realiza en hornos subterráneos a base de piedras y leña, proceso artesanal, sino que también puede realizarse en autoclaves u hornos de mampostería que realizan su función de hidrolisis térmica a base de vapor, aun así se forman compuestos tóxicos que pueden inhibir el crecimiento celular, tal como lo comprobó Zamora et al. (2010), quienes analizaron la cocción de agave con vapor, proceso en el que se genera gran cantidad de efluvios ricos en carbohidratos fermentables que regularmente son desechados por la presencia de saponinas, ya que pueden influir de manera negativa en la fermentación. Ellos obtuvieron muestras de efluvios cada 3 h durante el tiempo de cocción de las cabezas enteras de maguey, y se les midió el pH, temperatura, sólidos totales y abundancia de saponinas por la espuma durante agitación. La concentración de azúcares reductores la obtuvieron por método de Fehling-Soxhlet y por Cromatografía de Líquidos de Alta Resolución (CLAR). La cuantificación de saponinas la realizaron por el método descrito por Baccou, registrando una disminución gradual del pH y la concentración de saponinas, y un incremento en los azúcares reductores. Así como una tendencia similar entre las dos técnicas para saponinas (figura 3).
El tratamiento óptimo de la hidrolisis térmica del agave. Estudios realizados para el tratamiento térmico óptimo de agave también se han desarrollado. Botello et al. (2011), estudiaron las cinéticas de la hidrolisis de los fructanos del Agave salmiana durante la etapa de cocción de mezcal en un autoclave escala piloto. La hidrolisis térmica la llevaron a cabo en un rango de temperatura de 96 a 116 °C y tiempos de cocción de 20 a 80 h. Sus resultados indicaron que la hidrolisis térmica del agave fue óptima en un rango de temperatura de 106-116 °C con tiempos de cocción de 6-14 h. Las condiciones óptimas correspondieron a una hidrolisis de fructanos del 80 %, produciendo jarabes con concentraciones de furanos y azúcares reductores de 1 ± 0.1 y 110 ± 10 g/L.
La cocción de las cabezas de agave es una reacción heterogénea en una matriz vegetal junto con el calor y el transporte de masa. Modelos rigurosos requieren una comprensión completa y caracterización de las reacciones de depolimerización y degradación, así como ecuaciones de la formulación de calor y transferencia de masa. Las propiedades térmicas de las cabezas de agave son desconocidas pero otros procesos similares se han estudiado mediante el empleo de modelos simplificados que describen los datos experimentales. En estos modelos simplificados, la matriz vegetal se considera que es un sistema homogéneo y sin restricciones de transporte. La hidrólisis y reacciones de degradación se consideran reacciones concentradas (Botello et al., 2011).
Durante el proceso de cocción de las piñas de agave, se producen compuestos volátiles, compuestos de Maillard, además de los azúcares fermentables (fructosa y glucosa). Estos compuestos aunados a los producidos durante el proceso de fermentación asociados a la levadura usada o especies levaduriformes presentes pueden tener un impacto significativo sobre las características de la bebida alcohólica (Mancilla y López, 2002; Arrizon y Gschedler, 2006; Díaz, 2008; Pinal et al., 2009).
Aunque el tratamiento térmico de agave es un paso clave en la producción de mezcal, el proceso no ha sido completamente investigado y las relaciones entre las condiciones de funcionamiento, el grado de hidrólisis, la generación de furanos y el efecto de estos en la fermentación no han sido todavía examinados. Por otra parte las Normas Oficiales Mexicanas sobre las bebidas alcohólicas requieren que la concentración de furfural debe ser inferior a 4 mg/100 mL de etanol anhidro (Secretaría de Economía, 2006; Secretaría de Salud, 1996). Para promover la comercialización internacional de mezcal, estas restricciones deben ser estrictamente forzadas (Botello et al., 2011).
Fermentación alcohólica: la conversión de azúcares en compuestos aromáticos
Como en todos los procesos de producción de bebidas alcohólicas, existen variables del proceso que influyen en la productividad y calidad de las bebidas. En el caso de la fermentación, la levadura utilizada en el proceso y el método utilizado, así como el contenido de azúcares y otros componentes adicionados al mosto son variables que influyen en la productividad y características organolépticas finales de la bebida, ya que se produce etanol y otros compuestos, que definen directamente las principales características del mezcal (López et al., 2012; De León et al., 20082).
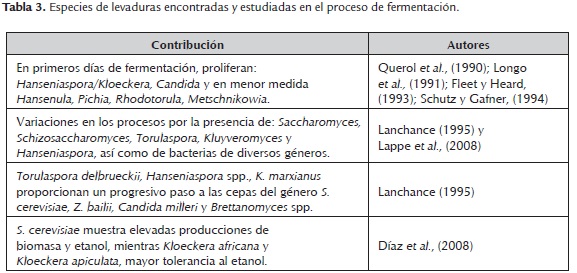
Los microorganismos. En la producción de mezcal, la fermentación espontánea es una práctica común, estas fermentaciones son aquéllas que se producen de forma natural, las realizan las levaduras provenientes de la planta (Agave) y del material de la bodega, sin ningún tipo de inoculación externa. Existen numerosos estudios basados en la identificación de las dinámicas poblacionales responsables de estas fermentaciones (tabla 3), las cuales se ha traducido en un menor rendimiento y calidad sensorial, debido a las variaciones en el proceso de producción entre cada lote, ocasionado por la presencia de varias especies de microorganismos en el mosto como las levaduras y los hongos, así como de bacterias de diversos géneros, las cuales compiten por el consumo de los azúcares del medio, transformándolos en una gran variedad de compuestos orgánicos que generan una disminución en la producción de etanol ocasionando un destilado de baja calidad (Lanchance, 1995; Lappe et al. (2008). Es importante el estudio minucioso de las poblacionales que conforman dichas fermentaciones, ya que es la única forma de conocer la dinámica poblacional propia de una región, con lo cual se lograría utilizar las cepas nativas como iniciadoras de la fermentación en otros procesos y regiones, por encontrarse mejor adaptadas, presentar buenos rendimientos y mediante las cuales es posible conservar las características propias de una región determinada (Kunkee y Amerine, 1970; Ribéreau et al., 1975; Lafon, 1983; Zambonelli, 1988).
Así, en los primeros días de fermentación, los géneros mayoritarios que proliferan son levaduras no convencionales. Después de los primeros días, estos géneros son drásticamente reducidos debido a una supuesta intolerancia al etanol (Kunkee, 1984) y/o a una limitación nutricional (Valle, 2009), dando paso al crecimiento de otras especies más tolerantes al etanol como son las Saccharomyces. De hecho es considerada la principal especie responsable de las fermentaciones alcohólicas (Ribéreau, 1985).
Algunos estudios realizados por Fleet et al., (1984); Heard y Fleet (1986), han demostrado que algunas especies de no-Saccharomyces también contribuyen durante la fermentación, ya que estas especies sobreviven más de lo que se pensaba inicialmente, pudiendo alcanzar crecimientos significativos que influyen en la composición organoléptica de las bebidas alcohólicas. Son particularmente importantes, ya que sintetizan una gran variedad de compuestos volátiles que contribuyen de manera determinante al bouquet de la bebida (Díaz et al., 2008). Estos tipos de levaduras tienen rendimientos de entre 25 a 49 g/L de etanol pero pueden llegar a producir cantidades de etanol incluso iguales a las del género Saccharomyces, siempre y cuando se les cultive en un medio apropiado que cumpla con las características nutricionales y físicas para su óptimo desarrollo (Díaz et al., 2011), por medio de la adición de nutrientes, los cuáles mejoran la eficacia de la fermentación, aumentando el consumo de azúcares reductores y la producción de etanol, en comparación con fermentaciones con ausencia de estos (Díaz et al., 2012). Además, las modificaciones que produzcan éstas en la composición del mosto tendrán un efecto en la cinética de la fermentación y comportamiento bioquímico de Saccharomyces. La diversidad, composición y evolución de la microbiota de levaduras presentes en el mosto depende de varios factores como son la localización geográfica, las condiciones climáticas, así como la variedad y madurez del Agave.
Díaz et al. (2008), estudió cinco cepas de levaduras aisladas de jugo de agave para evaluar sus capacidades fermentativas y aromáticas. Sus experimentos fueron realizados utilizando jugo de agave suplementado con fosfato de amonio, proceso que es muy común en las destilerías de tequila. Clasificaron tres cepas como S. cerevisiae, las cuales mostraron elevadas producciones de biomasa y etanol. También clasificaron a Kloeckera africana y Kloeckera apiculata como cepas con la mayor tolerancia al etanol, las cuales mostraron un escaso crecimiento. Los resultados encontrados sugirieron que estas cepas se vieron afectadas por una limitación nutricional y/ó a compuestos tóxicos presentes en el jugo de agave. Las cepas de S. cerevisiae produjeron predominantemente alcohol amílico, isoamílico, n-propanol, 2-feniletanol, ácido succínico, glicerol, metanol, acetato de isoamilo, hexanoato de etilo, acetaldehído e isobutanol. Mientras que las cepas del género Koleckera mostraron una alta producción de ácido acético, 2-finil acetato de etilo y acetato de etilo. La concentración de metanol fue significativamente diferente entre las levaduras estudiadas. La diversidad entre las 3 cepas de S. cerevisiae fue mayor en el perfil aromático que en el nivel genético y el cinético. Por otra parte la diversidad en las cepas del género Kloeckera fue menor en cuanto a S. cerevisiae, a pesar de pertenecer a dos especies diferentes.
Análisis moleculares. Otros estudios fueron los realizados por Gschaedler et al. (2011), quienes caracterizaron el proceso de fermentación del mezcal de San Luis Potosi, México, e identificaron las levaduras presentes en la fermentación utilizando métodos moleculares de cultivos dependientes (RFLP de 5.8S-ITS y secuenciación de los dominios D1/D2), también utilizaron métodos de cultivos independientes (DGGE). Analizaron 2 mostos diferentes obtenidos de Agave salmiana e identificaron 192 colonias de levaduras diferentes, las cuales fueron sembradas en placas de agar WL e identificadas por RFLP de ITS-58S-ITS2 del gen de rRNA, con endonucleasas de restricción (HhaI, HaeIII y HinfI). Las cepas identificadas fueron S. cerevisiae, Kluyveromyces marxianus, Pichia kluyveri, Zygosaccharomyces bailii, Clavispora lusitaniae, Torulaspora delbrueckii, Candida ethanolica y Saccharomyces exiguus, las cuales fueron confirmadas por secuenciación de las regiones D1-D2 de el gen rRNA 26S. Con el método PCR-DGGE las bandas correspondientes a S. cerevisiae, K. marxianus y T. delbrueckii fueron claramente identificadas, confirmando los resultados obtenidos con técnicas clásicas.
Esteve et al. (1999), utilizó los patrones de restricción generados a partir de la región que abarca los espaciadores internos transcritos (ITS1 e ITS2) y el gen rRNA 5.8S para identificar un total de 132 especies de levaduras pertenecientes a 25 géneros diferentes. En muchos casos, el tamaño de los productos de PCR y los patrones de restricción obtenidos con endonucleasas Cfol, HaeIII y HinfI arrojaron un perfil único para cada especie, demostrando que el uso de la técnica "Polimorfismos en la longitud de los fragmentos de restricción" (RFLP) proponía un nuevo método de rutina rápido y fácil de identificación de levaduras. Técnica que más tarde fue utilizada por González et al., (2012), quien realizó la caracterización molecular y fermentativa de una cepa de levadura aislada de una región productora de mezcal, mediante la técnica RFLP.
La levadura LEVM que había proporcionado un amplificado de 880 pb fue digerida con la enzimas Cfol que proporciono tres patrones de restricción uno de ellos de un tamaño de 320 pb y otro de 365 pb y uno de 150 pb, con la enzima Hae III generó patrones de 150 pb, 180 pb, 230pb y 320 pb, la enzima Hinf I genero un perfil de 365 pb y uno de 155 pb. Comparando dichos perfiles de restricción con los creados en la levadura S. cerevisiae 288 C se puede observar que son similares por lo que la levadura LEVM pertenece al género de S. cerevisiae.
De la Torre, (2010), también realizó trabajos moleculares sobre microorganismos presentes en fermentaciones para la elaboración de mezcal, él estudió la dinámica poblacional de las principales especies de levaduras presentes durante la fermentación en medio sintético y medio de mosto, donde analizó la cinética de metabolitos y la sucesión poblacional de cultivos mixtos de aislamientos nativos de S. cerevisiae, K. marxianus, y Torulaspora delbrueckii. Determinó que el análisis de las fermentaciones con la técnica ARISA (análisis automatizado de los espaciadores intergénicos) permitía obtener patrones diferenciales en los electroferogramas de las 3 especies, representados por picos de diferente tamaño y fluorescencia, demostrando con ello que la técnica puede ser utilizada tanto como un sistema de identificación y etiquetamiento molecular de las especies, así como para verificar que la población deseada se encuentre presente en la fermentación. El análisis de las poblaciones por la técnica FISH (hibridación con fluorescencia in situ) le permitió cuantificar la concentración celular de cada una de las especies durante toda la fermentación, y con la cual observó que en las primeras horas de cultivo el crecimiento era similar en las 3 cepas pero también que después de 24 horas S. cerevisiae comenzaba a predominar, mientras que las otras especies permanecían viables aunque en baja concentración hasta en final de la fermentación, resultados similares a los planteados por Querol et al. (1990), tal como se mencionó en párrafos anteriores.
Análisis cinético. La levadura utilizada en la fermentación está estrechamente relacionada con el contenido de compuestos volátiles en los destilados, tal relación implica el estudio del comportamiento cinético de las cepas seleccionadas ya sea puras o en consorcio. En cuanto a parámetros cinéticos existe una gran cantidad de estudios relacionados, como el caso de Ramírez y Molina (2005), quien estudió el comportamiento cinético de S. cerevisiae, ellos encontraron que al aumentar la concentración de levaduras de 50 a 70 millones por mililitro a 28 ºC, reducían la fase "lag" en una hora, y que la velocidad específica máxima de crecimiento era de 0.38 h-1, con una constante de saturación de 1.35 g/L, determinaron además un rendimiento de 1.68 para esta cepa. González et al. (2012), reportó un crecimiento celular de Kluyveromyces marxianus de 3.58x108 cel/mL con una concentración de etanol producido de 12.45 % v/v, al igual que Carbó et al. (2008), quien reportó una producción de etanol de 12 a 13 % entre las 24 y 48 horas de fermentación utilizando cultivos mixtos de Brettanomyces/Dekkera y S. cerevisiae. González et al. (2012), también encontraron que para obtener mayores cantidades de etanol el proceso debe aproximarse hacía sustratos intermedios (12 °Brix) utilizando jugo de Agave cupreata, y una temperatura de 28 °C aproximadamente.El consumo de sustrato para K. marxianus varia de una concentración inicial de 109.5 g/L de azúcares (10 °Brix) llegando a una cantidad final de 9.01 g/L, Díaz et al. (2011), obtuvieron valores similares con Kloeckera africana y Agave tequilana reportando un consumo de sustrato de aproximadamente 105.32 gr/L. Santiago et al. (2009), obtuvo concentraciones de 4.2x107 a 9.8x107cél/mL a las 54 horas de fermentación utilizandoAgave potatorum y 1.6x107 a 2.5 x 107cél/mL conAgave angustifolia. Sin embargo son concentraciones bajas comparadas con las reportadas en el caso del tequila en condiciones rústicas, donde la población alcanza valores de 6 a 15x107cél/mL (Cedeño, 1995) o en condiciones controladas de 2x107cél/mL(Arrizony Gschedler, 2006; Arrizon y Gschedler, 2002).
La optimización del proceso. Otra área de estudio involucrada en las fermentaciones alcohólicas es la optimización del proceso. De León et al., en (20082), aplicó la metodología de Superficie de Respuesta para optimizar la etapa de fermentación en la producción de mezcal a partir de Agave salmiana. Utilizaron un diseño factorial 3k, para obtener modelos que describieran la relación entre la producción de etanol, el proceso de productividad y el rendimiento de producto respecto a la temperatura de fermentación y a la concentración de azúcares, encontrando que las condiciones fermentativas si afectaban la composición de alcoholes superiores en el mezcal y establecieron como condiciones operativas óptimas, 28 °C de temperatura y 105 g/L de azúcares iniciales. Al igual que Pérez et al. (2013), quienes estudiaron el comportamiento cinético de biomasa y etanol nivel matraz durante la fermentación alcohólica, donde utilizó jugo de Agave cupreata y se establecieron como variables de estudio: tipo de levadura, concentración de azúcares y temperatura, utilizando un diseño Box-Behnken de segundo orden, ellos establecieron como condiciones ideales 28 °C de temperatura, 12 °Brix de azúcares iniciales y la levadura perteneciente al género K. marxianus, la cual presento los mejores rendimientos de etanol.
Otra área relacionada con los procesos fermentativos y de relevante importancia es la planteada por Escalante et al. (2009), quienes describieron un algoritmo para el monitoreo continuo de las concentraciones de biomasa y etanol, así como de la velocidad del crecimiento celular durante la fermentación alcohólica para la elaboración de mezcal. El algoritmo desarrolla la función con las mediciones lineales del potencial redox. El procedimiento combina una red neuronal artificial que relaciona el potencial redox de las concentraciones de biomasa y etanol con el algoritmo, el cual utiliza las estimaciones de biomasa para inferir la tasa de crecimiento en la fermentación. Los resultados muestran que el potencial redox es un valioso indicador de la actividad metabólica de los microorganismos en la fermentación del mezcal. Además la tasa de crecimiento estimada puede ser considerada como una evidencia directa de la presencia de cultivos mixtos de microrganismos, sin embargo los datos totales de biomasa no proporcionan una evidencia definitiva de ello. Ellos además presentaron el diseño detallado del software del sensor utilizado, así como su aplicación experimental nivel laboratorio.
Análisis químico del mezcal: la composición de compuestos volátiles de la bebida
El aroma y sabor de las bebidas alcohólicas (cerveza, vino, tequila y mezcal), son el resultado de numerosos compuestos volátiles y no volátiles producidos en varias etapas del proceso de producción, cuya mezcla compleja define sus atributos organolépticos, sensoriales y la aceptación por el consumidor (López, 1999; Vallejo y González, 2000; Vallejo et al., 2004; Cole y Noble, 2003). Aunque se sugiere que en su mayoría son producidos principalmente por la o las levaduras contenidas naturalmente o adicionadas en la fermentación del mosto de agave (Díaz et al., 2008) pueden también estar contenidos en la materia prima y variar entre especies, regiones geográficas y entre condiciones climáticas del cultivo; por otra parte pueden generarse por las características del mosto y las condiciones del proceso, o durante la maduración del producto (Cole y Noble, 2003). Por tal motivo la composición de la comunidad microbiana es un factor clave en la calidad aromática de las bebidas fermentadas (López et al., 2012; Benn y Peppard, 1996) y una vez destilado el mosto, se requiere del análisis químico de sus componentes volátiles, este representa un problema analítico complejo, desde su aislamiento, caracterización e interpretación (Botello et al., 2007).
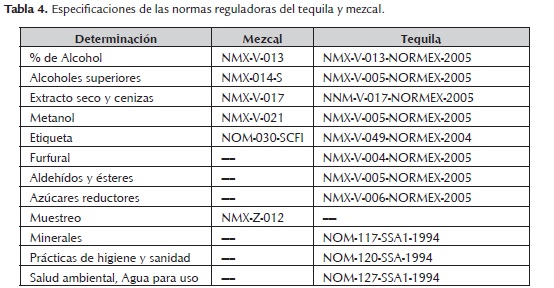
El mezcal es una bebida que al igual que todas las bebidas fermentadas o destiladas tienen determinado grado alcohólico y una gran variedad de compuestos aromáticos que le confieren las características sensoriales que lo diferencian de las demás. Esta bebida se encuentra regulada por la Norma Oficial Mexicana (NOM-070-SCFI-94), la cual se apega sus formas tradicionales de producción, incidiendo en el control de la calidad, higiene y legitimidad del producto; también señala los requisitos para su producción, estableciendo las características y especificaciones que deben cumplir los usuarios autorizados para producir y/o comercializar la bebida. La norma reguladora del mezcal no se encuentra actualizada y las especificaciones que establece no son tan estrictas como las que especifica la norma reguladora del Tequila (NOM-006-SCFI-2005), esto quizá por el motivo de que la mayoría de los productores de mezcal cuentan con sistemas artesanales para conducir sus procesos y difícilmente pueden lograr cumplir con la normatividad vigente mientras no estandaricen sus procesos. Se muestran a continuación (tabla 4) las diferencias entre ambas normas.
El contenido de metales ha sido reportado como un parámetro de calidad en relación a la autenticidad de bebidas destiladas y no destiladas. Sin embargo la mayoría de los productores utilizan alambiques de cobre como equipo de destilación, otros más utilizan aleaciones de cobre y acero o sólo de madera. Lo anterior indica un alto grado en cuanto al uso del cobre, y la NOM-SSA1-142-1995 (que señala máximo 2 mg de cobre/L) no es adecuada, ya que la mayoría de los productos obtenidos, con el método tradicional presentan concentraciones de cobre superiores a las permitidas por dicha normativa.
Se han identificado componentes en el mezcal que por su naturaleza química se clasifican en acetales, ácidos orgánicos, alcoholes, cetonas, aldehídos, ésteres, fenoles y terpenos, siendo los grupos más abundantes en constituyentes y presencia el metanol, alcoholes superiores y ácidos (Lanchenmeier et al., 2006; De León et al., 20081; Botello et al., 2007) que pueden llegar a ser tóxicos y están regidos por las normas oficiales mexicanas. Los compuestos con concentraciones más bajas son los esteres, aldehídos, cetonas, ácidos, furanos y terpenos (López, 1999; López y Guevara, 2001; De León et al., 20081), que contribuyen al aroma del mezcal. Por su parte el furfural representa un indicador para comprobar que la bebida se obtuvo a partir de agave como materia prima (Gallardo et al., 2008).
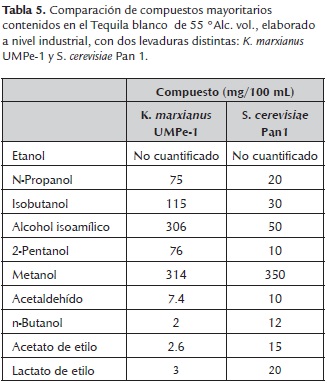
Se han identificado aproximadamente 800 componentes en vinos mediante técnicas de detección olfatométrica y cromatografía de gases, de los cuales, se han identificado de 40 a 50 compuestos como los principales agentes responsables de la producción de aromas (Ferreira et al., 2002). Por otra parte algunos estudios han descrito la caracterización de los compuestos volátiles contenidos en el tequila, donde alrededor de 175 diferentes compuestos han sido identificados y se ha observado un alto contenido en alcoholes superiores junto con bajas concentraciones de ésteres, acetales, terpenos, furanos, ácidos, aldehídos, cetonas, fenoles y sulfuros. Se ha reportado que algunas especies de no-Saccharomyces tales como Kloeckera spp. y Hanseniaspora uvarum son conocidas por su aporte en la calidad de volátiles (Benn y Peppard, 1996). La caracterización de la composición de estas bebidas ofrece ventajas en su procesamiento y en sus propiedades sensoriales finales, en la selección de cepas de levaduras por la producción de terpenos (Carrau et al., 2005), en la selección de barricas para los procesos de reposo y añejamiento (Waterhouse y Towey, 1994) y en el efecto de la región de cultivo de la materia prima sobre el contenido de odorantes importantes (Arrhenius et al., 1996). Se presentan a continuación (tabla 5) algunos compuestos mayoritarios encontrados por López et al., 2012, en tequila utilizando dos cepas de levaduras.
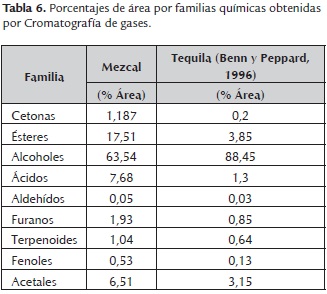
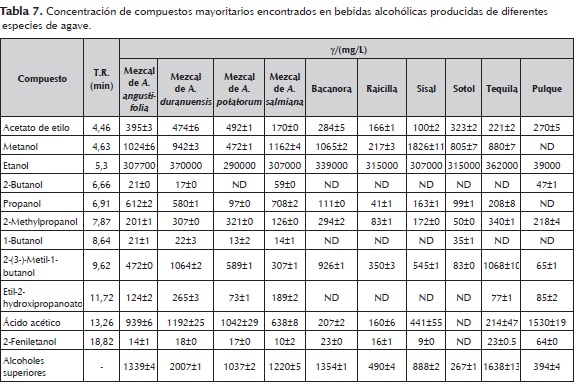
Los estudios de Botello et al. (2007), se basan en al análisis químico del mezcal, los cuales analizan un conjunto de diez mezcales comerciales diferentes mediante extracción líquido-líquido con diclorometano y concentrado del extracto orgánico por evaporación. El análisis de los extractos lo realizaron por cromatografía de gases y espectrofotometría de masas (GC-MS). Identificaron 85 componentes, además identificaron 30 componentes más previamente reportados en la literatura como importantes descriptores de aromas en bebidas alcohólicas. Reportaron concentraciones de cetonas de 1.187 %, ésteres de 17.512 %, alcoholes de 63.54 %, ácidos de 7.685 %, aldehídos de 0.055 %, furanos de 1.930 %, terpenoides de 1.043 %, fenoles de 0.528 % y acetales de 6.511 % aproximadamente. Se muestra un resumen de los porcentajes promedio de áreas por familias químicas encontradas por Botello et al. (2007), en Mezcal (tabla 6), comparadas con las reportadas por Benn y Peppard, (1996) en un extracto orgánico de tequila. De León et al. (2008)1, no sólo analizó la caracterización de compuestos volátiles del mezcal, sino también analizaron otras bebidas alcohólicas étnicas de agave como la raicilla, sisal, tequila, bacanora, sotol y pulque por cromatografía de gases-microextracción en fase sólida de espacio de cabeza-cromatografía de gases-espectrometría de masas (HS-SPME-GC-MS) (tabla 7). Identificaron 105 compuestos, de los cuales 11 fueron clasificados como compuestos mayoritarios y los demás como compuestos minoritarios. Diecisiete de los compuestos minoritarios pueden ser utilizados como marcadores de autenticidad por ser específicos de este tipo de bebidas. Ellos indican que diecisiete de estos últimos compuestos pueden ser utilizados como marcadores de la autenticidad ya que son específicos de estas bebidas. El análisis de conglomerados (AC) mostró que las bebidas alcohólicas de agave se pueden distinguir por el análisis multivariado de los compuestos mayoritarios, sin embargo, el análisis de compuestos minoritarios proporcionan una mejor toma de huellas dactilares. En la tabla 5 se muestran los resultados obtenidos en sus estudios.
Como ya se ha mencionado anteriormente, la gran mayoría de los compuestos volátiles están asociados con las especies de levaduras presentes en los mostos de fermentación, por tal motivo varios investigadores han desarrollado estudios relacionadas entre la cepa y los compuestos volátiles producidos, tal es el caso de López et al. (2012), quienes realizaron un análisis comparativo del rendimiento y el contenido de compuestos volátiles producidos durante la fermentación de mostos de agave para tequila, utilizando una levadura aislada de ambientes naturales perteneciente al género K. marxianus y otra del género S. cerevisiae. Ellos encontraron con K. marxianus una velocidad máxima de consumo de azúcares fermentables de 4.79 g/L*h y una producción de etanol de 2.32 g/L*h, acumulando 54.2 g de etanol/L de mosto después de 72 horas de fermentación; mientras que para la levadura S. cerevisiae la riqueza alcohólica acumulada fue de 39.4 g de etanol/L. Los rendimientos de producción alcohólica obtenidos con respecto a la concentración de azúcares fermentables, correspondieron a 96 % para K. marxianus y 70 % para S. cerevisiae. También identificaron 29 compuestos volátiles en el tequila con K. marxianus (por GC-MS), mientras S. cerevisiae presentó menor número de compuestos y en menor concentración. Sus resultados sugirieron que la cepa K. marxianus es una levadura adecuada para la fermentación, contribuyendo con el mejoramiento de las características organolépticas de la bebida. Estudios similares realizados por Pérez et al. (2013), muestran resultados con concentración de etanol en una muestra destilada de mezcal de 46.75 % y un 1.88 % de metanol utilizando la cepa K. marxianus y Agave cupreata. Valores similares a los reportados por Díaz et al., 2012, con una concentración de etanol de 30-45 %, utilizando Agave tequilana y cepas de levadura Kloeckera africana.
Conclusiones
Las bebidas alcohólicas como el mezcal presentan una amplia variabilidad en su composición química y propiedades sensoriales, esto como resultado del inmenso número de microorganismos que pueden participar en el proceso de fermentación (natural o espontánea) con o sin la adición de otros azúcares permitidos por la norma reguladora; así como por la gran diversidad de especies de agave utilizados; por los diferentes métodos para llevar a cabo la hidrólisis térmica del agave; por las diferentes prácticas locales del proceso de destilación yrectificación; por el procesoreposo o añejamiento y por la denominación de origen que se encuentra muy dispersa en el territorio mexicano, contrario al tequila que es la bebida con menor variabilidad por ser producida de una única especie de agave y contar con un proceso industrializado. Todo esto aunado a la falta de estandarización de los procesos, por ser en su mayoría conducidos por sistemas tradicionales, involucra que no existan estudios concretos sobre un proceso o producto específico que permita la mejora de las etapas de producción. Existe además escasa información sobre el análisis de bebidas artesanales como el mezcal, la poca información disponible es un importante antecedente de los logros y avances que se han realizado y que comenzarán a surgir en esta área de investigación comoresultado de la actual y creciente demanda de este tipo de bebidas y de su regulación para llevar al mercado nacional e internacional un producto de calidad. Lo importante no sólo es conocer los compuestos mayoritarios como lo plantea Botello et al. (2007), cuya presencia está reglamentada, sino también aquellos componentes minoritarios que confieren una huella distintiva de cada producto, propia de un agave, de una región, de un procesamiento; que permita elucidar pruebas de autenticidad y diferenciación de las distintas zonas mezcaleras. Esta variabilidad no debe considerarse como sinónimo de falta de calidad, sino como la expresión de particularidades propias y distintivas de cada región productora de mezcal. Motivo por el cual es de vital importancia estudiar los compuestos que constituyen el mapa químico de cada mezcal, los microorganismos de los que derivan estos compuestos, el tipo de agave utilizado y el proceso local empleado en su elaboración para así tener el conocimiento necesario que permita caracterizar apropiadamente los diferentes mezcales producidos en México. También es importante que se realicen prácticas de manejo sustentables en la cosecha del agave, permitiendo que las especies continúen regenerándose, ya que actualmente existe una preocupación por preservar las diferentes especies de agave silvestre y cultivado que está siendo explotado sin medidas de control alguno y se pone en riesgo su conservación. Esto a consecuencia del creciente comercio del mezcal para el mercado nacional y para exportación, lo que da lugar a la intensificación en la extracción de agave. Es importante por ello, que la producción de mezcal se realice mediante procesos sustentables, lo cual exige grandes cambios en la cadena productiva y la adopción de nuevas innovaciones científicas y tecnológicas.
Referencias bibliográficas
Aguirre, D., Eguiarte, L. (2013). Genetic diversity, conservation and sustainable use of Wilde Agave cupreata and Agave potatorum extracted for mezcal production in Mexico. Journal of Arid Environments, 90, 36-44. [ Links ]
Arrhenius, P., McCloskey, P., Sylvan, M. (1996). Chemical Markers for aroma of Vitis vinífera Var. Chardonnay Regional Wines. Journal of Agricultural and Food Chemistry, 44 (4), 1085-1090. [ Links ]
Arrizon, J., Gschaedler, A. (2002). Increasing fermentation efficiency at high sugar concentrations by supplementing an additional source of nitrogen during the exponential phase of the tequila fermentation process. Canadian Journal of Microbiology, 48 (11), 965-970. [ Links ]
Arrizon, J., Gschaedler, A. (2006). Effects of the addition of different nitrogen sources in the tequila fermentation process at high sugar concentration. Journal of Applied Microbiology, 102 (4), 1123-1131. [ Links ]
Bahre, J., Bradbury, E. (1980). Manufacture of mezcal in Sonora, Mexico. Economic Botany, 34, 391-400. [ Links ]
Benn, M., Peppard, L. (1996). Characterization of Tequila Flavor by Instrumental and Sensory Analysis. Journal of Agricultural and Food Chemistry, 44 (2), 557-566. [ Links ]
Botello, J., Cárdenas, M., Estrada, A., Molina, J., Jiménez, H., Navarrete, J., Rico, R. (2007). Compuestos volátiles en el mezcal. Revista Mexicana de Ingeniería Química, 6 (1), 41-50. [ Links ]
Botello, J., García, M., Jiménez, H., Navarrete, J., Rico, R., Miranda, R. (2011). Kinetic study of the thermal hydrolysis of Agave salmiana for mezcal production. Journal of Agricultural and Food Chemistry, 59 (13), 7333-7340. [ Links ]
Bruman, J., (1983). Genetic Aspects of Plant Introduction. The Scientific Monthly, 46 (2), 120-131. [ Links ]
Burwell, T. (1995). Bootlegging on a desert mountain: the political ecology of Agave (Agave spp.) demographic change in the Sonora River Valley, Sonora, Mexico. Human Ecology, 23, 407-432. [ Links ]
Carrau, M., Medina, K., Boido, E., Fariña, L., Gaggero, C., Dellacassa, E., Versini, B., Henschke, P. (2005). De novo synthesis of monoterpenes by Saccharomyces cerevisiae wine yeast. FEMS Microbiology Letters, 243 (1), 107-115. [ Links ]
Cedeño, M. (1995). Tequila Production. Critical Reviews in Biotechnology, 15, 1-11. [ Links ]
Cervantes, M. (2002). Plantas de importancia económica en las zonas áridas y semiáridas de México. México: UNAM, Instituto de Geografía. [Versión electrónica]. Recuperado de: URL (https://books.google.com.mx), pp. 63-66, 73. [ Links ]
Cházaro, M., Valencia, O., Hernández, M. (2007). Agaves silvestres usados en la elaboración de bebidas alcohólicas. Agaves del Occidente de México. Guadalajara, México: CUCBA-CUCSH, [Versión electrónica], pp. 123-126. [ Links ]
Cházaro, M. (2002). Antología Botánica Del Occidente de México. Universidad de Guadalajara, Departamento de Geografía y Ordenación Territorial, pp. 35-79. [ Links ]
Choteborská, P., Palmarola, B., Galbe, M., Zacchi, G., Melzoch, K., Rychtera, M. (2004). Processing of wheat bran to sugar solution. Journal of Food Engineering, 61 (4), 561-565. [ Links ]
Cole, C., Noble, C. (2003). Flavor chemistry. In: Fermented Beverage Production. New York, United States: Kluwer Academic/Plenum Publishers, pp. 393-396. [ Links ]
Colunga-GarcíaMarín, P., Zizumbo-Villarreal, D. (2006). Tequila and other agave spirits from west-central México: Current germplasm diversity, conservation and origin. Biodiversity and Conservation, 16, 1653-1667. [ Links ]
Colunga-GarcíaMarín, P., Zizumbo-Villarreal, D., Martínez, J. (2007). Tradiciones en el aprovechamiento de los agaves mexicanos: una aportación a la protección legal y conservación de su diversidad biológica y cultural. In: Colunga-GarcíaMarín, P., Larqué, A., Eguiarte, L.E. and Zizumbo-Villarreal, D. En lo ancestral hay futuro: del tequila, los mezcales y otros agaves. México: CICY, CONACYT, CONABIO, INE, p 229-248. [ Links ]
COMERCAM (Consejo Mexicano Regulador de la Calidad del Mezcal). (2015). Informe de actividades. [ Links ]
Conabio. (2006). Comisión Nacional para el conocimiento y uso de la biodiversidad. México, D.F.: Redacta, S.A. de C.V, p 5-70. [ Links ]
Cuello, C., Juárez, B., Aguirre, J., Pinos, J. (2008). Quantitative characterization of non-structural carbohydrates of mezcal Agave (Agave salmiana Otto ex. Salm-Dick). Journal of Agricultural Food and Chemistry, 56 (14), 5753-5760. [ Links ]
De León, A., Escalante, P., Jiménez, M., Ordoñez, L., Flores, J., Barba, A. (20081). Characterization of Volatile Compounds from Ethnic Agave Alcoholic Beverages by Gas Chromatography-Mass Spectrometry. Food Technology, 46 (4), 448-455. [ Links ]
De León, A., Escalante, P., Barba de la Rosa, A., Blaschek, H. (20082). Optimization of fermentation conditions for the production of the mezcal from Agave salmiana using response surface methodology. Chemical Engineering and Processing: Process Intensification, 47 (1), 76-82. [ Links ]
Delgado-Lemus, A., Casas, A., Téllez, O. (2014). Distribution, abundance and traditional management of Agave potatorum in the Tehuacán Valley, Mexico: bases for sustainable use of non-timber forest products. Journal of Ethnobiology and Ethnomedicine, 10, 63. [ Links ]
Diario Oficial de la Federación. (2012). Alejandro López González, Director General adjunto, Secretaría de Gobernación, http://www.dof.gob.mx. [ Links ]
Díaz, D., Marie, D., Estarrón, M., Strehaiano, P. (2008). Fermentative capability and aroma compound production by yeast strains isolated from Agave tequilana Weber juice. International peer-reviewed journal Enzyme and Microbial Technology, 42 (7), 608-616. [ Links ]
Díaz, D., Córdova, J., Valle, J. (2011). Efecto interactivo de las fuentes de nitrógeno orgánico e inorgánico en la fermentación de jugo de agave con Kloeckera africana. XIII Congreso Nacional de Biotecnología y Bioingeniería y VII Simposio Internacional de Producción de Alcoholes y Levaduras. Acapulco Guerrero, México. [ Links ]
Díaz, D., Valle, J., Córdova, J., Estarrón, M., Hernández, G. (2012). Fermentation of Agave tequilana juice by Kloeckera africana: influence of amino-acid supplementations. Antonie Van Leeuwenhoek, 101 (2), 195-204. [ Links ]
Dirección General Adjunta de Planeación Estratégica y Análisis Sectorial, Dirección Ejecutiva de Análisis Sectorial. (2011). México, pp 1-5. [ Links ]
Escalante, P., Ibarra, V., Rosu, H., De León, A., González, R. (2009). Online monitoring of mezcal fermentation based on redox potential measurements. Bioprocess and Biosystems Engineering, 32 (1), 47-52. [ Links ]
Esteve, B., Belloch, C., Uruburu, F., Querol, A. (1999). Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers. International Journal of Systematic Bacteriology, 49 (1), 329-37. [ Links ]
Ferreira, V., Ortian, N., Escudero, A., Loapez, R., Cacho, J. (2002). Chemical characterization of the aroma of grenade rose wines. Aroma Extract Dilution Analysis, quantitative determination and sensory reconstitution studies. Journal of Agricultural and Food Chemistry, 50 (14), 4048-4054. [ Links ]
Figueredo, C., Casas, A., Colunga-GarcíaMarin, P., Jafet, M., González-Rodríguez, A. (2014). Morphological variation, management and domestication of 'maguey alto' (Agave inaequidens) and 'maguey manso' (A. hookeri) in Michoacán, México. Journal of Ethnobiology and Ethnomedicine, 10 (66), 1-12. [ Links ]
Fleet, H., Lafon, S., Ribéreau, P. (1984). Evolution of yeasts and lactic acid bacteria during fermentation and storage of Bordeaux wines. Applied Environ Microbiology, 48, 1034-1038. [ Links ]
Foster, M. (1945). Sierra Popoluca Folklore and Beliefs. American Archaeology and Ethnology, 42, 177-250. [ Links ]
García-Mendoza, A. (2007). Los agaves de México. Ciencias, Universidad Autónoma de México. 087: 14-23. [ Links ]
García-Mendoza, A., Ordoñez, M., Briones, M. (2004). Agaváceas. Biodiversidad de Oaxaca, pp. 159-169. [ Links ]
Gallardo, J., Gschaedler, C., Cházaro, M., Tapia, E., Villanueva, S., Salado, J. H., Villegas, E., Medina, R., Aguirre, M., Vallejo, M. (2008). La producción de mezcal en el estado de Michoacán. Gobierno del Estado de Michoacán y Centro de Investigación y Asistencia Tecnológica y Diseño del Estado de Jalisco. Michoacán, México, pp. 90-96. [ Links ]
Gentry, H. (1982). Agaves of Continental North America. Arizona, Estados Unidos: Univesity of Arizona Press, pp. 25-47, 670. [ Links ]
González, J. C., Damián, R. M., Pérez, E., Chávez, M. C. (2012). Isolation, molecular and fermentative characterization of a yeast used in ethanol production during mezcal elaboration. Revista Mexicana de Ingeniería Química, 11 (3), 389-400. [ Links ]
Gschaedler, A., Verdugo, A., Segura, L., Kirchmayr, M., Ramírez, P., González, A., Coria, R. (2011). Yeast communities associated with artisanal mezcal fermentations from Agave salmiana. Antonie Van Leeuwenhoek, 100 (4), 497-506. [ Links ]
Heard, M., Fleet, H. (1986). Occurrence and growth of yeast species during fermentation of some Australian wines. Food technology in Australia, 38, 22-25. [ Links ]
Hernández, G., Cházaro, M., Flores, E. (2007). Inventario, distribución y hábitat del género Agave en Jalisco, Agaves del Occidente de México. Guadalajara, México: CUCBA-CUCSH, p 6-12. [ Links ]
Illsley, C., Tlacotempa, A., Rivera, G., Morales, P., Garcia, J., Casarrubias, L., Calzada, M., Calzada, R., Carranca, C., Flores, J., Omar, E. (2005). Maguey papalote: para todo mal, mezcal; para todo bien, también. La riqueza de los bosques mexicanos: más alla de la madera. SEMARNAT, México. [ Links ]
Kelly, I. (1974). Stirrup Pots from Colima: Some Implications in B. Bell, ed. The Archaeology of West Mexico. Ajijic, Jalisco: Sociedad de Estudios Avanzados de Occidente, pp 206-211. [ Links ]
Kunkee, E., Amerine, M. (1970). Yeasts in winemaking. In: The Yeasts Technology. Academic Press, London: A.H. Rose and J.S. Harrison, p. 5-72. [ Links ]
Kunkee, E. (1984). Selection and modification of yeasts and lactic acid bacteria for wine fermentation. Food Microbiology, 1 (4), 315-332. [ Links ]
Lafon, S. (1983). Wine and brandy. In Biotechnology. Weinheim, Verlag, Chemie: H.H. Rehm y G. Reed, p 81-163. [ Links ]
Lachance, M. (1995). Yeast communities in a natural tequila fermentation. Antonie Van Leeuwenhoek, 68, 151-160. [ Links ]
Lachenmeier, W., Sohnius, M., López, G. (2006). Quantification of selected volatile constituents and anions in mexican Agave spirits (tequila, mezcal, sotol and bacanora). Journal of Agricultural and Food chemistry, 54 (11), 3911-3915. [ Links ]
Lappe, R. Moreno, R., Arrizón, J., Herrera, T., García, A., Gschaedler, A. (2008). Yeasts associated with the production of Mexican alcoholic nondistilled and distilled Agave beverages. FEMS Yeast Research, 8 (7), 1037-1052. [ Links ]
López, M. C. (1999). Tequila Aroma. In: Flavor Chemistry of Ethnic Foods. New York, United States: Edited by Shahidi, and Kluwer Academic, p 211-217. [ Links ]
López, M., Guevara, Y. (2001). Authenticity of three mexican alcoholic beverages by SPME-GCMS. New Orleans, L. A: Annual Meeting of Institute of Food Technologists, p 10-3. [ Links ]
López, A., Díaz, P., Campos, G. (2012). Estudio comparativo de rendimiento y contenido de compuestos volátiles en un proceso de elaboración de Tequila a nivel industrial. Ciencia Nicolaita, 57, 41-52. [ Links ]
Lumholtz, C. (1902). Unknown Mexico. 2v. New York. [ Links ]
Mancilla, N., López, M. (2002). Generation of Maillard compounds from inulin during the thermal processing of Agave tequilana Weber Var. Azul. Journal of Agricultural and Food Chemestry, 50 (4), 806-812. [ Links ]
Martin, M., Peters, C., Palmer, M., Illsley, C. (2011). Effect of habitat and grazing on the regeneration of wild Agave cupreata in Guerrero, Mexico. Forest Ecology and Management, 262, 1443-1451. [ Links ]
Modig, T., Liden, G., Taherzadeh, J. (2002). Inhibition effects of furfural on alcohol dehydrogenase, aldehyde dehydrogenase and pyruvate dehydrogenase. Biochemical Journal, 363, 769-776. [ Links ]
Nattorp, A., Graf, M., Spuhler, C., Renken, A. (1999). Model for Random Hydrolysis and End Degradation of Linear Polysaccharides: Application to the Thermal Treatment of Mannan in Solution. Journal of Industrial and Engineering Chemistry, 38, 2919-2926. [ Links ]
Needham, J., Ping-Yu, H., Gwei-Djen, L., Sivin, N. (1980). Science and Civilization in China. Vol. 5. Alchemy and Chemistry. Part IV. Apparatus, Theories and Gifts. J. Needham, ed., Science and Civilization in China. Cambridge: Cambridge University Press. [ Links ]
NOM-070-SCFI-1994. (1994). Norma Oficial Mexicana: Bebidas Alcohólicas-Mezcal-Especificaciones. Dirección General de Normas. Secretaría de Economía. México. [ Links ]
NOM-006-SCFI-2005. (2005). Norma Oficial Mexicana: Bebidas Alcohólicas-Tequila-Especificaciones. Dirección General de Normas. Secretaría de Economía. México. [ Links ]
Nobel. (1998). Los incomparables agaves y cactus. México, 1ª ed., Trillas, p. 166. [ Links ]
Palmqvist, E., Hahn, B. (2000). Fermentation of lignocellulosic hydrolysates. II: Inhibitors and mechanisms of inhibition. Bioresource Technology, 74 (1), 25-33. [ Links ]
Palmqvist, E., Almeida, S., Hahn, B. (1999). Influence of Furfural on Anaerobic Glycolytic Kinetics of Saccharomyces cerevisiae in Batch Culture. Biotechnology and Bioengineering, 62 (4), 447-454. [ Links ]
Pérez, E., González, J. C., Chávez, M. C., Cortés, C. (2013). Fermentative characterization of producers ethanol yeast from Agave cupreata juice in mezcal elaboration. Revista Mexicana de Ingeniería Química, 12 (3), 451-461. [ Links ]
Pinal, L., Cornejo, E., Arellano, M., Herrera, E., Nuñez, L., Arrizon, J., Gschaedler, A. (2009). Effect of Agave tequilana age, cultivation field location and yeast strain on tequila fermentation process. Journal of Industrial Microbiology, 36 (5), 655-661. [ Links ]
Plan rector del sistema producto Maguey-Mezcal. (2006). Comité Nacional Sistema Producto Maguey-Mezcal, A.C. [ Links ]
Querol, A., Jiménez, M., Huerta, T. (1990). A study on microbiological and enological parameters during fermentation musts from poor and normal grape-harvest in the region of Alicante (Spain). Journal of Food Science, 55 (6), 1603-1606. [ Links ]
Ramírez, O., Molina, M. (2005). Evaluación de parámetros cinéticos para Sacharomyces cerevisiae utilizando agua de coco como sustrato. Ingeniería, 15 (1, 2), 91-102. [ Links ]
Ribéreau, J., Peynaud, E., Ribéreau, P., Sudraud, P. (1975). Sciences et Techniques du Vin. Tome II. Dunod, Paris. [ Links ]
Ribéreau, P. (1985). New developments in wine microbiology. American Journal of Enology and Viticulture, 36 (1), 1-10. [ Links ]
Rodriguez, L., Espinosa, G. (1995). Listado florístico del estado de Michoacán, sección I (Gymnospermae; Angispermae: Acanthaceae-Commelinaceae). Flora del Bajío y de regiones adyacentes, 6, 1-208. [ Links ]
McVaugh, R. (1989) Myrtaceae. In: Howard, R.A. (Ed.) Dicotyledoneae-Part 2. Flora of the Lesser Antilles, Leeward and Windward Islands: Arnold Arboretum Harvard University, Cambridge, pp. 463-532. [ Links ]
Santiago, P., López, M., Vera, A. M. (2009). Compuestos volátiles aromáticos generados durante la elaboración de mezcal de Agave angustifolia y Agave potatorum. Revista Fitotecnia Mexicana, 32 (4), 273-279. [ Links ]
Sárvári, I., Franzén, C., Taherzadeh, M., Kiklasson, C., Lidén, G. (2003). Effects of Furfural on the Respiratory Metabolism of Saccharomyces cerevisiae in Glucose-Limited Chemostats. Applied and Environmental. Microbiology, 69 (7), 4076-4086. [ Links ]
Secretaría de Economía. NOM-006-SCFI-2005. (2006). Norma Oficial Mexicana: Bebidas alcohólicas-Tequila-Especificaciones. Diario Oficial de la Federación. [ Links ]
Secretaria de Salud. NOM-142-SSA1-1995. (1996). Norma Oficial Mexicana: Bienes y servicios. Bebidas alcohólicas. Especificaciones sanitarias. Etiquetado sanitario y comercial. Diario Oficial de la Federación. [ Links ]
Torres, I., Blancas, J., León, A., Casas, A. (2015). TEK, local perceptions of risk, and diversity of management practices of Agave inaequidens in Michoacán, Mexico. Journal of Ethnobiology and Ethnomedicine, 11(1), 1. [ Links ]
Valenzuela, A. (1997). El agave tequilero, su cultivo e industria. México: 2ª ed., Monsanto-Lítteris, p 204. [ Links ]
Valle, J.O., Córdova, A., Estarrón, M., Hernández, G., Díaz, D. M. (2009). Effect of the amino-acids supplementation on the Agave tequilana juice fermentation by Kloeckera africana in batch and continuous cultures. Journal of the Science of Food and Agriculture. [ Links ]
Vallejo, C., González, C. (2000). Identificación de los compuestos volátiles del tequila. Bebidas Mexicanas, 8, 1-17. [ Links ]
Vallejo, B., González, A., Estrada, M. (2004). Tequila volatile characterization and ethyl ester determination by solid phase micro-extraction gas chromatography/mass spectrometry analysis. Journal of Agricultural and Food Chemestry, 52 (18), 5567-5571. [ Links ]
Waleckx, E., Gschaedler, A., Colonna, B., Monsan, P. (2008). Hydrolysis of fructans from Agave tequilana Weber var. azul during the cooking step in a traditional tequila elaboration process. Food Chemistry, 108 (1), 40-48. [ Links ]
Waleckx, E, Mateos, J., Gschaedler, A. (2011). Use of inulinases to improve fermentable carbohydrate recovery. Food Chemistry, 124 (4), 1533-1542. [ Links ]
Waterhouse, L., Towey, P. (1994). Oak Lactone Isomer Ratio Distinguishes between Wines Fermented in American and French Oak Barrels. Journal of Agricultural and Food Chemistry, 42 (9), 1971-1974. [ Links ]
Zambonelli, C. (1988). Microbiologia e Biotecnologia dei Vini. Edagricole. Bologna, Italy. [ Links ]
Zamora, P., Juárez, F., Aguirre, R., Ortiz, P., Godínez, H., Álvarez, F. (2010). Variación de la concentración de azúcares y saponinas durante la cocción del maguey mezcalero Potosino. Revista Digital Científica y Tecnológica, e-Gnosis, 8, 1-11. [ Links ]
Zizumbo-Villareal, D., González, F., Olay, A., Platas, R., Cuevas, M., Almendros, M., Colunga-GarcíaMarín, P. (20091). Archaeological Evidence of the Cultural Importance of Agave spp. in Pre-Hispanic Colima, Mexico. Economic Botany, 63(3), 288-302. [ Links ]
Zizumbo-Villareal, D., Vargas, O., Rosales, J. J., Colunga-GarcíaMarín, P. (2012). Sustainability of the traditional management of Agave genetic resources in the elaboration of mezcal and tequila spirits in western México. Genetic Resources and Crop Evolution, 60, 33-47. [ Links ]
Zizumbo-Villareal, D., González, F., Olay, A., Almendros, L., Flores, P., Colunga-GarcíaMarín, P. (20092). Distillation in Western Mesoamerica before European Contact. Economic Botany, 63(4), 413-426. [ Links ]