Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Biotecnología
Print version ISSN 0123-3475
Rev. colomb. biotecnol vol.18 no.2 Bogotá July/Dec. 2016
https://doi.org/10.15446/rev.colomb.biote.v18n2.61528
DOI: http://dx.doi.org/10.15446/rev.colomb.biote.v18n2.61528
ARTÍCULO CORTO
Anatomía comparada de plantas de Dioscorea alata L. clon Caraqueño cultivadas en tres ambientes de crecimiento in vitro
Compared anatomy of Dioscorea alata L. clone Caraqueño plants cultivated in three in vitro growth environments
Misterbino Borges García*, Bernard Malaurie**, Silvio Meneses Rodríguez***, Rafael Gómez Kosky****, Marc Lartaud*****, Jean-Luc Verdeil******
* Doctor en Ciencias Biológicas . Profesor Titular. Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma. Carretera Bayamo-Manzanillo Km 17, Apdo 21, Bayamo 85 100, Granma, Cuba (Email: mborgesg@udg.co.cu.)
** Doctor en Ciencias Biológicas . Investigador Titular. IRD, Palm Development Group, UMR DIADE, 34394 Montpellier Cedex 5, France
*** Doctor en Ciencias Biológicas . Profesor Titular. Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma. Carretera Bayamo-Manzanillo Km 17, Apdo 21, Bayamo 85 100, Granma, Cuba
**** Doctor en Ciencias Agrícolas. Profesor Titular. Instituto de Biotecnología de las Plantas. Universidad Central "Marta Abreu" de Las Villas. Carretera a Camajuaní km 5. Santa Clara. Villa Clara. Cuba.
***** Especialista principal histología. CIRAD, UMR AGAP, 34398 Montpellier, France
****** Doctor en Ciencias Biológicas . Investigador Titular. CIRAD, UMR AGAP ,34398 Montpellier, France
Recibido: enero 10 de 2016 Aprobado: noviembre 17 de 2016
Resumen
La conservación in vitro de Dioscorea alata L. clon Caraqueño es fundamental para garantizar la propagación y distribución de material de plantación sano a los productores, y disponer de un banco in vitro de un clon de gran valor agronómico y comercial en la región oriental de Cuba. Con el fin de evaluar las modificaciones anatómicas que se producen en plantas de ñame en tres condiciones de cultivo in vitro: plantas conservadas por métodos de mínimo crecimiento, plantas regeneradas y plantas en fase de multiplicación en el medio MS 75 %, se realizó un análisis de la anatomía foliar y caulinar a partir de cortes transversales de la lámina foliar y del tallo, y cortes longitudinales y transversales de microtubérculos formados durante el proceso de conservación. Las hojas de las plantas conservadas mostraron menor espesor del mesófilo y la epidermis y el área de los haces conductores del tallo también fue menor, debido al proceso de stress durante la conservación in vitro. Sin embargo, durante la recuperación del material conservado a través de la regeneración y la multiplicación in vitro se restablecieron de manera normal estos parámetros. También se evidenció que los microtubérculos formados en la conservación in vitro, poseen parénquima amilífero con abundantes gránulos de almidón, capa delgada de parénquima cortical, y haces conductores poco desarrollados, todo lo cual indica la presencia de actividad meristemática.
Palabras clave: Caracterización anatómica, conservación in vitro, microtubérculos, ñame, segmentos nodales.
Abstract
The in vitro conservation of Dioscorea alata L. clone Caraqueño is fundamental to guarantee the propagation and distribution of healthy plantation material to the farmers and the establishment of one in vitro bank of this clone of great agronomic and commercial value in the Oriental Region of Cuba. With the purpose of evaluating the anatomical modifications that take place in yam plants under three in vitro culture conditions: conserved plants by slow growth, regenerated plants and in plants multiplication phase in MS 75% medium, was carried out an analysis of the foliar and caulinar anatomy from transversal cuts of the foliar sheet and of the stem, and longitudinal and transversal cuts of microtubers formed during the conservation process. Smaller thickness of the mesophyll and of the epidermis in the leaves of the conserved plants were showed and the conductive sheaves area of the stem were also smaller, due to the stress process during the in vitro conservation. However during the recovery of the conserved material through the regeneration and the in vitro multiplication were reestablished to their normal state these parameters. It was also evidenced that the microtubers formed in the in vitro conservation, have reserve parenchyma with abundant starch granules, thin cortical parenchyma and conductive sheaves little developed were determined. All this characteristics indicated the presence of meristematic activity.
Key words: Anatomical characterization, In vitro conservation, In vitro tubers, Nodal cutting, Yam.
Introducción
La producción de ñame posee como principales inconvenientes la escasez de semilla sana libre de plagas y enfermedades, y su plantación en suelos de baja fertilidad, aspectos que provocan una pérdida de hasta un 90% de los rendimientos de este cultivo (Balogun et al., 2014).
La conservación de ñame mediante el empleo de segmentos nodales fue abordada por primera vez en el Instituto Internacional de Agricultura Tropical (IITA) de Nigeria (Ng & Hahn, 1985) a las temperaturas de 18-22 °C con una frecuencia de subcultivos de 1,5 a 2 años. Ng (1996) citado por Malaurie et al. (2001), reportó una collección de 1700 accesiones, pertenecientes a 7 especies. Hanson (1986) señaló los métodos de almacenamiento de las colecciones de las plantas tuberosas y en particular de las colecciones in vivo (bancos de germoplasma en campo) e in vitro (corto, mediano y largo plazo) del ñame en el mundo.
Malaurie et al. (1993), fueron los primeros en evaluar el establecimiento y mantenimiento de una colección in vitro de ñame, en las condiciones de crecimiento mínimo, mediante el cultivo de segmentos nodales en un medio con 2 g L-1 de carbón activado y una baja concentración en elementos minerales y sacarosa. Estos autores señalaron como principales inconvenientes de ese método la necesidad de realizar frecuentes subcultivos lo que aumenta el costo de conservación, posibles errores de identificación, la contaminación microbiana y la necesidad de instalaciones con mano de obra especializada.
Mantell (1993), logró la conservación in vitro exitosa por mínimo crecimiento durante 9 meses con altos porcentajes de supervivencia (95%), los menores porcentajes de senescencia foliar (10%) y 96% de regeneración en plantas completas con un crecimiento normal en condiciones de micropropagación, de los principales cultivares de las zonas del Caribe, Pacífico y Oeste de África, para las especies de D. alata, D. bulbifera, D. cayenensis, D. esculenta, D. rotundata y D. trifida.
En Cuba a partir de 1990, dada la necesidad de incrementar el material de plantación de ñame de buena calidad, se comenzó a desarrollar la propagación in vitro de los principales clones comerciales de D. alata, mediante la utilización de segmentos nodales (Borges et al., 2011).
Borges et al. (2003), evaluaron la conservación por crecimiento mínimo durante 9 meses de algunos clones del germoplasma de D. alata en Cuba en un medio de cultivo complementado con carbón activado (0; 2 g L-1), manitol y BAP a diferentes concentraciones, pero no definieron las concentraciones más adecuadas de estas dos últimas sustancias. Esto fue logrado posteriormente por Borges et al. (2009), quienes demostraron que las variantes de cultivo formadas por el medio MS al 75% + vitaminas MS + sacarosa 30 g.L-1 + carbón activado 2 g.L-1 y el MS al 75% + vitaminas MS + sacarosa 30 g.L-1 + carbón activado 2 g.L-1 + BAP 0,1 mg.L-1 permitió de manera efectiva la conservación de plantas in vitro a partir de segmentos uninodales de D. alata durante 9 y 12 meses con altos porcentajes de supervivencia, un número significativo de microtubérculos, los menores porcentajes de senescencia foliar y 100% de regeneración en plantas completas con un crecimiento normal en condiciones de micropropagación.
Borges (2011) determinó la conservación in vitro efectiva a partir de segmentos uninodales de D. alata clon Caraqueño en el medio de cultivo compuesto por sales MS (75%), sacarosa 30 g.l-1 y carbón activado 2,0 g.l-1, durante 12 meses, con el mayor porcentaje de supervivencia (97%) y número de microtubérculos (1.5), menor porcentaje de senescencia foliar (19,5%) y 100% de regeneración en plantas completas, sin diferencias morfológicas con el control in vitro sin conservar. Sin embargo, se debe profundizar a nivel celular y de tejidos en el proceso de conservación in vitro del material vegetal. Es por ello, que ha sido necesario continuar trabajando en la obtención de una metodología eficiente y segura de preservación de los recursos genéticos de esta especie, para garantizar la propagación y distribución de material de plantación sano a los productores, y disponer de un banco in vitro para el intercambio de germoplasma e iniciar futuros programas de mejoramiento genético necesarios para diversificar y potenciar este cultivo a partir de una validación de la metodología de conservación in vitro no solo desde el punto de vista morfoagronómico y molecular, sino también histológico, en un clon de gran importancia económica en Cuba (Borges et al., 2015) y donde no se dispone hasta la fecha de antecedentes de cómo se afecta la anatomía de las plantas in vitro durante el proceso de conservación por mínimo crecimiento, aspecto novedoso que ofrece la presente investigación.
Tomando en consideración lo antes expuesto, el objetivo de esta investigación fue estudiar la anatomía de plantas de ñame bajo tres condiciones de cultivo in vitro: conservación por mínimo crecimiento, regeneración y multiplicación, a fin de determinar las características anatómicas que pudiesen afectar el establecimiento a las condiciones convencionales de micropropagación.
Materiales y métodos
La investigación fue desarrollada en el Centro de Estudios de Biotecnología Vegetal de la Facultad de Ciencias Agrícolas en la Universidad de Granma, Bayamo, Cuba en colaboración con los Centros IRD/CIRAD de Montpellier, Francia.
Técnicas y procedimientos generales
Material vegetal. Se emplearonhojas y tallos provenientes de: 1) plantas in vitro de Dioscorea alata L clon Caraqueño conservadas durante 12 meses (medio MS 75% + vitaminas MS + sacarosa 30 g.L-1 + carbón activado 2 g. L-1); 2) plantas in vitro en fase de multiplicación (regeneradas a los 56 días) (medio MS 75% + vitaminas MS + sacarosa 30 g.L-1 + cisteína 10 m g. L-1) procedentes del material conservado durante 12 meses y 3) plantas in vitro en fase de multiplicación a los 35 días (medio MS 75% + vitaminas MS + sacarosa 30 g.L-1 + cisteína 10 m g.L-1). También se utilizó los microtubérculos formados por las plantas in vitro conservadas durante 12 de meses (1.5 microtuberculos por planta).
Análisis histológico
Los análisis histológicos se realizaron en cortes transversales de hojas y tallos de plantas in vitro conservadas, plantas in vitro regeneradas y plantas in vitro en fase de multiplicación. También se analizaron los cortes longitudinales y transversales de los microtubérculos formados por las plantas in vitro conservadas.
Las muestras fueron fijadas en 20 ml de una solución compuesta por 50% etanol, 10% formaldehído y ácido glacial acético (18:1:1) durante 72 horas. La deshidratación de las mismas se realizó mediante la inmersión en baños sucesivos de etanol (30, 50, 60, 70, 80, 90, 95 y 100%) en un equipo Histo-TEK. Luego se efectuó la impregnación de las muestras en resina Technovit 7100 (Heraeus Kluzer GmbH, Germany) (1g de kit de resina pura en 100 ml de solución de impregnación) y su inclusión en una solución compuesta por 1ml de endurecedor con 15 ml de medio de impregnación, se añadió a las placas histológicas, una vez realizada la orientación de las muestras, se dejó polimerizar una noche a temperatura ambiente en el flujo laminar vertical.
Posteriormente se insertó un cilindro con cola sobre el cual polimerizó el medio de inclusión (Technovit 3040; 2:1 polvo-liquido) y se dejó secar 24 horas hasta separar los bloques con las muestras incluidas en la resina.
Los cortes fueron realizados con la ayuda de un microtomo (Historange, LKB), equipado de cuchillas Histoknife Kulzer, que permitieron la obtención de cortes muy finos de 3 µm de espesor, los cuales fueron depositados en un recipiente conteniendo agua. Posteriormente, fueron recuperados con una pinza para ser transferidos a un portaobjeto y secados sobre una placa caliente a temperatura de 50°C, durante 10 minutos. Finalmente, a los cortes histológicos se les realizó una doble coloración con el ácido periódico-reactivo de SCHIFF (evidencia las reservas glucídicas) y el Naphthol Blue Black (indica las reservas proteicas) según Buffard-Morel et al. (1992), y el montaje en Bálsamo de Canadá. Las láminas preparadas fueron observadas bajo el microscópio óptico (Zeiss Imager A.1 microscope, Germany) acoplado a computadora (Pentium Dell).
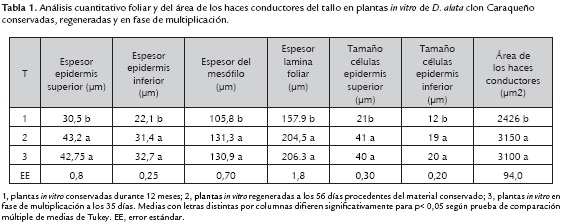
Para el análisis cuantitativo (a partir de la toma de imágenes) se determinaron las siguientes evaluaciones: en la hoja, espesor epidermis superior e inferior (µm), espesor del mesófilo (µm), espesor lámina foliar (µm), tamaño células epidermis superior e inferior (µm); en el tallo, área de los haces conductores (µm2); en el tubérculo, número de gránulos de almidón por célula y área de los mismos (µm2). Las mediciones fueron realizadas mediante la utilización del software Imagen J versión 1.41h. (Sheffield, 2008).
El análisis cualitativose realizó mediante la observación directa en la computadora de las imágenes tomadas de los diferentes cortes observados bajo el microscópio óptico, en las cuales se determinaron las principales características: forma de los gránulos de almidón; presencia, forma y tipos de células y tejidos de diversos órganos, así como espacios intercelulares.
Análisis estadístico
Se realizó un análisis de varianza de clasificación simple a los datos del análisis histológico cuantitativo de los cortes transversales de hojas y tallos. Se aplicó la prueba de comparación múltiple de medias de Tukey al 5 % de probabilidad del error. Todos los análisis estadísticos se realizaron con el programa Statistica para WINDOWS, versión 10.0 (StatSoft, 2011).
Resultados y discusión
Análisis histológico de hojas y tallos
El análisis histológico cuantitativo foliar y del área de los haces conductores del tallo de plantas in vitro conservadas, plantas in vitro regeneradas y plantas in vitro en fase de multiplicación se presentan en la tabla 1. Los mayores valores significativos para los distintos parámetros evaluados referidos al espesor de epidermis superior e inferior, del mesófilo, la lámina foliar, el tamaño promedio de las células de la epidermis superior e inferior y el área de los haces conductores correspondieron para las plantas in vitro regeneradas y plantas in vitro en fase de multiplicación.
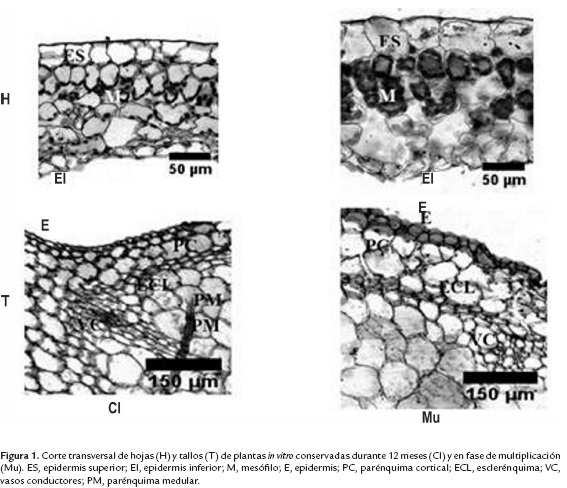
En la figura 1 se ilustran los resultados del análisis histológico cualitativo realizado al tejido foliar y del tallo de plantas conservadas in vitro durante 12 meses y en fase de multiplicación (los resultados de las plantas in vitro regeneradas no se muestran ya que son semejantes a los de las plantas in vitro en fase de multiplicación). Se evidencia un menor tamaño de las células y tejidos de los órganos vegetativos analizados, del contenido de pigmentos fotosintéticos del mesófilo de la hoja y un pobre desarrollo de los vasos conductores del tallo en la plantas in vitro conservadas. En este sentido Espiand (1983), al analizar desde el punto de vista histológico las consecuencias del cultivo in vitro sobre la morfogénesis de plantas in vitro de D. alata cv. Tahíti obtenidas a partir de segmentos nodales cultivados a los 35 días en el medio MS en condiciones normales de micropropagación (Mantell et al.,1978), determinó en el corte transversal del tallo estructuras anatómicas comparables a las descritas para este órgano en esta investigación. Para las características anatómicas de las plantas in vitro conservadas y regeneradas, no fue posible realizar comparación con otros autores, pues no existe información hasta la fecha al respecto en la literatura, lo que destaca el aporte novedoso de la investigación.
Finalmente, los resultados del análisis histológico tanto cuantitativos como cualitativos de hojas y tallos, demostraron claramente una disminución significativa del crecimiento de las células y tejidos de las plantas in vitro durante el proceso de conservación hasta los 12 meses de cultivo, atribuible al estrés producido durante la conservación, fundamentalmente a causa de la disminución de la absorción de agua y nutrientes a nivel celular y tisular (Roca et al., 1991).
La presente investigación demostró además que una vez que desaparece este estrés, las plantas in vitro regeneradas del material proveniente de la conservación durante 12 meses recuperan su capacidad normal de crecimiento y multiplicación, aspecto esencial que constituye un aporte novedoso desde el punto de vista histológico en favor del protocolo de conservación obtenido para D. alata L clon Caraqueño, el cual desde el punto de vista morfoagronómico y molecular ya ha sido validado por Borges (2011).
Análisis histológico de microtubérculos
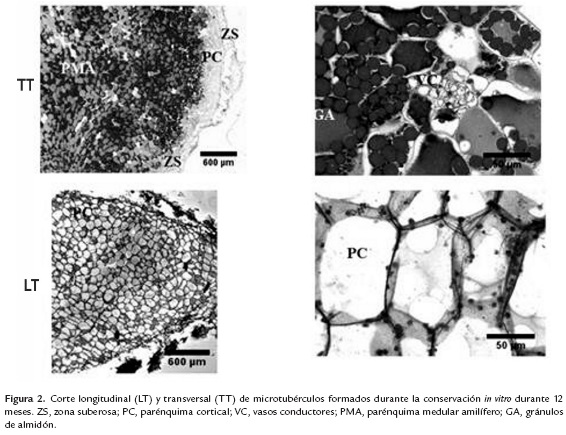
El análisis histológico cuantitativo de los microtubérculos formados en la conservación in vitro durante 12 meses arrojó un número de gránulos de almidón por célula de 9 con un área de 193,2 µm2 , mientras que las características cualitativas (figura 2) de la sección transversal muestran que la mayor parte de los microtubérculos está formado por parénquima amilífero con abundantes gránulos de almidón de forma esférica, una delgada capa de parénquima cortical, fina zona suberosa y haces conductores poco desarrollados que poseen cambium extrafasicular que constituye un tejido meristemático secundario producto de una desdiferenciación todo lo cual indica la presencia de actividad regenerativa meristemática.
Estos resultadosconcuerdan con los estudios histológicos realizados en tubérculos in vitro de D. alata (Espiand, 1983), en los cuales se ha demostrado una estructura integrada por un parénquima fundamental amiláceo, un cambium extrafasicular, un parénquima cortical y una delgada zona suberosa. Esta estructura, revela la alta capacidad de reserva energética y regenerativa de estos órganos, lo cual ofrece la posibilidad adicional del uso de los microtubérculos como una vía fundamental para potenciar la propagación de este cultivo. En este sentido Ondo Ovono et al. (2009), plantearon que en muchas especies de Dioscoreas cultivadas in vitro a partir de segmentos nodales son capaces de producir microtubérculos bajo ciertas condiciones, los cuales constituyen un gran potencial para la multiplicación rápida de material clonal libre de patógenos, mientras que, Balogun & Gueye (2013) y Rodríguez et al. (2015), declararon que la formación de microtubérculos constituye una de las formas más importantes de micropropagación vía organogénica del cultivo del ñame.
Por otra parte, Cabrera (2010), demostró las potencialidades de los microtuberculos de D. alata en sistemas de propagación directa en campo con altos porcentajes de supervivencia y rendimientos mayores que con el material de propagación convencional.
En la revisión realizada no se apreciaron estudios similares en la caracterización histológica de materiales de Dioscorea spp. conservados in vitro.
Conclusiones
Las hojas de las plantas conservadas mostraron de manera significativa menor espesor del mesófilo y de la epidermis y el área de los haces conductores del tallo también fue menor, debido al stress de las plantas durante el proceso de conservación in vitro. Sin embargo, durante la recuperación del material conservado a través de la regeneración y la multiplicación in vitro se restablecieron de manera normal estos parámetros.
Los microtubérculos formados en la conservación in vitro durante 12 meses, poseen principalmente un parénquima amilífero con abundantes gránulos de almidón de forma esférica, una delgada capa de parénquima cortical, fina zona suberosa y vasos conductores poco desarrollados todo lo cual indicala presencia de actividad meristemática.
Agradecimientos
Esta investigación fue ejecutada exitosamente gracias a la cooperación bilateral universitaria Cuba-Francia y el apoyo incondicional de los equipos de investigación IRD/CIRAD/UM II de Montpellier, Francia y CEBVEG de la Universidad de Granma, Cuba. A todos mis más sinceros agradecimientos.
Referencias bibliográficas
Balogun, M.O., & Gueye, B. (2013). Status and prospects of biotechnology applications to conservation, propagation and genetic improvement of yam. In: Kishan Gopal Ramawat and Jean Michel Merillon (eds). Bulbous Plants: Biotechnology. CRC. Press. Pp. 92-112. [ Links ]
Balogun, M.O., Maroya, N., & Asediu, R. (2014). Status and prospects for improving yam seed systems using temporary immersion bioreactors. African Journal of Biotechnology, 13 (15), 1614-1622. [ Links ]
Borges, M., Meneses, S., Vázquez, J., & García, M. (2003). Conservación in vitro de germoplasma de Dioscorea alata L. por crecimiento mínimo. Plant Genetic Resources Newsletter, 133, 8-12. [ Links ]
Borges, M., Alarcón, Y., Malaurie, B., Hernández, Y., & Silva, J. J. (2009). Conservación in vitro de Dioscorea alata L. clon Caraqueño. Revista Peruana de Biología, 16 (2), 20-25. [ Links ]
Borges, M. (2011). Caractérisation de la diversité génétique de Dioscorea alata L. et optimisation de la production de plantes in vitro saines comme source de semence conforme á Cuba. Thèse pour le doctorat en Sciences agronomiques, Biotechnologies Agro-alimentaires. Université des Antilles et de la Guyane, Guadeloupe, France. 91 pp. [ Links ]
Borges, M., Destrade, R., Meneses, R., Gómez, R., Malaurie, B., Hamon, P., & Demenorval, L.C. (2011). Optimización de un medio de cultivo para plantas micropropagadas de Dioscorea alata L. Revista Colombiana de Biotecnología. 18(2), 221-228. [ Links ]
Borges, M., Gómez, R., Estrada, E., Reyes, D., Malaurie, B., & Destrada, R. (2015). Respuesta en campo de plantas in vitro de Dioscorea alata L. clon 'Caraqueño' en distintos momentos de plantación. Biotecnología Vegetal, 15(3), 137-142. [ Links ]
Buffard-Morel, J., Verdeil, J.L., & Pannetier, C. (1992). Embryogenèse somatique du cocotier (Cocos nucifera L.) à partir de tissus foliaires : étude histologique. Canadian. Journal. Botanical, 70, 735-741. [ Links ]
Cabrera, M., Gómez, R., Rayas, A., De Feria M., López J., Medero V., Basail M., Rodríguez G., & Santos, A. (2010). Evaluación en campo de plantas de ñame (Dioscorea alata L.) obtenidas de los microtubérculos formados en Sistema de Inmersión Temporal. Revista Colombiana de Biotecnología, 12(1), 1-6. [ Links ]
Engelmann, F. (1997). In vitro conservation methods. In Biotechnology and PIant Genetic Resources: Conservation and Use, B.V. Fordlloyd, J.H. Newburry and J.A. Callow (Eds.). CAB I, in press. [ Links ]
Espiand, H. (1983). Conséquences de la culture in vitro sur la morphogenése de boutures nodales de I'igname (Dioscorea alata L. cv « Tahiti »). Thése 3e cycle, Paris XI, no 3460. Orsay, France, 80 pp. [ Links ]
Malaurie, B. (2001). Medium and long term conservation and safe international exchange of germplasm from food and cash tropical crops. Acta Horticulturae, 560, 69 -77. [ Links ]
Malaurie, B., Pungu, O., Dumont, R., Trouslot, M.F. (1993). The creation of an in vitro germplasm collection of yam (Dioscorea spp.) for genetic resources preservation. Euphytica, 65, 113-122. [ Links ]
Mantell, S.H. (1993). lntegrated use of micropropagation and convencional propagation techniques for production of certified seed tubers of tropical yams (Dioscorea spp.) in Adapted propagation techniques for commercial crops of the tropics. Proceedings of the southeast Asian Regional workshop on propagation techniques for commercial crops of the tropics, Ho Chi Minh City, Vietnam, 7-12 February 1993. IFS, Internacional Foundation for Sciences, p. 66-93. [ Links ]
Mantell, SH, Haque, SQ & Whitehall, AP. (1978). Clonal multiplication of Dioscorea alata L. and Dioscorea rotundata Poir. yams by tissue culture. Horticultural Sciences, 53 (2), 95-98. [ Links ]
Ondo Ovono, P., Kevers, C., Dommes, E. (2009). Effects of reducing sugar concentration on in vitro tuber formation and sprouting in yam (Dioscorea cayenensis-D. rotundata complex). Plant Cell Tissue and Organ Culture, 99, 55-59. [ Links ]
Rodríguez, D., Galvéz, D., Cabrera, M., Beovides, Y, García, Y., & Robaina, A. (2015). Respuesta agronómica de plantas de Dioscorea rotundata Poir cv. 'Blanco de Guinea' obtenidas de minitubérculos producidos en casa de cultivo". Biotecnología Vegetal, 15(1), 53 - 58. [ Links ]
Sheffield, J.B. (2008). Imagen J. A useful tool for image processing and analysis. Version 1.41 h. National Institutes of Health. USA. [ Links ]
Statsoft. (2011). Statistica for Windows. Release 10. Tulsa. OK. [ Links ]