INTRODUCCIÓN
La industria petrolera es la principal fuente de ingresos para Venezuela, cuyas actividades de manejo y extracción han provocado graves contaminaciones de suelos, agua y aire; algunos de estos entornos con vocación agrícola, ganadera o piscícola (Windevoxhell et al., 2009).
El petróleo es una mezcla de hidrocarburos alifáticos, aromáticos, resinas y asfaltenos, algunos de los cuales son carcinogénicos y neurotóxicos causantes de grandes trastornos en los componentes bióticos y abióticos de los ecosistemas (Khan & Abbas, 2011; Udeh et al., 2013). Los residuos petroleros se pueden originar por derrame o dispersión durante las actividades de perforación, refinación y transporte, o a filtraciones desde los depósitos, derrames durante las operaciones de carga y descarga en los puertos y por fugas o desperdicios desde los buques tanqueros (Gofar, 2013).
Se han desarrollado técnicas físicas, químicas y biológicas para enfrentar los efectos adversos causados por un derrame de petróleo en los diferentes ecosistemas. Estas técnicas sirven para eliminar tanto contaminante como sea posible y reducir el impacto ambiental generado (Narváez et al., 2008). Sin embargo, estas tecnologías son costosas y pueden conducir a la descomposición incompleta de los contaminantes (Das & Chandran, 2011).
La biorremediación es una tecnología prometedora para el tratamiento de sitios contaminados, ya que es de bajo costo, lleva a la completa mineralización y no requiere técnicas sofisticadas para su funcionamiento. Se puede igualmente llevar a cabo in situ, eliminando así los riesgos asociados con el transporte de los suelos contaminados (Das & Chandran, 2011; Chibuike & Obiora, 2014). La biorremediación ocurre naturalmente, por lo que se le considera como una manera segura de tratar suelos contaminados. Los subproductos son principalmente agua, CO2 y biomasa celular, los cuales son inofensivos y útiles para el crecimiento vegetal. Las técnicas de biorremediación están basadas en la habilidad de algunos organismos (bacterias, algas, hongos, nematodos y plantas) de consumir hidrocarburos como fuente de energía y carbono, a la vez que simultáneamente limpian el área contaminada. Las bacterias son los agentes más activos y principales degradadores en la descomposición del petróleo (Hassaine & Bordjiba, 2015).
La asociación entre las plantas de la zona contaminada y los microorganismos es el factor clave en el proceso de biorremediación. Las raíces incrementan la diversidad y número de microorganismos en la rizosfera al proporcionar carbono y nitrógeno a través de los exudados radicales (azúcares, ácidos orgánicos y otros compuestos orgánicos de elevado peso molecular); este efecto de la rizosfera puede ser explotado y utilizado en la biorremediación; proceso específicamente definido como rizorremediación (Mikkonen et al., 2011).
En la rizorremediación, la transferencia de los compuestos desde la fase insoluble a la soluble se considera como la etapa limitante, pues los compuestos deben ser liberados a la fase acuosa antes de entrar a las células microbianas para sufrir la ulterior transformación intracelular por las enzimas catabólicas. Los surfactantes aumentan la solubilidad de los hidrocarburos y mejoran la afinidad de las células microbianas por los sustratos facilitándose su disponibilidad y degradación (Kumar et al., 2006). En algunas especies de Pseudomonas, capaces de degradar hidrocarburos, la producción de surfactantes ha sido reconocida como la primera etapa del proceso de degradación. Los surfactantes son de naturaleza glicolipídica, siendo los ramnolípidos los más comunes (Leite et al., 2016). Se han identificado en P. aeruginosa (Moussa et al., 2014), P. putida (Janek et al., 2013), P. fluorescens (Olanipekun et al., 2012) y P. stutzeri (Canada, ME & MH, 2015; Xiao et al., 2016).
El género Pseudomonas es el grupo más heterogéneo y ecológicamente importante de las bacterias conocidas. Debido a que los requerimientos nutricionales de las especies de este género son muy simples, se han detectado representantes en prácticamente todos los hábitats naturales y tienden a ser predominantes entre las bacterias asociadas a la rizosfera de las plantas (Arora, 2015; de Oliveira et al., 2015). Uğur et al. (2012), Agrawal et al. (2015), y Kumar et al. (2015), encontraron varias especies de Pseudomonas en algunas leguminosas, que exhibieron actividades de control biológico y biorremediación.
Las plantas leguminosas se han utilizado para la revegetación de los sitios contaminados con crudos, muy probablemente por ser eficaces en el proceso de rizorremediación, debido a su habilidad de aumentar el nitrógeno del suelo y a la elevada relación C:N (Mikkonen et al., 2011; Edwin-Wosu, 2013) . El uso de la asociación leguminosa-Pseudomonas spp., para la rizorremediación de suelos contaminados de la sabana del estado Monagas podría ser de gran valor en la recuperación de estas áreas. En este contexto el objetivo del presente estudio incluye el aislamiento, caracterización e identificación de las especies de Pseudomonas existentes en la rizosfera de una leguminosa presente (colonizadora o sobreviviente) en un suelo de sabana contaminado por un derrame de petróleo ocurrido en el año 2011, con el fin de explicar cómo estas especies bacterianas naturalmente apoyan el crecimiento de esta leguminosa a través de la reducción de la toxicidad del crudo derramado (efectos hidrocarburoclásticos). Al mismo tiempo los resultados favorecerían la recomendación de revegetación del área contaminada con la especie identificada.
MATERIALES Y MÉTODOS
Área de muestreo. La zona contaminada por crudo está ubicada a 100 metros (9° 38' 52" N, 63° 7' 20'' E, 46 msnm) de la entrada del pueblo de Amana del Tamarindo, estado Monagas, Venezuela. La contaminación se produjo por un derrame de petróleo de la tubería de 16 pulgadas Caripito-Puerto La Cruz. El área muestreada se circunscribió a 50 m2 de la zona.
Identificación y caracterización de la leguminosa colectada. Las porciones de la parte aérea de una leguminosa presente en el área muestreada fueron prensadas por los métodos tradicionales para su posterior identificación. Se realizaron observaciones del espécimen durante cuatro años (2012-2016) a los fines de detectar y observar floración. Debido a la carencia de flores y frutos, para la determinación de la especie se utilizaron los ejemplares del herbario antes mencionado, así como descripciones taxonómicas y claves basadas en características vegetativas (Keller, 2004; Rodríguez & Gámez, 2010; Parra & Gámez, 2012). El nombre específico válido fue actualizado según la base de datos TROPICOS del Missouri Botanical Garden (MBG, 2016). Las exsiccatae fueron depositadas en el herbario de la Universidad de Oriente (UOJ, UDO, Maturín, Venezuela).
Aislamiento, caracterización e identificación de especies hidrocarburoclásticas de Pseudomonas. Para aislar las especies de Pseudomonas asociadas a la rizosfera de la leguminosa colectada, las raíces distribuidas en un área de 60 cm3 fueron transferidas al laboratorio en una bolsa estéril de plástico bajo refrigeración en hielo. Se obtuvo suelo rizosférico por sacudidas de la raíz, del cual, una vez mezclado en condiciones asépticas se tomaron 5g. Esta muestra fue suspendida en 100 ml de medio líquido de Bushnell Haas: HB (Bushnell Haas, 1941) con 1% (p/v) de petróleo como única fuente de carbono, para favorecer la multiplicación de microorganismos hidrocarburo degradantes. Las muestras se incubaron a temperatura ambiente en un agitador orbital a 180 rpm durante 7 días. Luego se diluyeron en medio líquido HB (5%, v/v) con crudo (1% w/v) para obtener cinco réplicas, cada una fue sembrada en placas de agar base para Pseudomonas suplidas con Cetrimida (C: 10g), Fucidina (F: 10g) y cefalosporina (C: 50gL-1) (Agar CFC). Las colonias aisladas se sembraron nuevamente en agar CFC para su purificación; siguiendo así las recomendaciones de Mead y Adams (1977), quienes sugieren esta combinación (CFC) para producir un medio más específico para aislar Pseudomonas, el cual permite el crecimiento de especies pigmentadas y no pigmentadas. La incubación se efectuó a 30º C durante 48 h. Se realizaron subcultivos de las colonias en placas de agar nutritivo (Difco) para la observación de las características fenotípicas. La prueba de tinción de Gram se utilizó para confirmar la negatividad de las colonias, grupo al cual pertenecen las especies de Pseudomonas. También, se hicieron ensayos de actividad de la enzima catalasa, mediante la adición de peróxido de hidrógeno (3%) a cultivos puros, y citocromo oxidasa (prueba diagnóstica Pathotec® CO), la cual permite diferenciar Pseudomonas spp. (oxidasa+) de otras especies de Pseudomonas y de otros bacilos gramnegativos (oxidasa-). La caracterización de las especies en cuanto a la utilización de carbohidratos se realizó a través de RaPIDTm NF Plus (Remel) y API 20 NZ (BioMérieux). La producción de los pigmentos piocianina y fluoresceína se observó en los medios Pseudomonas agar P y Pseudomonas agar F, respectivamente. Los micrométodos cualitativos RaPIDTm NF Plus (Remel) y API 20 NZ (BioMérieux), también permitieron la identificación de las especies, al incorporar pruebas convencionales y monosubstratos cromogénicos. Los resultados fueron comparados con los obtenidos por Uğur et al. (2012), quienes ampliamente caracterizaron varias especies de Pseudomonas, y con los registrados en el Manual de Bacteriología Sistemática de Bergey (Brenner et al., 2005). Además, se realizó la confirmación de especies con MicroScan AutoScan4 de Dade Behring, siguiendo la metodología indicada por el fabricante y utilizando los paneles de identificación rápida.
Con la finalidad de confirmar la capacidad hidrocarburoclástica de las cepas identificadas, estas se cultivaron en 250 ml de medio HB con (1%) de petróleo como única fuente de carbono. Las muestras se incubaron a temperatura ambiente en un agitador orbital a 180 rpm durante 48 horas. Se midió la densidad óptica de cada cultivo al inicio (T0) y a las 24 (T24) y 48 (T48) h a 600 nm en un espectrofotómetro (Spectronic 20) Bausch & Lomb.
RESULTADOS Y DISCUSIÓN
Área de muestreo. En el área de muestreo se encontraron muy pocas plantas, pertenecientes a las familias Fabaceae y Poaceae, por lo cual se puede considerar como un sitio arrasado (figuras 1A y 1B). Se sostiene que la muerte de las plantas en sitios contaminados por petróleo es debido a los efectos negativos de los hidrocarburos en la anatomía, morfolología y fisiología de las plantas. Eze et al. (2013), y Tanee & Albert (2015) reportaron al crudo como un material hidrofóbico, que reduce la respiración y la permeabilidad de las membranas celulares de las partes afectadas; por lo tanto, disminuye la absorción de nutrientes, el metabolismo y el crecimiento, y eventualmente conduce a la muerte.

Figura 1 Áreas de la zona muestreada. (A) Restos vegetales, productos de la muerte de las plantas por la contaminación con crudo, (B) Residuos de petróleo dejados por el derrame.
Identificación y caracterización de la planta leguminosa colectada. Según las descripciones y claves consultadas y la comparación con las exsiccatae del herbario UOJ, la leguminosa recogida fue identificada como Samanea saman (Jacq.) Merr., perteneciente a la Familia Fabaceae.
Rodríguez & Gámez (2010) y Parra & Gámez (2012) detallan las características que distinguen a S. saman - árboles, 10-20 m de alto. Tallos jóvenes angulares, pilosos, lenticelas pequeñas. Hojas alternas, compuestas, bipinnadas; pinnas y pinnulas opuestas; pinnulas elípticas-ovobadas, base convexo-asimétrica, borde liso, ápice redondeado con un pequeño mucrón, pilosas en la superficie abaxial y casi glabras en la adaxial. Pinnas 3-4 pares y 4-8 pínnulas por pinnas; pinnas 1,5-10 cm de largo; pínnulas 1-4,8 cm de largo. Pecíolos levemente angulares-acanalados, pilosos, 2,5-5,5 cm de largo. Peciolulos acanalados, 0,6-1,8 cm de largo. Pulvínulos 0,5-1 cm de largo. Pulvinulillos 0,3-0,8 cm de largo. Raquis principal acanalado; piloso, 3,5-8,5 cm de largo. Raquis secundarios levemente angulares, pilosos, 2-8,5 cm de largo. Mucrón diminuto presente. Glándula 1, convexa, en el ápice del pecíolo y cerca de la base de cada par de pinnas, por lo general ausente en el primer par, varían mucho de tamaño en una misma pinna. Estípulas laterales, lineales; caducas, 0,3-0,7 cm de largo. Venación broquidódroma.
Samanea saman (Jacq.) Merr. tiene los siguientes sinónimos: Albizia nicoyana Britton & Rose, Albizia saman (Jacq.) F. Muell., Enterolobium samán (Jacq.) Prain, Mimosa saman Jacq., Pithecellobium saman (Jacq.) Benth. y Pithecellobium saman var. saman; siendo los nombres aceptados: Albizia saman (Jacq.) F. Muell., Pithecellobium saman (Jacq.) Benth. y Samanea tubulosa (Benth.) Barneby & J.W. Grimes (MBG, 2016).
El espécimen colectado se caracterizó por una altura menor a la descrita en la literatura, con pocas ramas y hojas, y pérdida de follaje (figuras 2A y B). Durante los cuatro años de observación por visitas al área contaminada no se observó floración. Efectos adversos en el crecimiento de las plantas debidos a la contaminación por petróleo han sido indicados por varios investigadores, se considera que son consecuencia de alteraciones morfológicas, anatómicas, fisiológicas y metabólicas. En este contexto, Achuba (2006) reportó que la disminución del crecimiento es debida a una reducción de la actividad mitótica y al tamaño de las células formadas. Lorestani et al. (2014), demostraron la compactación de los haces vasculares en el tallo, lo cual reduce el transporte de petróleo hacia la planta pero también de agua y nutrientes y Komolafe et al. (2015), comprobaron el rompimiento y dispersión de las células epidérmicas foliares y la reducción del tamaño de los estomas. Aunado a estas observaciones, se han notado cambios morfológicos en algunas especies, incluyendo Samanea saman, a los cuales se les considera como una adaptación al medio ambiente adverso producido por la presencia de crudo. Entre estos pueden citarse: reducción de las regiones meristemáticas (Inckot et al. 2008), reducción del área foliar y de la densidad estomática (Adenipekun et al. 2009), pérdida de follaje para minimizar la tasa de transpiración (Osawaru et al., 2013), engrosamiento de la epidermis para impedir la pérdida del agua intercelular (Lorestani et al., 2014).

Figura 2 Samanea saman (Jacq.) Merr. A. Planta sumergida en el área inundada y contaminada por crudo, B. Hojas bipinnadas (muestra de herbario).
En cuanto a la ausencia de floración en la planta de Samanea saman colectada, muchos investigadores han considerado esta condición como una consecuencia de la inhibición o reducción de la división celular. Kabir et al. (2012), encontraron que en Samanea saman creciendo bajo condiciones climáticas adversas y en suelos con fuerte contaminación ocurre una reducción de las partes reproductivas y de la biomasa. Observaciones similares son citadas por Osawaru et al. (2013), en especies de Abelmoschus, donde ocurrió un retraso en el número de días para la primera floración cuando crece en suelos contaminados por crudo, siendo necesario el doble del número de días en comparación con el control, y Baishya y Chandra (2015) notaron una completa inhibición de la floración en Ricinus communis en los niveles más altos de contaminación (5% de crudo).
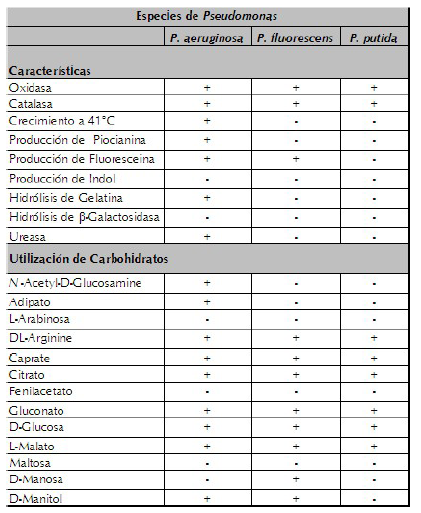
Aislamiento, caracterización e identificación de especies hidrocarburoclásticas de Pseudomonas De las placas de agar CFC se aislaron 20 cepas de presuntas Pseudomonas, cuya prueba de tinción de Gram permitió la observación de bacilos y determinar la reacción al tinte, la cual resultó negativa (Gram-), grupo al que pertenecen las especies de Pseudomonas. En agar nutritivo, las colonias fueron circulares, convexas, con margen entero, con o sin pigmentación, que varió entre marrón y amarillo pálido, algunas brillantes. Además, la prueba de la enzima catalasa, permitió descartar cinco aislados (catalasa negativos), lo cual los excluye como pertenecientes al género Pseudomonas. Los resultados de la caracterización bioquímica y la producción de los pigmentos piocianina y fluoresceína, en placas con agar P y agar F, respectivamente, permitieron la comparación con las descripciones de las especies de Pseudomonas dadas en el Manual de Bacteriología Sistemática de Bergey (Brenner et al., 2005) y en Uğur et al. (2012). De las veinte cepas, diez fueron identificadas como Pseudomonas fluorescens, 5 como P. putida y 5 como P. aeruginosa (tabla 1). La identificación de las especies encontradas fue confirmada a través de paneles de identificación rápida (MicroScan AutoScan 4 de Dade Behring).
Tabla 1 Características diferenciales y utilización de carbohidratos de las especies aisladas de Pseudomonas
Las mediciones de la densidad óptica de los cultivos de cada una de las cepas identificadas variaron desde 0,3 a 0,4 en T0, 0,8 a 1,0 en T24 y 1,1 a 1,2 en T48, y denotan el crecimiento de cada una de las cepas en el medio HB con petróleo como única fuente de carbono.
La resistencia de las especies de Pseudomonas a la contaminación por petróleo podría basarse en mecanismos similares a los presentados contra los antibióticos, llamados resistencia mediada por impermeabilidad, cuyas bases son la resistencia de la membrana externa poco permeable, dada por la presencia de porinas; la aparición de una β - lactamasa AmpC inducible; y un sistema activo de bombas de expulsión de antimicrobianos (Adekunle, 2012). Adicionalmente, los estudios de Weber et al. (1994), y Lăzăroaie (2009), revelaron varios mecanismos defensivos desarrollados por P. aeruginosa en condiciones de toxicidad por contaminación con hidrocarburos; entre estos:
Mineralización de los hidrocarburos saturados y aromáticos.
Reducción de la hidrofobicidad, lo que impide la acumulación de hidrocarburos en la membrana celular.
Cambios en los grupos principales de los fosfolípidos de las membranas para mantener su fluidez e impermeabilidad, restaurar su integridad y reducir la degradación de los hidrocarburos en ella.
Fuerte inducción de la síntesis de algunas proteínas y reordenamiento de las vesículas para extraer hidrocarburos del interior de las células.
Modificación de los polisacáridos de la membrana celular.
Flujo de hidrocarburos en un proceso energético dependiente unido al sistema de transporte flagelar, que permite la transferencia de algunas proteínas con hidrocarburos fuera del espacio periplásmico.
La acción colonizadora de las especies hidrocarburoclásticas del género Pseudomonas (P. aeruginosa, P. fluorescens y P. putida) requiere de la coordinación y acción específica de ciertas enzimas y proteínas como se mencionó anteriormente, aseverado por Fernández et al. (2013), Ramos et al. (2015) y Cuenca et al. (2016). Estas especies además de su acción correctiva por su capacidad de utilizar hidrocarburos (biodegradación) también pueden actuar como promotoras del crecimiento, haciendo disponible el fósforo y por la liberación de las fitohormonas AIA y citoquininas (Kumar et al., 2015; Maheshwari et al., 2015; Goswami et al., 2016), por lo tanto, son un gran potencial para la limpieza de suelos contaminados con hidrocarburos.
Los efectos benéficos de las bacterias hidrocarburoclásticas del género Pseudomonas en el crecimiento de las plantas, a través de la degradación de los hidrocarburos y de la reducción de los efectos tóxicos, se ha mostrado en varias investigaciones; por ejemplo, Benedek et al. (2012), encontraron que Pseudomonas fluorescens BBN1 y Rhodococcus qingshengii BBG1, alcanzaron tasas de degradación del 95% (n-dodecano), 66% (tolueno) y 70% (naftaleno) de la concentración inicial en 42 días. Gofar (2013) mostró que en Lepironia mucronata ocurre un aumento en el peso seco de la corona y de las raíces y una disminución de un 70.1% de los hidrocarburos totales de petróleo y Ogbulie et al. (2015), mostraron degradación de los n-alcanos y la eliminación de cadenas de carbono en cultivos de Vigna unguiculata var unguiculata, Mucuna pruriens, Zea mays y Telfaira occidentalis en un suelo contaminado con petróleo crudo.
CONCLUSIONES
En una área contaminada con petróleo (a 100 metros de Amana del Tamarindo, estado Monagas, Venezuela), se identificó la especie Samanea saman, de cuya rizósfera se lograron obtener diez aislados del género Pseudomonas con capacidad para degradar petróleo. En base a la caracterización bioquímica y producción de los pigmentos piocianina y fluoresceína con el apoyo de técnicas de identificación rápida y de la literatura especializada se identificaron tres especies: P. aeruginosa, P. fluorescens y P. putida.














