Introducción
La roca fosfórica (RP) es la principal fuente natural inorgánica de fósforo (P) en el mundo, es usada para sinterizar fertilizantes fosfóricos solubles (90%) y P elemental (10%) para la industria química, de alimentos y de detergentes (Hammond & Day, 1992; Goenadi et al., 2000; Reyes et al., 2001; Bhatti & Yawar, 2010). Ésta consiste en un fosfato de calcio insoluble conocido genéricamente como apatita (Ca5(PO4)3OH,F) (Hammond & Day, 1992).
Desafortunadamente, la RP es poco soluble (<0.001 g L-1), lo cual limita su efectividad como fertilizante y, por ende, su uso masivo es restringido (Rajan et al., 1996; Reddy et al., 2002; Msolla et al., 2007; Shrivastava et al., 2007; Pramanik et al., 2009). Una alternativa para mejorar la solubilidad de este material es la acidulación con ácidos fuertes (e.g., ácido sulfúrico, ácido fosfórico), pero este procedimiento es costoso y tiene riesgos de afectar operarios y contaminar el ambiente (Smith & Moore, 2005). Una alternativa atractiva es el uso de microorganismos solubilizadores de fósforo (MSP) productores de ácidos orgánicos que disuelven la RP, esta aproximación ha sido evaluada por varios autores (Narsian & Patel, 2000; Whitelaw 2000; Osorio & Pérez 2000, Vassilev & Vassileva, 2003; Ramírez, 2005; Jayasinghearachchi & Seneviratne, 2006; Relwani et al., 2008; Singh & Reddy, 2011; Restrepo Franco et al., 2015). A pesar de que se conoce la reacción de disolución de la RP (Yusdar et al., 2007; Osorio, 2012), falta precisar cuáles son las condiciones que optimizan el proceso de bioacidulación para cada microorganismo o cepa específica (Cunningham & Kuiack, 1992). Entre estos factores están el tipo de RP (Sharan et al., 2008; Scervino et al., 2010; Tallapragada & Seshachala, 2012), los requerimientos nutricionales y algunas condiciones de la reacción como el tiempo, la velocidad de agitación, temperatura, entre otros (Vassileva et al., 1998; Sahu & Jana, 2000; Vassileva et al., 2000; Ivanova et al., 2006; Bojinova et al., 2008).
La bioacidulación de RP es muy atractiva en países como Colombia, ya que: (i) la mayoría de los suelos son deficientes en P, (ii) existen fuentes naturales de este mineral que son poco utilizadas, (iii) existe una alta demanda de productos naturales como la RP compatibles con agriculturas sostenibles, y (iv) la volatilidad de los precios de los fertilizantes fosfóricos solubles (en su totalidad importados para Colombia) pone en riesgo la seguridad y soberanía alimentaria de los países consumidores. Por lo anterior, las políticas estatales de Colombia recomiendan el uso de minerales locales, como la RP, y el uso de microorganismos que puedan usarse como biofertilizantes (CONPES, 2009).
Nuestra hipotesis es que la eficiencia del proceso de bioacidulación de la RP puede ser mejorada a través de factores asociados al tipo de material y a condiciones propias de la reacción. El objetivo de este trabajo fue evaluar bajo condiciones in vitro el efecto que tienen el tipo de RP, el tiempo de incubación, la concentración de P soluble inicial y la adición de suplementos nutritivos (vitaminas y micronutrientes) sobre la capacidad del hongo Mortierella sp. para disolver RP.
Materiales y métodos
Estos estudios se realizaron en el Laboratorio de Ecología y Conservación Ambiental de la Facultad de Ciencias de la Universidad Nacional de Colombia, Sede Medellín.
El hongo Mortierella sp. fue originalmente aislado en la Universidad de Hawaii a partir de un Andisol (Osorio & Habte, 2001). Para su uso en los experimentos, el hongo se cultivó en el medio papa-dextrosa-agar (PDA) durante 5 días y luego se suspendió en agua destilada estéril sin micelio y se conservó en refrigeración a 4 °C. Antes de su uso se realizaron conteos en el medio PDA, los cuales arrojaron valores de densidad de 107 esporas/mL.
Se utilizaron tres tipos de RP: Huila, Santander y Carolina del Norte; las dos primeras son de origen Colombiano, la tercera de Estados Unidos, se empleó como referencia ya que es ampliamante estudiada (tabla 1). Las RPs se caracterizan por ser fluoroapatitas, presentan sustituciones variables de fosfato por carbonato y fluoruro y de calcio por sodio y magnesio (Chien & Hammond, 1978). Para todos los experimentos las RPs se pasaron a través de un tamiz de 500 µm (malla 30) y retenidas en un tamiz de 250 µm (malla 60).
La composición del medio de cultivo fue (g L-1): glucosa 10, NH4Cl 0.5, KCl 1.87, CaCl2.2H2O 0.2, MgSO4.7H2O 0.4 y RP 3.5 (Osorio, 2008). La única fuente de P en el medio fue la RP. A Erlenmeyers de 250 mL de capacidad se adicionaron 75 mL del medio y luego se esterilizaron en autoclave (120 ºC, 0.1 MPa) por 20 min. Luego, los Erlenmeyers se inocularon con 1 mL de Mortierella sp. (1x107 UFC mL-1). Los Erlenmeyers se agitaron continuamente a 100 rpm durante 7 días, la temperatura fue de alrededor de 28 °C.
Las condiciones del medio se alteraron en cada experimento en función de los objetivos, tal como se describe a continuación. Los factores que no se mencionan permanecieron como se describió anteriormente.
Experimento No. 1. Concentración de P inicial Se determinó el efecto de la concentración de P inicial sobre la disolución microbiana de la RP del Huila. Para esto, al medio de cultivo se adicionaron niveles crecientes de K2HPO4 para obtener concentraciones de P de 0, 1, 5, 10, 50 y 100 mg L-1.
Experimento No. 2. Adición de vitaminas y micronutrientes Se determinó el efecto de la adición de vitaminas y micronutrientes sobre la disolución de la RP del Huila. Se adicionaron por separado niveles crecientes de estos complementos nutricionales a razón de 0.0, 0.5, 1.0 y 2.0 mg L-1. Como fuente de vitaminas se usó el complejo vitamínico CentrumR (vitamina A: 2000 unidades internacionales (U.I.), beta caroteno equivalente a 2000 U.I. de vitamina A, vitamina D 200 U.I., vitamina E 15 U.I., vitamina K1 30 µg, vitamina C 60 mg, ácido fólico 200 µg, vitamina B1 1.4 mg, vitamina B2 1.6 mg, niacinamida 18 mg, vitamina B6 2 mg, vitamina B12 1 µg, ácido pantoténico 6 mg, biotina 150 µg, luteína 250 µg y elementos tales como Ca 162 mg, P 125 mg, I 150 µg, Fe 14 mg, Mg 100 mg, Cu 0.7 mg, Mn 2.5 mg, K 40 mg, Cl 36.3 mg, Cr 25 µg, Mo 25 µg, Se 25 µg, Zn 7.5 mg). Para el tratamiento con adición de micronutrientes se utilizó una mezcla de quelatos EDTA-Mn, -Fe, -Cu y -Zn razón de 24, 24, 24 y 12 mg L-1, respectivamente. Las otras condiciones del cultivo permanecieron constantes. Las vitaminas y los micronutrientes se esterilizaron en autoclave junto con el medio de cultivo a 121 ºC por 15 min a 0,1Mpa.
Experimento No. 3. Tiempo de incubación Con el fin de conocer el tiempo al cual se puede presentar la mayor disolución de RP del Huila, se monitoreó el pH y la concentración de P en solución a diferentes tiempos de incubación (0, 1, 3, 5, 7, 10 y 14 días). Las otras condiciones del cultivo permanecieron constantes.
Experimento No. 4. Tipo de RP Se evaluó la disolución de las tres RPs: Huila (H), Santander (S) y Carolina del Norte (CN) en función de la inoculación con Mortierella sp. Las otras condiciones del cultivo permanecieron constantes.
Variables evaluadas: luego del periodo de incubación, se determinó pH con un potenciómetro (WTW electrodo Sentix 81) y la concentración de P (mg L-1) con el método del azul-molibdato (Murphy & Riley 1962) (espectrofotómetro Genesys 20, Thermo Spectronic, 890 nm), previa centrifugación (centrifuga Jouan MR 1812, 1520xg (4000 rpm), 10 minutos) y filtración con papel filtro (Whatman No. 42).
Para el experimento No. 1, se calculó la concentración de P solubilizado a partir de la RP, sustrayendo del valor final la cantidad de P adicionado (P neto solubilizado).
En los experimentos se empleó un diseño experimental completamente al azar. Cada tratamiento tuvo 4 repeticiones, incluyendo el control no inoculado. El efecto de los tratamientos se evaluó mediante análisis de varianza (prueba F) y cuando estos fueron significativos se utilizó la prueba de rangos múltiples de Duncan para la separación de medias (prueba t). En ambas pruebas se empleó un nivel de significancia (P) ≤0.05 y se hicieron en el software STATGRAPHICS versión Centurión XVI.
Resultados
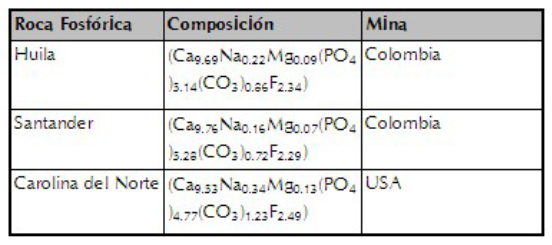
Los Erlenmeyers no-inoculados presentaron un pH de 7.8, que no fue afectado por la presencia inicial de P soluble. Al inocular con el hongo el pH disminuyó significativamente, pero en este caso la concentración inicial de P soluble afectó (P ≤ 0.05) la disolución de la RP (figura 1.). Así, cuando el P soluble inicial estuvo entre 0 y 1 mg P L-1 el pH del medio fue de 3.2, a 5 mg P L-1 el pH fue significativamente más bajo (3.05). En contraste, con los niveles de P más altos (10, 50 y 100 mg P L-1) el pH fue significativamente mayor (5.8, 5.5 y 5.6, respectivamente) (figura 1.(A)).
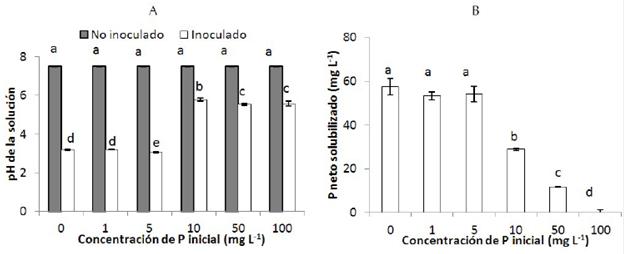
Figura 1 (A) pH de la solución en función de la concentración de P inicial en el medio y (B) P neto en la solución (mg L-1), inoculados con Mortierella sp. (P neto: P solubilizado de la RP-P adicionado como KH2PO4). Cada columna representa el promedio de cuatro repeticiones. Las barras indican la desviación estándar. Columnas con las letras minúsculas diferentes indican diferencias significativas de los tratamientos según la prueba de Duncan (P≤0.05).
En los controles, si bien hubo P inicial soluble, no hubo P neto solubilizado (:0 mg L-1). La concentración de P soluble inicial afectó significativamente la concentración de P neto solubilizado (figura 1.). Por ejemplo, cuando no se adicionó KH2PO4 o se adicionó en bajas concentraciones (P soluble inicial: 0 a 5 mg P L-1), la concentración de P neto solubilizado por Mortierella sp. fue en promedio de 54.9 mg P L-1 (no hubo diferencias significativas). Con concentraciones de P inicial de 10, 50 y 100 mg P L-1 el nivel de P neto solubilizado al final de la incubación fue de 29.0, 1.1 y 0.0 mg P L-1, respectivamente, entre ellos se presentaron diferencias significativas (figura 1.).
La adición de vitaminas y micronutrientes no presentó un efecto significativo en el pH (3.1) del medio (figura 2.(A)); sin embargo, el aumento de estos disminuyó la cantidad de P en solución (figura 2.(B)) el cual fue significativo estadisticamente para micronutreintes y no lo fue para la adición de vitaminas. Se puede observar una disminución en la concentración de P en solución de 88.3 mg L-1 sin vitaminas ni micronutrientes a 74.1 mg L-1 con la adición de vitaminas y 69.5 mg L-1 con la adición de micronutrientes.
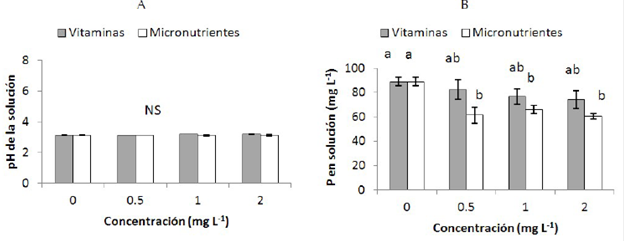
Figura 2 (A) pH de la solución en función de la adición de vitaminas y micronutrientes y (B) Concentración de P en la solución (mg L-1), en las muestras inoculadas con Mortierella sp. cada columna representa el promedio de cuatro repeticiones. Las barras indican la desviación estándar. Columnas con las letras minúsculas diferentes indican diferencias significativas de los tratamientos según la prueba de Duncan (P≤0.05). NS: no hay diferencia significativa.
El tiempo tuvo un efecto significativo en el pH para Mortierella sp. (figura 3.(A)) el pH cambió a partir del primer día (4.2) con respecto al control (7.6) y presentó una disminución hasta los días 5 y 7 (3.1), posteriormente presentó un aumento para los días 10 y 14 (3.3). De acuerdo a estos resultados, la cantidad de P en la solución presenta un comportamiento parabólico (figura 3.(B)), en las muestras inoculadas, aumentando desde el día 3 (40.1 mg L-1), presentando un máximo el día 5 (88.3 mg L-1) y a partir de este día disminuyó la cantidad de P llegando a valores de 68.8 mg L-1 para el día 14.
Figura 3 (A) pH de la solución en función del tiempo y (B) Concentración de Fósforo (P) en la solución (mg L-1) en las muestras inoculadas con Mortierella sp. Cada columna representa el promedio de cuatro repeticiones. Las barras indican la desviación estándar. Columnas con las letras minúsculas diferentes indican diferencias significativas de los tratamientos según la prueba de Duncan (P≤0.05).
La inoculación con Mortierella sp. disminuyó significativamente (P≤0.05) el pH del medio con respecto a los controles no inoculados para los tres tipos de RP (figura. 4), el pH alcanzó valores de 3.4, 2.9 y 2.9 para las RP de CN, H y S respectivamente (figura 4.(A)). Por otro lado, al inocular con Mortierella sp. en los tres tipos de RP aumentó la concentración de P en solución con respecto al control no inoculado (figura 4.(B)). La magnitud de este efecto fue mayor cuando el medio contenía RP de Carolina del Norte (157.1 mg L-1), seguido de la RP del Huila (86.6 mg L-1) y por último la RP de Santander (58.9 mg L-1).
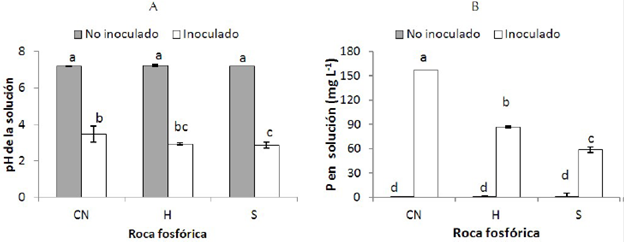
Figura 4 (A) pH de la solución y (B) Concentración de P en la solución (mg L-1) en función del tipo de RP inoculados con Mortierella sp. Cada columna representa el promedio de cuatro repeticiones. Las barras indican la desviación estándar. Columnas con las letras minúsculas diferentes indican diferencias significativas de los tratamientos según la prueba de Duncan (P≤0.05). CN: Carolina del Norte, H: Huila y S: Santander.
Discusión
La eficiencia del proceso de bioacidulación de la RP por el hongo Mortierella sp. se mejoró evaluando factores asociados al tipo de material y a condiciones propias de la reacción.
La disolución de RP por Mortierella sp. se vio favorecida cuando en el medio la concentración de P inicial soluble fue muy baja. Al incrementar la concentración de P inicial (con aplicaciones de KH2PO4), la capacidad de este hongo para producir ácidos disminuyó y, por ende, disminuyó su capacidad para disolver RP. Cálculos hechos para estimar la eficiencia del hongo para disolver RP [EDRP(%)= 100x(P soluble÷P total en RP)] indican que el EDRP de Mortierella sp. fue de 13% sin la adicion o con la adición de niveles bajos de KH2PO4 (0-5 mg L-1), a niveles medios (10 mg L-1) el valor de EDRP fue de 0.6% y los niveles más altos de P soluble adicionado (50 y 100 mg L-1) la eficiencia fue muy baja (0.02%) o nula.
El metabolismo asociado a la producción de ácidos por los hongos depende de un sistema de enzimas que pueden ser constitutivas o inducidas (Madigan et al., 2004). Para este hongo varios factores del medio de cultivo inducen la producción de ácidos, como la fuente y cantidad de carbono (C) y nitrógeno (N) (Osorno & Osorio, 2014). En este caso, los resultados indican que la falta de P soluble inicial induce la producción de ácidos por el hongo. Esto puede deberse a que, con la escasez de P soluble, el hongo se ve obligado a producir ácidos para liberar el P de la RP requerido para sus actividades metabólicas. Cuando en el medio de cultivo el P soluble está presente en concentraciones suficientes para el metabolismo del hongo, la producción de ácido disminuye.
Es claro que la adición de vitaminas y micronutrientes al medio de cultivo disminuyó la producción de ácido (no se presentaron pH bajos) y, por ende, no hubo una efectiva disolución de RP. Los valores de EDRP para Mortierella sp. sin la adición suplementos nutricionales fue de 21%, con la adición de micronutrientes disminuyó a un promedio de 14.6% y con vitaminas a 18.5%.
Aunque los micronutrientes Fe, Mn, Cu y Zn son requeridos por los hongos, en altas cantidades pueden limitar el desempeño de estos (Max et al., 2010). Por ejemplo, Shu & Johnson (1948) encontraron valores óptimos de Zn y Fe para solubilización de RP de 0.3 y 1.3 mg L-1, respectivamente. Por su parte, Grewal & Kalra (1995) encontraron un efecto negativo en la producción de ácido cítrico en A. niger con la adición de Fe y Mn. Así mismo, Netik et al. (1997), encontraron que la presencia de Zn, Cu y Fe inhibieron la producción de ácido cítrico en A. niger, mientras que dosis moderadas de Mn pudieron regular su producción. En A. niger la ausencia de Mn inhibe tanto la producción de ácido cítrico como su paso a través de la membrana celular (Max et al., 2010; Netik et al., 1997), pero altas concentraciones de Mn (~10 mg L-1) también pueden ser inhibitorias (Gyaneshwar et al., 1966; Mattey & Bowes, 1978).
En general, se considera que en el proceso de disolución de RP no es necesario aplicar micronutrientes ya que la RP puede aportar cantidades significativas de estos (Zapata & Roy, 2007). En el presente estudio las dosis aplicadas de Fe, Mn y Cu fueron de 2.2 mg L-1, mientas que la de Zn fue de 1.1 mg L-1, las cuales además de los aportes de la RP parecen exceder los requerimientos de micronutrientes y así alcanzar concentraciones inhibitorias para el proceso de disolución de RP.
Desafortunadamente, no se encontró información relevante entre la concentración de vitaminas y su impacto en la producción de ácidos orgánicos por microorganismos, particularmente hongos, ni tampoco sobre la disolución de la RP.
Los resultados indican que el tiempo de incubación fue un factor significativamente importante en la disolución de la RP por el hongo. La máxima disolución de RP se alcanzó al día 5 (tabla 2), tal como lo ilustran los valores de EDRP. Resultados comparables han sido reportados por Bojinova et al. (2008).
Tabla 2 Efeciencia del hongo para disolver roca fosfórica (EDRP) para Mortierella sp. en función del tiempo.
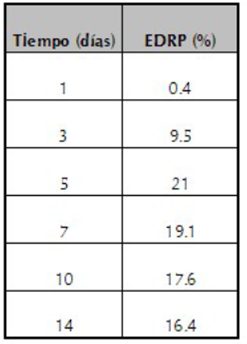
Para el día 5 se alcanzaron los valores máximos de solubilización (EDRP fue de 21 % para Mortierella sp.), al aumentar el tiempo, la concentración de P disminuye, lo que puede ser debido a que aumenta la población microbiana y se da mayor inmovilización de P del medio.
Varios autores han reportado la disolución microbiana de RP a diferentes tiempos: 3 días (Chen et al., 2006; Tao et al., 2008), 4 días (Relwani et al., 2008), 6 días (Jain et al., 2012), 7 días (Alam et al., 2002; Barroso et al., 2006; Osorio, 2012), 8 días (Kucey, 1983, Xiao et al., 2008; Schneider et al., 2010), 10 días (Collavino et al., 2010), 30 días (Sahu & Jana, 2000). Sin embargo, en pocos estudios se ha evaluado el efecto del tiempo. Por ejemplo, Bojinova et al. (2008), evaluaron la disolución de RP con A. niger a diferentes días (1, 4, 7 y 10) y encontraron que entre el día 4 y 7 la cantidad de fosfóro inorgánico (P) soluble aumentó. Igualmente, Vassileva et al. (1998), evaluaron los días 3, 6, 9, 12 y 17 con A. niger y encontraron que en el día 9 se dio la mayor producción de P soluble. Por su parte, Ivanova et al. (2006), evaluaron la disolución de RP con Erwinia y Azotobacter en los días 3, 6, 9, 12 y 15 y encontraron que para Erwinia se necesitan 6 días para encontrar el valor máximo de P soluble, mientras que Azotobacter necesitó 12 días. Sahu & Jana (2000) evaluaron 30 días del proceso y encontraron que para Bacillus la máxima concentración de P ocurrió a los 12 días.
Los resultados del presente estudio nos permiten afirmar que el hongo fue más efectivo en un tiempo relativamente corto, de 5 días. La reducción del tiempo requerido para alcanzar una mayor eficiencia de un proceso biotecnológico es un factor clave en la implementación industrial del proceso (Doran, 1995). Esto ayuda a reducir los costos de producción.
En general, Mortierella sp. exhibió un comportamiento similar en cuanto a la disolución de los tres tipos de RP. Sin embargo, la cantidad de P disuelta varió entre RP. Se obtuvieron mejores resultados con la RP de Carolina del Norte (EDRP para Mortierella sp.: 37%), seguido de la RP del Huila (EDRP para Mortierella sp. 21 %) y de Santander (EDRP para Mortierella sp. 14 %).Tales diferencias muy probablemente se deben a diferencias en la composición mineralógica de estas. La RP de Carolina del Norte es una roca sedimentaria (fluoroapatita carbonatada) más reactiva (Chien & Menon 1995; Schneider et al., 2010) que las RPs sedimentaras del Huila y de Santander y, por ende, tiene mayor efectividad agronómica (Chien & Hammond, 1978). La RP de Carolina del Norte tiene un mayor contenido de P (13%), mientras que la del Huila y Santander contienen 9.1 y 8.0%, respectivamente (Chien & Hammond, 1978). Por otro lado, la RP de Carolina del Norte tiene un mayor contenido de carbonato (1.23xCO3) en la fórmula que las RPs de Santander y Huila (0.72-0.86 xCO3) y esto le confiere un mayor índice de disolución con ácido cítrico (Van Kauwenbergh, 2006). Schneider et al. (2010), evaluaron la disolución de tres RP (Carolina del Norte, una de Brasil y de Canadá), encontraron que A. niger fue más efectivo disolviendo la RP de Carolina del Norte que con otras RP. Según los autores, la razón para tales diferencias es que la primera en de origen sedimentario, mientras que las otras son de origen ígneo.
Por otro lado, las RP pueden presentar diferentes concentraciones de elementos traza tales como F, Fe, Al, Mn, As, Cd, Cu, Pb, Ni, Zn, Hg y U (Zapata & Roy, 2007; Grewal & Kalra, 1995), los cuales pueden afectar el crecimiento microbiano, la capacidad del microorganismo para biosíntesis y liberaración de ácidos orgánicos (Schneider et al., 2010). Algunos de estos elementos pueden ser tóxicos para los microorganismos (Madigan et al., 2004) y las plantas que reciben su aplicación (Dietz et al., 1999). Así, Schneider et al. (2010), hallaron que las RP que presentaron mayores concentraciones de Fe y Mn, disminuyeron la producción de ácido cítrico por A. niger.
A pesar de las diferencias detectadas entre las RP, este estudio sugiere que las RPs del Huila y Santander son buenas candidatas para la disolución microbiana, ya que se mejora su efectividad agronómica para su aplicación directa (Osorio, 2008) o para la producción de fertilizantes más solubles (Nahas, 1996). Así, promover el uso de las RPs colombianas tiene grandes ventajas: están localmente disponibles (Huila, Boyacá, Santander del Norte), son económicas (Reyes et al., 2001; Osorio & Habte, 2009) y, por ende, se puede disminuir la dependencia de fertilizantes importados, lo cual ayuda a la soberanía y seguridad alimentaria y podría disminuir los costos de producción.
Conclusiones
La baja concentración inicial de P soluble en el medio de cultivo para el hongo Mortierella sp. promovió una mayor eficiencia en la disolución de RP, se podria inferir que la escasez de este nutriente es un factor inductivo para la producción de ácidos orgánicos.
La adición de micronutrientes y vitaminas desfavoreció la disolución de RP por parte del hongo. Al parecer, los micronutrientes requeridos por el hongo son suministrados por la RP.
Aunque la disolución microbiana fue más efectiva con la RP de Carolina del Norte, las RP del Huila y Santander presentaron un buen nivel de disolución en un periodo de tiempo relativamente corto. Este tratamiento puede mejorar la efectividad agronómica de estas RP para su uso directo o a través de un proceso biotecnológico previo.