INTRODUCCIÓN
En las últimas décadas, el cultivo de la cianobacteria Arthrospira platensis se ha incrementado por ser una fuente natural fácilmente renovable y asequible de metabolitos como proteínas (55-70 %), ácidos grasos insaturados (18%), carbohidratos (15-25 %), vitaminas, minerales, pigmentos, enzimas, aceites esenciales, antibióticos, entre otros metabolitos biológicamente activos y de interés económico (Cohen, 2002; Leema et al., 2010). Es considerada como el “alimento del futuro” por su alta versatilidad nutricional y su participación en el incremento de los niveles de energía, mejorar el apetito y ofrecer protección antioxidante (Capelli & Cysewski, 2010), también se le conoce por su aplicación en la acuicultura como alimento para moluscos (Belay, 2002), biorremediación de aguas residuales (Çelekli et al., 2016) y como indicadoras y/o depuradoras de aguas contaminadas (Pérez & Consuelo, 2012). En torno al mejoramiento biotecnológico del cultivo de A. platensis, su crecimiento se ha evaluado sobre diversos sustratos entre estos, aguas residuales porcinas (Chaiklahan et al., 2010), orina humana diluida (Bezerra et al., 2013), gallinaza (Ungsethaphand et al., 2009) y ácido indol acético comercial, el cual demostró ser un eficaz estimulante de crecimiento (Mohammed & Mohd., 2011; Gómez et al., 2012).
Los ácidos húmicos (AH) son macromoléculas polielectrolíticas que desempeñan un papel importante en el ciclo global de carbono y nitrógeno y en la regulación de la movilidad de nutrientes y contaminantes ambientales (Christi et al., 2000). Su uso en la agricultura se ha extendido al producir efectos positivos a nivel morfológico, fisiológico y bioquímico en las plantas. Se encuentran en carbones marrones como carbón de bajo rango (CBR) tipo lignito, el cual presenta bajo grado de carbonificación (Peña et al., 2005; Giannoulli et al., 2009). Se ha reportado que los AH pueden actuar como fitohormonas, debido a que presentan sustancias que estimulan el crecimiento celular y que su bioactividad (efecto “Like auxin”) está relacionada con un mayor contenido de grupos nitrogenados en su estructura, muy parecida a la actividad de promoción de crecimiento del ácido indol acético (Nardi et al., 2002; Pasqualoto et al., 2009).
Investigaciones han demostrado que pequeñas cantidades de AH pueden ser utilizados como promotores de crecimiento de microalgas como Scenedesmus acutus Meyen y Chlorella vulgaris Beyerinck y de las algas verde-azul Nostoc commune Vaucher, Anabaena variabilis Kützing y Microcystis aeruginosa Kützing (Pouneva, 2005; Kosakowska et al., 2007) al promover la biodisponibilidad de nutrientes (debido al incremento de la solubilidad), participar en el incremento en la acumulación de biomasa, captación de nutrientes, biosíntesis de metabolitos etc., (Bährs & Steinberg, 2012).
Haynes & Mokolobate (2001), informaron que los AH son capaces de mejorar la producción de algas a un costo muy bajo, requiriéndose de 40-70 mg/L para aumentar el crecimiento y síntesis de pigmentos. Rivera et al. (2016), reportaron que concentraciones de 50 y 60 mg/mL de carbón de bajo rango tipo lignito (rico en sustancias húmicas), adicionadas a cultivos de A. platensis, coadyuvaron en el crecimiento y mayor producción de biomasa y pigmentos.
Con base a lo anterior, el objetivo de esta investigación fue determinar el efecto de tres concentraciones de AH, provenientes de un carbón de bajo rango tipo lignito, sobre la producción de biomasa, contenido de pigmentos, proteínas, carbohidratos y lípidos de A. platensis.
MATERIALES Y MÉTODOS
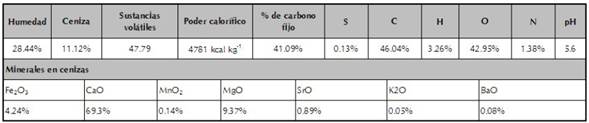
Extracción de ácidos húmicos (AH) a partir de carbón de bajo rango (CBR). Se utilizó un carbón de bajo rango tipo lignito, colectado de la mina “El Cerrejón” (La Guajira, Colombia), el cual posee un alto contenido de humedad y bajo poder calorífico (menos de 6390 kcal kg−1) (ver tabla 1) (Cubillos et al., 2015). Las sustancias húmicas (SH) se obtuvieron por el método clásico de extracción con NaOH 0.5M y se procedió a separar las fracciones de ácidos húmicos y ácidos fúlvicos de acuerdo al protocolo descrito por Sharif et al. (2002).
Tabla 1 Características fisicoquímicas de carbón de bajo rango (CBR) tipo lignito usado en los bioensayos.
Microorganismo bajo estudio. Se utilizó una cepa de A. platensis, aislada del pozo de agua Salina Rica, (Maracaibo), la cual fue donada por el Laboratorio de Microorganismos Fotosintéticos de la Universidad de Zulia, Venezuela, cultivada y conservada en el Laboratorio de Microbiología Agrícola y Ambiental de la Universidad Popular del Cesar, Colombia. Cultivos viables de la cianobacteria se sometieron inicialmente a cuatro lavados con agua destilada estéril y posteriormente se mantuvo en medio de crecimiento mineral Zarrouk 25% (Zarrouk, 1966).
Condiciones generales de los cultivos. Para determinar el efecto de AH sobre el crecimiento de A. platensis cultivos en batch, de 500 mL en medio nutritivo Zarrouk al 25 % (Zarrouk, 1966), fueron suplementados con AH a diferentes concentraciones (tratamiento 1: 1 mg/L; tratamiento 2: 10 mg/L y tratamiento 3: 100 mg/L), tratamiento 4: 80 mg/L de ácido indol acético (AIA), el cual fue tomado como control positivo de sustancias promotoras del crecimiento y para comparar el efecto de ambos suplementos sobre el crecimiento de la cianobacteria (Arancon et al., 2006; Gómez et al., 2012) y tratamiento 5: medio de cultivo zarrouk, como control negativo. Se utilizó un diseño experimental completamente al azar en el cual se tuvieron en cuenta cinco tratamientos con tres repeticiones (53).
Los cultivos fueron provistos de una irradiación de 50-60 µmol photon/m2/s1 (aprox. 4000 lux) generada por lámparas fluorescentes, Philips Dayligth con tubos de 40 W de orientación lateral, ajustadas a un temporizador modelo 4001-00 Td-1724-00, para generar fotoperiodos 12:12 horas (luz-oscuridad) y una temperatura promedio de 25-28 °C. Todos los cultivos fueron mantenidos en incubación por un periodo 30 días y se encontraban conectados a un sistema de aireación provisto de tubos que eran alimentados por motores para acuarios de dos salidas (Power Life P-500®), esto se hizo con el fin de que el burbujeo generado por los motores mantuviera homogeneizados los cultivos y favoreciera la distribución completa de los elementos nutritivos y las células, además de permitir un buen intercambio de oxígeno y dióxido de carbono (CO2) con el medio circundante. Todos los tratamientos se establecieron inicialmente con un inoculo de 1x10-6 células/mL, medido en espectrofotómetro (Thermospectronic GENESYS 20®) a una densidad óptica de 750 nm (DO750) (Leduy & Therien, 1977; Bermúdez et al., 2004) y pH inicial de 8-9 el cual se monitoreo utilizando un potenciómetro (pH-metro portátil 3110 WTW®).
Evaluación del crecimiento y la composición bioquímica de A. platensis . El crecimiento en términos de biomasa seca se determinó utilizando un sistema de filtración de Millipore (Sampling Manifold 1225®) mediante el método modificado de Utting (Rodolfi et al., 2009). Durante el periodo de incubación se realizaron tomas de muestras de los cultivos en tubos Eppendorf (1.0 mL) cada 72, por cada variable a evaluar. Para determinar las concentraciones de biomasa, pigmentos y composición bioquímica, se utilizó espectrofotometría mediante el equipo Thermospectronic GENESYS 20®. El contenido de clorofila a y carotenoides se determinó utilizando como solvente metanol al 95 % a 665 nm para clorofila a y 480 nm para carotenoides (Ritchie, 2008). La concentración de ficobiliproteínas fue estimada siguiendo el método de choque osmótico de Wyman & Fay (1986) modificado por Soltani et al., (2006), medido a 615 nm para ficocianinas, 652 nm para aloficocianina y 562 nm para ficoeritrinas. Las proteínas totales se determinaron según el método de Lowry modificado por Herbert et al. (1971), utilizando como estándar una solución de seroalbúmina bovina (Rideralbumin 22% BIOTEST®) de 1 mg/mL, a partir del cual se obtuvo la curva patrón. El análisis de carbohidratos estuvo basado en el método fenol-sulfúrico propuesto por Dubois et al., (1956) y modificado por Albalasmeh et al. (2013). El contenido de lípidos totales en la biomasa, se evaluó según el método de carbonización simple descrito por Marsh & Weinstein (1966), utilizando una mezcla de cloroformo - metanol (1:2 v/v). Se determinó la máxima producción de biomasa (MPB), la máxima producción metabólica (MPM) y los valores promedios por cada variable evaluada (PPB: promedio de producción de biomasa; PPM: promedio producción metabólica).
Análisis estadístico. Los datos obtenidos fueron sometidos a análisis de varianza de una vía, ANOVA simple, utilizando el paquete estadístico SPSS® versión 15, con un nivel de confianza de 95 % (p >0,05) con el fin de verificar diferencias significativas entre los tratamientos. Para las variables en las que no se encontró diferencias significativas, se procedió a realizar un análisis de comparación de medias por el método de Diferencias Mínimas Significativas (prueba de Chi-cuadrado).
RESULTADOS
Biomasa y pH. El análisis de varianza muestra que no existen diferencias significativas entre los tratamientos (p > 0,05). Desde el día 24 de incubación, se obtuvieron las concentraciones máximas de biomasa seca (ver tabla 2 y figura 1), la más alta para el tratamiento 1 (MPB= 3.1 x 10-3 mg/mL), seguida del tratamiento 4 (3.0 x 10-3 mg/mL). El mayor promedio de biomasa seca (PPB= 2.2 x 10-3 mg/mL) fue alcanzado por el tratamiento 2 y el más bajo (PPB= 1.5 x 10-3 mg/mL) por el tratamiento de 3. Durante el proceso de incubación, el pH fue incrementando poco a poco hasta llegar a un promedio de 10 donde se mantuvo constante.
Tabla 2 Valores promedios y producción máxima de biomasa seca y producción de metabolitos de A. platensis en función en función de los tratamientos.
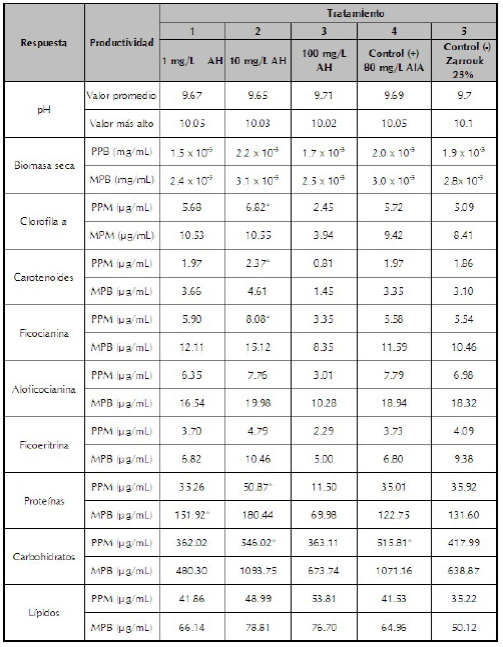
PPB: promedio producción de biomasa; MPB: máxima producción de biomasa; PPM: promedio producción metabólica; MPM: máxima producción metabólica.
*La diferencia de medias es significativa (p >0.05).
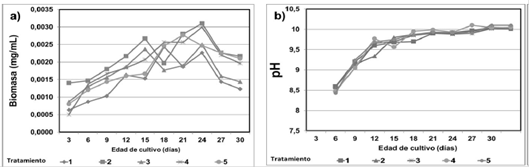
Figura 1 Efectos de AH y de AIA sobre las curvas de crecimiento celular y pH de cultivos de A. platensis: a) Biomasa b) pH.
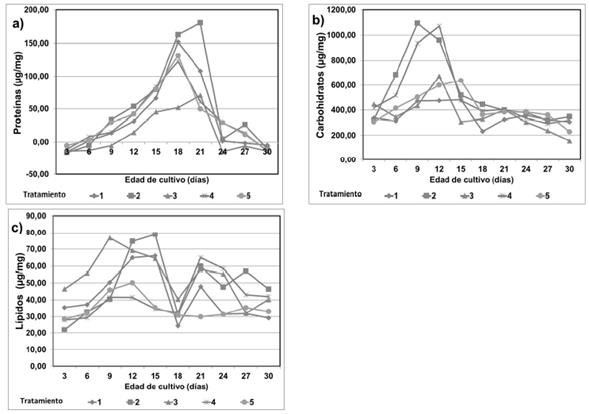
Clorofila a y carotenoides. La producción de clorofila a y carotenoides son factores importantes en el crecimiento de A. platensis. El análisis de varianza mostró que la mayor parte de la producción de clorofila a fue significativamente diferente entre los tratamientos (p <0,05); los carotenoides mostraron una tendencia similar a la observada en la síntesis de clorofila a, pero no mostraron diferencias significativas (p >0,05). Los tratamientos 2 y 4 presentaron los valores promedios más altos de clorofila a (PPM= 6.82 y 5.72 µg/mL) respectivamente y el mejor resultado en carotenoides se alcanzó con el tratamiento 2,00 (MPM= 2.37 µg/mL) respecto a los demás. El contenido de clorofila a, para los tratamientos de 1y 2 se incrementó gradualmente a los días 18 y 15 respectivamente registrando así las producciones máximas (MPM= 10.53 y 10.55 µg/mL) después decreció y volvió a incrementarse apreciablemente de forma inconstante (ver tabla 2 y figura 2).
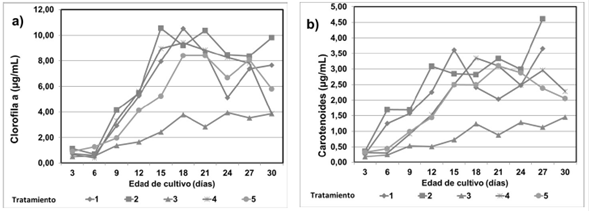
Figura 2 Efectos de ácidos húmicos (AH) a diferentes concentraciones y de ácido indol acético (AIA) sobre contenido de los pigmentos: a) clorofila a, b) carotenoides, de A. platensis.
Ficobiliproteínas. La producción máxima para las ficocianinas (MPM= 15.12 µg/mL) se observó en el tratamiento 2 al día 27, así como el valor promedio más alto (PPM= 8.08 µg/mL) (ver tabla 2 y figura 3). La menor producción se observó en el tratamiento de 100 mg/L (MPM= 8.35 µg/mL). Los valores promedios más altos para aloficocianina (PPM= 7.76 µg/mL) y ficoeritrina (PPM= 4.79 µg/mL), se observaron en los cultivos suplementados con 10 mg/L de AH (tratamiento 2).
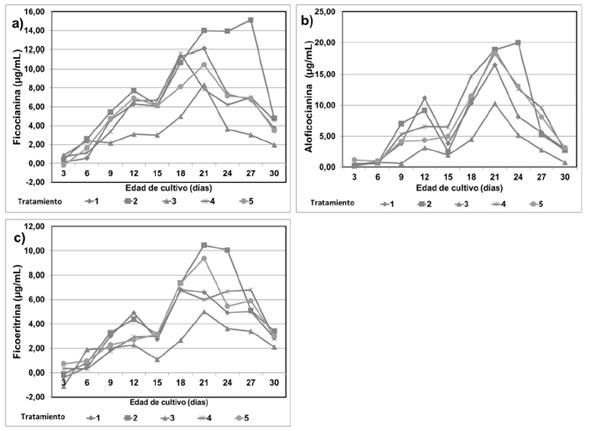
Figura 3 Efectos de ácidos húmicos (AH), a diferentes concentraciones, y de ácido indol acético (AIA) sobre contenido de los pigmentos a) ficocianina, b) aloficocianina, c) ficoeritrina, de A. platensis.
Las concentraciones empleadas de AH no indujeron diferencias significativas (p >0,05) en el contenido de aloficocinina y ficoeritrina con respecto a los controles. Solo se observaron diferencias significativas para ficocianina (p <0,05) en el tratamiento 2. En los primeros días de cultivo la producción de ficobiliproteínas descendió y luego incrementa alcanzando las concentraciones máximas.
Composición bioquímica. Hubo diferencias mínimas significativas (p <0,05) entre los tratamientos de 1 y 2 con respecto a los demás. El análisis de los datos muestra que la producción máxima de proteínas (MPM= 180.44 µg/mL) y el valor promedio más alto (PPM= 50.87 µg/mL) fueron observados en el tratamiento 2. El contenido de carbohidratos se incrementó gradualmente con el aumento en el periodo de incubación, en promedio hasta el día 15, luego comenzó a decrecer. Se observó un incremento en el contenido de éstos en el tratamiento 2 y en el tratamiento control positivo 4, comparados a los demás tratamientos (p <0,05). El valor más alto de producción (MPM= 546.02 µg/mL) fue para el tratamiento de 2 (ver tabla 2 y figura 4). En el contenido de lípidos los tratamientos no presentaron diferencias significativas (p >0,05), sin embargo, el tratamiento 3 registró la producción promedio más alta con respecto a los demás (MPM= 53.81 µg/mL). A diferencia de las demás variables, el tratamiento 3 actuó como un estimulante en la producción de lípidos y no como un inhibidor como si lo fue para el resto de metabolitos evaluados. Los valores más bajos se registraron para los tratamientos controles 4 y 5 sugiriendo que los AH actúan positivamente sobre el metabolismo de compuestos lipídicos de A. platensis.
DISCUSIÓN
Bajas concentraciones de AH obtenidos de CBR tipo lignito, demostraron ejercer un efecto positivo sobre la producción de biomasa y metabolitos de una cepa de A. platensis. Se demostró el efecto estimulador que presentan 10 mg/L de AH (tratamiento 2), y en menor grado 1 mg/L de AH (tratamiento 1); los resultados obtenidos con el tratamiento 2se asemejan a los obtenidos con el tratamiento 4 (adicionado con AIA), conocido por estimular el crecimiento de organismos fotosintéticos. Para el tratamiento 2se evidenció que el efecto estimulante fue más en la producción de clorofila a, carotenoides, proteínas y carbohidratos, estos hallazgos concuerdan con Mostafa & Ali (2009) y Prakash et al. (2011), quienes demostraron que bajas concentraciones de AH (20 y 40 mg/L) provenientes de compost de arroz y suelo incrementaron los contenidos en biomasa, clorofila a, carbohidratos y ácidos grasos en cultivos de A. platensis después de 21 días de incubación.
El incremento en el pH puede estar correlacionado al consumo de la fuente de carbón a partir de bicarbonato que contiene el medio de cultivo Zarrouk, los iones de bicarbonato son asimilados por la cianobacteria y subsecuentemente convertidos en dióxido de carbono y carbonato, lo que ocasiona un desplazamiento del equilibrio iónico (Raoof et al., 2006); el pH alcalino pudo favorecer la solubilización de los AH presentes en el medio aumentando así la disponibilidad de iones minerales para la nutrición de A. platensis (Volkmann et al., 2007). La producción de clorofila a, carotenoides y ficobiliproteínas mostró la tendencia de disminuir al aumentar la concentración de AH. La estimulación en el crecimiento celular fue asociada con la aceleración en la biosíntesis de pigmentos y proteínas, estos resultados concuerdan con los reportados por Pouneva (2005).
Cabe mencionar que A. platensis puede crecer usando diferentes vías metabólicas que pueden ser mixotróficas o heterotróficas dependiendo de la disponibilidad de las fuentes de carbono orgánico (Chojnacka & Márquez, 2004). Se ha reportado que tanto el AIA como los AH tienen similares mecanismos y vías de acción de estimulación de crecimiento y desarrollo vegetal y microbiano, los AH pueden presentar actividad hormonal muy parecida a la de las auxinas, dilucidando así los mecanismos a través de los cuales ejercieron sus efectos estimuladores en el tratamiento 2 (Nardi et al., 2002; Arancon et al., 2006; Pasqualoto et al., 2009). De acuerdo a esto se ha sugerido que los efectos positivos de los AH sobre el crecimiento de A. platensis están relacionados con el estímulo del metabolismo celular de la cianobacteria a través del incremento de la actividad enzimática, aumento de la biodisponibilidad de moléculas, participación en la formación fotólica de sustratos de bajo peso molecular, permitiendo su mejor asimilación; actuando como un material de intercambio iónico, incrementando la biodisponibilidad de los elementos nutritivos inorgánicos limitantes, interviniendo como agente sensibilizante de la membrana celular, que permite una mayor permeabilidad celular; de esta forma se incrementa la captación de elementos nutritivos y se estimulan las poblaciones microbianas asociadas a la cianobacteria (Bertilsson & Tranvik, 2000; Pouneva, 2005). Así mismo, Mostafa & Ali (2009) demostraron que los AH podrían ser utilizados por A. platensis como una fuente de fósforo inorgánico.
Por otra parte, el efecto inhibitorio ejercido en el tratamiento 3 sobre el crecimiento de la cianobacteria, pudo deberse a fenómenos de sobrequelación reduciendo la disponibilidad de iones esenciales para el crecimiento celular (Bährs & Steinberg, 2012), además la alta concentración de AH puede inducir estrés fisiológico, con consecuente pérdida de energía respiratoria y excretoria, (Volkmann et al., 2007). En los bioensayos con altas concentraciones de AH se produjo un oscurecimiento del medio de cultivo debido a la naturaleza química de las sustancias húmicas adicionadas esto pudo desencadenar que dicha coloración evitara el paso de la luz ocasionando una disminución en las tasas de fotosíntesis; resultados similares a los obtenidos en esta investigación fueron reportados por Mostafa & Ali (2009), quienes observaron una disminución en la producción de metabolitos con una concentración de 80-100 mg/L de AH, provenientes de compost de arroz, en cultivos de A. platensis. También resulta interesante el incremento en la acumulación de lípidos que se observó al aumentar la concentración de AH, lo cual ha sido reportado en numerosas microalgas bajo condiciones de estrés similares, lo cual se ha discutido como un mecanismo de osmoprotección (Pohndorf et al., 2016). Con base en lo expuesto esta investigación se presume que los AH tienen actividad estimulante sobre el desarrollo de cultivos de A. platensis.
Se observa que la producción de metabolitos y biomasa seca de A. platensis es influenciada por los AH, debido a que se presentan aumentos y disminuciones en las concentraciones de los metabolitos evaluados, logrando así producción alta de biomasa y metabolitos en etapas tempranas de crecimiento; muchos autores han descrito a las sustancias húmicas como moléculas complejas de alto peso molecular sin una estructura química definida, entre ellas los AH presentan el más alto peso molecular, además al poseer la característica de ser solubles en pH alcalinos tienen la capacidad de reagruparse en grandes moléculas aun después de ser solubilizadas en pequeñas partes (Thurman et al., 1982). Dentro de este contexto se ha sugerido que las sustancias húmicas, aunque se caractericen por presentar estructuras de compuestos de alto peso molecular, pueden también contener componentes de bajo peso molecular con estructuras similares a las fracciones de alto peso molecular (Kujawinski et al., 2002a, 2002b).
Fracciones de sustancias húmicas de bajo peso molecular se vuelven fácilmente asimilables por las algas promoviendo su rápido crecimiento, elucidando de esta forma que la estimulación temprana en la producción de biomasa y metabolitos, que se presentó durante el crecimiento de A. platensis en los diferentes tratamientos, pudo deberse al uso de las sustancias húmicas por parte de la cianobacteria para su nutrición (Peña et al., 2005; Rivera et al., 2016). Concentraciones residuales de AH en los tratamientos no fueron determinadas debido al bajo porcentaje de recuperación de éstos en los cultivos.
CONCLUSIÓN
Durante el cultivo de A. platensis, influenciado por tres concentraciones de AH, se observó que los promedios de biomasa seca, pigmentos y composición bioquímica entre tratamientos no presentaron grandes diferencias significativas entre sí, solo entre tratamiento por tratamiento, demostrándose que el tratamiento 2 de 10 mg/L de AH difiere de los demás en cuanto a los resultados que se obtuvieron, incluyendo los tratamientos controles positivo y negativo, al proveer un estímulo en la producción de la mayoría de los parámetros evaluados. En la búsqueda por mejorar la producción de biomasa y metabolitos de interés de A. platensis de manera eficiente, es necesario definir la composición de un medio óptimo consistente en sales minerales y complejos orgánicos derivado de fuentes de bajo costo. El uso de ácidos húmicos se presenta como una alternativa a estas fuentes de nutrientes que, junto con técnicas de cultivo eficientes, sea capaz de reducir los costos de dicha producción.