Introducción
Durante la extracción de carbón, se generan grandes volúmenes de estériles o materiales de bajo valor económico. Estos son acumulados en escombreras al aire libre permitiendo que los minerales sulfurados (FeS2) asociados, queden expuestos al agua y al oxígeno dando origen a lixiviados conocidos como drenajes ácidos de mina (DAM). Los DAM se caracterizan por tener bajo pH, alta concentración de sulfatos y metales (Mn2+, Fe3+, A13+, Cd2+, Cu2+, Mo2+, Ni2+, Pb2+ y Zn2+) en solución (Nordstrom et al., 2015). Estos vertimientos provocan la alteración física, química y biológica de los hábitats acuáticos y del suelo irrumpiendo la cadena trófica (Johnson & Hallberg, 2005).
El distrito minero de Zipaquirá es la zona carbonífera más grande de la cordillera oriental y una de las principales fuentes de carbón térmico del país. En él se ha reportado la actividad de 600 minas artesanales, donde se estima que se generan aproximadamente 12.500 toneladas de estériles por mes provenientes de los procesos de extracción (Prieto & Duitama, 2004). Algunos de estos estériles contienen un alto porcentaje de azufre pirítico (FeS2 > 1,5%) lo que favorece la formación de DAM con bajo pH (3,0 - 4,5), alta concentración de sulfatos (> 2,500 mg L-1) y metales disueltos como Fe2+, Mn2+ y Zn2+ (> 200, 35, 20 mg L-1, respectivamente) (Vasquez et al., 2016).
Actualmente, se conoce que prevenir la formación del DAM y no su posterior tratamiento es la mejor opción ambiental (Nordstrom et al., 2015). Tratando de mitigar el problema, varios sustratos orgánicos han sido utilizados exitosamente como enmiendas, estos incluyen humus, estiércol fresco y compostado, aserrín, astillas de madera, residuos de papel y biosólidos (Clemente et al., 2006; Lindsay et al., 2011; Nason et al., 2014). Sin embargo, en algunas investigaciones se han reportado que cantidades no controladas de compost, pueden afectar la inmovilización de metales, por tal motivo se recomiendan ensayos de lixiviación en laboratorio antes de su uso en campo (Clemente et al., 2015). También, se debe tener en cuenta que los substratos orgánicos sean económicos, disponibles y abundantes en la región minera. Esto hace que no exista una “receta” y se requieran ensayos de laboratorio y campo que permitan la selección correcta del sustrato orgánico y del porcentaje de mezcla con el estéril minero.
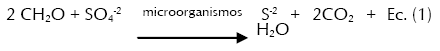
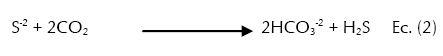
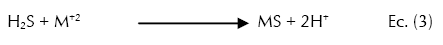
Por otra parte, se ha encontrado que la eficiencia de los substratos orgánicos para ser utilizados como enmienda en áreas mineras, depende de las bacterias celulolíticas, fermentativas y sulfato-reductoras (BSR). Las dos primeras contribuyen con la degradación de la materia orgánica haciéndola disponible para las BSR, que reducen el sulfato a sulfuro cuando tiene una fuente de carbono disponible y los sulfuros reaccionan con los metales para formar precipitados de sulfuro metálico mientras se incrementa el pH y la alcalinidad (Muyzer & Stams, 2008). El proceso es presentado bajo las siguientes reacciones químicas:
En donde CH2O (Ec. 1) representa la materia orgánica (donadora de electrones) que en presencia de los microorganismos facilitan la trasferencia de electrones hacia el sulfato (SO4-2) (aceptor de electrones). El CO2 (Ec. 2) producido en la primera reacción permite la formación del ión bicarbonato (HCO3 -2), el cual neutraliza el pH y favorece la reacción entre los sulfuros (S-2) libres y los metales para formar sulfuros metálicos (MS) que finalmente precipitan (Ec. 3). Los dos protones producidos (Ec. 3) son neutralizados por la alcalinidad generada a partir del CO2 (Ec. 2) (Hwang et al., 2011; Lindsay et al., 2011; Nazon et al., 2014).
La actividad de la comunidad microbiana puede ser evaluada a través de la cuantificación de la enzima deshidrogenasa (DHs) que es utilizada como un indicador de la actividad general en diferentes ambientes (Serra-Wittling et al., 1995), debido a que desempeñan un rol primordial en la producción de energía de los microorganismos (Chaperon & Sauvé, 2007). En previos estudios donde se han evaluado residuos alimenticios como enmienda se ha reportado que la actividad de las DHs es un indicador de un ambiente apropiado para bacterias anaerobias heterotróficas en términos de cantidad y cualidad de substrato, pH y condiciones reductoras (Hwang et al., 2011).
Esta investigación tiene como objetivo evaluar el compost de champiñón como enmienda de carbono orgánico para promover sulfato-reducción y precipitación de metales durante la formación de DAM. Además, se pretende determinar la actividad microbiana con base en la enzima DHs y los índices de saturación de las especies químicas presentes en el lixiviado.
Metodología
Muestreo de substratos orgánicos y del estéril de carbón Los estériles de carbón fueron colectados en la mina Los Pinos, asociada a la empresa Uniminas Ltda., ubicada en la vereda Falda de Molino (5°21´25,11” N 73°41´31,81” O) del municipio de Guachetá, Distrito minero de Zipaquirá (Colombia). En la mina se estima que el volumen de estériles producido diariamente es de 20 m3 cuya concentración de azufre pirítico puede variar entre 0,84 y 2,38 %. Se colectaron 8 Kg de estéril los cuales fueron seleccionados manualmente por su tamaño (0.5- 1.0 cm) y coloración (rojiza) que indica oxidación de pirita (FeS2). El compost de champiñón se compró en la empresa Agrohumus Ltda., y previamente había sido caracterizado fisicoquímica y microbiológicamente (Vasquez et al., 2016). El estiércol de vaca utilizado como inóculo microbiano de BSR se obtuvo de una finca familiar en los límites del barrio el Codito, localidad de Usaquén en Bogotá.
Construcción de las celdas. Se construyeron cinco celdas en duplicado con capacidad de 2,4 L, utilizando tubos de PVC (30 cm alto × 10 cm ancho) con tapa fija en la parte posterior y removible en la superior. La tapa inferior contenía una válvula de silicona que permitía el muestreo controlado del lixiviado una vez a la semana. En el fondo de la celda se colocó una capa de gravilla (0,3-0,8 cm) de 5 cm de espesor para evitar el taponamiento de la válvula y sobre esta se adicionó la mezcla suavemente compactada. Tres celdas contenían 300 g de mezcla de compost de champiñón y estéril de carbón (en peso seco) en porcentajes de 40:60, 25:70, 60:40 y dos celdas fueron asignadas como controles, una con 300 g de compost de champiñón y la otra con 300 g estéril de carbón. Todos los tratamientos fueron mezclados con 5 g de estiércol vacuno (húmedo) y 400 mL de agua des-ionizada (18,5 Ω). Finalmente, las celdas se dejaron en aclimatación durante una semana a temperatura ambiente (17,0 ± 1,5°C). Los porcentajes de las mezclas habían sido previamente evaluados en estudios de biorremediación de suelos contaminados con metales (Farrell et al., 2010).
Ensayo de lixiviación. Para determinar si el compost de champiñón promueve la sulfato-reducción y precipitación de metales durante la formación de DAM, semanalmente se colectaron 50 ml de lixiviado a través del puerto de muestreo situado en la tapa inferior de la celda. Inmediatamente, se determinó el pH, el oxígeno disuelto (OD) y el potencial de óxido reducción (ORP) (HI11310; HI764080; HI98120, HANNA; instruments, Romania). En muestra sin filtrar se determinó la alcalinidad (TitroLine alpha plus 20, Schott, Mainz, Alemania) por el método 2320B y se cuantificó el sulfuro disuelto por el método 4500 D donde el azul de metileno es determinado por espectrofotometría UV-VIS (Genesys 10, Thermo Scientific; Waltham, MA) (APHA, 2005). Las curvas de calibración fueron evaluadas independientemente por estándares previamente preparados corriendo un control cada 50 muestras. La muestra restante se filtró (0,45 µm) y se cuantificó sulfato por espectrofotometría utilizando el método 4500-SO4 (APHA, 2005). El remanente se acídulo con 5 gotas de HNO3 hasta pH 2,0 conservándose a 4°C hasta el análisis de metales por espectrometría de absorción atómica (Varian 240 FS, Agilent Technologies, Santa Clara, CA), utilizando el método 7000B (USEPA, 2007). Los metales analizados (Fe2+, Mn2+ Ca2+, Mg2+ y Zn2+) habían sido reportados previamente en la zona (Vasquez et al., 2016; Prieto & Duitama, 2004). Las curvas de calibración fueron evaluadas con patrones externos (NIST traceable quality control standards, Perkin-Elmer Corporation, Merck®, Germany) y los límites de detección fueron determinados en un rango de 0.03 hasta 1.0 mg L-1.
Determinación de los mecanismos de remoción. Para identificar los posibles mecanismos de remoción de los metales durante el uso del compost de champiñón como enmienda orgánica, se calculan los índices de saturación de minerales formados durante el proceso, utilizando el software de modelado geoquímico Visual MINTEQ 3,0 (Gustafsson, 2011). Este software de modelado considera la solución química y la distribución de equilibrio de las especies químicas de acuerdo a procesos geoquímicos, como la disolución/precipitación, oxidación/reducción de complejos, y el intercambio de iones. Sin embargo, Visual MINTEQ no considera la actividad microbiológica y la precipitación de sulfuros biogénicos (Zagury et al., 2006).
Determinación de la actividad microbiana. Al finalizar el ensayo de lixiviación las celdas fueron desmanteladas y la mezcla extraída fue homogenizada retirando manualmente la gravilla. Posteriormente la muestra se dejó secar al aire durante 24 horas sobre papel absorbente y se tamizó (malla No 50, 0.297). La actividad de la enzima deshidrogenasa se midió por duplicado por el método propuesto por Serra-Wittling et al, 1995. En un tubo falcón (15 ml) se colocó 1 g de mezcla y 4 ml de cloruro de 2,3,5-trifenil-tetrazolio (TTC), se agitó fuertemente y se incubó en oscuridad durante 24 horas a 30°C. Durante este tiempo las enzimas deshidrogenasas utilizan el TTC como aceptor de electrones, reduciéndolo a trifeniltetrazolio formazán (TPF) generando una coloración roja. Posteriormente, para extraer el TPF se adicionó 10 ml de metanol (grado analítico), se agitó durante 1 hora a 350 rpm, y se centrifugó a 9000 rpm durante 5 minutos. Finalmente, en el sobrenadante se cuantificó la actividad enzimática por espectrofotometría UV-VIS a una longitud de onda de 485 nm. El control negativo se preparó bajo las mismas condiciones con suelo estéril.
Análisis estadístico. Se realizó un análisis ANOVA para buscar diferencias entre las mezclas y los controles seguido de una prueba post hoc (Tukey). Por último, se realizó una correlación de Pearson para encontrar la relación directa o inversa entre los parámetros fisicoquímicos evaluados. El análisis estadístico se realizó con el software SPSS Statistics 19 (IBM, 2010).
Resultados y discusión
Ensayo de lixiviación. El OD se redujo a lo largo del estudio en todas las celdas y en la sexta semana se observaron dos grupos con diferencias significativas (ANOVA; p < 0,05) (figura 1). El primero conformado por las celdas con menor porcentaje de compost de champiñón (25:70) y el control de estéril que presentaron una concentración final de OD 0,5 ± 0,1 mg L-1 y el otro grupo conformado por las mezclas con mayor porcentaje de compost (60:40, 40:60) y el control de compost con una concentración final de 1,3 ± 0,6 mg L-1. La diferencia entre los dos grupos es causada por el porcentaje de estéril en las mezclas, en el primer grupo el OD es utilizado por el control de estéril para oxidar la pirita generando Fe2+ y sulfato lo que explica la fuerte correlación entre estos parámetros (r= 0,786; r= 0,852; p < 0,05, respectivamente), mientras que en las celdas con compost el oxígeno se utilizó para oxidar la materia orgánica cambiando el sistema a condiciones anaeróbicas (Hwang et al., 2011). Estas observaciones son corroboradas por las mediciones del ORP, donde las celdas con compost presentaron un descenso desde 200 ± 50 hasta (112 ± 21 mV en las primeras semanas, mientras que el control de estéril aumentó hasta 334,5 ± 17 mV (figura 1). El fuerte incremento del ORP en el control de estéril puede deberse a la oxidación del Fe2+ a Fe3+ que posteriormente ataca la pirita produciendo más protones en la solución manteniendo las condiciones oxidativas del medio (Nazon et al., 2014).
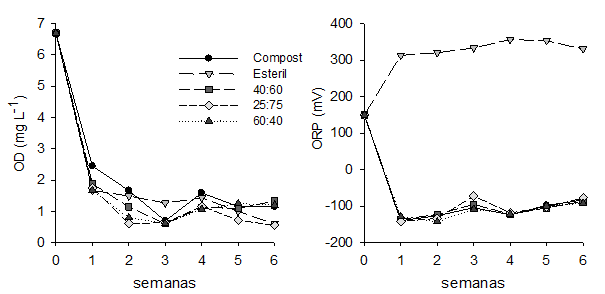
Figura 1 Cambios en el Oxígeno disuelto (OD) y en el potencial de óxido reducción (ORP) durante el ensayo de lixiviación.
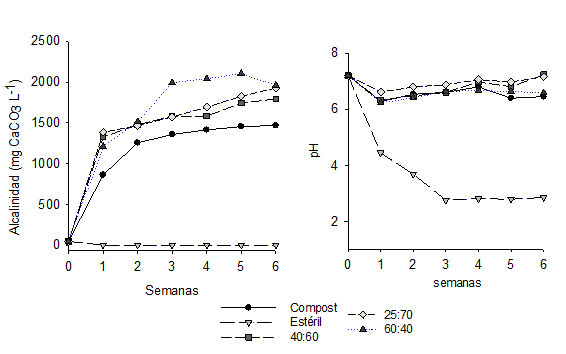
En la primera semana el pH disminuyó desde 7,2 ± 0,1 hasta 6,3 ± 0,5 en las celdas que contenían compost de champiñón, mientras que en el control de estéril el pH disminuyó hasta 4,5 ± 0,7 y continuó descendiendo hasta 2,5 ± 0,1 (figura 2). En las semanas posteriores, el pH de las celdas con compost fue incrementando hasta encontrarse diferencia significativa entre ellas. Las celdas con menor porcentaje de compost (40:60, 25:70) presentaron un pH de 7,5 ± 0,8, mientras que la celda con mayor porcentaje de compost (60:40) y el control de compost tenían un pH de 6,0 ± 1,0. El descenso inicial del pH en las celdas con compost puede atribuirse a la descomposición del substrato que genera ácidos orgánicos, mientras que el incremento posterior puede ser producido por la oxidación de la materia orgánica por BSR que liberan iones bicarbonato (HCO3 -) (Ji et al., 2012).
En el control de estériles la disponibilidad de oxígeno inicial favoreció la oxidación de la pirita liberando iones H+ y acidificando el medio. Estas observaciones se atribuyen al bajo potencial de neutralización de los residuos mineros y han sido previamente descritas (RoyChowdhury et al., 2015). El pH presentó correlación negativa con el OD (r= ( 0,604; p <0,05) y con el ORP (r= ( 0,979; p <0,01), confirmando que durante el ensayo se crearon condiciones anaerobias que favorecen el establecimiento de las BSR y que la presencia de OD contribuye con la acidificación del medio.
La alcalinidad aumentó continuamente en todas las celdas que contenían compost de champiñón encontrándose diferencia significativa entre los tratamientos y el control de compost al final del estudio (figura 2). La alcalinidad de las celdas con mezcla (1.866 ± 271 mg CaCO3 L-1) fue mayor que la del control de compost (1.466 ± 271 mg CaCO3 L-1), esta diferencia se atribuye a la disolución de los carbonatos presentes en el compost y al establecimiento de las BSR en los tratamientos que se ven favorecidos por la presencia del sulfato que se genera durante la oxidación de la pirita presente en el estéril de carbón. En estudios previos, el aumento de la alcalinidad en tratamientos con enmiendas orgánicas se atribuye a la oxidación de sustratos orgánicos por las BSR (Lindsay et al., 2011; Park et al., 2011; Ji et al., 2012). La alcalinidad del control de estéril no fue determinada por que el pH era menor de 4,5 lo que indica ausencia de iones carbonatos, bicarbonatos e hidróxidos.
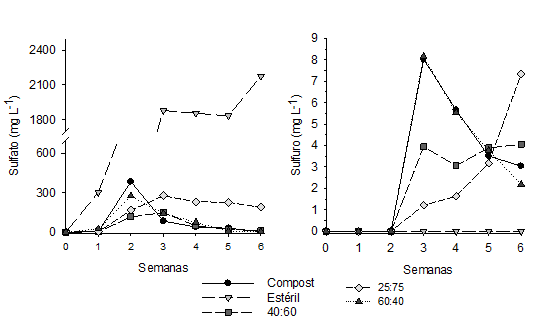
Los sulfatos fueron detectados en el lixiviado a partir de la segunda semana y se encontraron diferencias significativas (p < 0,05) que separaron los tratamientos en tres grupos al final del estudio: uno conformado por el control de estéril (2.175,9 ± 809mg L-1), otro por la mezcla 25:70 (190,1 ± 18,5 mg L-1) y el último por las mezclas 40:60 y 60:40 (7,3 ± 0,1 mg L-1) (figura 3). El incremento de sulfato en el lixiviado de los tratamientos pudo deberse a la liberación del yeso (CaSO4.2H2O) presente en el compost (Vasquez et al., 2016a), así como, a la oxidación química del azufre de la pirita. En cuanto a su posterior remoción pudo deberse al proceso de sulfato-reducción llevado a cabo por las BSR, y a una posible precipitación de yeso (CaSO4) según la modelación realizada en Visual MINTEQ 3,0.
La presencia BSR en las celdas con compost fue confirmada por la producción de sulfuro que fue detectado en el lixiviado a partir de la tercera semana donde el control de compost y la celda con mayor porcentaje de substrato (60:40) presentaron la mayor concentración (8,1 ± 2,4 mg L-1) (figura 3). Sin embargo, al final del estudio la concentración de sulfato disminuyó en estas celdas en más del 50% mientras que en la celda con menor porcentaje de compost (25:75) la concentración de sulfuro incremento en más del 70% (7,3 ± 0,1 mg L-1). Este comportamiento puede deberse a que en las celdas con mayor contenido de compost el sulfato generado al inicio del estudio fue reducido rápidamente por las BSR mientras que en las celdas con menor contenido de compost la producción de sulfato fue continua a lo largo del estudio. Además, en las celdas con compost el agotamiento del OD, la reducción del ORP y la neutralización del medio, dieron paso al establecimiento de las BSR que reducen el sulfato hasta sulfuro (Lindsay et al., 2011).
El Fe2+, Mn2+ y Zn2+ fueron lixiviados en baja concentración (9,5 ± 1,5; 3,2 ± 0,5; 1,8 ± 1,3 mg L-1, respectivamente) en las celdas que contenían compost y sin diferencias significativas entre ellas, mientras que en control de estéril se observó alta concentración de metales (100,7 ± 30,5; 6,4 ± 1,5; 21,8 ± 1,7 mg L-1, respectivamente) en el lixiviado con un alto valor de la desviación estándar debido a la heterogeneidad de la muestra. Estos resultados fueron producto de la oxidación de la pirita que libera en la solución Fe2+, SO4 2- y H+ que reducen el pH, aumentan la movilidad y disolución de los metales (figura 4). En previos estudios se ha encontrado que el uso de substratos orgánicos como enmienda previene la lixiviación de los metales a través de diferentes mecanismos como la adsorción en ligandos orgánicos (ácidos húmicos, fúlvicos y nutrientes), y la precipitación en forma de minerales (óxidos, hidróxidos, carbonatos y sulfuros) que se ve favorecida por el incremento de la alcalinidad y la generación de sulfuros por parte de las BSR (Lindsay et al., 2011; Park et al., 2011).

Figura 4 Cambios en la concentración de metales (Fe2+, Mn2+ y Zn2+) durante el ensayo de lixiviación.
En este estudio los resultados de Visual MINTEQ 3.0 sugieren la precipitación de Siderita (FeCO3) como único contribuyente a la eliminación Fe2+, esto se debe al aumento de la alcalinidad y la condición anaeróbica del sistema que hace que el hierro permanezca en forma reducida y no precipite en forma de hidróxido como se ha descrito en trabajos previos (Jensen et al., 2002; Ji et al., 2012).
En cuanto al Zn, se encontró que en las tres primeras semanas precipitó como Goslarita (ZnSO4(7H2O) y smithsonita (ZnCO3) gracias a la formación de sulfato por la oxidación del azufre pirítico de los estériles de carbón y al incremento de la alcalinidad y del pH. A partir de la cuarta semana el modelo indica que posiblemente el Zn precipitó como wurtzita (ZnS) debido a la presencia del sulfuro generado por las BSR. Estudios anteriores, determinaron que inocular BSR en la enmienda reduce la concentración de Zn2+ a través de la precipitación como sulfuro metálico (Park et al., 2011). Este podría ser un mecanismo de remoción en los tratamientos con enmienda sabiendo que el estiércol utilizado como inóculo cuenta con BSR, previamente reportadas en el tracto intestinal del ganado vacuno (Waybrant et al., 2002).
La remoción de Mn2+ presentó fuerte correlación con el pH (r = 0,977; p<0,01), comportamiento observado en estudios previos donde se ha determinado que la eliminación de Mn2+ está ligada al aumento del pH (> 8,0) y la alcalinidad (RoyChowdhury et al., 2015). Además, se conoce que la concentración de Mn2+ en aguas anaerobias pueden ser controlada por el equilibrio de solubilidad de fases minerales poco solubles, por la cinética de reacciones de precipitación, por mecanismos de intercambio catiónico, o por procesos de adsorción (Hwang et al., 2011). No obstante, la modelación arroja índices de saturación favorables para la rodocrosita (MnCO3) a causa de su baja solubilidad y del ambiente anaerobio caracterizado por altas concentraciones Mn2+ (Jensen et al., 2002; Nazon et al., 2014).
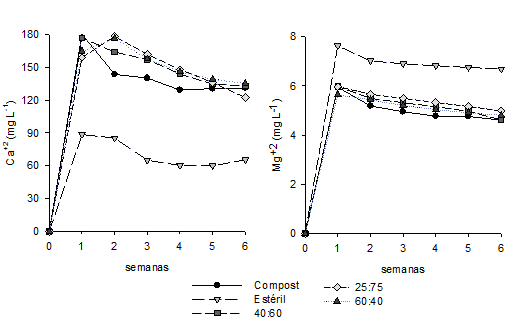
Durante la primera semana las concentraciones de Ca2+ y Mg2+ incrementaron en los lixiviados de todas las celdas, con diferencias significativas (p < 0,05) entre las que contienen compost de champiñón y el control con sólo estéril de carbón (figura 5). El incremento inicial de Ca2+ (170,2 ± 24,6 mg L-1) se atribuye a la disolución del carbonato de calcio (CaCO3) y del yeso (CaSO4) que son adicionados durante el proceso de compostaje (información suministrada por Agrohumus Ltda.). La reducción posterior de calcio posiblemente se debe a la formación de aragonita y calcita donde pH más alcalinos favorecen la precipitación de estos carbonatos (Warren et al., 2001), resultado que fue confirmado con el software Visual MINTEQ 3,0. La calcita tiene una cinética de disolución más lenta, más estable y menos soluble que la aragonita, por ende, es fácilmente reemplazada por la calcita en su precipitación, justificando los índices de saturación mayores en la calcita (Sunagawa, et al., 2007).
Por otro lado, el incremento de Mg2+ (6,2 ± 4,3 mg L-1) se atribuye a la composición química del compost y a la posible presencia de este metal en el estiércol bovino (Vásquez et al., 2016). La consecuente disminución de sus concentraciones, se debe posiblemente a las condiciones favorables de pH, alcalinidad y oxígeno disuelto que reducen la disponibilidad de metal como resultado de la adsorción de la materia orgánica y óxidos metálicos (Park et al., 2011).
En resumen, en las celdas con materia orgánica se crearon condiciones anaerobias con bajo OD y ORP que permitieron el crecimiento de BSR que contribuyen con el incremento del pH, la alcalinidad y sulfuro. Sin embargo, en la mezcla con menor porcentaje de compost de champiñón (25:75) se observó una mayor concentración de sulfuro lo que posiblemente favorece la formación de sulfuros metálicos que son los minerales esperados cuando se usan sustratos orgánicos como enmienda dada su baja solubilidad (ZnS -28.39; FeS -22.39 y MnS -13.34) (Jong & Parry, 2003).
Actividad enzimática. Los resultados de la enzima DHs muestran alta actividad microbiana en las mezclas que contenían compost indicando que su presencia contribuyó en la formación de un apropiado ambiente para los microrganismos anaerobios en términos de OD, pH, ORP y nutrientes (figura 6). La mayor actividad se encontró en el control de compost mientras que la menor en el control de estéril de carbón (5.0 ± 2.4 comparado con 0.15 ± 0.1 mg TPF g de mezcla seca−1) debido a que en el control de estéril las condiciones fisicoquímicas crearon una fuerte presión sobre los microorganismos y sólo se desarrollaron aquellos que podían adaptarse.
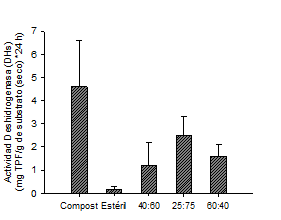
Figura 6 Actividad de la enzima deshidrogenas (DHs) en los controles y en las celdas con mezclas de compost de champiñón y estéril de carbón.
El control de compost presentó una diferencia significativa con respecto a las celdas que contenían la mezcla (ANOVA; p < 0,05). Esta diferencia puede ser debida a la presencia de metales lixiviados por el estéril presente que generan un ambiente tóxico para los microorganismos. En este estudio se encontró una correlación negativa entre el Zn y la actividad DHs (r = (0,795; p<0,01) la cual ha sido previamente reportada dada la capacidad del Zn de formar quelatos con los grupos sulfihidrilos de los sitios activos de las enzimas (Mikanova, 2006). Las enmiendas aumentan la actividad de las enzimas que juegan un papel fundamental en la degradación y evolución de la materia orgánica (Farrell et al., 2010). La adición de enmiendas favorece la presencia de una comunidad microbiana activa que puede contribuir en prevención de la formación de DAM.
Conclusiones
El uso de compost de champiñón como enmienda orgánica sobre estériles de carbón con alto contenido de azufre pirítico mostró resultados promisorios para establecer condiciones sulfato-reductoras, inmovilizar los metales e incrementar la alcalinidad, el pH y la actividad microbiana durante la formación del DAM. Aunque todas las mezclas evaluadas en este estudio fueron prometedoras, la mezcla con menor porcentaje de compost de champiñón (25:75) presentó una mayor concentración de sulfuro en el lixiviado, así como mayor actividad microbiana. Estos resultados confirman que en la remoción de los metales participan BSR que a través de su actividad metabólica reducen el sulfato a sulfuro que químicamente reacciona con los metales para generar sulfuros metálicos. No obstante, se recomienda evaluar el compost de champiñón como enmienda orgánica en ensayos de campo porque aún no se conoce si este substrato puede ser fuente de carbono y energía para una comunidad microbiana activa durante un largo período de tiempo o si las condiciones ambientales pueden inducir una posterior movilidad de los metales.