INTRODUCCIÓN
Las cianobacterias, comúnmente denominadas algas verde azules, comprenden un grupo grande y heterogéneo de procariontes fotoautotróficos oxigénicos (Van Den Hoek et al., 1995). Las mismas han sido aprovechadas para diferentes fines, destacándose su utilidad en la biorremediación de ambientes contaminados (Santos et al., 2012), como productora de energía (Harun et al., 2010), fertilizantes (Venkataraman, 1981), metabolitos secundarios de interés farmacológico (Nuhu, 2013) y muy especialmente como alimento para el consumo humano y animal (Kovaè et al., 2013).
En vista de la gran aplicabilidad de las cianobacterias, se han diseñado dos métodos de producción para estos microorganismos: los sistemas abiertos en los que el cultivo está expuesto a la atmósfera y los sistemas cerrados, comúnmente denominados fotobiorreactores, en los que el cultivo tiene poco o ningún contacto con la atmósfera (Grobbelaar, 2000). El segundo método de cultivo es el que más se ha desarrollado, ya que permite obtener mayores rendimientos en cuanto a biomasa y evita ciertas dificultades que se presentan en los sistemas abiertos a la hora de cultivar y cosechar microalgas (Ravelonandro et al., 2011; Uslu et al., 2011; Yuan et al., 2011).
Una de las cianobacterias más cultivada en fotobiorreactores es Arthrospira (A. maxima y A. platensis), anteriormente llamada Spirulina; y la producción de su biomasa o metabolitos dependerá de diversos factores tales como la temperatura (Pandey & Tiwari, 2010; Colla et al., 2007a; Colla et al., 2007b; Ogbonda et al., 2007), tasa de aireación (Ravelonandro et al., 2011), concentración de CO2 (Soletto et al., 2008; Ravelonandro et al., 2011), fuentes de carbono (Soundarapandian & Vasanthi, 2010), fuentes de nitrógeno (Colla et al., 2007a; Colla et al., 2007b; Uslu et al., 2011; Yuan et al., 2011), fosfato y fase de crecimiento (Ravelonandro et al., 2011; Yuan et al., 2011).
Arthrospira se comercializa por su alto contenido de proteínas, ácidos grasos esenciales y vitaminas y sus efectos beneficiosos se han atribuido a sus componentes, como los polifenoles, ácidos grasos poliinsaturados (PUFAs), terpenos, clorofila y pigmentos accesorios del aparato fotosintético. En general, estos compuestos son antioxidantes que reducen la intensidad del estrés oxidativo (Cano-Europa et al., 2012). Adicional al alto contenido proteico, mineral y vitamínico que presenta Arthrospira, su cultivo se ha venido masificando con la finalidad de obtener biomasa con altos contenidos de pigmentos, tales como clorofila a, carotenos, xantófilas (mixoxantófilas, zeaxantina, criptoxantinas, entre otras) y muy especialmente las ficobiliproteínas: aloficocianina, ficocianina y ficoeritrina; las cuales presentan en su estructura grupos prostéticos que son cromóforos tetrapirrólicos de cadena abierta (Challem, 1981; Glazer, 1985).
Los pigmentos de las cianobacterias pueden ser extraídos, identificados y cuantificados por distintos métodos químicos. Generalmente, las extracciones se realizan con agua, solventes orgánicos, tales como acetona, metanol, etanol, entre otros (Medina-Jaritz et al., 2011; Vonshak, 1997a; Vonshak, 1997b) o soluciones salinas, entre las que se cuentan: nitrato de sodio, cloruro de calcio, entre otras (Medina-Jaritz et al., 2011; Rodríguez-Sánchez et al., 2012); y actualmente, estos pigmentos naturales se emplean como aditivos en fórmulas farmacéuticas y alimentos procesados; como por ejemplo la clorofila, la cual proporciona una actividad quelante que puede utilizarse en tratamientos farmacológicos, especialmente la reparación celular, el aumento de la hemoglobina en la sangre y el aumento del crecimiento celular (Humphrey, 2004).
En Venezuela, las investigaciones sobre producción de biomasa de Arthrospira y productos derivados de ésta, son escasos (Loreto et al., 2007; Romero, 2009; Romero et al., 2011; Rincón et al., 2013; Licet et al., 2014) y no se ha logrado desarrollar una tecnología que pueda aprovechar los beneficios que brinda esta microalga. Por tal motivo, el trabajo aquí descrito será pionero en la evaluación del contenido de pigmentos liposolubles (β-caroteno, clorofila a, zeaxantina) y ficobiliproteínicos (ficocianaina, ficoeritrina, aloficocianina) extraídos de Arthrospira maxima, cultivada en dos sistemas de fotobiorreactores, en ambientes controlados.
MATERIALES Y MÉTODOS
Microorganismo. Se utilizó una cepa de Arthrospira maxima procedente de la colección de Texas (UTEX), donada por el Laboratorio de Microalgas del Centro de Investigaciones Biológicas del Noroeste, S.C. (CIBNOR, México) y mantenida en el Banco de Germoplasma de Algas de la Universidad de Oriente (Código: BGAUDO-260), ubicado en el Laboratorio de Biotecnología de Microalgas, Departamento de Biología Pesquera, Instituto Oceanográfico de Venezuela, Universidad de Oriente.
Condiciones de cultivo. A. maxima fue cultivada en medio Zarrouk (Zarrouk, 1966), de forma discontinua, durante 30 días, en dos tipos de fotobiorreactores, como se describe en Romero et al. (2011), con suministro de luz artificial haciendo uso de lámparas fluorescentes de 40 w, las cuales suministraban una intensidad luminosa de 5000 lux, con fotoperiodo de 12:12. En estos sistemas de cultivo se determinaron las fases de crecimiento exponencial y estacionario. Durante este periodo de cultivo, diariamente se midió el pH, utilizando un pHmeter Denver, AP 10.
Determinación del contenido de pigmentos
Clorofila a, â-caroteno y zeaxantina. Los pigmentos fueron determinados durante las fases de crecimiento exponencial (día 12) y estacionaria (día 24), a partir de 20 mg de biomasa humeda, obtenida por filtración en papel de fibra de vidrio Advantec GC50 (1,2 µm) haciendo uso de equipo Millipore, la cual se homogenizó con 10 mL de acetona al 90%, durante 24 h, a 4 ºC. Seguidamente, se centrifugó (3500 r.p.m., 5 min) para obtener el extracto de pigmentos, el cual se llevó a sequedad bajo ambiente de nitrógeno gaseoso y se mantuvo a -20 ºC hasta su posterior análisis por cromatografía líquida de alta resolución (HPLC). La columna utilizada fue Agilent Hypersil MOS (4,6 x 100 mm, 5 µm de tamaño de partícula); detector de arreglo de diodos, utilizando estándares de clorofila a y β-caroteno y zeaxantina, bajo parámetros periódicos de flujo de solventes de 1 ml min.-1, tiempo de corrida y post-corrida de 20 y 1 min respectivamente, con rangos de presiones entre 0-400 bar, longitud de onda de 440 y 667 nm; y tiempo de detección de 20 min; con volumen de inyección de 100 µL; corrida por gradiente.
Pigmentos ficobiliproteinícos. Para la extracción de estos pigmentos se evaluaron, por triplicado, cuatro (04) métodos. En todos los casos, la cuantificación de los contenidos de ficocianina, aloficocianina y ficoeritrina se realizó mediante espectrofotometría UV-Visible, midiendo las absorbancias de los extractos a los máximos de absorción de 650, 620 y 565nm (Boussiba & Richmond, 1979; Bryant et al., 1979):
Primer método: extracción con regulador de fosfatos y enzima (Boussiba & Richmond, 1979).
Segundo método: extracción con solución alcalina, previo tratamiento con CaCl2, la cual consistió en mezclar 20 mg de la biomasa de la cianobacteria con 4 mL de una solución de CaCl2 (10 mg L-1) durante 45 min., posteriormente se realizaron lavados con 4 mL de CaCl2, y se eliminó el sobrenadante. Al precipitado se le adicionó 4 mL de solución alcalina (pH = 10; NaHCO3-Na2CO3). Se agitó por 2 horas, se centrifugó, y el sobrenadante fue lavado con 4 mL de C6H14; finalmente, la fase acuosa fue filtrada y se realizaron las medidas a las absorbancias a los máximos de absorción.
Tercer método: extracción con regulador de fosfato tratado con hielo seco. Para ello, se mezclaron 20 mg de la biomasa de la cianobacteria con 4mL de regulador de fosfato y se sometió a congelación inmediata, incorporándole hielo seco; seguidamente se dejó a temperatura ambiente para su descongelación, repitiéndose tres veces este ciclo. Posteriormente, se centrifugó (3500 r.p.m., 5 min) y al sobrenadante se le midió las absorbancias a los máximos de absorción.
Cuarto método: extracción con agua a baja temperatura. Consistió en triturar en vortex, 20 mg de la biomasa de la cianobacteria con 4 mL agua destilada fría (4°C); posteriormente, se centrifugó y al sobrenadante se le midió las absorbancias a los máximos de absorción.
Análisis estadísticos
Una vez evaluados los datos en el cumplimiento de los supuestos de homogeneidad y normalidad, los resultados de pigmentos liposolubles (clorofila a, β-caroteno y zeaxantina) se analizaron a través de una ANOVA de dos vías (factor 1: fases de crecimiento, factor 2: sistema de cultivo). Los contenidos de ficobiliproteínas se analizaron a través de un ANOVA de tres vías (factor 1: fases de crecimiento, factor 2: sistema de cultivo y factor 3: metodología de extracción), siguiendo recomendaciones de Sokal & Rolhf (1995). La existencia de diferencias significativas (P<0,05) se contrastó mediante el método de comparaciones múltiples de Scheffé (Zar, 1984), empleándose en ambos análisis el paquete estadístico Statgraphics plus 4.1.
RESULTADOS Y DISCUSIÓN
Los valores de pH registrados en los cultivos de A. maxima en ambos fotobiorreactores variaron entre 9,81 y 10,32 unidades de pH, los cuales están en concordancia con lo reportado por la mayoría de los autores, quienes indican que el metabolismo de A. maxima, así como el de otras especies del género Arthrospira es óptimo a pH entre 9 y 11 (Rafiqul et al., 2005), lo cual garantiza, además, que los cultivos sean menos contaminados por otros organismos competidores y/o depredadores, tipo microalgas o protozoarios (Ciferri, 1983). Situación está que se corroboró en este trabajo, ya que no se evidenció en los cultivos la presencia de este tipo de organismos. El estudio del pH como un factor que afecta el crecimiento de cianobacterias ha sido estudiado por Monaselidze et al. (2002), quienes concluyen que el rango óptimo de pH para S. platensis (en medio Zarrouk, en fase estacionaria y en oscuridad) varió entre 9,4 y 10,3; y que la termoestabilidad de las macromoléculas y los complejos responsables de la respiración celular depende débilmente del pH, más no así la morfología de los tricomas, células y composición proteica.
Los contenidos de clorofila a, zeaxantina y β-caroteno se muestran en la figura 1. El análisis de varianza reveló diferencias significativas (P<0,05) en el contenido de estos pigmentos tanto en los tipos de fotobiorreactores como en la fases de crecimiento, siendo el fotobiorreactor helicoidal y la fase de crecimiento exponencial (12 días) donde se obtuvieron los mayores contenidos de clorofila a (11,08 ± 0,006 µg mL-1; 0,96%), zeaxantina (0,72 ± 0,002 µg mL-1; 0,06%) y β-caroteno (1,82 ± 0,003 µg mL-1; 0,16%).
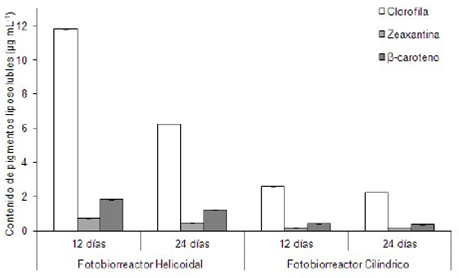
Figura 1 Contenido de pigmentos liposolubles (μg mL-1, pro-medio ± desv. estándar) en A. maxima, cultivada bajo condiciones controladas de laboratorio en fotobiorreactores.
Los resultados del contenido de clorofila a en esta investigación coinciden con lo reportado por Godoy et al. (2011), y Parages et al. (2012), quienes encontraron en Arthrospira contenidos de este pigmento entre 0,6-1,6%. Contenidos de clorofila a, superiores a los encontrados en esta investigación (11,08 ug mL-1, 0,96% con respecto a la masa seca) fueron señalados por otros autores. Sin embargo, otros trabajos han reportado valores superiores, por ejemplo Leema et al. (2010), llegó a determinar hasta 350 ug mL-1 en la fase estacionaria para Arthrospira (Spirulina) platensis cultivada en medio Zarrouk modificado con NaHCO3 y agua de mar; y Jain & Singh (2012) obtuvieron contenidos de clorofila a de hasta 2,1% en cultivos de Spirulina (Arthrospira) platensis enriquecidos con NaHCO3, NaCl, NaNO3 y extractos (30%) de calabaza blanca (Benincasa hispida). Esta discrepancia de resultados puede deberse a las diferencias en las condiciones de cultivos y a los métodos de cuantificación empleados.
Contenidos de β-caroteno similares a los determinados en esta investigación (1,82 ± 0,003 µg mL-1; 0,16% con respecto a la masa seca) fueron señalados por Rafiqul et al. (2003), con Spirulina platensis; sin embargo, Leema et al. (2010), cuantificaron valores de β-caroteno superiores (0,37%) en A. platensis cultivada en medio Zarrouk. Estas diferencias de resultados podría deberse a que los anteriores autores utilizaron intensidades luminosas de 140 umol photon m-2 s-1, mayores que las empleadas en este trabajo (95 umol photon m-2 s-1), y se ha demostrado que cultivos de microalgas expuestos a mayores intensidades luminosas tienden a acumular mayores contenidos de carotenoides para contrarrestar la fotoxidación (Demming-Adams & Adams, 2002).
Con respecto a los contenidos de ficobiliproteínas, de acuerdo a los diferentes métodos de extracción, el análisis de varianza reveló diferencias significativas (P<0,05) entre los 4 métodos de extracción usados, los dos tipos fotobiorreactores y los dos periodos de cosecha, para cada uno de los pigmentos analizados; obteniéndose los mayores contenidos en el fotobiorreactor cilíndrico, en la fase de crecimiento estacionario (24 días) y cuando la extracción fue realizada con regulador de fosfato tratado con hielo seco (figura 2). El pigmento en mayor proporción fue la ficocianina (78,51±0,778 mg L-1; 8,72% con respecto a la masa seca), seguido por la aloficocianina (49,24±0,767 mg L-1; 5,36% con respecto a la masa seca) y ficoeritrina (20,27±0,235 mg L-1; 2,25% con respecto a la masa seca).
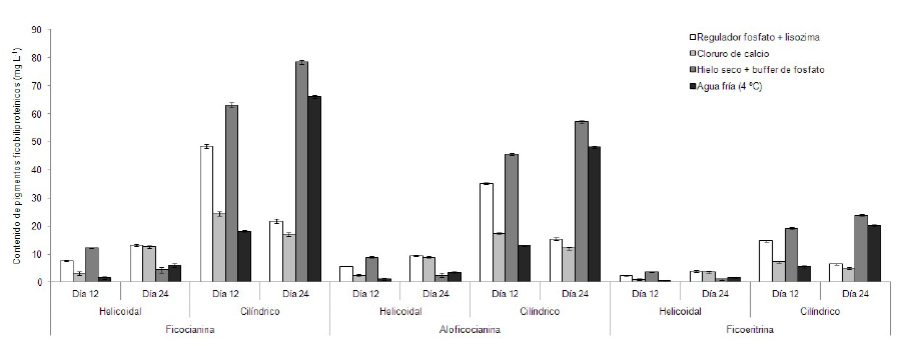
Figura 2 Contenido de ficobiliproteínas (mg L-1; promedio ± desv. estándar), obtenido a través de los diferentes métodos de extracción, de A. maxima cultivada bajo condiciones controladas de laboratorio en fotobiorreactores helicoidal y cilíndrico y cosechada durante las fases de crecimiento exponencial (12 días) y estacionario (24 días).
El mayor contenido de ficocianina obtenido en esta investigación (78,51 mg L-1, equivalente al 8,72%) fue superior que el obtenido por Sandeep et al. (2015), en A. platensis (5%) utilizando buffer fosfato como solvente de extracción y similar a los señalados por Becker (1994) y Simpore et al. (2005), quienes indicaron que en Arthrospira las concentraciones de ficocianina pueden llegar a alcanzar entre el 9 y 15% de la masa seca del alga. Las mayores concentraciones de ficocianina presentes en los cultivos realizados en el fotobiorreactor cilíndrico se puede deber a limitación lumínica que afectó a este cultivo, ya que a juicio de Vernerey et al. (2001), quienes realizaron un estudio relacionado con el diseño de fotobiorrectores para el cultivo de Spirulina platensis, se podría propiciar la síntesis de ficocianina por parte de las células de esta cianobacteria al verse limitadas de luz, para captar de manera más eficiente la energía luminosa.
Así mismo, Ajayan et al. (2012), además de reportar altos valores de clorofila a, también cuantifican el contenido de ficobiliproteínas (PC = 148,1 mg g-1; APC = 45,2 mg g-1; FE = 5,8 mg g-1), encontrando que las mayores concentraciones de estos pigmentos, al realizar la extracción con buffer fosfato, se logran producirse por Spirulina (Arthrospira) platensis dependiendo del tipo de nutriente utilizado para su cultivo (urea y KNO3) y las distintas intensidades lumínicas.
En vista del interés biotecnológico que representa la ficocianina, la búsqueda de sistemas de cultivo y técnicas de extracción y purificación más eficientes para la obtención de este pigmento se han venido incrementando. De esta manera, Furuki et al. (2003), lograron obtener un mayor contenido de ficocianina de A. platensis, utilizando irradiación ultrasónica 28 kHz, Lamela & Márquez-Rocha (2000) obtuvieron 19,83 mg g-1 de ficocinaina (1,9 % con relación a su masa seca) al aplicar sonicación y posterior congelación con buffer fosfato (pH = 7). García & Pérez (2011) incrementaron la extracción de ficocianina a partir de Arthrospira platensis (Spirulina), realizando la extracción de las ficobiliproteínas con la técnica de congelación-descongelación de -4°C a 4°C, en cuatro ciclos consecutivos, reportando una pureza de ficocianina igual al 2%, con un porcentaje de recuperación del 2%.
De forma general, en la presente investigación se puede indicar que el tratamiento de la biomasa de A. maxima con buffer de fosfato más hielo seco permitió extraer un contenido considerable de ficocianina similar al reportado por otros investigadores (Bryant et al., 1979; Bryant, 1981; Fukushima & Aizaki, 2005), faltando por precisar mejores condiciones y sistemas de cultivo de esta microalga, a fin de optimizar la producción de este valioso metabolito.
Al culminar esta investigación se corroboró que Arthrospira maxima es una cianobacteria con potencial biotecnológico, debido, entre otras características, al contenido de pigmentos que posee, los cuales son productos base en la industria de la alimentación humana y animal, farmacéutica y de la medicina; Por tal motivo, es importante encontrar un sistema de cultivo que permita obtener biomasa con altos contenidos de estos pigmentos, aunado a ensayar metodologías que permitan la mejor obtención de los mismos, evitando su degradación.
CONCLUSIONES
El tipo de fotobiorreactor a utilizar para la obtención de pigmentos dependerá del interés que se tenga en un pigmento u otro. Así, para obtener los mayores contenidos de pigmentos liposolubles se recomienda utilizar un fotobiorreactor helicoidal, realizando la cosecha durante la fase exponencial. Si por el contrario, se quiere obtener mayores contenidos de ficobiliproteínas se recomienda utilizar fotobiorreactor cilíndrico, con cosecha en fase estacionaria, con extracción con regulador de fosfato tratado con hielo seco. Es importante seguir desarrollando nuevos diseños de fotobiorreactores que permitan obtener biomasa de Arthrospira rica en compuestos de interés biotecnológico.














