INTRODUCCIÓN
Los inoculantes biológicos son productos que contienen cepas o consorcios microbianos como principio activo, los cuales, al ser aplicados al suelo o las plantas, promueven el desarrollo vegetal por diferentes mecanismos, especialmente facilitando la absorción de nutrientes por parte de las plantas (Owen et al., 2015), este concepto define a los productos conocidos como biofertilizantes (ICA, 2011). De otro lado, las enmiendas orgánicas son insumos ricos en sustancias húmicas, utilizados para compensar la pérdida de la materia orgánica humificada en el suelo, lo que está asociado al incremento de algunos índices edafológicos físicos, químicos y biológicos (Valero et al., 2016). Las sustancias húmicas (SH) son de gran importancia en la conservación del suelo, debido a que están directamente relacionadas con la formación de agregados, la disponibilidad de nutrientes por aumento en la capacidad de intercambio catiónico, la capacidad de retención de humedad y la estimulación del desarrollo de las plantas por efectos de tipo hormonal (Piccolo et al., 1997; Canellas & Olivares., 2014).
No obstante, la aplicación directa de SH (obtenidas generalmente por solubilización alcalina) en suelos de zonas cálidas como el trópico seco es poco provechoso, puesto que estas son fácilmente mineralizadas (Kleber, 2003). Por lo tanto, deben desarrollarse estrategias que permitan la aplicación de fuentes más conservadas de materia orgánica humificada en el suelo (Valero et al., 2016; Cubillos-Hinojosa et al., 2015, 2017). En ese sentido, no se han realizado avances en el desarrollo de bioproductos que contemplen el uso de microorganismos y materia orgánica con el fin de aumentar el contenido SH en el suelo.
Valero et al. (2014), describieron la capacidad de la cepa bacteriana solubilizadora de carbón (BSC3) Microbacterium sp. para producir SH mediante la solubilización de carbones de bajo rango (CBR), lo que permitió plantear la posibilidad de desarrollar un inoculante que contemplara el uso de carbón tipo lignito inoculado con BSC3, para usarlo como fuente de materia orgánica humificada en suelos degradados por la minería (Cubillos-Hinojosa et al., 2015, 2017). El género bacteriano Microbacterium sp., pertenece al grupo de las actinobacterias y ha sido descrito como un organismo endófito o asociado a la rizosfera de plantas en zonas áridas y salinas, con actividad promotora de crecimiento vegetal a través de diferentes mecanismos (Kaur et al., 2011; Rashid et al., 2012; Shrivastava y Kumar, 2013; Alves et al., 2014).
Para la elaboración de bioproductos se requiere de la multiplicación de las células microbianas que constituyen el principio activo del producto. Los medios de cultivo utilizados para multiplicar la biomasa microbiana, durante la elaboración de inoculantes biológicos, deben desarrollarse a partir de sustratos económicos, residuales, de amplia disposición y garantizar la conservación de la actividad biológica por la que el organismo fue seleccionado (Angulo-Cortés et al., 2012). De esta forma, resulta muy útil el aprovechamiento de residuos agrícolas o agroindustriales, para la producción biotecnológica de productos biotransformados, con alto valor agregado, tales como metabolitos y biomasa microbiana (Domínguez-Espinosa et al., 2002).
La optimización de los factores relacionados con la producción de biomasa microbiana, tales como concentración de nutrientes y el pH, en medios de cultivo complejos, es un proceso largo y costoso, por lo tanto se requiere el uso de diseños estadísticos que permitan la interacción de varios factores a la vez (Angulo-Cortés et al., 2012). Los diseños de superficie de respuesta, tales como el Box Behnken, se basan en modelos matemáticos que permiten observar el resultado de las interacciones entre los factores, al tiempo que reduce el número de combinaciones en el diseño, por eso son muy utilizados en la optimización de medios de cultivo (Gómez y Batista, 2006; Angulo-Cortés et al., 2012).
En este trabajo se diseñó un medio de cultivo para la multiplicación de biomasa de la cepa bacteriana Microbacterium sp. (BSC3), con el fin obtener el ingrediente activo para desarrollar un inoculante biológico que contribuya a la reposición de la materia orgánica en suelos degradados en el Departamento del Cesar.
MATERIALES Y MÉTODOS
Sustratos utilizados para la elaboración del medio de cultivo. Se utilizaron como materias primas tres residuos agroindustriales típicos en el departamento del Cesar: Melaza de caña, lactosuero dulce y extracto acuoso de cabecilla de arroz. La melaza de caña fue empacada en recipientes plásticos con tapa y conservada a temperatura ambiente, el lactosuero fue almacenado en botellas plásticas y conservado en congelación y los residuos fragmentados de arroz (cabecilla de arroz) fueron empacados en bolsas plásticas y conservados a temperatura ambiente hasta su uso.
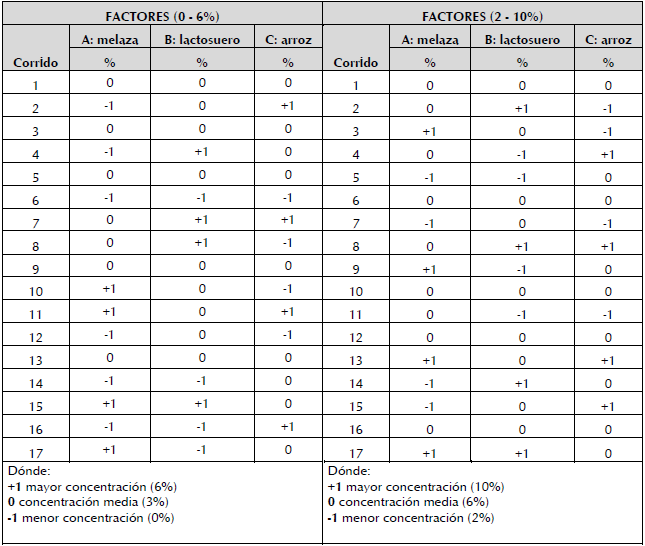
Diseño experimental. Para la optimización de las concentraciones de sustratos se utilizó un diseño de superficie de respuesta tipo Box Behnken, en el cual se evaluaron dos rangos de concentraciones de (0 - 6% y 2 -10%), con cinco repeticiones del punto central (tabla 1). Para el experimento, se utilizaron tubos de ensayo con un volumen de trabajo de 10 ml. El diseño estuvo constituido por tres factores (A: melaza; B: lactosuero; C: extracto acuoso de cabecilla de arroz) y tres niveles (+1: mayor concentración; 0: concentración media; -1: menor concentración), como variable de respuesta se tuvo en cuenta la obtención de biomasa del microorganismo en términos de peso seco. Todas las combinaciones resultantes del diseño, se prepararon con un medio mínimo de sales (MMS), con la siguiente composición en g/ L: K2HPO4, 1.73; KH2PO4, 0.68; NH4SO4, 1.0; MgSO4 7H20, 0.1; CaCl 2H2O, 0.02; MnSO4 H2O. 0.03 y FeSO4 7H2O, 0,03. (Carrillo et al., 2004). Los cultivos se incubaron a 30 ± 2 °C en agitación orbital a 250 rpm por 72 horas. Se seleccionaron las combinaciones en las que se obtuvo mayor producción de biomasa.
Tabla 1 Combinaciones con concentraciones de los sustratos en los rangos 0 - 6 % y 2 - 10 % para la producción de biomasa de BSC3.
Determinación del efecto del pH sobre la producción de biomasa de BSC3: Se desarrolló un experimento completamente al azar, con cinco repeticiones. Se evaluaron 3 valores de pH [5,6 (inicial del medio de cultivo); 6,0 y 6,5], el pH fue modificado con HCl (0,1N) o NaOH (0,1N) según fuera necesario. Estos valores de pH fueron seleccionados según los requerimientos reportados por Park et al., 2008 para Microbacterium sp.
Curva de crecimiento de BSC3
Preparación del inoculo: La cepa BSC3 fue sembrada en agar nutritivo, e incubada por 72 horas a 37° C, a partir de este cultivo se obtuvo un inoculo liquido en solución salina estéril, el cual fue estandarizado mediante espectrofotometría (D.O600nmn: 0,1). Se tomaron 3 mL de esta suspensión bacteriana y fueron sembrados en 27 mL de un medio de cultivo constituido por 30% del medio optimizado y 70% caldo nutritivo (Oxoid®), los frascos con el inóculo fueron incubados a 30 ± 2 °C a 250 rpm por 72 horas.
Determinación de la producción de biomasa de BSC3: El inóculo fue depositado en frascos cilíndricos con capacidad de 500 mL, con 270 mL del medio optimizado, hasta completar un volumen de 300 mL; estos fueron mantenidos a 30 ± 2°C en agitación orbital 250 rpm. Se tomaron muestras de 10 mL cada cuatro horas, durante 72 horas, estas fueron centrifugadas (5000 rpm) por 10 minutos, posteriormente se determinó la producción de bio-masa por peso seco. El experimento se hizo por triplicado y como medio control se utilizó peptona 1% + extracto de levadura 1 % + sacarosa 1%.
Determinación de parámetros cinéticos: A partir de los datos obtenidos de la curva de crecimiento microbiano se determinó la producción final de biomasa la velocidad especifica de crecimiento |i(h-1) y el tiempo de duplicación td (h).
Se utilizaron las siguientes fórmulas matemáticas:
Velocidad específica de crecimiento: µ = (1/x) dx/dt = (lnXf - lnXi)/tf - ti (Doran, 1995).
Dónde: x: Concentración de la biomasa en el instante t (g L-1)
dx/dt: Rata volumétrica de crecimiento de la biomasa (gL-1 h-1)
µ Rata específica de crecimiento (h-1). Es la rata de crecimiento por unidad de biomasa presente (Doran, 1995).
Tiempo de duplicación (td): td = ln 2/ µ = 0.693/ µ (Doran, 1995)
Caracterización elemental del medio de cultivo: Se adaptó la técnica analítica ASTM D5373 para la determinación instrumental de carbono, hidrógeno y nitrógeno utilizando, en un analizador elemental EAI CE-440.
Conservación de la actividad productora de SH por BSC3 a partir de CBR, después de ser cultivada en el medio optimizado: BSC3 fue sembrada en agar nutritivo a partir de un cultivo líquido con el medio diseñado; después se preparó una suspensión bacteriana 0,5 escala de McFarland en solución salina estéril mediante espectrofotometría. 1 mL de esta suspensión fue inoculado en tubos con 10 ml de caldo nutritivo, suplementado con 0.003 % de Humus Alfa®; los tubos fueron incubados a 37°C durante 48 horas. Después de este tiempo se adicionó a cada tubo 0,1g de CBR, con un tamaño de partícula 0 - 300 i previamente esterilizado en autoclave a 121 °C /15 lb por 15 minutos. Posteriormente los tubos se incubaron a 30 ± 2° C en agitación orbital a 360 rpm. Después de 7 días el cultivo bacteriano con el carbón fue centrifugado a 5000 rpm durante 10 minutos. La absorbancia del sobrenadante se midió por espectrofotometría a 465 nm (Valero et al., 2014); los datos fueron interpolados en una curva de calibración con concentraciones conocidas de SH desde 500 hasta 4000 mg.L-1. El experimento se realizó con diez repeticiones. Se utilizó un medio con CBR y sin inóculo como control.
Análisis estadístico: Para el diseño del medio de cultivo se aplicó un diseño experimental de superficie de respuesta, tipo Box- Behnken, con tres niveles y tres factores, utilizando el software Statgraphics Centurion XVI. Para determinar la producción de SH por las cepas, los experimentos complementarios al diseño experimental y la determinación del efecto del pH en la producción de biomasa se utilizó un análisis ANOVA, utilizando el test de Tukey (p<0,05).
RESULTADOS Y DISCUSIÓN
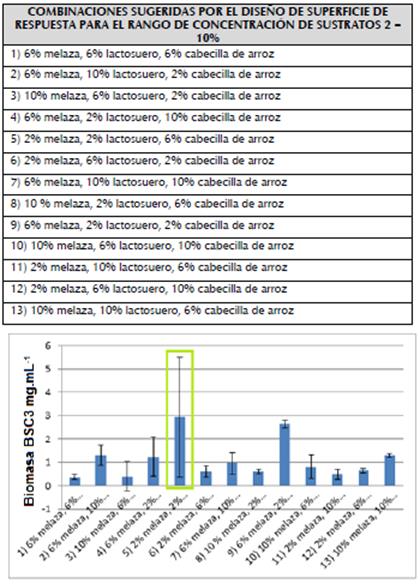
Diseño con concentraciones de 2-10 % de los sustratos para cultivo de BSC3: La interacción de melaza y lactosuero ejerce un efecto positivo y significativo sobre la producción de biomasa (figura 1A). Sin embargo, la melaza por sí misma no influye en la producción de biomasa, y el lactosuero por sí mismo no influye positivamente en el crecimiento del microorganismo. Las interacciones: lactosuero - extracto acuoso de cabecilla de arroz y melaza - extracto acuoso de cabecilla de arroz, influyeron positivamente en la producción de biomasa microbiana, pero no mostraron significancia estadística, mientras que las concentraciones del extracto acuoso de cabecilla de arroz no provocan efectos positivos ni significativos sobre la producción de biomasa de BSC3.
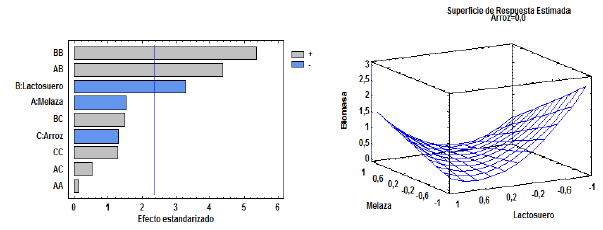
Figura 1 A) Diagrama de Pareto para el análisis de la significancia estadística de los factores. B) Superficie de respuesta de la producción de biomasa de BSC3 en el rango de concentraciones de 2-10 % de los sustratos.
Se obtuvo la mayor concentración de biomasa (3,4 mg.mL-1) (figura 1B), con la menor concentración de todos los sustratos (2%). Algunos autores han descrito la producción de biomasa y metabolitos de actinobacterias con concentraciones de melaza de 2 y 3%, (Fusconi et al., 2005), sin embargo, este resultado no fue tenido en cuenta debido a la alta variabilidad de los datos que muestran a la menor concentración de melaza (2%) como óptima para la producción de biomasa de BSC3 (material suplementario 1). Por otro lado, el diagrama de Pareto (figura 1A) permite inferir que en este rango de concentraciones ningún factor influye individualmente sobre la producción de biomasa de BSC3, lo que contrasta con el valor óptimo obtenido de biomasa.
Estos resultados muestran la reducción de la producción de biomasa con la utilización de la concentración más alta de melaza (10%), esto puede ser explicado por la saturación de los mecanismos enzimáticos y de transporte de nutrientes al interior de la célula, debido al exceso de nutrientes en el medio; concentraciones excesivas de azucares como glucosa y sacarosa (presentes en la melaza) generan cambios en la osmolaridad, (Shimizu, 2014) y en el equilibrio electroquímico del entorno celular bacteriano, los cuales inhiben la actividad del complejo enzimático PTS (phosphotranferase sugar) dependiente de PEP (phosphoenyl pyruvate), lo cual reduce la captación de azucares por parte de las células y la capacidad de crecimiento bacteriano, (Ellwood et al.,1979). El sistema PTS también ha sido descrito en el género Microbacterium sp (Singh et al., 1985; Sharma et al., 2013).
Los resultados de la concentración óptima de lactosuero coinciden con los obtenidos por Guerra et al. (2001), quienes describieron mayor producción de biomasa y bacteriocinas de Lactococcus lactis subsp. lactis CECT 539 y Pediococcus acidilactici NRRL B-5627, en concentraciones bajas de lactosuero.
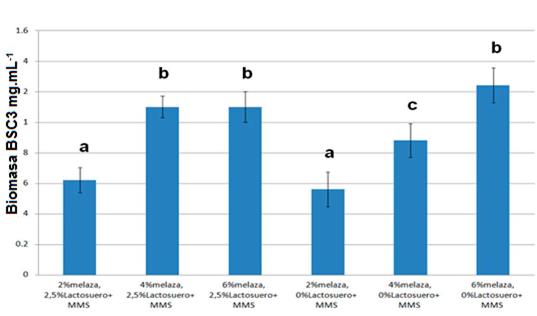
De esta forma y basados en los resultados presentados en el material suplementario 1, se sugiere que la concentración óptima de melaza para la obtención de biomasa de BSC3 es 6%.
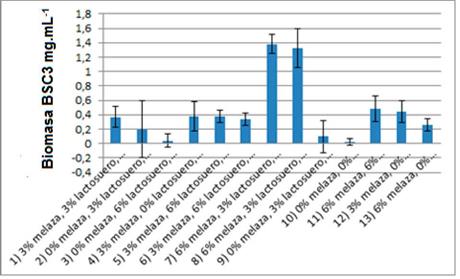
Diseño con concentraciones de 0-6% de los sustratos para cultivo de BSC3: El factor más influyente para la producción de biomasa de BSC3 en el rango de concentraciones de sustratos 0 - 6% fue la melaza, (figura 2A). La interacción melaza - lactosuero, así como el efecto individual del extracto acuoso de cabecilla de arroz y lactosuero, influyeron positivamente en la producción de biomasa, pero sin significancia estadística. Por otra parte, las combinaciones de melaza - extracto acuoso de cabecilla de arroz, lactosuero - extracto acuoso de cabecilla de arroz generan efectos negativos sobre el crecimiento de BSC3.
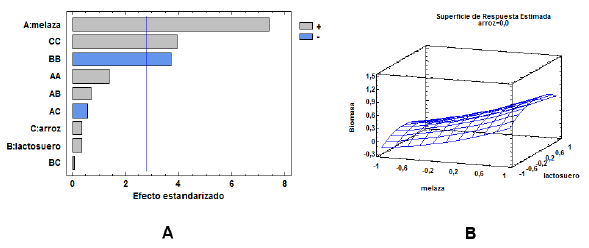
Figura 2 A) Diagrama de Pareto para el análisis de la significancia estadística de los factores. B) Superficie de respuesta de la producción de biomasa de BSC3 en el rango de concentraciones de 0-6% de los sustratos.
La mayor producción de biomasa en el rango 0 - 6% (1,16 mg.mL-1) se obtuvo con concentraciones de 6% de melaza, 2,59% de lactosuero y 0% de extracto acuoso de cabecilla de arroz (figura 2B). Este resultado es consistente con los presentados en los materiales suplementarios 1 y 2, en los que se puede observar que la concentración óptima de melaza para la producción de bio-masa de BSC3 es de 6%, con una baja variabilidad de los datos.
El factor menos significativo para el diseño 0 - 6% fue el extracto acuoso de cabecilla de arroz, hecho que concuerda con el diseño anterior. Aunque no hay reportes de la producción de biomasa de Microbacterium sp. en medios de cultivo diseñados a base de estos sustratos, si se ha reportado la optimización del cultivo de algunas actinobacterias, con fines de producción de biomasa y metabolitos de interés industrial en concentraciones de melaza de caña de 6 y 7%, (El-Enshasy et al., 2008; Choi et al., 2009; Abdelwahed et al., 2012), hecho que concuerda con lo reportado por este trabajo.
El medio de cultivo para la obtención de biomasa de BSC3 quedó constituido por: melaza de caña (6%) + lactosuero (2,5%) + MMS. Este resultado fue confirmado mediante otro ensayo en el que se comparó la producción de biomasa de BSC3 en los medios optimizados por cada diseño (material suplementario 3).
Determinación del efecto del pH sobre la producción de biomasa de BSC3: La mayor producción de biomasa se obtuvo con un pH de 6,5, mostrando diferencias estadísticas significativas con respecto a los otros valores (figura 3). Park et al. (2008), reportaron un rango óptimo para crecimiento de Microbacterium sp. entre 5 y 9. El incremento de la biomasa de BSC3 a pH 6,5 puede deberse al acercamiento de la cepa al pH 7, el cual ha sido descrito como óptimo para el desarrollo de este género bacteriano (Rivas et al., 2004; Bakir et al., 2008), puesto que en estas condiciones son más activos los sistemas enzimáticos relacionados con el metabolismo de fuentes de carbono complejas (Yamamoto y Asano, 2015).
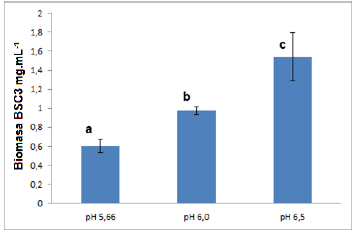
Figura 3 Efecto de pH sobre la producción de biomasa de BSC3. Letras comunes no difieren estadísticamente según el Test de Tukey (p<0,05).
Conservación de la actividad solubilizadora de carbón de BSC3 después de ser cultivada en el medio de cultivo diseñado. Se evidenció la producción de SH por BSC3 a partir de CBR, con diferencias significativas con respecto al control (figura 4), este fenómeno había sido descrito en esta cepa por Valero et al. (2014). Sin embargo, la producción de SH por parte de BSC3 fue menor a lo descrito previamente. Es posible que la elevada carga de nutrientes presentes en el medio de cultivo optimizado, haya funcionado como un activador, acelerando el consumo de sustrato de tal forma que los microorganismos pudieron metabolizar las SH generadas ("efecto priming") (Hamer et al., 2004). Este efecto también está relacionado con la saturación del metabolismo microbiano, debido a la elevada carga de nutrientes del medio, lo que se conoce como "efecto priming inverso" disminuyendo la capacidad biológica de la cepa (Hamer et al., 2004). No obstante, esta leve reducción en la actividad solubilizadora de carbón de BSC3, generada por su multiplicación en el medio de cultivo optimizado, no ha mostrado una reducción en su efectividad al ser inoculada en el suelo en conjunto con lignito, en experimentos a nivel de invernadero y de campo (Datos no mostrados - Grupo de Investigación Microbiología Agrícola y Ambiental).
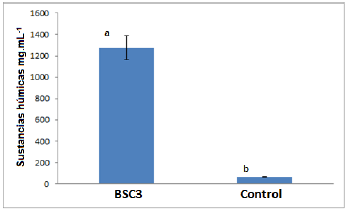
Figura 4 Producción de SH por BSC3 después de ser sembrada en el medio diseñado. Letras comunes no difieren estadísticamente según el Test de Tukey, (p<0,05).
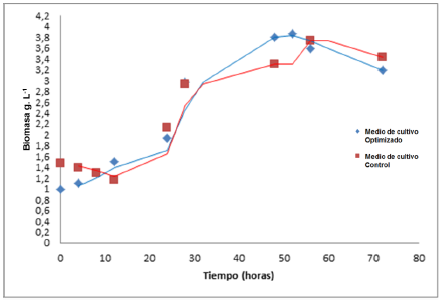
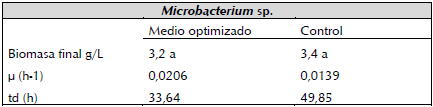
Curva de crecimiento y determinación de parámetros cinéticos: BSC3 inició su fase exponencial a las 24 horas, tanto en el medio diseñado, como en el medio control (figura 8). El valor más alto de producción de biomasa en el medio optimizado se presentó a las 52 horas (3, 86 g.L-1), mientras que para el medio control fue a las 56 horas (3, 76 g.L-1).
Después de 72 horas, en el medio optimizado se produjo menor biomasa, mayor velocidad especifica de crecimiento (u=0,0206 h-1) y menor tiempo de duplicación (td=33,64 h) en comparación con el medio control cuyos datos para u y td fueron: 0,01 39 h-1 y 49,85 h, respectivamente (tabla 2). Los cultivos bacterianos líquidos en concentraciones altas de azucares tienden a incrementar la velocidad o tasa especifica de crecimiento y el tiempo de duplicación durante las primeras horas del cultivo, pero al final del proceso suelen presentar valores inferiores en la producción de biomasa, esto se debe a que la saturación de nutrientes inducen cambios osmóticos que reducen la eficiencia de algunos sistemas enzimáticos implicados en la absorción y transformación de azucares, esto se traduce en disminución de biomasa bacteriana (Shimizu, 2014); esta explicación concuerda con los resultados obtenidos en este trabajo, sin embargo, pese a que la biomasa obtenida en el medio diseñado estuvo por debajo de la obtenida en el medio control, no se prestaron diferencias estadísticas significativas entre ellas.
Tabla 2 Parámetros cinéticos para el cultivo de BSC3. Letras comunes no difieren estadísticamente según el Test de Tukey(p<0, 05).
Caracterización elemental (CNH) del medio de cultivo
La tabla 3 muestra los resultados de la caracterización instrumental CHN del medio de cultivo optimizado, el contenido de carbono estuvo dentro del rango descrito previamente por Batista (1998) para este elemento en melaza, debe tenerse en cuenta que este trabajo presenta la caracterización del medio de cultivo con todos sus componentes, por lo tanto esta concentración de carbono está influenciada por el contenido de lactosuero y la dilución de la que fue objeto durante la optimización de la producción de biomasa de BSC3. De otro lado,
Tabla 3 Caracterización elemental del medio de cultivo optimizado. DE: desviación estándar.
| Muestra | Medio Optimizado | Lactosuero | |
| Especie elemental | %m/m DE g/L (Aprox) | %m/m | DE g/L (Aprox) |
| C | 1,87 0.06 18,7 | 2,07 | 0,03 20,7 |
| N | 0,50 0,14 5,0 | 0,26 | 0,00 2,6 |
| H | 3,98 0,08 39,8 | 0,47 | 0,00 4,7 |
Batista (1998) describe una concentración de N inferior (0,1 - 1,5 g.L-1) a la presentada en estos resultados (Aproximadamente 5,0 g.L-1), por lo tanto, el incremento en la concentración de N puede ser efecto del contenido de lactosuero, ya que su caracterización elemental indica que este resulta una fuente importante de carbono y nitrógeno en la constitución del medio. El contenido de C y N en el medio de cultivo optimizado permiten la obtención adecuada de biomasa bacteriana de BSC3.
CONCLUSIONES
Se optimizó el diseño de un medio de cultivo para la producción de biomasa de BSC3 a partir de melaza (6%) y lactosuero (2,5%), más un contenido mínimo de sales. No hubo diferencias entre la producción de bio-masa de BSC3 obtenida en el medio de cultivo diseñado y el medio de cultivo elaborado a partir de componentes comerciales; en el medio de cultivo diseñado se obtuvo mayor velocidad de crecimiento bacteriano y menor tiempo de duplicación; estos resultados indican la utilidad del medio ensayado para la producción de bio-masa de BSC3.
La cepa bactriana BSC3 conservó su capacidad de producir SH a partir de CBR después de ser cultivadas en el medio de cultivo optimizado, lo que indica posibilidad de elaborar la formulación de un inoculante bacteriano a partir de esta cepa cultivada en este medio. De esta manera se diseñó un medio de cultivo para la producción de biomasa de BSC3 a partir de residuos agroindustriales comunes en el Departamento del Cesar.