INTRODUCCIÓN
Ganoderma lucidum (Curt.: Fr.) P. Karst es una especie de la clase Basidiomycetes, que pertenece a la familia Polyporaceae del orden Aphyllophorales (Chang y Miles, 2004). Desde tiempos remotos, su cuerpo fructífero ha sido usado tradicionalmente para el tratamiento de enfermedades como hepatitis, artritis, nefritis, bronquitis, asma, arteriosclerosis, hipertensión, cáncer y úlcera gástrica (Berovic et al., 2003; Chang & Miles, 2004; Paterson, 2006; Wasser, 2013; Zhou et al., 2012). La producción de G. lucidum sobre diversos sustratos sólidos utilizando materiales lignocelulósicos que se encuentran en los subproductos de la agroindustria y la agricultura se desarrolla a diferentes escalas de industrialización en varios países (González et al., 2002; Lee et al., 2003). Adicionalmente, el cultivo de diversas especies de hongos, como el cultivo de G. lucidum son una alternativa para el aprovechamiento de residuos y la conversión de los mismos en productos de alto valor (Ke et al., 2011).
De acuerdo con Chang y Miles (2004, un factor ambiental desencadenante para la formación de hongos macromicetos en algunas especies es la luz, y ésta juega un papel crucial en el cambio de fase de estado vegetativo a reproductivo, siendo más notorio en la etapa de formación de primordios. Estudios previos, indican notoriamente el empleo de LED (Diodo Emisor de Luz) con ventajas sobre equipos de luces convencionales, dado que producen menos calor y su espectro de luz es más estable (Miyazaki et al., 2011).
Recientemente Zapata et al. (2009), obtuvieron en fermentación sumergida de G. lucidum una producción eficiente de biomasa micelial a longitudes de onda comprendidas entre 425 y 475 nm, que corresponden a luz azul, seguida por luz blanca, oscuridad, luz roja y amarilla incrementando los registros de producción actuales. En Schizophyllum commune, Pholiota nemako, Grifola frondosa y Lentinula edodes se demostró cambios en el ciclo productivo por fotoinducción de los cuerpos fructíferos por luz azul debido a la alta promoción de primordios incrementando la eficiencia biológica del cultivo (Leatham & Stahmann, 1987; Miyazaki et al., 2011; Perkins & Gordon, 1969). Para L. edodes, P. nemako y Pleurotus eryngii este tipo de luz logró activar el crecimiento y promover la pigmentación de primordios y cuerpos fructíferos. Leatham & Stahmann (1987) reportaron para L. edodes que el desarrollo del basidio-ma depende de la combinación de la fuente de luz y la intensidad, y la composición del medio de cultivo. Además, la intensidad del LED azul en P. eryngii influyó significativamente en los fenotipos de los cuerpos fructíferos producidos, cuanto más fuerte era la intensidad de luz, más grandes eran los cuerpos fructíferos y más oscura se tornaba su pigmentación (Miyazaki et al., 2011). Jang et al. (2013), evaluaron el efecto del color del diodo emisor de luz sobre el desarrollo del cuerpo fructífero en Hypsizygus marmoreus y encontraron que la exposición a la luz LED es útil para inducir cuerpos fructíferos de alta calidad, así como niveles más altos de ergosterol, actividad antioxidante, contenido total de polife-noles y potencia reductora en estos basidiomas en comparación con los expuestos a luz fluorescente (control). En Flammulina velutipes hubo lugar a cambios morfológicos en los cuerpos fructíferos expuestos a luz blanca presentando mayor longitud y grosor el estípite, tamaño del píleo y desarrollo de pigmentación (Sakamoto et al., 2004). En un estudio para Cordyceps militaris, se utilizaron LED con diferentes longitudes de onda de luz para evaluar los efectos de la fuente de luz en el comportamiento cinético de la producción de biomasa y exopolisacáridos (EPS) con una concentración máxima de biomasa de 17,06 g/L usando luz roja y una máxima producción de EPS de 2404,2 mg/L con luz azul durante 10 días de cultivo (Kho et al., 2016). Huang et al. (2017), demostraron que la intensidad de los diodos emisores de luz azul influye en las propiedades antioxidantes y en el contenido de azúcares de Lentinus edodes y Pleurotus sajor-caju.
En la Planta de Bioprocesos y Agroindustria de la Universidad de Caldas, se evaluó el efecto de la luz azul (longitud de onda 450nm - 470nm) sobre la producción y eficiencia biológica del cultivo de Schizophyllum commune en un proceso de fermentación en estado sólido realizado en el foto-reactor LED para crecimiento celular modelo ACL-002 serie A1. En este trabajo se obtuvo una reducción del ciclo de producción de 58,97% y 53,84% en tiempo total de cultivo para los tratamientos de 12 y 24 horas, respectivamente. Asimismo, se alcanzó eficiencias biológicas de 26,47%, 29,02% y 25,86% para los tratamientos de 12, 24 horas, y condiciones estándar de cultivo, respectivamente. Con estos resultados se observó una influencia de la luz azul en los tiempos del ciclo de cultivo del hongo y su eficiencia biológica (Henao et al., 2016). Asimismo, se han desarrollado proyectos de investigación aplicada a fin de buscar el incremento de las eficiencias biológicas del cultivo sólido de diferentes especies de macromicetos, entre los que se encuentra el G. lucidum. Para este hongo, se han desarrollado diferentes formulaciones y métodos de cultivo obteniéndose cuerpos fructíferos de diferentes cepas del macromiceto adaptadas a escala piloto de 200 kg de sustrato. Es así como, en estos proyectos se ha probado la suplementación de los medios de cultivo con diferentes sales como manganeso y cobre, con el propósito de estudiar su efecto sobre las actividades enzimáticas ligninolíticas, incremento en la eficiencia biológica, mejoras en su producción, entre otros. Del mismo modo, se han desarrollado proyectos a fin de evaluar la producción de polisacáridos como carbohidratos totales tanto en la fase vegetativa, como en la de fructificación para este hongo en cultivos a pequeña escala (Montoya et al., 2013). Sin embargo, hay pocos reportes sobre la aplicación de luz LED en el cultivo sólido de Ganoderma lucidum. En particular, se dispone de información limitada sobre el efecto de la irradiación de los sustratos con luz LED azul variando el foto-estímulo durante las fases del cultivo de este macromiceto. Por tal razón, en este estudio se usaron luces LED de color azul para investigar sus efectos sobre el cultivo sólido de Ganoderma lucidum. Para este propósito, se determinaron la eficiencia biológica (EB), la tasa de producción (TP) y el tamaño de los cuerpos fructíferos obtenidos del hongo.
MATERIALES Y MÉTODOS
Organismo
Se utilizó una cepa de Ganoderma lucidum WC806 obtenida de la Pensylvania State University Mushroom Culture Collection, EUA, disponible en la Planta de Bio-procesos y Agroindustria de la Universidad de Caldas, mantenida en agar papa dextrosa (PDA) con transferencia periódica. El micelio del hongo fue transferido desde la cepa de origen al centro de la caja Petri y fue incubado a 25°C y penumbra hasta colonización completa con posterior refrigeración a 4°C.
Preparación de semilla
La semilla fue preparada en dos etapas, la primera etapa, correspondió a la fase de adaptación de la cepa de G. lucidum sobre un material lignocelulósico, sorgo rojo, el cual fue previamente hidratado hasta 35 - 40% humedad. Se emplearon bolsas de polipropileno bio-rientado, polímero termoplástico que consiste en una película de polipropileno que fue extruida en dos direcciones durante su proceso de fabricación y fue seleccionado principalmente por sus propiedades químicas como la alta permeabilidad al agua, al vapor de agua, sus buenas propiedades mecánicas, constituido por moléculas sencillas sensibles a la luz UV, favoreciendo el proceso de esterilización además de ser un material fácilmente reciclable y considerado por la FDA como inocuo, reduciendo un foco de contaminación durante cultivo del hongo. El sorgo rojo hidratado fue empacado en las bolsas con 200 g cada una, esterilizado a 121°C por una hora, enfriado hasta temperatura ambiente e inoculado con cuatro trozos de 0,5 cm de lado de micelio extendido en agar PDA. Posterior a esto, fueron llevados a incubación hasta colonización completa a 25°C y penumbra. La segunda etapa, correspondió a la elaboración de la semilla o inóculo para los sustratos experimentales. La formulación en base seca utilizada fue: 50% de aserrín de roble, 27% cascarilla de café, 20% salvado de maíz, 2% carbonato de calcio, 1% de azúcar, con adición de agua hasta alcanzar una humedad de 60%. Este medio de cultivo fue empacado en bolsas de polipropileno biorientado con 1 kg de material formulado. Los sustratos empacados fueron esterilizados en autoclave a 121°C durante una hora aplicando el método Tyndall. Este método consiste en aplicar tratamiento térmico por un tiempo definido a 121°C durante dos días consecutivos, dejando el material a temperatura ambiente en intervalos de 24 horas. Durante el primer tratamiento térmico se destruyen las formas vegetativas pero no las endosporas bacterianas, por lo que se requiere la aplicación de dos periodos de tratamiento térmico consecutivos, con el fin de permitir el desarrollo de las formas esporuladas en el intervalo a temperatura ambiente. Posteriormente, se realizó la inoculación con el micelio crecido en sorgo rojo descrito antes al 4% (p/p) respecto al peso de sustrato húmedo. Las bolsas inoculadas fueron llevadas a incubación a 25°C y penumbra hasta colonización completa.
Preparación de sustrato para fructificación
La formulación en base seca de sustratos para producción de los cuerpos fructíferos de G. lucidum utilizada fue: 50% de aserrín de roble, 26,95% cascarilla de café, 20% salvado de maíz, 2% carbonato de calcio, 1% de azúcar y 0,05% de sulfato de manganeso. Todos los sustratos fueron formulados a 62% de humedad, empacados en bolsas de polipropileno biorientado de 1 kg con posterior esterilización a 121°C por dos horas y método Tyndall; luego, el sustrato se inoculó en cabina de flujo laminar al 5% (p/p) en base húmeda con la semilla. Posteriormente, los sustratos inoculados fueron llevados a la sala de cultivo, en la que se dividieron las bolsas para exposición a luz azul en foto-reactor y las que se dejaron como testigo expuestas a luz blanca.
Condiciones de crecimiento y producción de G. lucidum
Las bolsas inoculadas se llevaron a sala de cultivo bajo condiciones medioambientales controladas de iluminación, temperatura, humedad relativa y concentración de CO2 con relevos de aire fresco permanente realizado mediante ventilación de acuerdo a los requerimientos en cada fase de crecimiento y producción. En la sala de cultivo se ubicó el foto-reactor LED para crecimiento celular modelo ACL-002 serie A1 de dos compartimentos independientes que permitió la programación de los fotoperiodos (FP). En cada compartimento del foto-reactor se ubicaron seis bolsas de 1 kg de sustrato inoculadas y se sometieron a foto estímulos de 12 y 24 horas respectivamente durante todas las etapas de crecimiento y desarrollo del G. lucidum, utilizando como testigo seis bolsas de sustrato inoculadas con el hongo de estudio y sometidas a condiciones convencionales de crecimiento y desarrollo como lo describe Montoya et al. (2013), y Rodríguez & Jaramillo (2005; es de aclarar que, la potencia luminosa varió entre 0 y 151,5 lúmenes/m2 para el foto-estímulo de 12 h y 92,6-151,5lúmenes/m2 para los tratamientos restantes y se tuvo en cuenta que el ángulo del haz luminoso era de 110°, con altura desde el bombillo al centro geométrico de las unidades experimentales de 0,35m. La iluminancia alcanzada con un bombillo LED de potencia 10w azul sobre la superficie fue medida con un fotómetro de rango doble trazable en el centro geométrico de las unidades experimentales.
Parámetros de productividad de Ganoderma lucidum
Durante la fase reproductiva y para conocer el potencial de producción de la cepa estudiada se determinó la eficiencia biológica (EB) y la tasa de producción (TP). i). La eficiencia biológica del proceso, se determinó como la masa de hongos frescos referidos a la masa de sustrato seco al momento de la siembra en porcentaje de acuerdo a lo indicado por Chang & Miles (2004; y ii) la tasa de producción, según Vega & Franco (2013) se obtuvo mediante la relación del porcentaje de eficiencia biológica entre el número total de días del proceso.
RESULTADOS Y DISCUSIÓN
Período de crecimiento y desarrollo del hongo G. lucidum con y sin foto estímulos de luz azul
En la tabla 1 se exponen las condiciones de cultivo para el crecimiento y desarrollo de G. lucidum para los tratamientos fotobiológicos estudiados y el tiempo de duración de la etapa de incubación y producción del hongo. Es así como se puede observar que el factor de mayor relevancia fue el tiempo total de cada etapa; para el cual, el menor tiempo de incubación y de producción se obtuvo para el FP de 24 horas con un promedio de 10 y 34 días respectivamente.
Tabla 1 Condiciones de cultivo para crecimiento y desarrollo del hongo G. lucidum bajo el estímulo de luz azul en comparación con las condiciones convencionales.
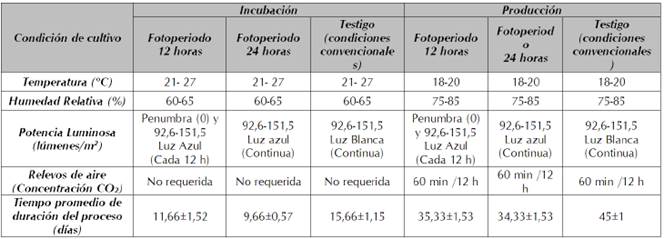
El ciclo total de crecimiento y desarrollo del hongo G. lucidum se extendió como máximo a 60,6 días para los sustratos expuestos a luz blanca fluorescente, con un total de dos cosechas; sin embargo, para los sustratos expuestos a fotoperíodos (FP) con luz azul de 12 y 24 horas, los ciclos de producción total fueron menores como se muestra en la tabla 2. Aquí, se presentan los valores de los parámetros de productividad y el tamaño de los carpóforos obtenidos. Los valores EB y TP más altos fueron obtenidos para G. lucidum cultivado bajo FP de 24 h, siendo de 28,04% y 0,64 respectivamente. Los valores más bajos de EB y TP se obtuvieron para G. lucidum cultivado bajo luz blanca fluorescente, correspondientes a 23,96% y 0,40, respectivamente. Lo anterior, se presentó como consecuencia de una cantidad superior de hongos frescos obtenidos y una reducción mayor del tiempo de cultivo en el tratamiento con foto-estímulo constante de 24 h. La duración del cultivo de G. lucidum se redujo en 13 y 16 días para los tratamientos con FP de 12 y 24 h con luz azul, respectivamente. De acuerdo con Chang y Hayes (2013), el efecto foto-morfogénico es de gran importancia para el crecimiento de los hongos; hasta cierto punto, la luz regula el tiempo en el que se produce la maduración y por tanto el tiempo de cosecha. Huang et al. (2017), reportaron que la inducción para la fructificación en macromicetos depende solo de controlar la intensidad de la luz y el fotoperíodo, y ocurre mucho antes de que los nutrientes disponibles se agoten en el medio de cultivo.
Los cuerpos fructíferos obtenidos en los tres tratamientos evaluados se muestran en la tabla 2, en la que es posible observar que los carpóforos de mayor tamaño se obtuvieron para el FP de 24 h, con basidiomas de 10 a 17,5 cm de píleo, carnosos, con peso promedio de 68,21 g cada ejemplar, lo que permite considerar que la estimulación lumínica del cultivo del hongo G. lucidum es un parámetro importante sobre su productividad y EB.
Los datos son presentados como la medición ± la desviación estándar (n=3). La diferencia en los parámetros de productividad para G. lucidum entre los tratamientos bajo irradiación con luz azul (LED) y con luz blanca fluorescente, puede explicarse por varios factores sensoriales como la presencia de fotorreceptores absorbentes de luz azul, moléculas que reciben fotones a través de cromóforos y transducen la energía del fotón en la célula para regular la foto-respuesta fúngica promoviendo una respuesta metabólica a través de expresión génica diferencial, como la biosíntesis de carotenoides, la agregación hifal, la formación de primordios y la diferenciación del hongo (Huang et al., 2017; Kurtzman & Martínez, 2013). El control atento del entorno de luz durante la diferenciación del micelio es efectivo para modular las respuestas secundarias relacionadas con los metabolitos en el micelio vegetativo o en los cuerpos fructíferos (Postemsky & Curvetto, 2016).
Miyazaki et al. (2011), reportaron que para percibir los estímulos de luz ambiental esenciales para el inicio del desarrollo de la fructificación en hongos, se cree que son necesarios los factores sensoriales y / o la maquinaria, como los fotorreceptores. Varios receptores de luz azul se han identificado en hongos, comenzando con WC-1, proteína que interactúa con el cromóforo flavín adenín dinucleótido (FAD), que ha demostrado un espectro de acción de respuesta fisiológica en ~ 465 nm (Froehlich et al., 2002). Estos cromóforos son los foto-rreceptores más importantes en hongos, se encargan de controlar el reloj biológico y regular muchas respuestas a la luz descritas en estos organismos, por lo que se han convertido en el paradigma de la fotobiología fúngica, tanto a nivel bioquímico como molecular (Fuller et al., 2015). WC-2 es otra proteína con dominio de zinc que actúa como factor transcripcional. Además, WC-1 interactúa con WC-2 para formar el heterodímero conocido como complejo WCC (Corrochano, 2007). Otras proteínas similares a WC-1 y WC-2 se han descrito en otros hongos, lo que sugiere un papel general para el complejo de WCC como receptor de hongos para la luz azul (Corrochano, 2007; Herrera-Estrella & Horwitz, 2007; Tisch & Schmoll, 2010). Sin embargo, fotorreceptores como las rodopsinas y los criptocromos, se han identificado en los hongos, pero su relevancia funcional no ha sido dilucidada hasta la actualidad (Corrochano, 2007).
Otras investigaciones realizadas, indican que la acción de las enzimas activas en carbohidratos (también conocidas como enzimas CAZy o CAZimas) son responsables de la hidrólisis de los polisacáridos de la pared celular de la planta, y juegan un papel importante en el proceso de degradación del sustrato. Los carbohidratos del sustrato lignocelulósico degradado, tales como mono y oligosacáridos, se utilizan como fuente de energía y nutrición para el desarrollo y reproducción de hongos. Un caso de estudio, se realizó para Pleurotus eryngii, un hongo comestible y medicinal de pudrición blanca donde se mostró que éste también produce diversas CAZimas para transformar todos los componentes de la biomasa vegetal, incluida la celulosa, la hemi-celulosa y la lignina (Xie et al., 2016a; Xie et al., 2016b). Resultados de la actividad enzimática de las CAZimas representativas indicaron que las actividades de estas enzimas fueron afectadas en la diferenciación de primordios en cuerpos fructíferos bajo la estimulación con luz azul (Xie et al., 2018). Sin embargo, todavía no está claro si la luz azul induce la expresión de CAZimas en el hongo Ganoderma lucidum. Esta información trans-criptómica podría promover nuestra comprensión de los mecanismos genéticos y moleculares del desarrollo del cuerpo fructífero bajo luz azul.
La descripción de los basidiomas obtenidos de G. lucidum corresponde a cuerpos fructíferos de color castaño rojizo, brillante y satinado por la cara superior, blanco en la cara inferior, con textura porosa, sombrero reniforme, con diámetro dentro de un rango similar al descrito por Calonge (2011). Respecto a las características morfológicas se observó que la luz azul provocó la formación de algunos cuerpos fructíferos con elongación del estípite y formación de píleos (sombreros) de mayor diámetro. Además, durante el crecimiento vegetativo del micelio, se presenció una mayor promoción de la formación de primordios lográndose producir una masa de cuerpos fructíferos u hongos frescos superior bajo los tratamientos con luz azul. Este efecto fue descrito por Miyazaki et al. (2011), para el hongo Pholiota nameko. Es así como, el control del ambiente luminoso durante la diferenciación del micelio es efectivo en la modulación de las respuestas relacionadas con los metabolitos secundarios en el micelio vegetativo o en los cuerpos fructíferos (Postemsky & Curvetto, 2016). Chiang et al. (2017), exponen que la aplicación de luz LED será una de las estrategias potenciales para mejorar la productividad de diferentes metabolitos secundarios útiles mediante fermentación en estado sólido. Sin embargo, los mecanismos del efecto de las diferentes longitudes de onda basada en LEDs que regulan las rutas metabólicas requieren más investigación.
CONCLUSIONES
El desarrollo de este proceso biotecnológico donde se evaluó la irradiación con luz azul mediante la exposición de las unidades experimentales demostró ser más eficiente en la producción de cuerpos fructíferos, logrando un incremento en la eficiencia biológica y la tasa de producción, una reducción del tiempo de cultivo lo que se traduce en disminución del costo de proceso y por tanto una contribución al estudio de la foto-biología en procesos fúngicos. Con esta investigación, se pone a disposición información científica sobre las condiciones adecuadas de foto-estímulo para el proceso de cultivo sólido del hongo G. lucidum. Aquí, se obtuvieron carpóforos en todos los tratamientos evaluados, pero con diferencia en la calidad de los cuerpos fructíferos con mejores resultados con foto-estímulo de 24 h, con basidiomas de 10 a 17,5 cm de píleo, carnosos, con peso promedio de 68,21 g cada ejemplar, lo que permite considerar que la iluminación durante el cultivo del hongo Ganoderma lucidum es un parámetro importante sobre su productividad. Estos resultados demuestran que pueden obtenerse altos valores de productividad y se relacionan estrechamente con la interacción de factores como la luz, que empleada de forma adecuada favorece el crecimiento de micelio y la fructificación. Finalmente, el uso de la luz azul en el cultivo sólido de G. lucidum proporciona un aumento en los rendimientos y una reducción de costos de los productos finales.














