INTRODUCCIÓN
La agricultura es el principal sector de crecimiento económico de los países en desarrollo (Nehra, Saharan y Choudhary, 2016), entre los cuales se encuentra México. Sin embargo, en los sistemas de producción contemporáneos, la mayoría de los cultivos son muy exigentes respecto a la demanda de fertilizantes (Naqqash, Hameed, Imran, Hanif, Majeed et al., 2016). En relación a dicha demanda, se ha estimado que para el 2018 habrá un consumo global de 200.5x106 toneladas de N-P2O5-K2O (FAO, 2015). Por otro lado, cada día existen más evidencias de que la aplicación continua de fertilizantes nitrogenados puede provocar impactos negativos en los agro ecosistemas, como lixiviación de nitratos, contaminación de recursos hídricos, y emisiones gaseosas, causando daños irreparables al ambiente (Zahid, Abbasi, Hameed y Rahim, 2015) y con riesgo potencial para la humanidad (Vejan, Abdullah, Khadiran, Ismail, Nasrulhaq-Boyce, 2016). Lo anterior, hace evidente que existen diversos problemas que demandan una atención permanente por parte de los investigadores. De manera específica, un método promisorio para reducir el uso de los fertilizantes sintéticos en la agricultura es la aplicación de las RPCV, como inoculantes microbianos (Nehra et al., 2016). El empleo de las RPCV como biofertilizantes son una opción sustentable para favorecer la disponibilidad de los elementos nutritivos, el crecimiento de las plantas y los rendimientos (Zahid et al., 2015). Por lo anteriormente señalado, se describen los elementos inherentes a la interacción entre las RPCV y las especies vegetales, enfocándose en los efectos que éstas provocan a los cultivos agrícolas, a través de su sistema radicular.
Rizobacterias Promotoras del Crecimiento Vegetal
La expresión Plant Growth Promoting Rhizobacteria (PGPR) fue acuñada por J. W. Kloepper y M. N. Schroth en 1978, para describir las bacterias que habitan la ri-zósfera y que afectan positivamente el desarrollo de las plantas (Labra-Cardón, Guerrero-Zúñiga, Rodríguez-Tovae, Montes-Villafán, Pérez-Jiménez et al., 2012). Estas bacterias tienen la capacidad de colonizar activamente el sistema radicular para favorecer y/o mejorar su crecimiento y rendimiento (Berendsen, Pieterse y Bakker, 2012). Las RPCV representan alrededor del 2 al 5 % de las bacterias rizosféricas (Jha y Saraf, 2015). Las siglas RPCV hacen referencia a todas las bacterias que son capaces de mejorar el crecimiento de las plantas a través de uno o más mecanismos. Los siguientes géneros de bacterias han sido reportados como RPCV: Agrobacterium, Arthrobacter, Azoarcus, Azospirillum, Azotobacter, Bacillus, Burkholderia, Caulobacter, Chromobacterium, Enterobacter, Erwinia, Flavobacterium, Klebsiella, Micrococcous, Pantoea, Pseudomonas, Rhizobium y Serratia (Ahemad y Kibret, 2013).
Las RPCV ejercen efectos benéficos en las plantas a través de mecanismos directos e indirectos, o una combinación de ambos (Aguado-Santacruz, Moreno-Gómez, Jiménez-Francisco, García-Moya y Preciado-Ortiz, 2012; Parray, Jan, Kamili, Qadri, Egamberdieva et al., 2016). Los mecanismos directos ocurren cuando las bacterias sintetizan metabolitos que facilitan a las plantas, o bien cuando éstas incrementan la disponibilidad de diferentes elementos nutritivos, requeridos para su metabolismo y para mejorar su proceso de nutrición (Gómez-Luna, Hernández-Morales, Herrera-Méndez, Arroyo- Figueroa, Vargas-Rodríguez et al., 2012). Entre los mecanismos directos destacan: la fijación de nitrógeno (N); la síntesis de fitohormonas, vitaminas y enzimas, la solubilización de fósforo (P) inorgánico y la mineralización de fosfato orgánico, la oxidación de sulfuros, el incremento en la permeabilidad de la raíz, la producción de nitritos, la acumulación de nitratos, la reducción de la toxicidad por metales pesados y de la actividad de la enzima ACC desaminasa, la secreción de sideróforos, la reducción de los niveles de etileno en los suelos, y el incremento de la permeabilidad de las raíces (Esquivel-Cote, Gavilanes-Ruiz, Cruz-Ortega y Huante, 2013).
Mientras que, los mecanismos indirectos se caracterizan porque las RPCV ocasionan la disminución o eliminación de microorganismos fitopatógenos, ya sea a través de la producción de sustancias antimicrobianas o de antibióticos, de enzimas líticas o una combinación de éstas; por competencia de nutrimentos o de espacio en el nicho ecológico, así como por estimulación de las defensas naturales de la planta mediante mecanismos de biocontrol; la inducción de resistencia sistémica (IRS) a un amplio espectro de organismos patógenos y la producción de sideróforos, como mecanismo para secuestrar el Fe disponible en los suelos y con esto limitar el desarrollo y la presencia de dichos fitopatógenos; producción de antibióticos y cianuros de hidrógeno que impactan sobre los fitopatógenos; hidrólisis de moléculas como el ácido fusárico generado por éstos para liberar 1-3-glucanasa, con la cual se inhibe el desarrollo de la pared fúngica de hongos como Phytium ultimum y Rhizoctonia solani (Esquivel-Cote et al., 2013).
Una de las limitantes de las RPCV es que el efecto benéfico que promueven sobre una determinada especie vegetal no es el mismo para otras plantas. En relación a lo anterior, Xu, Jeffries, Pautasso y Jeger (2011) señalan que el empleo combinado de agentes de biocontrol, generalmente no debe recomendarse en la práctica sin contar con una clara comprensión de sus principales mecanismos de control y de su competitividad relativa. Para evitar lo anterior, a la fecha existe un sinfín de reportes que clarifican acerca del tipo de RPCV, su efecto y los cultivos donde éstas se pueden aplicar, ver ejemplos en la tabla 1.
Tabla 1 Rizobacterias promotoras de crecimiento vegetal, efectos y cultivos donde se han evaluado.
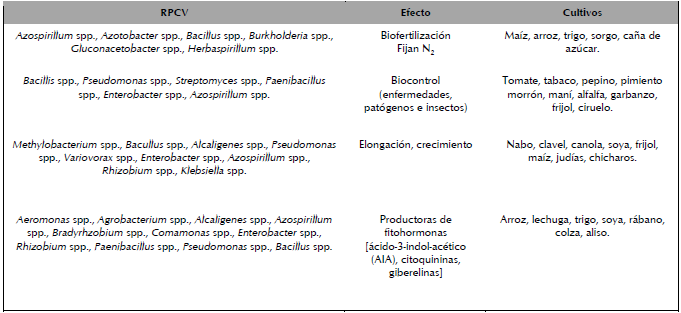
Fuente: Parray et al. (2016)
Colonización de raíces
Una etapa esencial para que las RPCV lleven a cabo de forma eficiente el control biológico y favorezcan el crecimiento de las plantas es sin duda la colonización de su sistema radicular (Noumavo, Agbodjato, Baba-Moussa, Adjanohoun y Baba-Moussa, 2016). Los elementos fundamentales para una colonización eficiente incluyen, entre otros, la capacidad de los microorganismos para: a) sobrevivir después de la inoculación; b) crecer en la espermosfera (región que rodea la semilla) en respuesta a la producción de exudados por la semilla; c) fijarse en la superficie de las primeras raíces; y d) colonizar todo el sistema radicular (Nihorimbere, Ongena, Smargiassi y Thonart, 2011; Noumavo et al., 2016). Por ejemplo, Labra-Cardón et al. (2012) señalan que la colonización en la espermosfera de las semillas de Cyperus elegans (Cyperaceae) y Echinochloa polystachya (Poaceae), fue un evento importante para promover el crecimiento de las plántulas obtenidas.
La colonización de la raíz por microorganismos endófitos incluye cuatro etapas: 1) atracción; 2) reconocimiento; 3) adhesión; e 4) invasión, las cuales están afectadas por factores bióticos y abióticos (Nihorimbere et al., 2011). Además, la colonización de las semillas es el primer paso en el propio proceso. Los microorganismos que se establecen sobre las semillas durante la germinación pueden crecer y colonizar las raíces en toda su extensión. La colonización de la semilla durante la fase de impregnación o inmersión tiene un efecto significativo sobre el crecimiento de la planta (Noumavo et al., 2016).
La capacidad de colonización es un factor clave en la prevención y el tratamiento de enfermedades fúngicas debido a que las plantas huésped están estrechamente relacionadas con la formación de biopelículas; una fuerte colonización conduce a una formación adecuada de biopelículas (Zhou, Luo, Fang, Xiang, Wang et al., 2016). Los mejores resultados en los cultivos dependen de una adecuada colonización de bacterias en la rizósfera; aplicar la técnica correcta de inoculación a las semillas se verá reflejado en un mayor porcentaje de germinación así como en la productividad del cultivo además de incrementar su resistencia al estrés (Mahmood, Turgay, Farooq y Hayat, 2016).
Adriano, Jarquín, Hernández, Salvador y Monreal (2011) señalan que cuando se aplican biofertilizantes a las semillas, a las superficies de las plantas o a los suelos, éstos colonizan la rizósfera o el interior de las plantas y favorecen su crecimiento, también promueven el desarrollo de mecanismos de defensa de las plantas y generan ambientes adversos contra organismos patógenos. Por ejemplo, P. fluorescens habitante natural del suelo, es predominantemente numerosa en la microflora de la rizósfera de muchas especies vegetales y son las primeras en colonizar las raíces jóvenes. Muchos de estos organismos suprimen enfermedades en las plantas, protegiendo las raíces y las semillas de la infección de los patógenos presentes en el suelo (Guerra, Betancourth y Salazar, 2011).
Mecanismos empleados por las RPCV que afectan a las especies vegetales
Los mecanismos de acción de las RPCV, a través de los cuales favorecen el incremento de la productividad agrícola de diferentes regiones, desde un enfoque sustentable, se describen en los siguientes apartados.
Biofertilización
Dentro de los procesos que inciden en el desarrollo y producción de las especies vegetales, la nutrición es considerada como esencial. Esto se debe a que los cultivos son exigentes respecto a los niveles de nutrición mineral apropiados, exigencia que se debe a sus volúmenes de producción por unidad de superficie (Chailleux, Mohl, Teixeira, Messelink y Desneux, 2014). En este sentido, el mejoramiento de la fertilidad del suelo ha sido una de las estrategias comúnmente utilizadas para incrementar la producción agrícola. Sin embargo, a través del tiempo, se ha vuelto evidente que el empleo de fertilizantes sintéticos no ha resultado ser la panacea esperada, ya que del total de los fertilizantes aplicados solo del 10 al 40 % es asimilado por las plantas (Bhardwaj, Ansari, Sahoo y Tuteja, 2014) y además, porque la pérdida de la fertilidad de los suelos, en los sistemas de intensivos, ha obligado a los productores a incrementar el uso de estos fertilizantes para mantener su producción, a costa del incremento de los costos de producción y de los impactos ambientales (Cotler, Martínez y Etchevers., 2016). Por otro lado, a consecuencia del encarecimiento de los fertilizantes sintéticos, las escasas reservas naturales de algunos minerales, así como los grandes consumos energéticos para su producción, se ha promovido el uso de las alternativas biológicas, no solo como una necesidad en la producción agrícola, sino también en la agricultura científica de hoy en día y del futuro, sin afectar el ambiente además de una factibilidad económica (Barroso, Abad, Rodríguez y Jerez, 2015). Así pues, a principios de la década de 1990 se desarrollaron nuevos conceptos y prácticas inherentes a la nutrición vegetal, condicionados por la creciente preocupación por el ambiente a nivel mundial. Las investigaciones en este campo del conocimiento se orientaron hacia el empleo de una nutrición que incluyera alternativas de fertilización con menor dependencia de insumos contaminantes (Armenta-Bojórquez García-Gutierrez y Camacho-Báez, 2010). Es decir, las nuevas tecnologías deben estar enfocadas a mantener y preservar la sostenibilidad del sistema de producción mediante la explotación racional de los recursos naturales y la aplicación de medidas pertinentes para preservar el ambiente (Grageda-Cabrera, Díaz-Franco, Peña-Cabriales y Vera-Nuñez, 2012). En este sentido, la inoculación y el manejo agronómico de los microorganismos con propiedades biofertilizantes se constituyeron en tecnologías racionales y surgieron como prácticas innovadoras y promisorias para la actividad agrícola (Sánchez et al., 2011).
Se entiende por biofertilizantes todos aquellos productos que contienen microorganismos vivos, con capacidad para colonizar la rizósfera o el interior de las plantas, que aplicados al suelo y/o a éstas, a través de la inoculación, pueden vivir asociados o en simbiosis con las especies vegetales y les ayudan a su nutrición y protección, con ellos se pretende sustituir parcial o totalmente la aplicación de fertilizantes sintéticos, y reducir su efecto contaminante (Mishra y Dash, 2014). A diferencia de los fertilizantes sintéticos y orgánicos, los biofertilizantes no suministran directamente ningún elemento nutritivo a los cultivos y éstos son bioproductos, elaborados principalmente a base de bacterias. Armenta-Bojórquez et al. (2010), describen que los microorganismos empleados en los biofertilizantes se agrupan en aquellos que: a) tienen capacidad para sintetizar sustancias que promueven el crecimiento de las plantas, a través de varios procesos como fijación de N2 atmosférico, solubilización de Fe y P inorgánicos, incrementan la tolerancia al estrés por sequía, salinidad, metales tóxicos y exceso de plaguicidas; b) son capaces de disminuir o prevenir los efectos de organismos patógenos; y c) cumplen ambas funciones - promueven crecimiento e inhiben efectos de patógenos, ejemplo Bacillus subtilis produce auxinas para promover el crecimiento de tomate e induce resistencia sistémica contra F. oxysporum, responsable de la marchitez y pudrición de sus raíces.
La inoculación de biofertilizantes que contienen bacterias rizosféricas ha provocado incrementos significativos en la productividad de los cultivos agrícolas (Armenta-Bojórquez et al., 2010). Esto se debe a que, las bacterias asociadas a las especies vegetales poseen la capacidad de producir o generar reguladores de crecimiento y aproximadamente el 80 % de éstas son productoras de auxinas. En términos cuantitativos, la auxina de mayor importancia es el ácido indol acético (AIA), el cual es responsable de incrementar tanto el sistema radicular como la absorción de elementos nutritivos (Grageda -Cabrera et al., 2012). A manera de complemento, y respecto al papel que desempeñan las bacterias, y de lo cual existe una miríada de reportes de investigación, Mishra y Dash (2014) elaboraron un listado de ventajas y desventajas inherentes al empleo de biofertilizantes, las cuales se describen a continuación:
Ventajas
➣. El suministro de elementos nutritivos es más balanceado, y ayuda a mantener la salud de las plantas.
➣. Ayudan a incrementar la actividad biológica del suelo, con lo cual se mejora la movilización de elementos nutritivos y la descomposición de sustancias tóxicas.
➣. Incrementan la estructura del suelo, favoreciendo un mejor crecimiento radicular
➣. Aumentan el contenido de materia orgánica (MO) del suelo, con lo cual se mejora la capacidad de intercambio catiónico, incrementan la retención de humedad, promueven la formación de agregados y amortiguan cambios bruscos contra acidez, alcalinidad, salinidad, pesticidas y metales pesados tóxicos.
➣. Liberan de forma gradual o lentamente elementos nutritivos y contribuyen a la reserva residual de N y P orgánicos del suelo, reduciendo las pérdidas de N por lixiviación y la fijación de P y también pueden suministrar micro elementos nutritivos.
➣. Favorecen el crecimiento de lombrices y microorganismos benéficos.
➣. Ayudan a suprimir enfermedades y parásitos transmitidas por organismos nativos del suelo.
Desventajas
➣. Comparativamente, con respecto a los fertilizantes sintéticos, presentan un reducido contenido de elementos nutritivos, por lo cual se requiere el empleo de grandes volúmenes para cubrir la demanda nutritiva durante el crecimiento de los cultivos.
➣. La velocidad de liberación de los elementos nutritivos es demasiado lenta para cubrir los requerimientos de las plantas, por lo que en éstos puede ocurrir alguna deficiencia nutritiva.
➣. Los macro elementos primarios pueden no estar en cantidades suficientes en los fertilizantes orgánicos para soportar el máximo crecimiento de los cultivos.
Una desventaja adicional es que en varios países, preferentemente en las áreas rurales, se ha dificultado o retrasado el empleo de los biofertilizantes, en gran parte por la idiosincrasia de sus habitantes, ya que la renuencia básica a usar bacterias, como microorganismos benéficos se debe a que éstos, en estas regiones, aún permanecen asociados con enfermedades humanas y de animales (Grageda-Cabrera et al., 2012).
Fijación de nitrógeno atmosférico
La fijación biológica de nitrógeno (FBN) está limitada a procariotas que poseen -a diferencia de la planta- un complejo enzimático de nitrogenasa, el cual consta de dos proteínas dinitrogenasa y dinitrogenasa reductasa: ambas contienen Fe en su estructura, además la dinitro-genasa contiene Mo (Acuña, Pucci y Pucci, 2010) que cataliza la reducción del N atmosférico en amoníaco (Venieraki, Dimou, Pergalis, Kefalogianni, Chatzipavlidis et al., 2011) proceso que se explica, en términos generales, por medio de la ecuación 1. López y Boronat (2016) describen esta ecuación señalando que, la activación microbiológica del N2 atmosférico genera amoníaco, el cual ioniza al catión amonio (NH4+), vía hidrólisis de ATP y la transferencia de poder reductor acoplado a una cadena de transporte electrónico. Las bacterias que fijan el N atmosférico en amonio, biológicamente utilizable, se denominan diazotróficas. Entre los organismos diazótrofos se encuentra un amplio rango de Arqueas y bacterias que colonizan a diversas especies vegetales, en una amplia variedad de ecosistemas (Venieraki et al., 2011).
N2 + 8H+ + 8e- + 16ATP - 2NH3+ +16ADP + 16Pi + H2 (Ecuación 1)
Entre las bacterias procariotas rizosféricas simbióticas que fijan N, en asociación con las leguminosas, se encuentra el grupo rhizobia, por ejemplo Rhizobium, Bradyrhizobium, Sinorhizobium, Azorhizobium, Mesorhizobium y Allorhizobium, y las cepas Frankia, pertenecientes al género Streptomicetaceas, bacterias esporuladoras filamentosas asociadas con plantas actinorrizas, especialmente géneros Alnus y Casuarina (Noumavo et al., 2016; Venieraki et al., 2011). Durante más de un siglo, la simbiosis entre las bacterias del género Rhizo-bium y las leguminosas ha sido considerada la forma más eficiente de fijar el N atmosférico, haciéndolo disponible para las plantas. Sin embargo, en décadas recientes, el estudio de la FBN por bacterias asociativas, de vida libre o asimbióticas, proceso descubierto en 1901 por Martinus Willem Beijerinck, ha cobrado mayor atención por parte de los investigadores, con el propósito de encontrar alternativas a la creciente demanda de fertilizantes sintéticos (Pazos, Hernández, Paneque y Santander, 2000).
En condiciones normales, los microorganismos que fijan N se benefician con este elemento sin excretar compuestos nitrogenados. Pero a su muerte y después de su descomposición, el N estará disponible para las plantas, generando un promedio de 25 kg Nha-1año-1 en los continentes. Este proceso es entonces suficiente para mantener las reservas y para recuperar las pérdidas de estos compuestos en el ecosistema (Noumavo et al., 2016). Finalmente, debido a la importancia del proceso de FBN, independientemente si es por simbiosis o de forma asimbiótica, Neyra, Terrones, Toro, Zárate y Soriano (2013) describen que la incorporación de este elemento promueve la estimulación de procesos microbianos durante la descomposición de la MO y el reciclaje de elementos nutritivos esenciales dentro de los sistemas agrícolas productivos, así como en aquellos considerados como agro ecosistemas sostenibles. Además mencionan que, es necesario continuar con el estudio de la capacidad promotora de crecimiento del Rhizobium debido a que la agricultura sustentable demanda mejorar la eficiencia del proceso de FBN a través del empleo de bacterias competitivas capaces de extender la ventaja de la simbiosis a otras especies vegetales no leguminosas.
Solubilización de fosfatos
El P es el elemento mineral más importante después del N, su deficiencia limita de manera crucial el crecimiento de las plantas (Beltrán, 2014). Al igual que para el N, hoy en día se puede aseverar que algunas RPCV, específicamente las bacterias solubilizadoras de fosfatos (BSF), solubilizan los fosfatos insolubles de los suelos y los vuelven disponibles para las plantas (Goswami, Thakker, Dhandhukia y Tejada-Moral, 2016) y éstas, a su vez les proporcionan compuestos carbonados que son metabolizados para el crecimiento microbiano e igualmente los exudados radiculares y los detritus vegetales suministran el sustrato energético que favorece su actividad solubilizadora. Las BSF constituyen del 1 al 50 % (tabla 2) del total de la población microbiana de los suelos (Beltrán, 2014). Además es necesario destacar que algunos microorganismos que solubilizan fosfatos del suelo, también pueden presentar otras actividades de promoción de crecimiento vegetal como la producción de AIA, ácido giberélico, cianuro de hidrógeno (HCN), citoquininas, etileno, fijación asimbiótica de N y resistencia a organismos patógenos del suelo (Beltrán, 2014).
Tabla 2 Principales géneros bacterianos solubilizadores de fosfato.
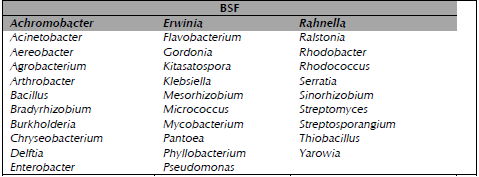
BSF = Bacterias solubilizadoras de fosfato; Fuente: Beltrán (2014).
Al grupo BSF pertenecen los géneros bacterianos que se presentan en la tabla 2 y éstas solubilizan fosfatos debido a su capacidad de producir ácidos orgánicos, entre los cuales destacan, los ácidos: acético, adípico, cítrico, fórmico, fumárico, glicólico, glucónico, indolacético, láctico, málico, malónico, oxálico, propiónico, succínico y 2-ketogluconic (Beltrán, 2014; (Goswami et al., 2016). Los más frecuentemente reportados como solubilizado-res de fosfato son el glucónico y el 2-cetoglucónico (Paredes-Mendoza y Espinosa-Victoria, 2010).
La mayoría de los ácidos orgánicos producidos por las BSP son alifáticos, es decir, son ácidos no aromáticos (Paredes-Mendoza y Espinosa-Victoria, 2010). Estos ácidos modifican el pH provocando la disolución de fosfatos insolubles de los suelos (Goswami et al., 2016). Además de tener una acción directa sobre la acidificación, la quelación, la precipitación y las reacciones de óxido - reducción de la rizósfera, forman complejos con metales, solubilizan metales y participan en su transporte. La solubilización de los minerales puede deberse a que estos ácidos disminuyen el pH y, más aún, a la formación de complejos estables con cationes como Ca+2, Mg+2, Fe+3 y Al+3. El efecto de los ácidos orgánicos también incide sobre los fosfatos incorporados al suelo, a través de los fertilizantes sintéticos, reduciendo la precipitación de dichos fosfatos por Fe y Al (Paredes-Mendoza y Espinosa-Victoria, 2010).
En los suelos la solubilización del fosfato por los ácidos orgánicos depende del pH y la mineralogía del mismo, este proceso se realiza por dos mecanismos: a) un intercambio ácido, por ejemplo, los iones H+ provenientes del citrato se intercambian por el P ligado a la superficie de los cristales del Al(OH)3 o Fe(OH)3, reduciéndolos y liberando el P; y b) el otro que depende de la concentración de los ácidos orgánicos producidos por las BSF; la cantidad y el tipo de ácidos orgánicos liberados dependen del tipo de microorganismos, el efecto quelante de estos ácidos en la solubilización consiste en que a través de sus grupos hidroxil y carboxil secuestran los cationes unidos al fosfato convirtiéndolo a formas solubles (Beltrán, 2014; Bhardwaj et al., 2014).
Las BSF también son capaces de mineralizar el fosfato orgánico insoluble a través de la excreción de enzimas extracelulares como las fosfatasas - catalizadoras de la hidrólisis de ésteres fosfóricos - fitasas y C-P liasas. Cabe señalar que los mecanismos de solubilización y minera-lización pueden coexistir dentro de las mismas BSF. La inoculación con BSF aumenta la disponibilidad de P en la rizósfera y su absorción por la planta (Faria, Dias, Melo y de Carvalho-Costa, 2013). Una reducción del 50 % en la aplicación de fertilizantes con P podría lograrse mediante el uso combinado de microorganismos solubilizadores de P y RPCV sin afectar el rendimiento (Tahir y Aqeel, 2013). Por otro lado, la introducción de genes sobre expresados en bacterias de la rizósfera para solubilizar fosfatos, y mejorar la capacidad de los microorganismos como inoculantes, ha llamado la atención de los investigadores. A la fecha, las bases de la genética de la solubilización de fosfatos minerales no están claramente establecidas, pues aunque se conoce que la generación de ácidos orgánicos es el principal mecanismo para llevar a cabo este proceso, se podría asumir que cualquier gen participante en la síntesis de los ácidos orgánicos podría tener algún efecto en esta característica: denominada fenotipo solubilizador. En relación a lo anterior, se ha evidenciado que la capacidad de algunas bacterias Gram negativas para disolver fosfatos de calcio - fenotipo solubilizador - es el resultado de la oxidación periplásmica de la glucosa a ácido glucónico por la vía de la quinoproteína glucosa deshi-drogenasa (G-DH), un componente de la ruta de oxidación directa de la glucosa (Beltrán, 2014).
Finalmente, Beltrán (2014) destaca que, aunque existen esfuerzos para entender la solubilización de P a escala molecular, el mecanismo utilizado por diferentes BSF requiere de investigaciones adicionales. Aunado a lo anterior, a pesar de las ventajas que puede acarrear la modificación genética de los microorganismos, su liberación al ambiente sigue siendo controversial, algunas naciones fomentan el manejo de los organismos genéticamente modificados, mientras otras lo prohiben y exigen etiquetar los productos que contienen ingredientes modificados genéticamente; sin embargo, y a pesar de dicha controversia, existen evidencias científicas de que siguiendo las regulaciones apropiadas, los microorganismos modificados genéticamente podrían, en un futuro cercano, ser usados sin riesgo en las actividades agrícolas.
Producción de sideróforos: quelación de hierro
Los sideróforos son pequeñas moléculas producidas por microorganismos bajo condiciones limitantes de Fe que incrementan su entrada a la célula microbiana (Saha, Saha, Donofrio y Bestervelt, 2013). Comúnmente, las bacterias adquieren Fe mediante la secreción de quelatos de Fe, de bajo peso molecular, denominados sideróforos, los cuales están en constante asociación con complejos de Fe (de los Santos-Villalobos, Barrera-Galicia, Miranda-Salcedo y Pena-Cabriales, 2012; Parray et al., 2016). Además de su bajo peso molecular estos compuestos son solubles en disoluciones acuosas a pH neutro y pueden ser fluorescentes o no (Tejera-Hernández, Rojas-Badía y Heydrich-Pérez, 2011).
Diversos organismos sintetizan pequeñas moléculas, péptidos no ribosomales, de alta afinidad por el Fe+3 que actúan en forma específica como agentes quelantes para secuestrar Fe en presencia de otros metales, y provocar su reducción a F+2 que es una forma mucho más soluble y aprovechable para la nutrición de dichos organismos (Aguado-Santacruz et al., 2012). El secuestro del Fe por parte de los microorganismos, en condiciones de escasez, se desarrolla de la siguiente manera: una vez que es secuestrado el Fe del medio circundante, el complejo sideróforo-Fe es reconocido por receptores específicos de la membrana microbiana y una vez dentro de las células, se deposita en un sitio específico por un proceso que involucra un intercambio de ligan-dos que puede estar precedido o no por la reducción del Fe o por la hidrólisis del sideróforo (Rives, Acebo y Hernández, 2007). La presencia de los sideróforos representaría una gran ventaja para los microorganismos, pues podrían adquirir el Fe del medio que los rodea de una forma más fácil que el resto de sus competidores (Tejera-Hernández et al., 2011).
Los sideróforos se dividen en tres familias principales dependiendo del grupo funcional característico: hidroxamatos, catecolatos y carboxilatos (Ahmed y Holmstróm, 2014). A la fecha, son conocidos más de 500 sideróforos y las estructuras químicas de 270 de ellos ya han sido determinadas (Aguado-Santacruz et al., 2012). Los sideróforos producidos por aislamientos resistentes a metales pesados se han relacionado con el control biológico de enfermedades, como el marchitamiento vascular causado por Fusarium oxysporum y la podredumbre del tallo de la nuez de guisante causada por Rhizoctonia solani (Sayyed y Patel, 2011).
Las RPCV han desarrollado diversas estrategias, tanto para sobrevivir y adaptarse a su entorno, como para proveer a la planta de Fe, una de estas estrategias es la producción de sideróforos (de los Santos-Villalobos et al., 2012). Por ejemplo, diversas especies de los géneros Pseudomonas, Bacillus y Enterobacter han sido evaluadas y reportadas como agentes de biocontrol contra patógenos de plantas, bajo condiciones de estrés de Fe, estas cepas producen sideróforos que quelan el Fe disponible y privan de este elemento a los fitopatógenos respectivos, restringiendo así su proliferación y colonización de la raíz (Solanki, Singh, Srivastava, Kumar, Kashyap et al., 2013).
Producción de polisacáridos extracelulares
La capacidad de producir, secretar o de exudar polisacáridos es otro de los múltiples beneficios que poseen las RPCV (Jha y Saraf, 2015). Estos exudados incluyen polisacáridos: estructurales, intracelulares y extracelulares o exopolisacáridos (EPS) (Noumavo et al., 2016), los cuales están compuestos principalmente por carbohidratos, formando homo o heteropolímeros y pueden contener sustituyentes orgánicos e inorgánicos. Estos productos ofrecen ventajas como la gran versatilidad de los microorganismos para sintetizar polisacáridos neutros o con carga negativa, a partir de fuentes renovables, en condiciones controladas y la posibilidad de manipulación genética, con lo cual puede ser posible la obtención de productos con mejores propiedades funcionales e incluso mayor calidad (Fuentes, Carreño y Llanos, 2013). La principal contribución de los microorganismos rizosféricos a la estabilidad del suelo está asociada a la producción de EPS. Estos productos se encuentran en forma de geles hidratados alrededor de las células y constituyen la interface entre los microorganismos y su entorno inmediato (Noumavo et al., 2016).
La producción de niveles elevados de EPS, por ciertas bacterias, permite a las plantas soportar mejor los entornos adversos (Nadeem, Ahmad, Naveed, Imran, Zahir et al., 2016). En la rizósfera los EPS producidos por las rizobacterias entran en los agregados del suelo y alteran su porosidad. Por lo tanto, la porosidad, la cual está directamente relacionada con la transferencia del agua del suelo hacia las raíces, es parcialmente controlada por la actividad bacteriana. También ayudan a: mantener la película de agua, requerida por la actividad fotosin-tética y el crecimiento de las plantas, mejorar el proceso de aireación del suelo y la infiltración, y cubrir y proteger a las raíces contra el ataque de fitopatógenos (Noumavo et al., 2016). En condiciones de estrés salino, los EPS quelan cationes disponibles en la zona de la raíz, contribuyendo así a reducir la salinidad de la rizósfera. Los EPS bacterianos en condiciones de estrés de agua en el suelo pueden limitar o aplazar la desecación del medio. Por el contrario, en caso de exceso de agua (lluvia, inundaciones), los EPS, contribuyen a evitar la dispersión de los suelos arcillosos (Noumavo et al., 2016).
Producción de sustancias promotoras de crecimiento vegetal
Estas sustancias son moléculas indicadoras que actúan como mensajeros químicos que influyen en la capacidad de las plantas para responder a su entorno (Tahir y Aqeel, 2013). Regulan la expresión de genes implicados en el crecimiento y desarrollo vegetal, las cuales son sintetizadas en diferentes estructuras de la planta y su acción varía en función de los cambios ambientales que modifican la expresión génica del organismo (Molina-Romero, Bustillos-Cristales, Rodríguez-andrade y Elizabeth, 2015) y generalmente son efectivas en pequeñas concentraciones (Tahir y Aqeel, 2013). Se ha establecido que también están implicadas en las vías de represión catabólica y regulación de la formación de biopelículas. Incluso, estas moléculas exhiben efectos específicos sobre la fisiología vegetal, como incrementar el volumen radicular, aumentar la tasa de respiración de la raíz de la planta hospedera y el flujo de protones en la membrana de la raíz; en consecuencia se favorece la absorción de elementos minerales solubles (Molina-Romero et al., 2015). Sin embargo, aunque se sabe que las fitohormonas, regulan el desarrollo de las plantas y su fisiología, así como la inmunidad, su producción por microorganismos no se ha considerado como un mecanismo de control biológico; por ejemplo, se ha identificado en P. fluorescens G20-18 la capacidad para controlar eficientemente la infección por P. syringae en el modelo Arabidopsis, lo que permite el mantenimiento de la integridad de los tejidos y, en última instancia, el rendimiento de la biomasa (GroBkinsky, Tafner, Moreno, Stenglein, Garcia-de-Salamone et al., 2016).
Molina-Romero et al. (2015), han establecido que las RPCV tienen la capacidad de producir más de un tipo de sustancias promotoras de crecimiento, dentro de éstas destacan cinco grupos: 1) auxinas (AIA); 2) giberelinas; 3) etileno; 4) cito quininas; y 5) ácido abscísico (ABA) y de éstas, los cuatro primeros participan en la fitoestimulación por rizobacterias (Tahir y Aqeel, 2013). Sarma y Saikia (2014) destacan que la fitoestimulación es considerada el mecanismo más estudiado de las RPCV. El fenómeno de la fitoestimulación está dado particularmente por la manipulación de la compleja y balanceada red de hormonas o compuestos similares que influyen directamente sobre el crecimiento de las plantas o estimulan la formación de sus raíces. Por ejemplo, muchas especies de Azospirillum producen auxinas, citoquininas y giberelinas, que estimulan el desarrollo radicular, provocando incrementos significativos en los rendimientos agrícolas (Rives et al., 2007).
Mecanismos de biocontrol o antagonismo
Los microbios deletéreos que habitan la rizósfera causan enfermedades y a veces provocan la pérdida completa de los cultivos (Raza, Wang, Wu, Ling, Wei et al., 2016). Para el control biológico de estas enfermedades se han empleado diferentes microorganismos: diversas RPCV como agentes de biocontrol eliminan de forma natural a los fitopatógenos mediante la producción de metabolitos secundarios, los cuales, además de ser excretados localmente o cerca de la superficie de la planta, son moléculas biodegradables y no se requieren en cantidades elevadas, a diferencia de los plaguicidas que son resistentes a la degradación y se aplican en grandes cantidades para mantener la salud de las plantas (Molina-Romero et al., 2015).
Algunas RPCV tienen la capacidad de prevenir el desarrollo de enfermedades transmitidas por el suelo de las plantas, manteniendo el nivel de microbios deletéreos por debajo del umbral (Raza et al., 2016). Estas RPCV producen antibióticos, compuestos orgánicos volátiles antimicrobianos (COV) y enzimas hidrolíticas, sideróforos o bacteriocinas, por un lado pueden estimular la resistencia, sistémica o inducida, de las plantas contra diferentes fitopatógenos o por otro eliminar a dichos organismos (Raza et al., 2016). Específicamente se han caracterizado diversas moléculas producidas por bacterias antagónicas Gram negativas capaces de ejercer biocontrol contra patógenos causantes de enfermedades de la raíz, dentro de éstas se encuentran: los ácidos cianhídrico y fenazina-1-carboxilico, la pioluteorina, la pirrolnitrina, los lipopéptidos cíclicos y el diacetilfloro-glucinol (Molina-Romero et al., 2015).
Se conoce que las rizobacterias deletéreas son un grupo de patógenos saprófitos, no parasitarios, que excretan exopolísacáridos y sustancias químicas en forma de cianuro, fitohormonas, sideróforos y fitotoxinas que pueden afectar negativamente el metabolismo de las plantas, recientemente este grupo de microorganismos se ha utilizado como un agente de control biológico de la maleza (Lakshmi, Kumari, Singh y Prabha, 2015). Como ejemplo, de los Santos-Villalobos et al. (2012), destacan que los sideróforos producidos por Burkholderia cepacia XXVI, aislada de huertos de mango, resultaron ser una alternativa de biocontrol del hongo Colletotrichum gloeosporioides causante de antracnosis en este cultivo.
La eficacia de los agentes de biocontrol bacteriano está estrictamente asociada con su capacidad para colonizar activamente los nichos ecológicos ocupados por los fitopatógenos, para alcanzar estos nichos, las bacterias se mueven en el ambiente gracias a apéndices externos, tales como flagelos (Tomada, Puopolo, Perazzolli, Musetti, Loi et al., 2016). Por otro lado, algunas bacterias aeróbicas formadoras de esporas poseen ventajas que las hacen candidatas adecuadas para su uso como agentes de biocontrol, e. g., las especies del género Bacillus son capaces de producir esporas que permiten resistir condiciones ambientales adversas, además de favorecer una fácil formulación y almacenamiento de los productos comerciales (Raza et al., 2016). La actividad de biocontrol, debe ser considerada como un modo de comportamiento, dependiente de las condiciones predominantes, más que como una propiedad inherente de una cepa bacteriana (Cray, Connor, Stevenson, Houghton, Rangel et al., 2016). Recientemente, el desarrollo de técnicas moleculares ha permitido construir herramientas de reconocimiento genético para analizar y estudiar el comportamiento bacteriano dentro de la comunidad microbiana del suelo (Kong, Kim, Lee y Lee, 2016). Por ejemplo, Gopalakrishnan, Upadhyaya, Vadlamudi, Humayun, Vidya et al. (2012), obtuvieron siete aislados bacterianos (SRI-156, SRI-158, SRI-178, SRI-211, SRI-229, SRI-305 y SRI-360), de la rizósfera de un sistema de arroz (Oryza sativa) intensivo con potencial, tanto para promover el crecimiento de la planta, como para el biocontrol de la pudrición carbonosa del sorgo, causada por Macrophomina phaseoíina, y concluyeron que las cepas bacterianas seleccionadas produjeron sideróforos, ácido indolacético (excepto SRI -305), cianuro de hidrógeno (excepto SRI-158 y SRI-305) y solubilización de fosfatos (excepto SRI-360).
Producción de antibióticos
La antibiosis es probablemente el mecanismo más conocido y quizá el más importante utilizado por las RPCV para limitar la invasión de patógenos en las plantas. Consiste en inhibir el desarrollo de microorganismos fitopatógenos a través de la producción de metabolitos secundarios (Saraf, Pandya y Thakkar, 2014), o de la secreción de moléculas de amplio espectro (Molina-Romero et al., 2015). Estos últimos autores destacan que estos metabolitos actúan a través de mecanismos de acción como: a) inhibición de síntesis de pared celular; b) desestabilización estructural de la membrana celular; y c) inhibición de la formación del complejo de iniciación de la traducción de los organismos fitopatógenos. Además, Raaijmakers y Mazzola (2012) señalan que los antibióticos abarcan un grupo químicamente heterogéneo de compuestos orgánicos de bajo peso molecular, producidos por microorganismos que son perjudiciales para el crecimiento o las actividades metabólicas de otros microorganismos, generalmente actúan sobre varios procesos vitales de éstos, incluyendo la biosíntesis de la pared celular y la síntesis de ADN, ARN y proteínas. Como ejemplo de RPCV productoras de antibióticos destacan los géneros Burkhoíderia y Streptom-ces (Molina-Romero et al., 2015).
Las bacterias que reducen la incidencia o la gravedad de las enfermedades de las plantas se denominan agentes de control biológico, mientras que las que exhiben actividad antagónica hacia un patógeno se definen como antagonistas. Se puede destacar el siguiente entorno rizosférico y las actividades antagónicas: 1) síntesis de enzimas hidrolíticas, tales como quitinasas, glucanasas, proteasas y lipasas, que pueden lisar células fúngicas patógenas; 2) competencia por elementos nutritivos y colonización adecuada de nichos en la superficie de la raíz; 3) la regulación de los niveles de etileno de las plantas a través de la enzima ACC-desaminasa, que puede actuar para modular el nivel de etileno en una planta en respuesta al estrés impuesto por la infección; y 4) producción de sideróforos y antibióticos (Beneduzi, Ambrosini y Passaglia, 2012). Las RPCV como agentes de biocontrol son aisladas e introducidas en una cantidad óptima en la rizósfera para controlar el desarrollo de enfermedades de las plantas (Raza et al., 2016). Por ejemplo, las P. fluorescens generan fenazinas y la pirrolnitrina que son antibióticos de amplio espectro (Upadhyay y Srivastava, 2011).
Producción de enzimas líticas
Una gran variedad de microorganismos producen diferentes enzimas que actúan contra otros microorganismos que están presentes en su hábitat, los cuales pueden actuar como fitopatógenos, provocando pérdidas económicas en cultivos como arroz, trigo, soya, entre otros (Tejera-Hernández et al., 2011). Debido a esta característica, diversas cepas de RPCV tienen la capacidad de degradar las paredes celulares de ciertos microorganismos, a través de la producción de enzimas hidrolíticas, tales como P-glucanasas, celulasas, dehidrogenases, exo y endo-poligalacturonasas, fosfatasas, hidrolasas, lipasas, pectinoliasas, proteasas y quitinasas, las cuales actúan fundamentalmente contra los hongos (Molina-Romero et al., 2015; Noumavo et al., 2016). Tejera-Hernández et al. (2011), señalan que B. subtilis produce estos metabolitos con capacidad para contrarrestar efectos del hongo F. oxysporum.
Dentro de las rizobacterias productoras de dichas enzimas destacan B. altitudinis, B. amyloliquefaciens, B. cereus, B. subtilis (Molina-Romero et al., 2015). Estos Bacillus utilizan diversos mecanismos que pueden inhibir patógenos fúngicos, incluyendo la competencia por elementos nutritivos, la producción de lipopéptidos antifúngicos, o la producción de enzimas líticas tales como quitinasas, que pueden degradar la pared celular de los hongos, como un medio para evitar la extensión de las hifas de éstos (Figueroa-Lopez, Cordero-Ramirez, Martinez-Alvarez, Lopez-Meyer, Lizarraga-Sanchez et al., 2016). La actividad antifúngica de los microorganismos se debe a su capacidad para generar lipopéptidos y glicopéptidos: ejemplos de éstos son los ramnolípidos y la surfactina producidos por P. aeruginosa y B. subtilis, respectivamente, lo que les permite solubilizar los principales componentes de las membranas celulares microbianas, además de brindarles una mayor oportunidad de supervivencia en hábitats con alta competencia por elementos nutritivos (Jiménez, Medina y Gracida, 2010). Esta actividad antifúngica permite a las RPCV proteger la planta contra el estrés biótico mediante la eliminación de patógenos (Mahmood et al., 2016).
Síntesis de cianuro de hidrógeno y de compuestos volátiles
La actividad antagónica de las RPCV también da resultados a través de la producción de compuestos volátiles (Lakshmi et al., 2015). Estos compuestos juegan un papel primordial en el control de patógenos, en contraste con los antibióticos, que sólo pueden prevenir que los patógenos infecten las plantas, adicionalmente, estos compuestos pueden propagarse a larga distancia y crear un microambiente bacteriostático alrededor de las comunidades antagónicas (Raza et al., 2016). El compuesto volátil más conocido es el cianuro de hidrógeno (CNH). El principal grupo de RPCV utilizadas como agentes de control biológico es el género Pseudomonas, las cuales se consideran las productoras más comunes de cianuro, además de poseer una amplia aplicación en procesos biotecnológicos, de gran envergadura para las agroindustrias (Lakshmi et al., 2015).
Como ejemplos complementarios, las bacterias P. fluorescens cepa F113rif (F113) es un agente biocontrol aislado de la rizosfera de la remolacha azucarera (Beta vulgaris var. altíssima) capaz de suprimir la enfermedad producida por el oomiceto Pythium ultimum, la capacidad de biocontrol de esta cepa se ha relacionado con la producción de metabolitos secundarios, entre los cuales destacan: sideróforos, diacetil-floro-glucinol (DAPG), CNH y una proteína extracelular (Barahona, Navazo, Martinez, Zea, Perez et al., 2011). Por su parte, las bacterias B. methylotrophicus presentaron los mayores efectos antagónicos contra fitopatógenos, debido a su capacidad para producir antibióticos y/o compuestos orgánicos volátiles como CNH, el cual inhibe el crecimiento de los hongos fitopatógenos y ejerce efectos nocivos en su crecimiento in vitro (Rios, Caro, Berlanga, Ornelas, Salas et al., 2016). Otro efecto significativo de las RPCV que producen CNH es que su incorporación a la rizosfera de la maleza reduce los parámetros de crecimiento de ésta, sin o con un efecto muy reducido sobre las especies vegetales de interés económico, esta práctica resulta ser una alternativa de bajo costo y ambientalmente amigable para el biocontrol de la maleza, contra la aplicación de herbicidas y compuestos sintéticos, nocivos para el ambiente. Además, la incorporación de estas rizobacterias ofrece diversas ventajas, como un cambio en el balance de la competencia entre maleza y cultivo - a favor del cultivo y en contra de la maleza; mayor selectividad, menor resistencia y la introducción de prácticas agrícolas que son sustentables (Lakshmi et al., 2015). Independientemente de los beneficios ya descritos, el papel de la producción de cianuro es contradictorio ya que puede estar asociado con rizobacterias deletéreas así como con bacterias benéficas (Saharan y Nehra, 2011).
Resistencia sistémica inducida y adquirida
Al igual que todos los seres vivos, las plantas poseen genes que codifican para generar diversas armas químicas - pequeñas moléculas exógenas, denominadas inductores, las cuales son extremadamente eficientes, que constituyen mecanismos de defensa que las protegen contra el ataque de organismos patógenos, ya sea disminuyendo o impidiendo dicho ataque. Este fenómeno biológico se ha denominado resistencia (Gómez y Reis, 2011). La resistencia sistémica es un estado fisiológico que mejora la capacidad defensiva, elicitado por estímulos específicos ambientales. Las defensas innatas de las plantas son potenciadas hacia subsecuentes desafíos bióticos. Este estado mejorado de resistencia es efectivo contra un amplio rango de patógenos, plantas parasitas e insectos herbívoros (Canchignia, Cruz, Barrera, Morante, Canchignia et al., 2015). El mecanismo de resistencia inducida, implica dos fenómenos: la resistencia sistémica inducida (RSI) y adquirida (RSA), que aunque son distintos, fenotípicamente son semejantes (Canchignia et al., 2015). La RSI está asociada con la capacidad de las RPCV para promover el crecimiento de las plantas y protegerlas contra el ataque de patógenos, y la RSA está asociada a las respuestas de las especies vegetales ante la presencia o ataque de los patógenos (Díaz-Puentes, 2012). La similitud de ambas resistencias se basa en que, las plantas, después de ser expuestas a un agente inductor, activan mecanismos de defensa tanto en el punto de infección como en otras regiones (resistencia sistémica), de forma más o menos generalizada y su diferencia radica en la naturaleza del elictor - molécula presente en el inductor - y las vías de señalización. Cuando estas últimas son provocadas por un agente biótico pueden depender tanto del ácido salicílico (AS), asociado con la acumulación de las proteínas relacionadas con la patogénesis (PRP), como del ácido jasmónico (jasmonato) y del etileno, no está asociado, en este caso, con la acumulación de las PRP, es conocida como RSA, mientras que si el inductor es de tipo abiótico sólo sigue la vía del ácido jasmónico y el etileno, entonces corresponde a la RSI (Gómez y Reis, 2011; Canchignia et al., 2015).
La RSI puede ser inducida por una gran variedad de microorganismos que incluyen bacterias Gram-positivas como B. altitudinis, B. amyloliquefaciens, B. cereus, B. mycoide, B. pasteuri, B. pumilus, B. sphaericus, o bacterias Gram-negativas pertenecientes al género Pseudomonas e.g., P. fluorescens, P. putida, P. aeruginosa y enterobacterias como Serratia e. g., S. marcesens, S. plymuthica, así como Pantoea agglomerans, a través de la generación de diversos metabolitos, entre los cuales destacan: AS, lipopolisacáridos (LPS), sideróforos, lipopéptidos cíclicos, 2,4-diacetilfloroglucinol, lactonas homoserinas y compuestos volátiles como acetoin y 2,3-butanediol (Molina-Romero et al., 2015).
Saharan y Nehra (2011) señalan que, provocadas por una infección local, las plantas responden con una cascada de señalización dependiente del AS que conduce a la expresión sistémica de amplio espectro y resistencia a la enfermedad de larga duración que es eficaz contra hongos, bacterias y virus. Después de la infección, los niveles endógenos del AS se incrementan local y sistemáticamente, y los niveles del AS se incrementan en el floema antes de que ocurra la RSI. Además establecen que, el AS es sintetizado en respuesta a la infección, tanto local como sistemáticamente: en consecuencia la nueva producción de AS en las partes no infectadas de las plantas puede contribuir en consecuencia a la expresión sistémica de la RSI. Por otro lado, Camarena-Gutiérrez y de la Torre-Almaráz (2007), señalan que sí las plantas sobreviven a un ataque inicial de organismos patógenos o bien sí la protección se genera después de: a) un ataque de artrópodos herbívoros o b) un daño mecánico o del contacto con algunos productos químicos sintéticos, éstas pueden protegerse contra ataques posteriores por patógenos homólogos aun cuando las plantas no posean genes determinantes de la resistencia específica del cultivar, quedando inmunes. Esta capacidad de las células para repeler los subsecuentes ataques y que se dispersa a toda la planta, corresponde a la RSA. La RSA presenta cuatro características peculiares: 1) es efectiva contra un amplio espectro de organismos patógenos, dependiendo de la especie vegetal tratada; 2) es de largo plazo; 3) se dispersa en las plantas, principalmente, en dirección apical; y 4) se mueve hacia las yemas injertadas: estas dos últimas características sugieren convincentemente que las señales establecidas por la RSA son traslocadas a través de la planta. El tiempo y grado de protección de la RSA depende de la especie vegetal y del inductor, esto se debe a que algunos efectores inducen la RSA en unas especies y en otras no (Díaz-Puentes, 2012). Adicionalmente, a través del tiempo, su fuerza y estabilidad pueden ser afectadas por las condiciones climáticas y la nutrición (Camarena-Gutiérrez y de la Torre-Almaráz, 2007).
Un aspecto esencial de la RSA es que la primera infección provocada por un patógeno genere una lesión necrótica, la cual puede ser el resultado de la muerte celular programada después del reconocimiento del patógeno en una interacción incompatible - donde se generó una respuesta hipersensitiva - o de la muerte celular originada por la acción del patógeno en una interacción compatible (Camarena-Gutiérrez y de la Torre-Almaráz, 2007). La secuencia de eventos que favorecen la RSA inicia localmente: es decir, en las células adyacentes a la respuesta hipersensitiva se observa el engrosamiento de las paredes celulares por incorporación de proteínas estructurales o lignina, deposición de calosa y la inducción de la síntesis de fitoalexinas (Camarena-Gutiérrez y de la Torre-Almaráz, 2007).
La RSA tiene un aspecto práctico muy interesante. En la agricultura se puede inducir ésta infectando la planta que se desea proteger, empleando primero una raza avirulenta o virulenta, cuya respuesta a la infección debe producir una necrosis grande. De manera alternativa, se pueden rociar las plantas ya sea con filtrados de cultivos de bacterias Gram-positivas o Gram-negativas o aún mejor, con uno de los productos identificados como señales, como el AS. Dado que estas sustancias son descompuestas biológicamente y que el espectro de patógenos que pueden ser repelidos es muy amplio, su aplicación en la liberación de la respuesta sistémica tiene un buen potencial en la protección de las plantas. La investigación intensa de la RSA, en particular su genética molecular, pronto mostrará que ésta puede ser aplicada exitosamente, quizá combinada con otras medidas de protección (Camarena-Gutiérrez y de la Torre-Almaráz, 2007).
Áreas de oportunidad inherentes a las RPCV
Derivado de la revisión, análisis e interpretación de las publicaciones citadas en este documento se sugiere que las actividades de investigación vinculadas con las RPCV se enfoquen a los siguientes temas, pues se estima que con éstas se obtendrán más y mejores conocimientos sobre el desarrollo de los cultivos agrícolas y su producción de manera amigable con el ambiente:
➣. Puesto que gran parte del deterioro de los agroeco-sistemas se debe al empleo irracional de los agroquímicos, para el control de plagas, enfermedades y maleza, continua la demanda de alternativas que promuevan el empleo de productos de origen ecológico, que permitan minimizar su impacto y reducir la contaminación del ambiente. Desde el punto de vista sustentable, se hace necesario estudiar las potencialidades de las RPCV en el mejoramiento de los cultivos de importancia económica y social, con la consecuente preservación del ambiente.
➣. Los microorganismos del suelo tienen una gran importancia para mantener la vida en la Tierra. El estudio de su diversidad es vital y trascendente, ya que éstos forman parte de numerosas comunidades complejas y dinámicas, y para comprender su función, así como los cambios que se producen en dichas comunidades, en respuesta a diferentes factores y perturbaciones ambientales, en nichos específicos, es fundamental identificar y cuantificar cada uno de los miembros de estas comunidades.
➣. Uno de los retos permanentes, debido a la miríada de microorganismos presentes en la rizosfera microbiana, de la cual se estima que falta por identificar y caracterizar una gran parte, y dado la relevancia que ha adquirido el desarrollo de una producción agrícola con enfoque sustentable, es el de continuar con la determinación del papel funcional de esta población en los diversos ecosistemas de la Tierra. Lo que permitirá dar respuesta a preguntas como ¿Qué especies de microorganismos aún no identificadas podrían tener relevancia biotecnológica?
➣. Existe la necesidad de continuar recabando información para entender y conocer con mayor detalle los mecanismos de resistencia vegetal y su relación con la aplicación de las RPCV.
➣. Debido a las limitantes que presentan los fertilizantes de origen sintético, tanto por empleo de recursos naturales no renovables para su elaboración como por su efecto residual sobre el ambiente, y los fertilizantes o abonos orgánicos, por su reducido contenido de elementos nutritivos, el estudio de la RPCV, con amplio espectro de colonización de especies vegetales, contribuirá a que estos microorganismos puedan ser empleados como biofertilizantes o fitoestimulantes eficaces en el sector agrícola, buscando mejorar los procesos de nutrición y de resistencia de los cultivos a la sequía, la salinidad y a las altas temperaturas, para incrementar su rendimiento, dada la necesidad de satisfactores, que demanda la creciente población mundial del sector primario de la producción.
CONCLUSIÓN
Debido a que diversos expertos señalan que es necesario dilucidar aún más sobre los mecanismos, descritos en este documento, a través de los cuales las RPCV incrementan el crecimiento y los rendimientos de las especies vegetales. Fortalecer el conocimiento integral de la rizosfera ha sido, es y seguirá siendo, esencial para la comprensión de una miríada de aspectos, procesos y fenómenos que son pilares para la sustentabilidad agrícola y ambiental. Adicionalmente, contar con una descripción más completa de la diversidad microbiana del suelo permitirá ampliar el conocimiento sobre el papel de ésta en los ciclos biogeoquímicos de los elementos esenciales para el desarrollo de las plantas.














