INTRODUCCIÓN
La yuca (Manihot esculenta Crantz) es una planta dicotiledónea perteneciente a la familia Euphorbiaceae, la cual se cultiva en regiones tropicales y subtropicales por el alto contenido de almidón en sus raíces (Ospina & Ceballos, 2012). Esté almidón es usado como fuente de carbohidratos para la dieta humana, para la producción de bioetanol y en industrias como la textil, de alimentos y de combustible (FAO, 2017). La yuca se ha convertido en un cultivo básico para aproximadamente 800 millones de personas en países en vía de desarrollo (Rosenthal & Ort, 2011; FAO, 2017). Su importancia ha impulsado diferentes investigaciones encaminadas a dar luces sobre las bases moleculares que conduzcan al mejoramiento de este cultivo, reducir el ataque de patógenos ó mejorar las condiciones de su producción. De manera general, una de las técnicas que ha sido empleada para el estudio de la función de genes ha sido la expresión transitoria (Jelly et al., 2014).
La expresión transitoria en plantas es una técnica utilizada para el estudio de localización subcelular de proteínas (Aung et al., 2017; Cheng et al., 2017), la función de promotores, silenciamiento de genes (Matsuo & Matsumura, 2017), la interacción proteína-proteína y la transducción de señales (Jelly et al., 2014; Yasuda et al., 2017). Comparada con la expresión estable, la expresión transitoria es un sistema rápido, sencillo y eficiente donde se puede obtener altos niveles de expresión de una proteína (Nanjareddy et al., 2016).
Existen varios métodos para evaluar la expresión transitoria de un gen en una planta, como la transfección de cloroplastos (Luong et al., 1995; Nanjareddy et al., 2016), el bombardeo de partículas (Takemoto & Jones, 2014) y la expresión transitoria mediada por Agrobacterium (agroinfiltración) (Takemoto & Jones, 2014). Entre estos tres métodos la agroinfiltración es más sencilla por cuanto no requiere la preparación de protoplastos, como tampoco el uso de equipos costosos (pistola de biobalística ó electroporador). Además, permite realizar ensayos funcionales de genes con altos rendimientos y tiempos cortos comparada con la expresión estable (Kapila et al., 1997).
La agroinfiltración consiste en el proceso de forzar el ingreso de una suspensión de Agrobacterium tumefaciens al interior de un tejido de la planta empleando una jeringa (Solliman et al., 2017). Esta técnica ha sido ampliamente utilizada en diferentes estudios en un amplio número de especies de plantas, incluyendo papa (Solanum tuberosum) (Du et al., 2014), Iridaceae (Dierama erectum) (Koetle et al., 2017), lechuga (Lactuca sativa) (Wroblewski et al., 2005), uva (Vitis vinifera) (Jelly et al., 2014), tomate (Solanum lycopersicum) (Chetty et al., 2013), soya (Glycine max) (Li et al., 2017), Arabidopsis thaliana (Lee & Yang, 2013), Fresa (Fragaria x ananassa DuchJ (Cui et al., 2017), entre otros. Estos estudios han demostrado que la expresión transitoria en plantas difiere entre monocotiledóneas y dicotiledóneas y que es afectada por el tejido de la planta, el plásmido y la compatibilidad hospedero-patógeno (Shah et al., 2013; Wroblewski et al., 2005)
En yuca se han realizado algunos estudios para evaluar la expresión transitoria del gen GUS en embriones somáticos, empleando electroporación (Luong et al., 1995) en protoplastos mediada por PEG (polietilenglicol) (Wu et al., 2017) en hojas de plantas adultas mediante bombardeo de micropartículas (Franche et al., 1991) y en hojas de plantas de yuca endurecidas (Díaz et al., 2014). Sin embargo, hasta la fecha no se ha descrito un protocolo de agroinfiltración para plantas adultas. Este trabajo se centra en la optimización de algunos parámetros con el objetivo de mejorar la expresión del gen GUS, tales como el tiempo post - inoculación, el efecto de diferentes cepas de Agrobacterium, la introducción de un gen de virulencia y el efecto en diferentes variedades de yuca.
MATERIALES Y MÉTODOS
Material vegetal.
Se emplearon plantas cultivadas "in vitro" de la variedad MCOL1505 y plantas adultas de las variedades TMS60444, MCOL1505, MCOl2215, SG107-35, MTA1 y TMS30572. Tanto las plantas adultas como las plantas cultivadas "in vitro" fueron obtenidas de la colección de germoplasma del Centro Internacional de Agricultura Tropical (CIAT). Plantas cultivadas in vitro de un mes o con mínimo cuatro entrenudos se transfirieron a suelo y se mantuvieron en el invernadero de la Universidad Nacional de Colombia, sede Bogotá. La temperatura del invernadero durante el día osciló entre 28-35 ° C y durante la noche entre 22-27 °C. La humedad se mantuvo alrededor de 70% y con un fotoperíodo de 12 h luz/ 12h oscuridad. Las plantas permanecieron en bandejas con agua para permitir la continua disponibilidad de humedad.
Cepas de Agrobacterium tumefaciens.
Las cepas de Agrobacterium tumefaciens utilizadas fueron GV3101, AGL1, EHA105 y C58C1 (Tabla 1). Para cada una de estas cepas se prepararon células competentes empleando la metodología descrita por Zottini et al., (2008). Las cepas fueron electroporadas con el plásmido pCambia1305.2 (Canberra, Australia), el cual contiene el gen gusPlus en el ADN-T interrumpido por un intrón de catalasa, con el objeto de evaluar la expresión del gen producido por la planta. La selección se realizó en medio LB (triptona 10 g/L, extracto de levadura 5 g/L, cloruro de sodio 5 g/L, agar 15 g/L) utilizando los antibióticos para cada cepa (tabla 1) y kanamicina (50 µg/mL) para la selección del plásmido.
Cultivo de Agrobacterium.
De cada una de las cepas de Agrobacterium se tomó una colonia, se inoculó en medio LB con rifampicina a 100 µg/mL, kanamicina a 50 µg/mL y se incubó a 28 °C y 250 rpm en oscuridad hasta que alcanzó una DO600nm: 0,8 ó 1,0. El cultivo de Agrobacterium fue colectado y centrifugado a 3000 rpm por 10 min, el sobrenadante fue descartado y se realizó un lavado con la solución de infiltración a una concentración 0,5 X (MES 5 mM, MgCl2 5 mM, acetosiringona 75 µM, pH 5.6). El cultivo fue centrifugado nuevamente y resuspen-dido en solución de agroinfiltración 1X (MES 10 mM, MgCl2 10 mM, acetosiringona 150 µM, pH 5.6), hasta alcanzar una DO600nm de 0,8 ó 1,0 (dependiendo del experimento) y se incubó a 18 °C por 3 horas.
Metodologías para introducir Agrobacterium en hojas de yuca.
Para los ensayos de agroinfiltración se utilizaron plantas cultivadas in vitro y posteriormente endurecidas, se seleccionaron hojas jóvenes y verdes. Las infiltraciones se realizaron a temperatura ambiente (20 °C), por triplicado y las plantas se mantuvieron en estas condiciones hasta la realización de la tinción GUS.
Vacío (VA).
En esta técnica las plantas endurecidas fueron sumergidas en 100 mL del cultivo de Agrobacterium descrito anteriormente y se les aplicó vacío. El vacío fue mantenido a un mínimo de 20 mmHg por 1 min y fue liberado lentamente. Este proceso se repitió tres veces con cada muestra. El excedente de la solución fue eliminado de las hojas usando papel filtro (Cui et al., 2017; Kapila et al., 1997).
Herida más vacío (HE+VA).
Previo a la aplicación de vacío en las hojas de las plantas, se realizaron varias punciones pequeñas cerca al nervio central por el haz de la hoja, empleando una aguja. Posteriormente se realizó el procedimiento de vacío descrito en Díaz et al. (2014).
Herida más aplicación del inóculo (HE+IN).
En esta metodología se realizaron heridas cerca al nervio central de la hoja usando una aguja y el inóculo de la bacteria fue esparcido sobre la hoja mediante un copo estéril.
Infiltración (IF).
La infiltración se realizó con una jeringa de 1 mL sin aguja, permitiendo la entrada de la solución por el lado abaxial de la hoja (Schób et al., 1997). Las hojas se mantuvieron en la planta durante y después de la agroinfiltración y se colectaron justo antes de realizar la tinción para visualizar la actividad de la enzima β-glucuronidasa (producto del gen GUS). En dependencia del estadío de la planta, la expresión del gen GUS fue evaluada en las hojas inoculadas, dos días post inoculación (dpi) para plantas endurecidas y de 5 a 7 dpi para plantas adultas.
Evaluación de la expresión del gen GUS .
Las hojas de las plantas inoculadas se separaron y se sumergieron en el buffer X-Gluc (NaH2PO4 0.02 M,Na2HPO4 0.03 M, K3Fe(CN)6 0.25 mM, K4Fe(CN) 60.25 mM, tritón X-100 0.5 % (v/v), DMSO 10 % (p/v) y X-Gluc (5-bromo-4-cloro-3-indolil β-D-glucuronido) 1 mg/mL (Sigma, St. Louis, MO, USA). Las muestras fueron ubicadas en una cámara de vacío durante 15 y 30 min (dependiendo del ensayo) a una presión de 20 mmHg y se incubaron a 37 °C durante 16 h sin agitación (Jefferson et al., 1987). Como control positivo se evaluó la expresión del gen GUS en plantas de Nicotiana tabacum y como control negativo la expresión del vector vacío en la misma planta.
Conjugación triparental para introducir un gen de virulencia en la cepa de Agrobacterium GV3101.
Para realizar la conjugación triparental se empleó Escherichia coli HB101 como cepa donadora y movilizadora y la cepa GV3101 de Agrobacterium como cepa receptora. La cepa donadora fue transformada con el plásmido pTiBo542 que contenía el gen VirG, la cepa movilizadora con el plásmido movilizador en trans pRK2013 y la receptora contenía previamente el plásmido pCAMBIA1302.5 con el gen GUS. Tanto la cepa donadora como la cepa movilizadora fueron incubadas a 37 °C por 16 horas y la cepa receptora a 28 °C por 48 horas. Pasado este tiempo las tres cepas fueron mezcladas en proporción 5:1:1 receptor:donador:movilizador, esta mezcla fue sembrada en LB e incubada toda la noche a 28 °C. Transcurrido el tiempo la mezcla fue resuspendida en LB con rifampicina, lavada y sembrada en medio sólido con Rf-Kan-Spec-Gen para obtener colonias aisladas.
RESULTADOS
Evaluación de diferentes metodologías para introducir Agrobacterium tumefaciens en hojas de yuca.
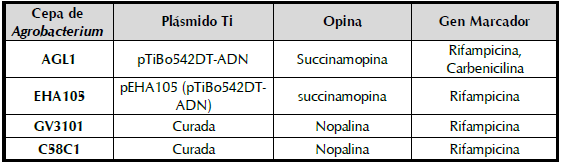
Para determinar la capacidad de Agrobacterium de introducir el ADN-T en las células de yuca, estas fueron tratadas con una suspensión de la bacteria ya sea por vacío (VA), herida más vacío (HE+VA), herida más aplicación del inóculo (HE+IN) e infiltración (IF). La actividad del gen que codifica para la β-glucoronidasa solo se evidenció en dos de las cuatro metodologías utilizadas, HE+VA e IF mientras que en los tratamientos con VA y HE+IN no se observó la coloración azul característica del gen GUS (figura 1). En el tratamiento HE+VA se evidenció una coloración azúl cobalto, solamente alrededor de los puntos donde se generaron las heridas y a pesar de aplicar vacío no se observó la difusión del X-gluc más allá del punto de origen de la herida. En el caso de IF, se observaron manchas azules de mayor intensidad y una mayor área teñida alrededor del punto de inserción del X-gluc. Los resultados demostraron el ingreso de la bacteria en la hoja en aquellas metodologías en donde se generó una fuerte presión mecánica. La infiltración fue la técnica que permitió el ingreso de una mayor cantidad de bacteria y por esta razón se seleccionó para los experimentos subsiguientes.
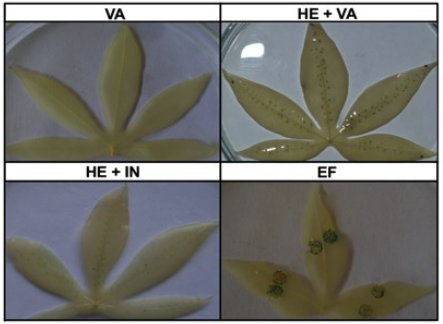
Figura 1 Evaluación de la coloración GUS en hojas de yuca inoculadas con A. tumefaciens usando diferentes metodologías. Plantas de yuca endurecidas de la variedad TMS60444 fueron inoculadas mediante VA: vacío, HE+VA: herida más vacío, HE+IN: herida más aplicación del inóculo e IF: infiltración. Se empleó A. tumefaciens cepa GV3101 a una DO600nm:0,3. La coloración GUS fue realizada dos días después de la inoculación.
Efecto de la cepa de Agrobacterium y del tiempo post inoculación.
Una vez seleccionada la metodología de inoculación, se decidió evaluar el efecto de otras cepas ya que es un factor determinante para la expresión transitoria de un gen (Chetty et al., 2013; Li et al., 2017). Dos días después de la inoculación con las cepas AGL1, EHA105, GV3101 y C58C1, las hojas no mostraron la coloración azul (figura 2A). Tras la inoculación con las cepas AGL1, EHA105 y C58C1 se observaron manchas cafés típicas de una respuesta necrótica por parte de la planta desde los 2 hasta 7 dpi. Sin embargo al realizar la evaluación de la actividad del gen GUS a los 5 y 7 dpi se observó una coloración azul cobalto en las hojas inoculadas con la cepa GV3101. En el caso de las plantas de tabaco empleadas como control se presentó una clara actividad de la enzima β-glucoronidasa en las hojas infiltradas con las cuatro cepas a los 2 dpi (figura 2B). Esta actividad disminuyó a los 5 y 7 dpi. Estos resultados indican que las cepas AGL1, EHA105 y CS8C no son adecuadas para los ensayos de expresión transitoria en yuca bajo las condiciones evaluadas.

Figura 2 Determinación del tiempo y de la cepa de A. tumefaciens óptimos para la detección de la expresión del gen GUS en hojas de yuca. A. Plantas de yuca adultas de la variedad MCOL1505 fueron inoculadas con cuatro cepas de Agrobacterium GV31 01, AGL1, EHA105 y C58C1 a una DO600nm:1,0. La coloración GUS fue realizada 2, 5 y 7 días después de la inoculación. B. Plantas de Nicotiana tabacum infectadas con los mismos tratamientos los cuales fueron utilizados como controles positivos del experimento.
Efecto de la introducción del gen VirG en la cepa de Agrobacterium tumefaciens GV3101.
Debido a que la reacción enzimática del gen GUS no mejoró con el uso de otras cepas de Agrobacterium, se decidió incrementar la virulencia de la cepa GV3101 mediante la introducción del plásmido pTiBo542 el cual contiene el gen virG. Este plásmido, y en particular el gen virG, se caracteriza por conferir un fenotipo de supervirulencia (Chen et al., 1991). Las hojas infiltradas con la cepa que contiene solamente el vector con el gen VirG, mostraron manchas cafés más intensas comparadas con aquellas hojas infiltradas con la cepa que contiene solamente el vector vacío (figura 3). Además, se evidenció un incremento en la cantidad de puntos azules en hojas inoculadas con la cepa GV3101 transformada con los plásmidos que poseen el gen GUS y el gen VirG, respecto a las hojas inoculadas con la cepa GV3101 conteniendo el plásmido con el gen GUS. El incremento en la coloración azul y en la necrosis no fueron observados en las plantas de Nicotiana tabacum utilizadas como control. Las evidencias anteriores indican un incremento en la proporción de células de yuca que expresan el transgen GUS, como consecuencia de la introducción del gen VirG en la cepa GV3101.
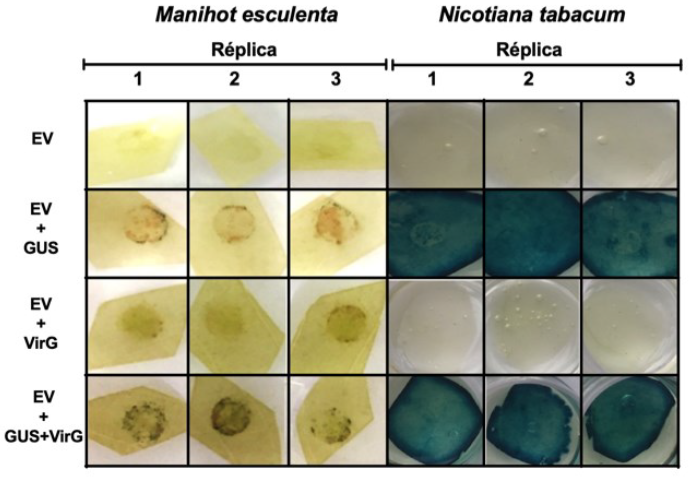
Figura 3 Efecto de la introducción del gen VirG en la expresión del gen CUS. Plantas de yuca adultas de la variedad MCOL1505 fueron inoculadas con la cepa de Agrobacterium GV3101 transformada con las construcciones pCAM-BIA1302.5:GüS y pTiBo542:V/VG a una de DO600nm:1,0. La coloración GUS fue realizada a los 7 dpi. Plantas de Nicotiana fueron utilizadas como controles positivos del experimento.
Efecto de la introducción del gen VirG en la cepa GV3101 en diferentes variedades de yuca.
El gen VirG efectivamente incrementó la virulencia de la cepa GV3101, es por esta razón que se decidió emplearla sobre diferentes variedades de yuca. Tras la inoculación de las cinco variedades de yuca se evidenció una mayor cantidad de puntos azules en aquellas hojas donde se empleó la cepa GV3101 transformada simultáneamente con los plásmidos que poseen el gen GUS y el gen VirG que la cepa GV3101 conteniendo únicamente el plásmido con el gen GUS (figura 4). Así mismo se observó mayor intensidad en la coloración azul en las variedades MCOL1505, SG107-35 y MTAI8. Para las variedades TMS60444 y TMS30572 la cantidad de puntos azules en la zona de inoculación fueron pocos y enmascarados por manchas cafés oscuras. Finalmente las plantas de tabaco utilizadas como control presentaron actividad GUS con la cepa normal y la cepa complementada con el gen VirG.
Figura 4 Actividad GUS en cinco variedades de yuca inoculadas con la cepa GV3101 transformada con el gen VirG. Plantas de yuca adultas de las variedades MCOL1505, TMS60444, SG107-35, TMS30572 y MTAI-8 fueron inoculadas con la cepa de Agrobacterium GV3101 transformada con las construcciones pCAMBIAI302.5:GL/5 y pT¡Bo542:V/>G a una de DO600nm:1,0. La coloración GUS fue realizada a los 7 dpi. En la parte inferior se observan plantas de Nicotiana tabacum utilizadas como controles positivos del experimento.
DISCUSIÓN
Aunque la transformación estable permite el estudio de la función de un gen in planta, esta técnica requiere más trabajo y está acompañada de un proceso largo de regeneración de todo el individuo y su eficacia es dependiente de la especie vegetal. Por el contrario la transformación transitoria, es una técnica fácil y rápida La cual no interfiere con la estabilidad del genoma de la planta (Lu et al., 2013) y permite igualmente el estudio de la función de un gen (Cui et al., 2017). En yuca hasta el momento no se ha reportado algún estudio en donde se emplee la expresión transitoria para la determinación de la función de un gen en plantas adultas. Este trabajo representa una primera contribución al estudio funcional de genes empleando esta aproximación.
En este trabajo se desarrolló una metodología para evaluar la expresión transitoria mediada por Agrobacterium en hojas de yuca de plantas adultas. El primer paso fue seleccionar una técnica para introducir la bacteria dentro del tejido vegetal, una vez allí la bacteria podrá transferir el ADN-T conteniendo el gen reportero. Los resultados aquí obtenidos permitieron evidenciar que para el caso de yuca se deben realizar heridas para que la solución que contiene Agrobacterium logre ingresar. Los mejores resultados se obtuvieron a través de la infiltración de hojas (figura 1). Estos resultados son opuestos a algunos otros trabajos donde reportan muy buena eficiencia en la transformación con la aplicación de vacío (Cui et al., 201 7; Leuzinger et al., 2013). Sin embargo, para nuestro caso esta eficiencia pudo disminuir como consecuencia de exponer al vacío la suspensión de Agrobacterium por un tiempo prolongado, ya que esto genera disminución en la temperatura, factor relevante en la expresión transitoria (Wroblewski et al., 2005). Un factor importante que se observó al realizar la infiltración en yuca es que la cantidad de solución que logra ingresar no sobrepasa el área de la jeringa, mientras que para el caso de Lactuca sativa, Solanum lycopersicum, Arabidopsis y Nicotiana la infiltración permite el ingreso de grandes cantidades de la solución (Jelly et al., 2014; Schób et al., 1997). Esta limitación puede ser considerada teniendo en cuenta el carácter altamente coriáceo que caracteriza las hojas de yuca (Ospina & Ceballos, 2012).
Muchos parámetros han sido investigados que afectan la eficiencia de la transformación. Dentro de los parámetros evaluados en este trabajo se encuentran el tipo y fondo genético de la planta, la cepa de Agrobacterium y el tiempo post- inoculación. En primer lugar se observaron grandes diferencias respecto al tipo de planta utilizado. Al emplear plantas cultivadas in vitro y luego endurecidas se obtuvo una eficiencia de transformación más alta (figura 1) respecto a las plantas adultas (figura 2-4). Resultados similares han sido encontrados en Vitis vinifera (Jelly et al., 2014) y en Fragaria x ananassa Duch (Cui et al., 2017). Es posible que al ser las plantas cultivadas in vitro mucho más jóvenes, suaves y menos gruesas, sea más fácil la entrada de la solución que contiene la bacteria y en consecuencia la transferencia del ADN-T. Otro aspecto a considerar es que en plantas cultivadas in vitro se requiere menos tiempo para evaluar la expresión de un gen, respecto a las plantas adultas.
Dentro de las cepas de Agrobacterium que fueron evaluadas se encuentra la cepa AGL1, la cual se conoce como una cepa hipervirulenta y que ha sido ampliamente empleada para la transformación estable de callo embriógenico en yuca (Beltran et al., 2010). En contraste, la cepa EHA105 es usada rutinariamente para la transformación en otras especies de interés agronómico incluido Musa spp. (Escuola et al., 2011), Vitis vinifera L. (Torregrosa et al., 2002), Zingiber officinale Rosc. (Suma et al., 2008) y Brassica napus L (Radchuk et al., 2000). Por otro lado, la cepa C58C1 ha permitido obtener altos niveles de actividad de la enzima GUS en Lactuca sativa, Solanum lycopersicum y Arabidopsis entre 45 dpi (Wroblewski et al., 2005). En la literatura se encuentra que el orden de eficiencia para liberar el ADN-T en plantas es el siguiente: AGL1 EHA105 GV3101 C58C1 (Chen et al., 2010). Sin embargo, para el caso de yuca la eficiencia fue más alta con la cepa GV3101 que con AGL1 y EHA105, indicando que puede existir un efecto de compatibilidad entre la cepa de Agrobacterium y el hospedero.
Una modificación que logró incrementar ligeramente la virulencia de la cepa GV3101 fue la introducción del gen de virulencia VirG. Este gen codifica para una proteína la cual se une corriente arriba a las regiones promotoras del grupo de genes vir para activar su transcripción. Esta unión incrementa la eficiencia para liberar el ADN-T dentro de la planta (Buchanan et al., 2015). El gen VirG presente en el plásmido pTiBo542 posee diferencias en el promotor, en la secuencia codificante y en la región 3'UTR respecto a la versión original presente en la mayoría de las cepas, lo que le confiere un fenotipo superactivador a la cepa que lo contenga (Chen et al., 1991).
El hecho de observar claras diferencias en los niveles de expresión del gen reportero entre variedades (figura 4), demuestra que el factor genético es clave en la eficiencia de la agroinfiltración, tal como se ha demostrado en algunos ecotipos de Arabidopsis (Wroblewski et al., 2005) y en otras especies vegetales (Bhaskar et al., 2009; Sheludko et al., 2007; Zottini et al., 2008).
CONCLUSIONES
Este trabajo permitió identificar que la mejor metodología para inducir la expresión transitoria del gen GUS en hojas de yuca es mediante agroinfiltración y que la cepa más adecuada de Agrobacterium es GV3101. Se logró evidenciar un sutil incremento en la expresión transitoria cuando se introdujo el gen VirG en la cepa de Agrobacterium. Adicionalmente existe una fuerte dependencia de la variedad de yuca para que el proceso de agroinfiltración sea eficiente.