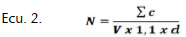INTRODUCCIÓN
Listeria monocytogenes es un microorganismo patógeno transmitido principalmente por el consumo de alimentos, este patógeno es causante de la listeriosis humana, una enfermedad grave que puede provocar meningitis, encefalitis, septicemia y abortos en mujeres gestantes, presentando tasas de mortalidad considerables (Abdollahzadeh et al., 2016). La dosis infecciosa reportada para causar listeriosis en adultos sanos por el consumo de L. monocytogenes en alimentos varía entre 105 y 109 UFC/g, para individuos susceptibles incluso concentraciones de menos de 100 UFC/g puede causar problemas de salud (Sip et al., 2012).
La incidencia de brotes producidos por L. monocytogenes en la década de los 80 en diferentes partes del mundo, llevaron a que las autoridades sanitarias previnieran la aparición de enfermedades transmitidas por el consumo de alimentos contaminados con este patógeno, pues estas especies de microorganismos presentan una alta tasa de mortalidad (20-30%) y han sido asociadas en el 99% de los casos de enfermedades transmitidas por el consumo de alimentos contaminados. (Muñoz et al., 2002).
L. monocytogenes es una bacteria bacilar gram-positiva, anaerobia facultativa, que no forma esporas, ni contiene cápsula y se encuentra distribuida ampliamente en el suelo, agua, y numerosos alimentos (Galan et al., 2006). Posee la capacidad para sobrevivir durante largos períodos de tiempo en condiciones adversas, tales como temperaturas de refrigeración, presencia en matrices con baja actividad de agua, altas concentraciones de sal (10%), y un amplio rango de valores de pH (4.1 - 9.6), además, puede proliferar en equipos para el procesamiento de alimentos listos para el consumo, debido a su capacidad para formar biopelículas (Abdollahzadeh et al., 2016).
Gran cantidad de estudios han evidenciado la presencia de L. monocytogenes en frutas, hortalizas, peces, productos de mar y, entornos de procesamiento de alimentos, aunque las carnes crudas y los productos lácteos han sido considerados los alimentos más susceptibles de contaminación con este patógeno y presentan una mayor amenaza para la salud pública. Estos alimentos pueden contaminarse, incluso, durante la manipulación realizada por el consumidor final (Abdollahzadeh et al., 2016; D'Ostuni et al., 2016). Colombia no cuenta con una regulación en la detección de L. monocytogenes en alimentos a pesar del deterioro que pueden causar las enfermedades producidas por este microorganismo patógeno en la salud humana. En nuestro país se ha reportado una mortalidad del 26% debido a enfermedades transmitidas por alimentos contaminados con L. monocytogenes, aunque es un porcentaje bajo comparado con otros países (38-40%) (Del Pilar et al., 1999). La alta prevalencia de L. monocytogenes en los productos lácteos ha llevado a la busca de alternativas para la prevención de la contaminación y proliferación para el aumento de la vida útil de estos productos. En muchos alimentos esta prevención se hace mediante la utilización de conservantes químicos, que ha sido cuestionada debido a sus efectos potencialmente tóxicos y cancerígenos (Woraprayote et al., 2016), lo que ha llevado a que actualmente, exista la tendencia hacia el uso de aditivos alimentarios naturales, impulsando exploración de compuestos antimicrobianos naturales como una alternativa a los aditivos alimentarios sintéticos (Woraprayote et al., 2016).
Entre los antimicrobianos naturales se han reportado ácidos orgánicos y péptidos como la lactoferrina, la lisozima y la nisina, esta última es una sustancia extracelular diferente a los antibióticos, que es producida de forma natural por algunas especies bacterianas como Lactobacillus plantarum y ha sido reconocida como bacteriocina, las cuales exhiben una actividad inhibitoria frente a diferentes especies microbianas alterantes o patógenas. L. plantarum es un fermentador por naturaleza y uno de los microorganismos probióticos más estudiados alrededor del mundo, tiene una serie productos metabólicos de gran interés que se están investigando y aplicando, a los cuales se les ha logrado demostrar efecto inhibitorio sobre el crecimiento de microorganismos patógenos (Kozak et al., 2017; Woraprayote et al., 2016; Concha-Meyer et al., 2011).
Esta investigación buscó determinar el efecto sobre la tasa de crecimiento de L. monocytogenes cuando es inoculada en co-cultivos con diferentes cepas de bacterias ácido lácticas (BAL) aisladas de suero costeño utilizando leche ultrapasteurizada (UHT) comercial como medio de cultivo.
MATERIALES Y MÉTODOS
Cepas bacterianas y materiales. L. monocytogenes ATCC 19118 fue obtenida del banco de reserva del Grupo Biotransformación de la Escuela de Microbiología y las cepas de bacterias ácido lácticas (Lactobacillus plantarum 60-1 y Lactobacillus plantarum 62-1) son microorganismos nativos aislados de suero costeño producido en la región caribe colombiana obtenidos en investigaciones previas y que se encuentran en la colección de cepas del Grupo de Biotransformación, estos últimos microorganismos fueron aislados e identificados mediante la amplificación y secuenciación del gen 16S rRNA, la identidad taxonómica de las cepas, fue determinada empleando el programa BLAST y el Proyecto de Base de Datos Ribosomal (Motato et al., 2017). Los medios de cultivo empleados para la activación y recuentos de los microorganismos fueron caldo infusión cerebro corazón (siglas en inglés BHI) (MERCK- Alemania), caldo y agar para lactobacillus según De Man, Rogosa y Sharpe (MRS) (marca MERCK- Alemania) y el agar Listeria Selective Agar Base (Oxford formulation, marca Sigma- USA) suplementado con Listeria Selective Supplement (Oxford formulation, marca Sigma- USA) y la leche líquida entera UHT lote 1497070810 fue adquirida en un mercado local.
Activación de células. La cepa de L. monocytogenes crioconservada fue activada, sembrada por agotamiento en Listeria Selective Agar Base (Oxford formulation, marca Sigma- USA) suplementado con Listeria Selective Supplement (Oxford formulation, marca Sigma- USA) e incubada a 37±2 °C por 48 horas, pasado este tiempo se seleccionó una colonia con un asa estéril y se inoculó en 7 mL de caldo BHI, estos tubos fueron incubados a 37±2 °C por 15-18 horas (cultivo overnight), a partir de los cuales se hicieron los diferentes ensayos.
Cepas crioconservadas de L. plantarum (60-1) y L. plantarum (62-1) fueron activadas adicionando 50pl del cultivo congelado atemperado en agar MRS (marca MERCK- Alemania) y sembradas individualmente por agotamiento. Las cajas fueron llevadas a incubación a 37±2°C por 48 horas. Pasado este tiempo se verificó la pureza de cada cepa y se realizó una coloración de gram. Posteriormente, se seleccionó una colonia con un asa estéril que se inoculó en 7 mL de caldo MRS (marca MERCK- Alemania) llevándo los tubos a incubación a 37±2 °C por 18 horas. Otra siembra similar fue realizada para obtener una segunda activación y a partir de esta se midió la densidad óptica del cultivo a 600 nm en un espectrofotómetro ESPECTRONIC®GENESYS 2PC. La densidad óptica (DO) fue ajustada a 0,8 DO6oo a partir de esta concentración celular se realizaron los diferentes ensayos.
Curva de calibración entre unidades formadoras de colonias y densidad óptica para L. monocytogenes. Al cultivo overnight de L. monocytogenes (18- 24h) se le hizo el recuento de microorganismos y le fue medida de manera simultánea la DO a 600nm en un espectrofotómetro ESPECTRONIC®GENESYS 2PC y a partir de esta suspención celular fueron preparados asépticamente, las diluciones 1/2, 1/4, 1/8, 1/16, 1/32 y 1/64 con un volumen final de 5mL, estas diluciones fueron llevadas a cabo con agua peptonada. A cada dilución le fue realizado el recuento de microorganismos y simultáneamente les fue medida la DO a 600nm.
Validación de la técnica de recuento de microorganismos por microgota con la técnica de extensión en caja. Para comparar los dos métodos de siembra y definir con cuál trabajar, cada dilución obtenida para la curva fue nuevamente diluida seriadamente hasta 10-7, empleando 1 mL de la dilución y 9mL de agua peptona-da al 1%. Un volumen de 0,1mL de las últimas cuatro diluciones preparadas fueron sembradas por la técnica de extensión en agar BHI o MRS por duplicado. Todas las cajas se llevaron a incubación por 24 horas a 37±2° C. Las mismas diluciones preparadas y sembradas en la siembra por extensión en caja fueron inoculadas por microgota y fueron puestas sobre la superficie de agar BHI, colocando las cuatro muestras sobre una misma caja de agar con BHI, estas muestras fueron hechas por duplicado. Todas las cajas se llevaron a incubación por 24 horas a 37±2 °C.
Tratamiento de la leche UHT. Las cajas leche UHT empleadas para la experimentación con los microorganismos fueron limpiadas con alcohol etílico al 75% y sometidas a luz UV por 10 minutos antes de ser abiertas, posteriormente, 7mL de leche fueron pipeteados de manera aséptica en cada uno de los 75 tubos Falcon de 10 mL dispuestos para ello. Después de servir los tubos, a esta leche le fue realizado un control de esterilidad sembrando un 0,1mL en agar BHI.
Cinéticas de crecimiento de los microorganismos. Series de 24 tubos Falcon estériles que contenían 7 mL de leche entera UHT fueron inoculados con un 2% (v/v) de cada cultivo overnight (simulando concentraciones de uso de cultivos estárter en productos lácteos): L. plantarum 60-1, L. plantarum 62-1. Los tubos Falcón fueron incubados a 37±2°C, durante la incubación fueron tomados triplicados de cada muestra en los tiempos: 0, 2, 4, 6, 8 ,10 ,12 y 24 horas para realizar la curva de crecimiento. A cada muestra se le realizó el recuento de células viables (UFC/mL) por la técnica de la microgota.
Para las curvas de L. monocytogenes fueron preparados 27 tubos con leche UHT que fueron inoculados con 100p:L de una suspensión de células que contenía una concentración aproximada de 104 células/100p:L, obtenida con la ecuación de la curva de calibración, Absor-bancia= 0,0190289 + 6,04645x10-10 x Concentración (LogUFC), a las curvas de crecimiento para este microorganismo, se les tomó una muestra de más a las 14 horas.
Cinéticas de crecimiento en co-cultivo. A 24 tubos Falcon estériles adicionados con 7 mL de leche entera UHT previamente tratada fueron inoculados con un 2% (v/v) del cultivo overnight de BAL y 100pl de una suspensión de células aproximada de 104 células de Listeria monocytogenes. Los tubos Falcón fueron incubados a 37±2 °C y se tomaron 3 tubos en diferentes tiempos: 0, 2, 4, 6, 8, 10, 12, 14 y 24 horas. A cada muestra se les realizó el recuento de células viables (UFC/mL) de cada uno de los microorganismos adicionados. Se realizó la curva de crecimiento para cada cepa BAL en co-cultivo con L. monocytogenes. El cambio en el pH para cada co-cultivo se registró en los diferentes tiempos de la cinética usando un pH-metro multiparamétrico PH-20II Cii y electrodo HANNA, con un sistema de adquisición de datos elaborado por el Centro de Instrumentación Inter-facultades UdeA.
Cálculo de parámetros cinéticos. Los datos del Log natural de los recuentos de las unidades formadoras de colonias (UFC) por mililitro (Log UFC/mL) fueron empleados para graficar las curvas de crecimiento en leche UHT para los diferentes microorganismos: L. plantarum 60-1, L. plantarum 62-1 y L. monocytogenes, estas curvas iniciales fueron utilizadas como control de crecimiento de los microorganismos en mezclas en el sustrato empleado. Los datos obtenidos fueron empleados para calcular la velocidad específica de crecimiento (u.), la cuál fue calculada empleando la ecuación 1, para las diferentes condiciones evaluadas (monocultivos y co-cultivos). El tiempo de duplicación fue obtenido a partir de la velocidad específica de crecimiento (Díaz, 2012).
Recuento de células viables. Para las cepas BAL se llevó a cabo en agar MRS mediante la técnica por micro-gota, donde el rango de diluciones empleados para la inoculación iba de 10-2 a 10-9, esto según el tiempo de muestra e incubándolas a 37±2 °C por 48 horas. Para L. monocytogenes el recuento se realizó en Listeria Selective Agar Base suplementado con Listeria Selective Supplement sembrado por microgota la muestra de forma directa hasta la dilución 10-7 según el tiempo de muestra y se incubaron a 37±2 °C por 48 horas. Pasado el tiempo de incubación para ambos microorganismos se realizó el conteo de las UFC para cada tiempo y el logaritmo de las unidades formadoras de colonias fue calculado (Log UFC), con estos datos fueron construidas las curvas de crecimiento. Estos recuentos se llevaron a cabo mediante la ecuación:
Dónde:
Σc es la suma de las colonias contadas en las dos cajas provenientes de dos diluciones sucesivas; V es el volumen de inóculo puesto en cada caja en mililitros; d es la dilución correspondiente a la primera dilución seleccionada, d=1 cuando el producto no fue diluido.
Análisis Estadístico. Los datos fueron procesados empleando el software SPSS para la correlación mediante la prueba no paramétrica de Rho Spearman y el software Statgrafics Centurión 17.2.00, empleando ANOVA y prueba de comparación de medias LSD de Fischer con 5% de significancia.
RESULTADOS
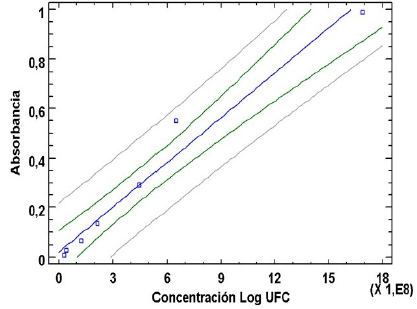
Curva de calibración L. monocytogenes. El análisis del modelo ajustado para la curva de calibración de los datos de la absorbancia (DO) vs logaritmo del recuento de microorganismos (Log UFC) y los valores estimados para el intercepto y la pendiente se presentan en la figura 1.
El análisis de regresión lineal muestra una alta correlación lineal positiva (0,98) para las variables Absorbancia y concentración Log UFC. Esta ecuación permitió ajustar la concentración de células de L. monocytogenes para la realización de las curvas de crecimiento en DO 0,02 (Log UFC= 3,5).
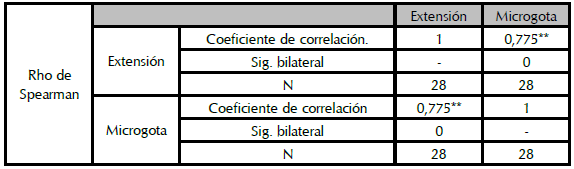
Para la correlación estadística entre las técnicas de microgota y extensión, se encontró que los datos no se ajustan a una distribución normal, por lo tanto, se realizó la prueba no paramétrica en la cual se evidencia una fuerte correlación entre los resultados como se muestra en la tabla 1. Por lo que se decidió utilizar el método de la microgota para la realización de los recuentos de microorganismos.
Crecimiento monocultivo de L. plantarum 60-1, L. plantarum 62-1 y L. monocytogenes. La cinética de crecimiento de los diferentes microorganismos inoculados en la leche UHT, durante 24 horas de incubación se presentan en la figura 2.
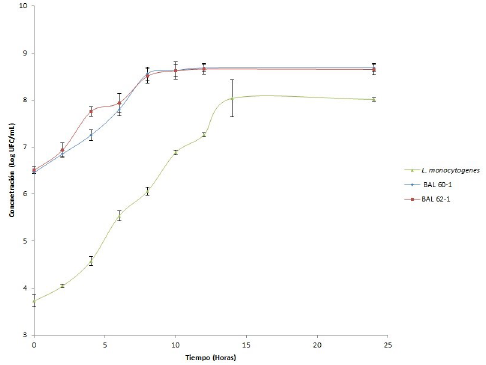
Figura 2 Cinética de crecimiento Lactobacillus plantarum 60-1, Lactobacillus plantarum 62-1 y L. monocytogenes en monocultivo.
Las bacterias L. plantarum 60-1 y L. plantarum 62-1 parten de una concentración inicial de 6.46 y 6.51 Log UFC/mL respectivamente, presentando una fase de adaptación corta y una fase logarítmica que alcanza el mayor crecimiento a las 8h de incubación. Después del tiempo de incubación de 24 horas ambas cepas alcanzan una concentración máxima de 8.69 y 8.65 Log UFC/mL. Para L. monocytogenes, el Logaritmo de la concentración inicial de UFC es de 3.72 Log UFC/mL, el crecimiento máximo es alcanzado a las 14 horas de incubación y permanece constante hasta las 24h, tiempo final hasta el cual se realizó la experimentación (8.01 Log UFC/mL).
Curvas de crecimiento de L. monocytogenes inoculadas en co-cultivo. La cinética de las curvas de crecimiento de L. monocytogenes inoculadas en co-cultivos con L. plantarum 60-1 y L. plantarum 62-1 y de la L. mo-nocytogenes inoculada en monocultivo (control) en la leche UHT se presentan en la figura 3.
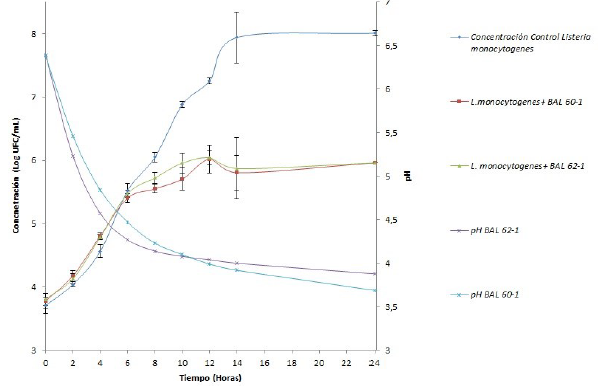
Figura 3 Curvas de crecimiento de L. monocytogenes en monocultivo y en co-cultivo y el cambio del PH en el tiempo.
La figura 3 muestra el crecimiento de la cepa de L. mo-nocytogenes durante un periodo de 24 horas, además del comportamiento del pH del medio a medida que se produce el crecimiento de las BAL y L. monocytogenes. Se puede ver que durante las primeras 6h de crecimiento, bajo las condiciones óptimas de incubación para L. monocytogenes, no se observan diferencias significativas entre los tratamientos y el control, mientras que durante este lapso de tiempo se presenta el mayor cambio en el pH del medio partiendo desde 6,39 y 6,38 hasta 4,84 y 4,57 para las cepas 62-1 y 60-1 respectivamente. Después de este punto se observan diferencias entre el crecimiento de L. monocytogenes cuando está inoculada en monocultivo, con los de L. monocytogenes en co-cultivos con las dos cepas de L. plantarum (60-1 y 62-1). En los co-cultivos, después de 12 horas de incubación, la concentración de L. monocytogenes no presentan una variación significativa y no se da un cambio representativo del pH (3,8-4,0) hasta el tiempo final de seguimiento (24h), alcanzando concentraciones de 5.95 Log UFC/mL de L. monocytogenes en ambos tratamientos, disminuyendo el crecimiento en aproximadamente 2,4 Log UFC/mL en comparación con el monocultivo.
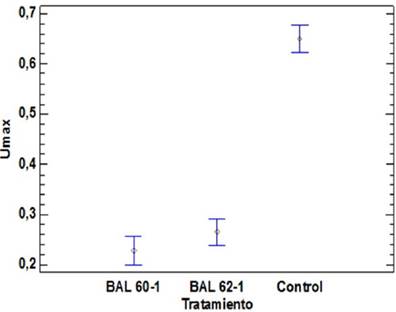
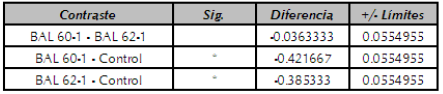
Los valores medios y los intervalos LSD (Diferencia menos significativa) de Fisher para la tasa de crecimiento (U máxima) de L. monocytogenes sola (control) y en co-cultivo se presentan en la figura 4.
El análisis de varianza de una vía muestra para la tasa de crecimiento para los tres tratamiento muestra que existe diferencias estadísticas (p<0,05), claramente se muestran dos grupos homogéneos, donde el tratamiento control forma un grupo con un valor promedio de tasa de crecimiento mayor, (u.max=0,65), y el otro grupo homogéneo esta conformado por los tratamientos en co-cultivo con las BAL Lp 60-1 (µ.max=0,22) y Lp 621 (u.max=0,27). La mayor diferencia entre este grupo homogéneo fue presentada por el tratamiento con BAL Lp 60-1 que obtuvo significativamente el menor valor promedio (-0,42) comparado con el tratamiento control (tabla 2).
DISCUSIÓN
El desarrollo de tecnologías alternativas para disminuir o tener bajo control la concentración de microorganismos patógenos en alimentos, incluye el enfoque de biopreservación, en la cual se utilizan cepas de bacterias ácido lácticas para controlar estos patógenos. La biopreservación tiene como finalidad aumentar la vida de almacenamiento y mejorar la seguridad de los alimentos que utilizan la microbiota natural o sus productos antimicrobianos (Angmo et al., 2016).
Las cepas de BAL y de L. monocytogenes utilizadas en este estudio iniciaron su fase exponencial desde su inoculación, esto era de esperarse debido a que se realizaron inóculos previos para hacerlas más activas metabó-licamente. En nuestro caso se logró evidenciar en células bacterianas activas el cambio en la velocidad de crecimiento (|imax) para L. monocytogenes, cambio que se presenta posiblemente debido a la presencia de los microorganismos (Lp60-1 y Lp62-1) o por la producción de metabolitos generados del metabolismo de las BAL. La capacidad antagónica para estos microorganismos ha sido reportada por Motato et al. (2016), quienes lograron evidenciar el antagonismo de las cepas de L. plantarum 60-1 y L. plantarum 62-1 aisladas de sueros costeños de productos autóctonos colombianos (Motato et al., 2016) y mostraron que estos microorganismos pueden presentar hasta 5 mm de halo de inhibición contra L. monocytogenes en medios convencionales, efecto que logró evidenciarse en la leche UHT. Esta capacidad inhibitoria ha sido reportada por otros autores. (Zeng et al., 2014; Dubourg et al., 2015; Malheiros et al., 2016).
El rápido crecimiento de las BAL genera una mayor producción de metabolitos entre ellos ácido láctico, ácido propiónico y ácido acético generados del metabolismo heterofermentativo del microorganismo (Ganzle, 2015), esta producción de ácidos es evidenciada por la disminución del pH en el medio de cultivo, variando las condiciones óptimas de crecimiento para L. monocytogenes, las cuales son reportadas con un pH optimo entre (4.1-9.6) (Jay et al., 2005).
Algunos autores han evidenciado la producción de bac-teriocinas tipo clase IIa, que pueden inducir efectos letales al actuar sobre la membrana citoplásmica de L. monocytogenes (Woraprayote et al., 2016); Wang et al., 2018). Resultados similares han sido reportados por Sakaridis et al. (2012), donde se evaluó la potencial actividad antagonista de 7 aislados de BAL contra cepas de Salmonella spp. y L. monocytogenes, en la cual todos presentaron una posible actividad inhibitoria contra Salmonella y Listeria, además de las características psicrotró-ficas necesarias para su uso como cultivos protectores.
En otro estudio de tipo experimental, se evaluó la capacidad de aislados de BAL en el biocontrol de L. mono-cytogenes aislada de granos de cerveza, encontrando que todas las cepas de BAL analizadas mostraron actividad antagonista contra L. monocytogenes por producción de compuestos tales como ácidos orgánicos, bacteriocinas, peróxido de hidrógeno, entre otros, este trabajo coincide con los resultados obtenidos en nuestra investigación, pero utilizando las BAL en una matriz láctea (Asurmendi et al., 2015).
Este trabajo mostró que el efecto antagónico de las BAL empleadas contra la inhibición de L. monocytogenes, se presenta después de las 6 primeras horas de co-cultivo, tanto en el tratamiento con la cepa Lp 60-1 como con Lp 62-1, evidenciando una disminución hasta de 2 log UFC/mL en las tasas de crecimiento para L. monocytogenes después de las 24h de cultivo, esto nos permite plantear la hipótesis que la baja en pH del medio de cultivo sumado a los demás mecanismo como la competencia por nutrientes, producción de ácidos, bacterio-cinas y mecanismos de contacto célula a célula influyeron en dicha reducción de la concentración de L. monocytogenes como lo plantea Giello et al. (2018), además estos resultados son consistentes con Campagnollo et al. (2018), quienes evaluaron el efecto antagónico de cepas BAL contra L. monocytogenes en quesos, obteniendo como resultado una reducción del crecimiento de L. monocytogenes de aproximadamente 4 log UFC/g cuando estos fueron inoculados con cepas de BAL, los autores atribuyeron esto a los diferentes mecanismos de inhibición producidos por las BAL.
Al comparar la velocidad de crecimiento del patógeno evaluado, no se encontraron procedimientos experimentales realizados en condiciones equivalentes, ya que los estudios difieren en tiempos experimentales, temperatura o matriz empleada para el crecimiento. Augustin et al. (2005), menciona que las curvas de crecimiento de L. monocytogenes dependen específicamente de los alimentos, los procesos y las condiciones donde se evalúan. Su estudio mostró que el valor medio para la imax obtenida de 186 cinéticas de crecimiento analizadas para L. monocytogenes, tuvo un promedio de imax=0,742 h-1, donde estos autores evaluaron diferentes parámetros y utilizaron diversos modelos de cálculo, dando como resultado un grupo de cinéticas de crecimiento heterogéneo para productos lácteos líquidos donde se encuentran la leche y el suero de leche. Para nuestro caso el haber obtenido una imax=0,65 h-1 para el crecimiento de L. monocytogenes en leche UHT comercial se aproxima a lo descrito por estos autores.
CONCLUSIONES
El presente estudio ha mostrado la eficacia para disminuir el crecimiento de L. monocytogenes en leche UHT al ser inoculada en co-cultivos con cepas de bacterias ácido lácticas L. plantarum (60-1 y 62-1), aisladas de productos autóctonos como lo es el Suero Costeño.
Los resultados obtenidos en esta investigación presentan una opción para la aplicación de estas cepas como cultivos adjuntos en el control de L. monocytogenes durante la producción de lácteos fermentados, con posibilidad de convertirse en una medida alternativa para mejorar la vida útil, el almacenamiento y la seguridad de dichos productos reduciendo el uso de aditivos químicos.