INTRODUCCIÓN
Los biomateriales que se utilizan en ingeniería de tejidos buscan señalizar al tejido con el que interactúan de manera parecida a las proteínas nativas, con el fin de regular actividades celulares favoreciendo los procesos de regeneración conllevando a restaurar la morfología y fisiología del tejido lesionado sobre los procesos de reparación que conducen a la formación de tejido cicatrizal (Sobajo et al., 2008). Aunque un gran número de materiales cuentan con características como ser biocompatible con el tejido a regenerar, los resultados funcionales a menudo están limitados por la falta de estímulos suficientes que lleven a que estos induzcan la regeneración del tejido en sitios de lesión o enfermedad (Uebersax et al., 2008). La seda, obtenida a partir de los capullos del gusano Bombyx mori L. es un material único que históricamente ha sido muy valorado en el campo textil por su fuerza y brillo (Rockwood et al., 2011, Tansil et al., 2011). En el campo de la medicina, ha sido utilizada durante siglos como material de sutura y recientemente ha ganado importancia como biomaterial por sus propiedades intrínsecas. (Kundu et al., 2013). La fibroína de seda es una proteína compuesta por más del 75% de residuos de alanina y glicina, presenta tres cadenas, la cadena pesada (391 kDa), la cadena ligera (25.8 kDa) y P25 (25 kDa), la cadena ligera está unida a la cadena pesada por un único enlace disulfuro, mientras que P25 se asocia principalmente con la cadena pesada a través de interacciones hidrófobas siendo la cadena pesada responsable de las propiedades físicas y mecánicas de la fibra (Kundu, 2014). La fibroína de seda es secretada por las glándulas sericígenas del gusano para formar su capullo, su bioactividad, baja inmunogenicidad, gran resistencia mecánica a la tracción, flexibilidad, biodegradabilidad y superficie altamente reactiva que le permite unirse covalentemente a péptidos, hormonas y factores de crecimiento hacen que se use como materia prima en la fabricación de diferentes tipos de andamios (esponjas, películas, microfibras, hidrogeles, esferas) con aplicación en medicina regenerativa (Anadón, 2008, Yan et al., 2012). Sus propiedades mecánicas únicas le permiten ser utilizada con éxito en ingeniería de tejidos entre las que se incluye la regeneración de cartílago, hueso, vasos sanguíneos, ligamentos, tejido nervioso, hepático, ocular, vejiga, tráquea, piel y tendones (Gellynck et al., 2008, Sobajo et al., 2008, Gaviria & Caballero, 2015). Los andamios de fibroína de seda, solos o acompañados de otros biomateriales naturales o sintéticos, sembrados con células madre mesenquimales favorecen procesos de adhesión, proliferación, diferenciación condrogénica y estimulan la acumulación de glicosaminoglicanos y colágeno, elementos primordiales en la formación de la matriz extracelular. (Gellynck et al., 2008, Haider et al., 2008, Jiang, 2013); este hecho es de gran importancia ya que pueden imitar la estructura nativa del tejido afectado constituyendo una alternativa terapéutica para la reparación condral.
A su vez, se ha identificado que células madre cultivadas en medio condrogénico expresan marcadores condrogénicos como colágeno tipo II, agrecano, colágeno X y sox9, al igual que producen una matriz extracelular propia de células tipo condrocito (Haider et al., 2008, Wray et al., 2011, Kundu, 2014).
En el presente trabajo se describió la diferenciación de células madre mesenquimales obtenidas de medula ósea hacia un linaje de condrocitos sembradas sobre soportes de fibroína, su diferenciación fue llevada a cabo mediante la evaluación de la expresión de marcadores específicos de cartílago.
MATERIALES Y MÉTODOS
Este estudio fue aprobado por el Comité de Bioética de la Universidad Tecnológica de Pereira (UTP), todo el procedimiento se realizó en el área de Medicina Regenerativa de las instalaciones del laboratorio de Biología Molecular y Biotecnología -Cenbiotep- adscrito a la Facultad de Ciencias de la Salud de la Universidad Tecnológica de Pereira.
Recolección del material
Los capullos de gusano de seda utilizados se obtuvieron de la granja experimental “El Pílamo” propiedad de la UTP. Se seleccionaron los capullos que no presentaban manchas, a todos ellos se les retiraron los restos sólidos de crisálida y pelusas mediante cepillado y corte.
Desgome y preparación de soluciones de fibroína
Para el desgome se siguió un procedimiento establecido por el grupo (Caballero et al., 2016). Los capullos fueron cortados a la mitad y sometidos a ebullición en una solución de Na2CO3 0,02M por 45 a 60 minutos (5 g de capullos/1 litro de solución). La fibroína desgomada obtenida fue lavada y secada en horno a 60°C por 6 horas. Se preparó una solución al 10% (p/v) de fibroína utilizando LiBr 9,3M e incubando en baño maría a 60°C por 4 horas. La fibroína disuelta obtenida fue filtrada y centrifugada con el fin de eliminar impurezas (Wang et al., 2006, Gellynck et al., 2008, Garcia et al., 2009, Wray et al., 2011, Jiang, 2013, Kundu, 2014).
Dialisis, contradialisis y fabricacion de peliculas
Con el fin de remover el LiBr, la fibroína fue dializada contra agua destilada utilizando tubos de membrana para diálisis (Spectra/Por MWCO 6-8000). (Caballero et al., 2016). La solución obtenida fue contradializada empleando polietilenglicol al 30% (Av. Mol Wt 8000) hasta conseguir una concentración de fibroína de 17% confirmado por el método de Bradford. De esta solución se tomaron 4 ml y se sirvieron en cajas cultivo, se secaron a 90°C por 24 horas, con el fin de estabilizar la película e inducir su cristalización e insolubilidad sugiriendo la formación de hoja β en la estructura de la fibroína. Las películas se evaluaron utilizando un microscopio de barrido de electrones (JEOL, modelo JSM 6490-LV), usando un haz de electrones acelerado ajustado entre 5-20 kV. Las cajas de cultivo fueron esterilizadas con etanol al 70%, seguido de lavados con Dulbecco´s Phosphate Buffered Saline 1x pH 7.1 (DPBS). Finalmente, las películas fueron acondicionadas con 2 ml de medio de cultivo Dulbecco’s modified Eagle’s medium (DMEM) + Glutamax, (4.5g/L D-Glucosa, 25mM HEPES y sin piruvato de sodio) en incubadora de CO2 a 37ºC por 48 horas.
Expansión y diferenciación celular sobre peliculas de fibroina
Se utilizaron células madre mesenquimales (CMMs) StemPro® (Gibco Life Technologies) provenientes de médula ósea humana de donantes anónimos en subcultivo S4. Las células fueron cultivadas como una mezcla de células adherentes hasta el subcultivo S7 en incubadora al 5% de CO2, atmósfera húmeda, 37°C. Se empleó el medio Mesenquimal Stem Cell Growth Medium suplementado con 50ml MCGS y 10ml L-Glutamina (200 mM), 0.5ml de sulfato de gentamicina /anfotericina B (50mg/ml). La viabilidad celular fue evaluada con una cámara de Neubauer bajo microscopio óptico utilizando el ensayo de exclusión con azul de tripán. Las células obtenidas fueron sembradas sobre las películas de fibroína y sobre cajas sin fibroína con una densidad de siembra de 5000 células/cm2. El ensayo se realizó por triplicado con tiempos de incubación de 14 y 21 días. Cuando las células alcanzaron una confluencia del 40-50%, se indujo el proceso de diferenciación condrogénica utilizando medio de cultivo que contenía DMEM + Glutamax con indicador de pH rojo de fenol suplementado con suero fetal bovino al 10% v/v (SFB), fungizona 0.1%, penicilina/estreptomicina/neomicina 1% (PSN), ácido ascórbico 50ug/ml, dexametasona 100nM, 10ng/ml proteína morfogenética ósea recombinante humana (BMP-2), 10ng/ml BMP-4, 10ng/ml Proteína de crecimiento transformante β recombinante humana (TGF- β3), 100ng/ml factor de crecimiento de tipo insulina recombinante humana (IGF-1), 1x de insulina, transferrina, selenio (ITS). Para los ensayos en los que se evaluaba la fibroína para soportar el crecimiento celular se utilizó Medio Eagle Modificado por Dulbecco (DMEM), con indicador de pH rojo de fenol suplementado con glutamax, SFB al 10%, fungizona 0.1% y PSN al 1%. Como control positivo del proceso de diferenciación se usaron CMMs sembradas sobre cajas de poliestireno cultivadas con medio de diferenciación; como control negativo, CMMs sembradas sobre películas de fibroína incubadas con medio de expansión sin factores de crecimiento y como control general del proceso de crecimiento CMMs sembradas sobre cajas de poliestireno alimentadas con medio de cultivo sin factores de crecimiento. Las células sembradas fueron incubadas a 35ºC, 5% de CO2 y atmósfera de humedad. Todos los sobrenadantes obtenidos a partir de los recambios de medio durante el proceso de expansión y diferenciación celular fueron sembrados en agar tripticasa soya (TSA), agar nutritivo y agar papa dextrosa (PDA) e incubados durante 7 días a 35ºC con el fin de descartar contaminaciones microbiológicas. Al finalizar el tiempo del ensayo (14 y 21 días), las células se disgregaron de las superficies de las cajas y de las películas de fibroína utilizando tripsina-EDTA al 0.5%, se realizó recuento de células/cm2 y porcentaje de viabilidad celular en cámara de Neubauer usando el ensayo de exclusión con azul de tripán. Las células fueron suspendidas en solución de Hanks´ estéril y almacenadas a una temperatura de -70°C para su posterior extracción de ARN.
Cebadores y síntesis de adn copia
Los cebadores se diseñaron con base en las secuencias reportadas en GenBank National Center for Biotechnology Information (NCBI), para los genes presentados en la tabla 1. La expresión del gen constitutivo gliceraldehído 3-fosfato deshidrogenasa (GAPDH) fue usada para normalizar la expresión de genes en cada muestra. Los cebadores se diseñaron en el programa Primer3Plus (www.bioinformatics.nl/primer3plus), se alinearon a cada secuencia de la proteína utilizando el recurso web nucleotide Blast perteneciente a NCBI (www.ncbi.nlm.nih.gov/BLAST). La extracción del ARN fue llevada a cabo con el estuche RNeasy Minikit (Qiagen). La síntesis de cADN se realizó en un termociclador Gene Amp PCR System 9700 Applied Biosystem utilizando el estuche OneStep RT-PCR (Qiagen) según las recomendaciones del fabricante, los productos obtenidos fueron evaluados en geles de agarosa al 2% y observados en un transiluminador de luz UV.
ANÁLISIS ESTADÍSTICOS
El análisis de los datos se realizó en los paquetes estadísticos GraphPad Prism 6.0 e InfoStat. Con el fin de determinar el impacto de las películas de fibroína sobre la viabilidad y recuento celular se realizó el modelo estadístico ANOVA de dos vías, previo a esto se comprobó la normalidad de los datos mediante la prueba de Shapiro Wilk y la homogeneidad de la varianza mediante la prueba de Bartlett. Todos los análisis estadísticos se realizaron bajo un nivel de significancia estadística del 95%.
RESULTADOS
Películas de fibroína
Se obtuvieron películas estables, transparentes y resistentes, que no se disolvieron al contacto con el medio de cultivo empleado para la alimentación de las células durante los 21 días que duró el ensayo, la película no influyó en la viabilidad ni en la multiplicación celular indicando que el uso de temperatura favoreció la cristalización de la proteína lo que sugiere la inducción en la formación de estructuras secundarias tipo hojas beta haciéndola insoluble. El proceso de esterilización con etanol al 70% demostró ser efectivo, ya que el cultivo de los sobrenadantes dio negativo a los 7 días de incubación (datos no mostrados).
Microscopía electrónica de barrido (meb)
Esta técnica permitió observar una superficie uniforme, continua, sin signos de fractura ni deformidad posterior al proceso de secado semejando la superficie de las cajas de poliestireno utilizadas para cultivo celular, estas características son fundamentales para los cultivos in vitro ya que facilita la adherencia de las células y su proceso de expansión (figura 1).
Proceso de expansión celular
Se estableció un cultivo primario de CMMs utilizando DMEM suplementado con SFB al 10%. El seguimiento de los cultivos durante la etapa de expansión celular realizado mediante microscopio invertido y microscopio vertical, permitió observar células adheridas a la superficie de las películas de fibroína, con características morfológicas típicas de CMMs entre las que se incluye su forma fusiforme tipo fibroblastoide con formación de colonias celulares en su crecimiento inicial como lo reportan investigaciones basadas en cultivo de CMMs. (Kassem et al., 2004, Csaki, et al., 2008, Baugé & Boumédiene 2015).
Diferenciación celular
Durante el ensayo se logró observar cambios a nivel de la morfología de la célula con respecto al control. Al 4º día de incubación con medio condrogénico, se observaron células con morfología redonda, formando conexiones entre células facilitando la adherencia con la película (figura 2/4ºdía C-D), las células alimentadas con medio de crecimiento crecidas con/sin película de fibroína (control negativo) conservaron su morfología típica fibroblastoide y aumentaron en número con respecto a las células en proceso de diferenciación (figura 2/4ºdía A-B). Al día 8º las células crecidas en medio condrogénico aumentaron en número manteniendo un crecimiento uniforme, sin embargo, se observó que su proliferación era más lenta con respecto al control negativo, de igual manera se evidencio adherencia a la superficie del andamio, observándose la presencia de sustancias granulares alrededor de estas con la formación de conexiones entre células intentando tapizar la superficie del andamio (figura 2/8º día C-D). Al día 12º las células en proceso de expansión (con/sin fibroína) continuaron multiplicándose manteniendo su morfología fusiforme, mientras que las células en proceso de diferenciación (con/sin fibroína) tomaron una morfología redondeada y estrellada formando agregados celulares rodeados por una matriz, aumentó el área de enmallado formado por nuevas conexiones intercelulares unidas a un grupo central de células siendo más notorias en las células en proceso de diferenciación sembradas sobre películas de fibroína (figura 2/12º día C-D). Al día 16º las células en proceso de diferenciación continuaron manteniendo su morfología redonda aumentando la zona de conexiones por agregados celulares, (figura 2/16º día C-D), las células en proceso de expansión mantuvieron su morfología fibroblastoide aumentando en número (figura 2/16º día A-B), al día 21º del ensayo se observó que las células en diferenciación aumentaron el área de tapizado por nuevas conexiones intercelulares con mayor formación de agregados celulares adyacentes, la población celular fue más homogénea, tomaron forma estrellada con presencia de una matriz, no se observaron cambios morfológicos significativos entre las células sembradas sobre el soporte y sin él (figura 2/21º día C-D).
ANALISIS DE EXPRESION
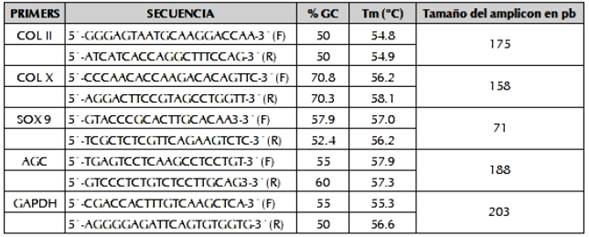
No hubo amplificados para colágeno II, colágeno X, sox9, y agrecano en las muestras sembradas con/sin fibroína alimentadas con medio de expansión, (figura 3-1 y 3-3). Se evidencio la presencia de bandas para los amplicones Sox9, colágeno II, agrecano y colágeno X en las muestras alimentadas con medio de diferenciación y factores de crecimiento (con/sin fibroína) (figura 3-2 y 3-4), indicando cambios en los patrones transcripcionales activos en las CMMs producto de su especialización terminando en la diferenciación hacia un linaje celular tipo condrocito.
Figura 3 Patrón de expresión marcadores moleculares. A. Muestras de células sembradas sobre fibroína con medio de expansión. B. Muestras de células sembradas sobre fibroína con medio condrogénico. C. Muestras de células sembradas sin fibroína con medio de expansión. D. Muestras de células sembradas sin fibroína con medio de condrogénico.
Con respecto al análisis estadístico, el ANOVA de dos vías realizado a los datos obtenidos del recuento celular (figura 4-1 y 4-2) y de los porcentajes de viabilidad celular a los días 14 y 21 (figura 4-3 y 4-4), ambos se comportaron igual al día 14 y al día 21, no hay diferencia significativa entre los 4 subgrupos de ensayo, de igual manera se demostró que el uso de fibroína como soporte no afectó el recuento celular ni la viabilidad celular, por tanto no hay diferencia entre usar o no fibroína en términos de diferenciación celular (figura 4).
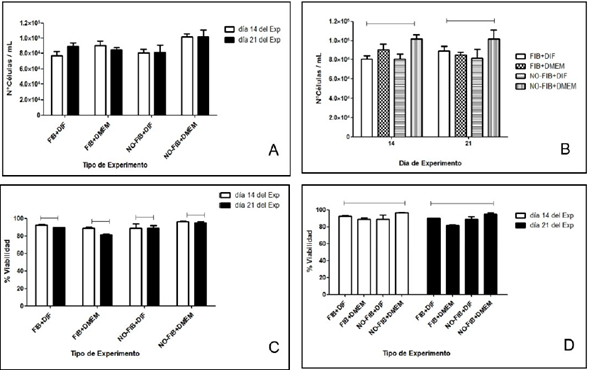
Figura 4 Recuento y viabilidad celular día 14 y día 21. A. Recuento celular y tipo de ensayo a los 14 y 21 días. La fibroína no afectó el número de células. B. Recuento celular vs tiempo. El número de células obtenidas es similar en ambos momentos del ensayo. C. Viabilidad celular y tipo de ensayo a los 14 y 21 días. La fibroína no afectó la supervivencia de la célula. D. Viabilidad celular vs tiempo. El número obtenido de células vivas es similaren ambos momentos del ensayo.
DISCUSION
El proceso inicial de selección de los capullos fue de vital importancia para obtener películas de buena calidad, como es reportado por varios ensayos en el procesamiento inicial de la fibroína. (Hardy y Scheibel, 2010, Zhang et al., 2010, Kundu, 2014). La película obtenida empleando calor fue estable, resistente e insoluble, sin embargo, su cristalización puede lograrse usando otras técnicas reportadas con éxito por varios autores como lo son el uso de metanol, (Hofmann et al., 2006, Marolt et al., 2006, Garcia et al., 2009, Zeng et al., 2014), la inmersión en solventes orgánicos y el uso de recosido por vapor de agua (water annealing) (Hu et al., 2007, Mo et al., 2009, Moraes et al., 2010, Kundu et al., 2013). El proceso de esterilización con etanol al 70% citado en varios ensayos demostró ser efectivo, (Wang et al., 2006, Bhardwaj & Kundu 2014), sin embargo, pueden emplearse otros métodos como el calor, calor húmedo o el uso de agentes esterilizadores. Al finalizar el proceso de diferenciación se pudo apreciar que las células alimentadas con medio de expansión mostraron una morfología homogénea típica a células de tipo fibroblastos, con citoplasma alargado y sin presencia de una matriz observándose la formación de colonias celulares propias de un proceso de expansión de CMMs mientras que las células alimentadas con medio de diferenciación con/sin fibroína pasaron por un proceso de transformación metabólica activa producto de su especialización evidenciado por la morfología de tipo esférica/estrellada, la formación de agregados celulares y cambios en su comportamiento (figura 2) muy similar a la reportado por otros investigadores quienes emplearon CMMs sobre combinaciones de andamios (seda, seda/quitosan, seda/ácido hialuronico, seda/colágeno y seda/agarosa) para promover procesos de condrogénesis. (Gelse et al., 2003, Schmitt et al., 2003, Mauck et al., 2006, Garcia et al., 2009, Bhardwaj & Kundu 2012, Jiang 2013, Kundu et al., 2013) y similar a la morfología de condrocitos presentes en un entorno fisiológico de tejido cartilaginoso articular y de condrocitos recién aislados de tejido articular sugiriendo un proceso activo de condrogénesis (Wang et al., 2006). Durante un proceso de diferenciación in vitro de CMMs pueden obtenerse condrocitos desdiferenciados que asumen un fenotipo con perfil de expresión de genes similar al observado en procesos de osteoartrosis, perdiendo la morfología esférica y adquiriendo una morfología de fibroblasto formando un tejido de tipo fibrocartílago como lo reporta Wang y col. en su estudio basado en el crecimiento de condrocitos articulares sobre andamios de fibroína para promover la ingeniería de cartílago (Wang et al., 2006). Este proceso se evitó empleando factores como el TGF-β3, BMP-2 y BMP-4; de igual manera, el uso concomitante de miembros de la familia TGF-β con elementos tipo hormonas esteroideas humanas como la dexametasona está estrechamente relacionado en la conducción de las CMMs a un proceso de diferenciación condrogénica. (Roh et al., 2001, Shintani & Hunziker 2011).
En este estudio se demostró que el medio de cultivo condrogénico enriquecido con los factores de crecimiento BMP-2, BMP-4, IGF-1 y TGF-β3 suplementado con dexametasona, ácido ascórbico e ITS, favoreció la especialización de una CMM hacia un linaje celular tipo condrocito (Schmitt et al., 2003). Está demostrado que la estimulación condrogénica de una célula madre puede lograrse empleando alguna de las tres isoformas de la familia TGF-β ya que son consideradas potenciadores en el proceso inicial de condrogénesis (Vinardell, et al., 2009, Freyria & Mallein 2012); diferentes estudios reportan que el uso de TGF-β3 incrementa el tamaño y peso celular, los depósitos de proteoglicanos, la síntesis de glucosaminoglicanos, la expresión de colágeno II y de otros marcadores condrogénicos. (Schmitt et al., 2003, Vinatier et al., 2009, Yun et al., 2010, Freyria & Mallein 2012), de igual forma el aumento en la expresión y síntesis de colágeno II y agrecano pueden lograrse con el uso de miembros de la familia IGF (Palmer et al., 2005, Chen et al., 2014). Además, el uso concomitante de estos factores con otras moléculas como BMP-2/BMP-4/BMP-6 conllevan a regular la expresión de COL2A1 y COL10A1, marcadores propios de un proceso condrogénico (Freyria & Mallein 2012).
La inducción de marcadores de hipertrofia como colágeno X, metaloproteinasa de matriz 13, fosfatasa alcalina y osteopontina junto con la mineralización del tejido indican que las rutas de diferenciación favorecen un proceso de hipertrofia de condrocitos asociado a procesos de osificación in vitro. (Diekman et al., 2009, Yun et al., 2010, Mahmoudifar and Doran 2012). En este estudio se demostró la expresión de colágeno X en todas las muestras bajo estimulación condrogénica, indicando que las CMMs pasaron por un proceso de condensación, proliferación, diferenciación y maduración hasta llegar a la formación de condrocitos hipertróficos (Fig. 4); dicho proceso puede controlarse in vitro utilizando otros factores de crecimiento como el uso de factor de crecimiento básico de fibroblastos (FGF-2), factor de crecimiento endotelial vascular (VEGF) y proteínas de la familia WNT 4-8. (Vinatier et al., 2009, Mahmoudifar & Doran 2012). Finalmente, es posible afirmar que, si el ensayo se extendiera a un tiempo mayor que el utilizado en este estudio, como lo reportan otras investigaciones (Karlsson et al., 2007, Murdoch et al., 2007, Freyria & Mallein 2012); se observaría una mayor área de tapizado producto de células diferenciadas que pretenden formar una estructura especializada similar a un tejido. Teniendo en cuenta que un andamio ideal debe favorecer los procesos de unión, migración y diferenciación celular, así como el transporte masivo y la integridad mecánica de los tejidos con el soporte y su posterior integración in vivo (Marolt et al., 2006); en este estudio se demostró que la fibroína de seda permitió el crecimiento, expansión y diferenciación de células madre utilizando un medio de cultivo condrogénico especifico, sus propiedades mecánicas únicas junto con sus características de ser biodegradable y biocompatible la postulan como un buen andamio para la regeneración de lesiones articulares. Finalmente se recomienda realizar estudios complementarios en cuanto a la caracterización física y mecánica de la película de fibroína de seda, así como su velocidad de degradación para confirmar su uso como biomaterial en la ingeniería de tejidos, de igual manera se recomienda la tipificación por citometría de flujo de las células diferenciadas, así como la realización de ensayos que cuantifiquen la expresión de los genes estudiados.
CONCLUSIONES
Los resultados de este trabajo evidenciaron que las películas de fibroína son estructuras estables, resistentes e insolubles, que no afectaron el crecimiento y la multiplicación celular y permitieron la diferenciación celular de células madre mesenquimales hacia células de tipo condrocito. Finalmente, estos resultados abren la posibilidad de emplear andamios fabricados con fibroína de seda en el tratamiento de defectos a nivel de cartílago.