INTRODUCCIÓN
La regulación de la expresión de un gen de interés agrícola en plantas transgénicas implica la interacción específica entre factores de transcripción que en trans reconocen elementos cis-regulatorios (presentes en la región promotora de los genes) (Lee & Young, 2000). Los promotores son secuencias de DNA localizados río arriba del sitio de inicio de la transcripción que contienen arreglos de múltiples elementos cis que regulan y determinan la transcripción de un gen específico (Lewin, 2006). En ingeniería genética de plantas se utilizan diferentes tipos de promotores: promotores constitutivos, aquellos que están activos en la mayoría de los tejidos y etapas de desarrollo; promotores espacio-temporales, activos únicamente en tejido-específica o etapa-específica; promotores inducibles, regulados por la aplicación de una señal externa sea física o química y por ultimo están los promotores sintéticos, que pueden dirigir un patrón de expresión constitutivo, espacio-temporal o inducible, dependiendo de los elementos cis-regulatorios con los que fueron diseñados (Peremarti et al., 2010; Hernández-García & Finer, 2014). El promotor 35S del virus del mosaico de la coliflor (Cauliflower mosaic virus, CaMV) es ampliamente usado en biotecnología y confiere una expresión constitutiva en plantas dicotiledóneas, siendo esta expresión relativamente menor en plantas monocotiledóneas (Liu et al., 2003). Bajo ciertas condiciones la sobreexpresión de un gen particular podría acarrear consecuencias indeseables; por ejemplo, la expresión constitutiva de los genes asociados con la tolerancia al estrés y respuestas de defensa podrían dar lugar a efectos pleiotrópicos y a la activación imprevista de las vías de defensa en ausencia de agentes patógenos (Gurr & Rushton, 2005), además, también podría generar incrementar cambios que conlleven a la inactivación transcripcional de genes (Stam et al., 1997). Esto ha incentivado la investigación orientada a la búsqueda y estudio de promotores con características biotecnológicamente deseables tales como, expresión en diferentes etapas de desarrollo o en tejidos, así como en células específicas de la planta.
La biobalística de baja presión en ensayos de expresión transitoria, provee una herramienta eficiente, rápida y conveniente para investigaciones básicas en biología molecular. Los ensayos transitorios fueron desarrollados para estudiar la función de genes así como caracterizar un constructo génico previo a una transformación genética estable de plantas (Hellens et al., 2005; Lee & Yang, 2006; Sparkes et al., 2006). En ensayos de expresión transitoria, existen altos niveles de transcripción temporal de secuencias de DNA que no están integrados en el genoma de la célula hospedera, los cuales están fusionados a genes reporteros (Sudowe & Reske-Kunz, 2013). Uno de los genes reporteros que más se ha usado es el gen uidA que codifica a la enzima β-glucuronidasa (GUS) de Escherichia coli (Jefferson et al., 1987). Este gen reportero se ha empleado en estudios cuyos objetivos han sido: (1) comprender los patrones de desarrollo de la expresión de un gen; (2) contrastar diferentes métodos de transformación genética; (3) realizar comparaciones entre explantes para transformación y regeneración de plantas; (4) optimizar los parámetros de bombardeo de partículas y (5) analizar las características de promotores claves en la expresión de genes (Park et al., 2010; Vaca-Vaca et al., 2014).
El virus de la distorsión de la hoja de maracuyá (Passionfruit leaf distortion virus, PLDV) es un virus que afecta cultivos de maracuyá en Valle del Cauca (Colombia), pertenece al género Begomovirus (Familia Geminiviridae) y es el segundo del este género viral reportado a nivel mundial que afecta pasifloras (Vaca-Vaca et al., 2016; 2017). Su genoma está constituido por dos componentes genómicos circulares de DNA de cadena sencilla denominados DNA-A y DNA-B con un tamaño de 2,6 y 2,5 kb, respectivamente. El componente genómico A contiene cinco Marcos de Lectura Abierto (MLA), AC1, AC2, AC3, AC4 y AV1 que codifican para las proteínas Rep, TrAP, REn, AC4 y CP, respectivamente, que participan en la replicación, transcripción y encapsidación del virus. Mientras que el componente genómico B contiene dos MLA (BC1 y BV1), que permiten el movimiento del virus a corta y larga distancia, respectivamente. En cada componente genómico hay presente una Región Intergénica (IR) de aproximadamente 300 pb. En esta región intergénica se encuentran dos promotores divergentes en relación a una estructura palindrómica a manera de tallo y asa (Ramesh et al., 2017; Vaca-Vaca et al., 2017). Estos promotores divergentes promueven la transcripción bidireccional de los MLAs presentes en cada uno de los componentes. Esto implica que la expresión transcripcional de los genes virales involucra estrategias de regulación complejas. Es decir, el proceso transcripcional de cada uno de los MLAs geminivirales es perfectamente coordinado, de manera tal que se puede hablar de genes de expresión temprana, intermedia y tardía, los cuáles brindan sus transcritos de acuerdo a la etapa infectiva que se esté verificando dentro del ciclo infectivo geminiviral (Gutierrez et al., 2004; Shivaprasad et al., 2005; Ramesh et al., 2017).
La replicación en el núcleo celular vegetal y la transcripción coordinada de sus genes, utilizando la maquinaria biosintética del hospedero, son características que hacen que los begomovirus en general sean un excelente modelo para comprender los procesos que determinan no solo el ciclo celular sino la expresión genética en las plantas (Hanley-Bowdoin et al., 2013). Debido a que los geminivirus han desarrollado eficientes estrategias, no solo para su replicación sino además para la expresión de sus genes, ellos per se tienen un potencial inmenso para su desarrollo como herramientas biotecnológicas. La identificación de múltiples elementos cis-regulatorios presentes en promotores geminivirales, algunos de los cuáles son comunes a aquellos encontrados en diversos promotores de genes vegetales de interés biotecnológico soportan esta idea (Yang et al., 2017).
El objetivo de esta investigación fue evaluar la expresión tejido especifica del promotor del gen AV1 que codifica para la proteína CP de PLDV fusionado al gen reportero GUS y bombardeada con partículas de oro con una pistola de genes de baja presión en tejidos foliares de plántulas de tabaco (Nicotiana tabacum cv. xanthi) cultivadas in vitro. Los resultados muestran que el promotor del gen AV1 de PLDV presenta una fuerte actividad de expresión del gen reportero en las células del mesófilo de las hojas, el cual podría ser usado para conferir expresión tejido específica en plantas transgénicas.
MATERIALES Y MÉTODOS
Análisis bioinformático del promotor del gen AV1 que codifica para la proteína CP de PLDV. Una secuencia de 200 pb que abarca la región promotora del gen AV1 presente en el componente genómico DNA-A del virus de la distorsión de la hoja de maracuyá - PLDV (Número de accesión en GenBank KT899302) (Vaca-Vaca et al., 2017) fue analizada en las bases de datos PlantCARE (Plant Cis-Acting Regulatory Element) (Lescot et al., 2002) y Plant Promoter (Hieno et al., 2014) con el fin de identificar posibles elementos cis-regulatorios.
Diseño de oligos y amplificación por PCR de la región promotor del gen AV1 de PLDV. A partir de la secuencia del componente A de PLDV se diseñaron un par de oligos que amplifican un fragmento de 480 pb que porta la región promotora del gen AV1. El diseño de los oligos se realizó con el software CLC Main Workbench v7.5 (Qiagen®) e incluyó sitios de corte para las enzimas de restricción que permiten su fácil clonación (sitio de restricción HindIII y PstI, respectivamente, subrayados en la secuencia de los oligos): CP MaraF: 5´-TCT-AAA-GCT-TAA-TTT-CTT-AGG-CGG-3´ y CP MaraR: 5´-GGG-CTT-CCT-GTA-CTG-CAG-GG-3´. La mezcla de reacción para la PCR se preparó en un volumen final de 25 μL y las condiciones de PCR en el termociclador fueron: 94 °C por 5 min; 36 ciclos de: 94 °C por 1 min; 52 °C por 1 min; y 72 °C por 1 min; y una etapa final a 72 °C por 15 min. El fragmento amplificado de 480pb fue purificado del gel de agarosa con el kit comercial Wizard® SV Gel and PCR Clean-Up System (Promega®), siguiendo las recomendaciones del fabricante. Posteriormente fue digerido con las enzimas de restricción HindIII y PstI, siguiendo las instrucciones del proveedor.
Construcción de la fusión traduccional CP-PLDV-GUS. La región promotora del gen AV1 amplificado y digerido fue ligado utilizando la enzima T4 DNA ligasa (Invitrogen®) en los sitios HindIII y PstI del vector de expresión pCP27_GUS new (Pulido-Rendón 2014), que porta la secuencia codificante del gen reportero uidA (GUS, β-glucuronidasa) y un terminador de expresión T-Nos del gen nopalina sintasa provenientes del plásmido pBI101 (Jefferson et al., 1987). Esta construcción se denominó CP-PLDV-GUS (Figura 1B). Los productos de la ligación de CP-PLDV-GUS se transformaron en células competentes de Escherichia coli (One Shot, Invitrogen®) por medio de choque térmico y las bacterias fueron cultivadas en cajas de Petri en medio sólido Luria-Bertani (LB) suplementado con el antibiótico Ampicilina (100 mg/mL). A partir de las colonias bacterianas resistentes al efecto del antibiótico, se purificó el plásmido recombinante CP-PLDV-GUS utilizando el QIAprep Spin Miniprep Kit (Qiagen®). Para verificar la presencia del fragmento de 480 pb clonado en CP-PLDV-GUS se realizó una doble verificación: amplificación del fragmento por PCR (de acuerdo a la metodología previamente descrita con los primers CPMaraR / CPMaraF) y liberación del fragmento de 480 pb de CP-PLDV-GUS por digestión con las enzimas de restricción HindIII y PstI. Finalmente, para confirmar que la secuencia del promotor del gen AV1 estuviera fusionada en el sentido correcto con respecto al codón de inicio de la traducción del gen reportero uidA, la construcción CP-PLDV-GUS fue secuenciada en la empresa Macrogen, Inc (Seúl, Corea del Sur).
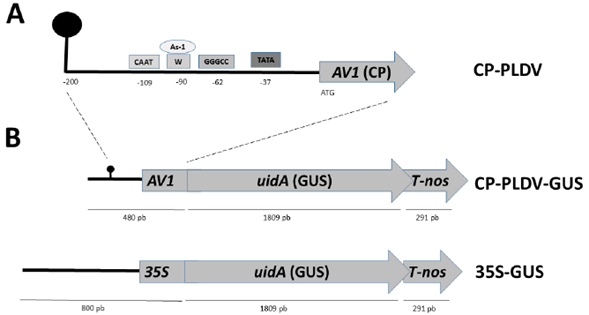
Figura 1 A. Identificación de elementos cis-regulatorios en la secuencia promotor del gen AV1 (CP) de PLDV. Representación gráfica del promotor CP constituido por 200 nt, donde se muestran los diferentes elementos cis-regulatorios. La región de nonanucleótidos (TAATATTAC) típica de los geminivirus se encuentra indicada con un tallo y asa en la posición 200. Los diferentes motivos y cajas, se encuentran dentro de un rectángulo de diferente color y se indica su posición con respecto al ATG del gen AV1. B. Representación gráfica de la construcción génica CP-PLDV-GUS y 35S-GUS. Ambas construcciones contienen el mismo gen reportero uidA (GUS) de 1809 pb con una región terminadora T-nos (Nopalina sintasa) de 291 pb provenientes del plásmido pBI101 (Jefferson et al., 1987).
Purificación del DNA plasmídico que portan las construcciones CP-PLDV-GUS y 35S-GUS. Para la purificación de los plásmidos recombinantes que portan las construcciones CP-PLDV-GUS (pCP-PLDV-GUS, plásmido construido en este trabajo de investigación) y 35S-GUS (pBI121), se utilizó el Plasmid Midi Kit (Qiagen®) siguiendo las instrucciones del fabricante. El plásmido pBI121 (35S-GUS) se utilizó como control positivo de los ensayos de expresión transitoria y fue adquirido comercialmente del proveedor Invitrogen®. El plásmido 35S-GUS porta el gen uidA bajo el control del promotor 35S de CaMV (figura 1B).
Preparación de microcarriers y cartuchos que portan CP-PLDV-GUS y 35S-GUS. La preparación de los microcarriers y cartuchos que portan CP-PLDV-GUS y 35S-GUS se realizó siguiendo los protocolos establecidos por BioRad® para el uso de la pistola de baja presión Helios Gene Gun System (BioRad®), con modificaciones realizadas por López-López et al. (2013).
Bombardeo de CP-PLDV-GUS y 35S-GUS con la pistola de genes Helios® Gene Gun System (BioRad®). Los ensayos de bombardeo de CP-PLDV-GUS y 35S-GUS se realizaron con la pistola de genes de baja presión (Helios® Gene Gun System, BioRad®) sobre hojas de tabaco cultivadas in vitro, siguiendo las condiciones de optimización reportadas por Vaca-Vaca et al. (2014). Las plántulas bombardeadas fueron colocadas en un cuarto de crecimiento a 24 °C durante 24 h.
Detección histoquímica de la expresión transitoria del gen reportero uidA (GUS). La detección histoquímica de la expresión transitoria de GUS bajo el control de los promotores AV1 de PLDV y 35S de CaMV en los tejidos bombardeados, se llevó a cabo siguiendo el protocolo propuesto por Jefferson et al. (1987). Con este propósito, fragmentos de las hojas bombardeadas se incubaron a 37 °C durante 22 h en ausencia de luz en un buffer que contenía: X-gluc (Ácido 5-bromo-4-cloro-3-indol-β-D-glucurónico) (Fermentas®), como sustrato para la enzima β-glucuronidasa. Para decolorar las hojas bombardeadas se utilizó etanol al 70% (v/v). Las hojas fueron completamente decoloradas y conservadas en glicerol al 50% (v/v) a 4 °C en placas de cultivo celular de fondo plano con tapa de baja vaporización (FALCON®). El conteo de los puntos azules observados en los tejidos foliares bombardeado se realizó en un esteromicroscopio (Carl Zeiss®).
Cuantificación de la expresión del gen reportero uidA (GUS). Para evaluar la expresión de GUS se siguió la metodología propuesta por Ruiz-Medrano et al. (1999), que consistente en hacer un conteo discreto de puntos azules presentes en los tejidos previamente bombardeados con los plásmidos que portan las construcciones CP-PLDV-GUS y 35S-GUS.
Análisis estadístico de los datos. Para evaluar la expresión transitoria del gen reportero GUS, se llevó a cabo un ensayo con 11 repeticiones. Cada unidad experimental consistió en una hoja completa de tabaco cultivado in vitro y la variable de respuesta fue el número de puntos azules observados en las hojas bombardeadas con cada construcción. Se evaluaron dos tratamientos: T1, construcción CP-PLDV-GUS; y T2, construcción 35S-GUS (control positivo). Los datos obtenidos fueron sometidos a un análisis comparativo, utilizando una prueba de suma de rangos con signo de Wilcoxon para muestras independientes, para ello se utilizó el programa estadístico Statistical Analysys System (SAS) versión 13.1.
RESULTADOS Y DISCUSIÓN
Identificación de elementos cis-regulatorios presentes en la región promotora del gen AV1 de PLDV.
En la figura 1A se observan los elementos cis-regulatorios identificados en la región promotora del gen AV1 del virus de la distorsión de la hoja de maracuyá, PLDV. Mediante este análisis se identificaron: una caja TATA, típica de promotores eucariotas (Lewin, 2006); y una caja CAAT, que son sitios blancos de reconocimiento para los factores de transcripción que pertenecen a la familia Factor de Unión a la caja CCAAT (CBF, siglas en inglés), también conocido como el Factor Nuclear Y, los cuales están presentes en todos los promotores eucariotas superiores, así como en las proximidades de algunos potenciadores transcripcionales (enhancers) (Laloum et al., 2013).
Río arriba del ATG, a 62 nt se identificó una secuencia consenso GGGCC, involucrada en la expresión de genes del Fitocromo A en Arabidopsis thaliana (Hudson & Quail, 2003). Adicionalmente, se encontró una caja W con una secuencia invariante TGAC, que es el sitio diana para miembros de la familia de factores de transcripción tipo WRKY (Yamasaki et al., 2013). Los factores de transcripción WRKY, son una de las familias más grande de reguladores transcripcionales en plantas, con funciones claves en la respuesta a estreses abióticos tales como: altas y bajas temperaturas, estrés hídrico, altos niveles de CO2, altas concentraciones de ozono y estrés salino (Rushton et al., 2010). Por último, se observó un presumible elemento denominado Factor de activación as-1, con el consenso TGACG, que se encuentra superpuesto sobre la caja W, este factor as-1, actúa como un enhancer dentro del promotor 35S de CaMV (Benfey et al., 1990).
Construcción traduccional de CP-PLDV-GUS.
Se amplificó por PCR un fragmento de 480 pb que porta la región promotora del gen AV1 (CP) presente en el componente A de PLDV unido al codón de inicio de la traducción (ATG) del gen más 141 pb que codifican para 47 aminoácidos de CP (Figura 1A). Este fragmento fue clonado al gen reportero uidA (GUS) para obtener la construcción traduccional CP-PLDV-GUS (Figura 1B). Se obtuvieron tres clones: pCP-PLDV-GUS 2, pCP-PLDV-GUS 15 y pCP-PLDV-GUS 16; y su secuenciación mostró que los tres clones eran idénticos. Adicionalmente, el análisis de la secuencia de nucleótidos de los clones CP-PLDV-GUS confirmó la correcta fusión del promotor del gen AV1 al gen reportero uidA.
Actividad y expresión específica de tejido del promotor del gen AV1 (CP) de PLDV.
La actividad de los promotores de CP de PLDV y 35S de CaMV evidenciada en la expresión del gen reportero GUS, mostró un total de 439 puntos azules con un promedio de 39,91 para la construcción CP-PLDV-GUS (Figura 2A, B y C); mientras que para la construcción 35S-GUS, se obtuvo un total de 696 puntos azules con un promedio de 63,27 (Figura 2D, E y F). En la Figura 2G, H e I se muestra el control negativo, hojas de tabaco sin bombardear con ausencia de puntos azules, indicando que los puntos azules observados son causados por las construcciones bombardeadas sobre las hojas. Los datos del ensayo con la construcción CP-PLDV-GUS, presentaron una distribución simétrica y normal (Figura 3A). Sin embargo, para la construcción 35S-GUS la distribución de datos es asimétrica y se alejan de la distribución normal, debido a que presenta un dato atípico (Figura 3B). Por ello, para el análisis estadístico comparativo de la actividad de expresión entre el promotor del gen AV1 de PLDV y 35S de CaMV, se utilizó una prueba no paramétrica denominada "Prueba con signo de Wilcoxon", con un nivel de significancia de 95% e hipótesis nula (H0), Media 1 = Media 2; hipótesis alterna (H1), Media 1 < Media 2. Dicho análisis demostró que el valor de P fue igual a 0,1075. En consecuencia, como valor P > α=0.05, se acepta la H0 (Figura 4). Por tanto, existe evidencia muestral suficiente para confirmar que tanto el promotor del gen AV1 del PLDV y 35S de CaMV presentan una actividad de expresión similar, bajo las condiciones en que se realizó este experimento.
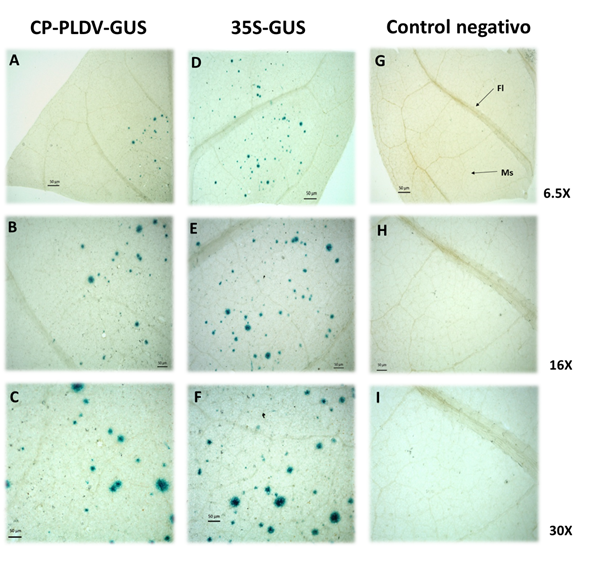
Figura 2 Expresión transitoria de tejido del gen GUS fusionado a la región promotora de CP de PLDV en hojas de tabaco bombardeadas in vitro. A, B y C, hojas bombardeadas con la construcción CP-PLDV-GUS; D, E y F, hojas bombardeadas con el control positivo de expresión, pBI121 (Construcción 35S-GUS); G, H e I, hojas no bombardeadas (control negativo). Observación en Estereoscopio Carl Zeiss a 6.5, 16 y 30X. Con una flecha se indica la localización de las células de Floema (Fl) y Mesofilo (Ms) en las hojas.

Figura 3 Distribución de datos, número de puntos azules observados en las hojas bombardeadas con la construcción génica CP-PLDV-GUS y 35S-GUS, respectivamente, de acuerdo a la prueba con signo de Wilcoxon. Para la construcción CP-PLDV-GUS la distribución de datos es simétrica (A), mientras que para la construcción 35S-GUS es asimétrica, siendo el dato atípico 208 puntos azules observados (B).
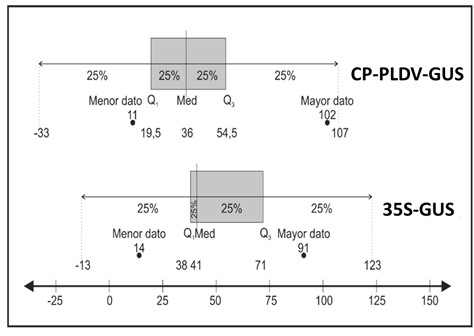
Figura 4 Comparativa de la distribución de datos de la prueba no paramétrica Prueba con signo de Wilcoxon para la construcción génica CP-PLDV-GUS y 35S-GUS. El 50 % de los datos para la construcción CP-PLDV-GUS está entre 19,5 a 54,5 puntos azules, con una mediana de 36; mientras que el 50 % de los datos para 35S-GUS está entre 38 a 71 puntos azules y una mediana de 41.
El análisis de la expresión tejido específica del promotor del gen de la proteína de la cápside de PLDV fusionado al GUS estuvo principalmente limitada a las células del mesófilo (Figura 2A, B y C). Este resultado es similar a la expresión tejido específica reportada para el promotor del gen CP del virus del mosaico amarillo de la papa (PYMV-Col) (Pulido-Rendón, 2014); del virus del enanismo del frijol (BDMV) (Levy & Tzafira, 2010); y del virus del enrollamiento de la hoja del repollo (CabLCuV) (Borah et al., 2016). Este resultado es relevante si se tiene en cuenta que la gran mayoría de los geminivirus presentan un tropismo de tejido principalmente hacia las células del floema (Sunter & Bisaro, 1997; Mazithulela et al., 2000; Vuorinen et al., 2011; Folimonova & Tilsner, 2018). La expresión tejido específica de los geminivirus bien sea por tejidos floemáticos o por tejidos del mesófilo, son el resultado de procesos co-evolutivos propios de la interacción virus-planta y que inciden en el desarrollo del ciclo infectivo del patógeno. Los resultados de actividad y expresión del promotor de CP de PLDV en las células del mesófilo de las hojas de tabaco indican que este promotor podría ser usado para conferir expresión tejido específica en plantas transgénicas de interés comercial. Es necesario realizar ensayos en plantas transgénicas de tabaco con la construcción CP-PLDV-GUS para analizar la expresión estable del transgén en el individuo vegetal conforme se da el desarrollo del mismo.
En la figura 2D, E y F, se observa que el promotor 35S de CaMV actuó como un promotor constitutivo fuerte, tal y como se esperaba para un control positivo (Benfey et al., 1990); esto es debido a que presenta una organización modular e interacciones sinérgicas entre los elementos cis-regulatorios. Igualmente, se han encontrado elementos individuales de expresión tejido específica del dominio A (-90 a +8) y del dominio B (-343 a -90). El dominio A, confiere expresión principalmente en tejidos de la raíz y presenta un factor denominado factor de activación (as)-1 que actúa como un enhancer, mientras que el dominio B, confiere expresión en la mayoría de células de la hoja, tallo y tejido vascular de la raíz (Benfey et al., 1989; 1990). Es interesante, que mediante el análisis bioinformático de elementos cis-regulatorios en el promotor de CP de PLDV (Figura 1) se identificó un elemento as-1 análogo al descrito previamente por Benfey et al. (1990) en el promotor 35S de CaMV. Para comprobar esto, es necesario realizar ensayos de mutaciones de este elemento y analizar su efecto en la actividad del promotor de CP de PLDV. Un enfoque similar debería seguirse para evaluar el posible papel de los otros elementos cis-regulatorios identificados en la región promotora de CP de PLDV, esto con el fin de para validar su posible papel biológico en la actividad de este promotor (figura 1A y 2A, B, C).
Estudios en el promotor del gen C1 del virus de la hoja rizada de algodón de Burewala (CLCuBuV), mostraron una expresión transitoria fuerte del gen reportero GUS en hojas de N. tabacum y Gossypium hirsutum, transformadas por agroinfiltración, y exhibió una actividad GUS de dos a tres veces mayor que el promotor 35S del CaMV (Ashraf et al., 2014). Además, Khan et al. (2015), demostraron una fuerte actividad del gen reportero GUS en hojas de plantas transformadas de N. tabacum cv. xanthi, bajo el control del promotor del gen AC1 (Rep) y AV1 (CP) del virus CLCuBuV.
CONCLUSIONES
Se reporta por primera vez que el promotor del gen AV1 (CP) del virus de la distorsión de la hoja de maracuyá es capaz de dirigir de manera eficiente la transcripción del gen reportero uidA (GUS), lo cual fue evidenciado por la presencia de puntos azules discretos presentes en las hojas de tabaco bombardeadas.
Los resultados de los análisis estadísticos confirman que tanto el promotor del gen AV1 de PLDV como del 35S de CaMV, presentan una actividad promotora aproximadamente similar. Finalmente, el promotor del gen AV1 mostró una fuerte actividad de expresión tejido específica del gen reportero a nivel de las células del mesófilo de las hojas, el cual podría ser usado para conferir expresión localizada de un transgén de interés particular a nivel de este tipo celular cuando las necesidades biotecnológicas lo requieran.















