INTRODUCCIÓN
La contaminación ambiental se ha categorizado como el principal problema que afecta la salud de todas las formas de vida, la pérdida de la calidad del aire, agua y suelo se ha evidenciado a través del tiempo. Los metales pesados (MP) son los principales contaminantes ambientales que presentan efectos negativos en la salud, considerados altamente tóxicos y están presentes en todos los compartimentos ambientales (Pérez et al., 2015). El mercurio (Hg), es uno de los MP de mayor toxicidad (Ramírez, 2008), ya que puede generar daños en órganos, sistema nervioso central, renal, pulmonar, cardiovascular, enfermedades autoinmunes, reducción del crecimiento y desarrollo y en altas cantidades, la muerte (Valderas et al., 2013; Crowe et al., 201 7); El mercurio en su estado Hg2+, puede ser reducido a Hg0 mediante la enzima citoplasmática mercurio reductasa (MerA) junto a la enzima organo-mercurio liasa; si son compuestos organomercuriales, específicamente el mecanismo consiste en proteína liasa organomercurial (MerB) que transforma el metilmercurio (CH3Hg+) a Hg2+ que es menos tóxico (Wu et al., 2010). Se han descrito otro tipo de enzimas tales como cromato reductasa, citocromo P450, para el cromato y ArsC para arsénico (Marrero et al., 2010).
El Níquel (Ni) por su parte, es un elemento esencial para los seres vivos que a niveles bajos actúa como cofactor enzimático, pero al aumentar los niveles puede volverse altamente tóxico causando pérdida de peso corporal, anemia, afecciones cardiacas y hepáticas, trastornos gastrointestinales, irritación de la piel, fibrosis pulmonar y cáncer de pulmón (Pahlavanzadeh et al., 2010); para el Ni se emplea un sistema de tolerancia denominado sistema de expulsión de cationes (CDF), presente en Bacteria, Archaea y Eukarya, las cuales, son transportadoras de Zn pero pueden expulsar MP como Cd, Co, Ni e incluso Fe y cuentan con seis segmentos transmembranales (STM), que funcionan como homodímeros en la membrana interna y expulsan los MP al espacio periplásmico, este transporte de iones se encuentra asociado con un proceso quimiostatico que se relaciona intercambio con protones en el que participan residuos de histidina, aspartato y glutamato (Cervantes et al., 2006).
En el mundo diariamente se calculan dos mil millones de metros cúbicos de aguas contaminadas, lo que pone en riesgo la calidad de este recurso. En Colombia, los aportes generados por la industrialización, ganadería, agricultura, minería, además del crecimiento de la población, ha elevado el interés por los estudios de calidad del agua (Reyes et al., 2016). Los niveles de MP máximos permitidos en agua residual por el Ministerio de Ambiente y Desarrollo Sostenible (2015) son de 0,5 y 0,02 mg/L para Ni y Hg, respectivamente, lo cuales están por encima de los permitidos por la Agencia de Protección Ambiental de los Estados Unidos son de 0,2 y 0,00003 mg/L, también para Ni y Hg, respectivamente (Nguyen et al., 2013).
Con el fin de mitigar los impactos negativos causados por los MP, se han implementado diferentes métodos fisicoquímicos que tienen la desventaja de ser altamente costosos, poco eficientes y pueden generar daños irreversibles en suelo y agua, por ende en los seres vivos que se encuentren en ellos. Las estrategías biotecnológicas surgen como excelentes alternativas; siendo la fitorremediación una de las técnicas implementadas que representa bajos costos y garantiza el cuidado del medio ambiente durante los procesos de rehabilitación. Las bacterias endófitas (BE), son definidas como aquellas que viven dentro de los tejidos de las plantas, sin generarle enfermedad (Porras y Bayman, 2011).
La interacción entre plantas y bacterias tolerantes favorecen la eficiencia de los procesos de fitorremediación, dada por la capacidad de las bacterias de transformar enzimáticamente los contaminantes, convirtiéndolos a su forma menos tóxica (Doncel et al., 2016). Las bacterias juegan un papel importante en la transformación de MP ya que influencian su biodisponibilidad y remediación, pueden alterar la toxicidad, solubilidad en agua y la movilidad del elemento (Bolan et al., 2014). La raíz es la principal ruta de entrada y acumulación de MP, por lo tanto, las bacterias que se encuentran presentes en este tejido son aquellas que se posee la maquinaria bioquímica o genética que le permite sobrevivir a estos contaminantes (Marrero et al., 2012). Luo et al. (2011), sostienen que es posible que las BE se adapten a vivir bajo estrés constante por la presencia de metal pesados, ganando tolerancia. Ésto puede deberse, a que cuando una célula se enfrenta a grandes concentraciones de algún metal pesado los transporta hasta el citoplasma en forma de cationes vía transportadores del sistema inespecífico celular; además, se activan otros mecanismos como el empleo de trasportadores de membranas que expulsan estos iones al ambiente, modificaciones enzimáticas para cambiar el estado redox y la incorporación de iones metálicos en las células; sin embargo, es posible que se generen mutaciones debido a la presión ejercida por el medio contaminado (Marrero et al., 2010; Martínez et al., 2010). Existe gran variedad de BE que mejoran el estado nutricional de las plantas mediante la fijación de nitrógeno (FBN), solubilización de fosfatos (SF) y producción de sideróforos (PS) necesario para la captación de nutrientes esenciales (Sessitsch et al., 2013); la capacidad del microrganismo producir el sideróforo, se puede demostrar empleando el medio cromo azurol-S (CAS) debido a que el sideroforo producido remueve el hierro del complejo creando un halo color naranja (García et al., 2012). Dentro de las utilidades más importantes de los sideróforos está, ayudar a las plantas a reducir la toxicidad generada por MP en medios contaminados y por ende optimizar los procesos de fitorremediación participando en la reducción del efecto inhibitorio de algunos MP sobre la síntesis de auxinas (Rajkumar et al., 2009). Las BE también son capaces de eliminar fitopatógenos y remover contaminantes optimizando los procesos de fitorremediación (Pérez y Chamorro, 2013).
La subregión fisiográfica de la Mojana se encuentra conformada por municipios pertenecientes a los departamentos de Antioquía, Bolívar, Córdoba y Sucre; se caracteriza principalmente por ser parte de la planicie aluvial de la depresión Momposina donde finalmente confluyen los ríos Cauca, Magdalena, San Jorge, Caribona y Nechí. Esta región se encuentra conformada por humedales que funcionan como zonas de regulación de corrientes de los ríos Magdalena, Cauca y San Jorge. Sin embargo, estos ríos se encuentran afectados por la minería del oro en la que se utiliza Hg durante la extracción del preciado metal. En el caso del Ni, existen seis yacimientos mineros cercanos a cuerpos de agua, tres en el departamento de Córdoba y tres en Antioquia, por lo que también afectan negativamente la Mojana Sucreña (Pérez et al., 2015). Los cuerpos de agua que hacen parte de esta región, son ricos en fauna y flora, albergan gran densidad de macrófitas que toleran condiciones de contaminación, por lo cual, esta flora constituye una gran materia prima de investigación científica y biotecnológica. Aunque existen estudios que indican la importancia de especies de macrófitas acuáticas utilizadas en procesos de fitorremediación de MP, hasta la fecha no existe reportes de BE asociadas con macrófitas acuáticas con capacidad de tolerar Ni y Hg. Es por ello, que esta investigación determinó in vitro la capacidad de tolerancia a MP de BE asociadas a plantas acuáticas presente en las ciénagas de San Marcos, San Benito Abad y Ayapel y evaluar su actividad promotora de crecimiento (APC).
MATERIALES Y METODOS
Área de estudio
El área de estudio fue seleccionada mediante levantamiento de información con reporte de alta contaminación con Hg y Ni, por lo cual, se eligió el río San Jorge que irriga las ciénagas San Benito Abad y San Marcos en el departamento de Sucre y la ciénaga Ayapel en Córdoba. El muestreo se realizó durante el mes de mayo de 2017 de forma aleatoria en zig-zag, colectando 10 plantas completas de cada especie. Las muestras fueron etiquetadas y almacenadas a 25°C, se procesaron dentro de las siguientes 24 h. Una parte de los especímenes vegetales fueron llevados al herbario de la Universidad de Sucre para corroborar la identidad taxonómica.
Aislamiento de BE
Las BE fueron aisladas en el laboratorio de Investigaciones microbiológicas de la Universidad de Sucre a partir de los tejidos; raíz, tallo y hojas, siguiendo el protocolo propuesto por Pérez et al. (2010), que consiste en realizar una desinfección superficial de cada tejido. Seguidamente, los tejidos fueron macerados y transferidos a 9 mL de caldo peptona e incubados a 30 ± 2 °C por 24 h. Después se realizaron diluciones seriadas hasta 108, se inocularon 100 μL en agar R2A e incubaron a 30 ± 2 °C por 72 h. La densidad poblacional de BE por tejido (UFC/g de tejido), fue estimada mediante la técnica de conteo directo de colonias, seleccionándolas según su forma, aspecto de la superficie, color y tamaño. Los morfotipos seleccionados fueron purificados y mantenidos en agar R2A.
Evaluación in vitro de la tolerancia a Hg y Ni de BE
El ensayo consistió en inocular cada morfotipo seleccionado en agar R2A suplementado con HgCl2 y NiCl2 a concentraciones de 50, 100, 150 y 200 mg/L e incubados a 32 °C por 8 días. Luego se procedió a la observación de la presencia o ausencia del crecimiento bacteriano en cada caja (Rajkumar et al., 2013).
Determinación in vitro de la APC de las BE Fijación biológica de nitrógeno (FBN)
La capacidad cualitativa de la FBN se realizó por siembra de colonias en medio BURK (Park et al., 2005; Tejera et al., 2005) carente de nitrógeno. Los resultados fueron observados según el crecimiento de la BE en medio.
Solubilización de fosfato (SF)
La evaluación de la actividad SF se llevó a cabo sobre la superficie del medio NBRID (Dawwam et al., 2013), el cual, contiene sales de fosfato de calcio y púrpura de bromocresol como indicador de pH. A los 6 días de siembra fueron seleccionadas las colonias bacterianas que formaron un halo transparente, indicando el proceso de acidificación del medio positivo para actividad SF.
Producción de sideróforos (PS)
La PS fue evaluada en medio cromo azurol-S (CAS) propuesto por Schwyny y Neilands (1987). Las cepas fueron inoculadas e incubadas durante 7 días a 30°C.
Extracción DNA, Amplificación y Secuenciamiento
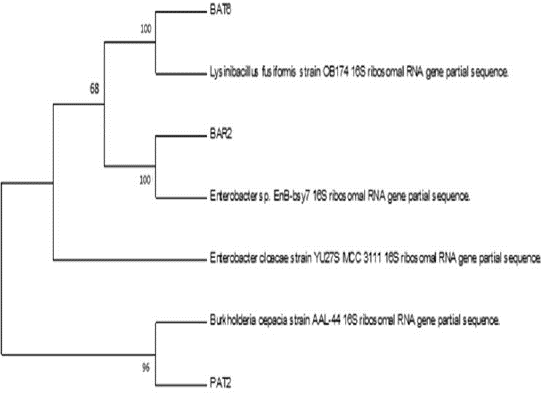
Los morfotipos de BE que mostraron mayor tolerancia a Hg y Ni fueron identificados molecularmente. Inicialmente se realizó tinción de Gram. Se siguió el protocolo descrito por Oliveira et al. (2013), para la extracción de rDNA 16S. La amplificación de los fragmentos se realizó por PCR usando oligonucleótidos específicos para grupos de eubacterias. Los productos fueron enviados a secuenciamiento a la empresa Macrogen (Seúl, Corea del Sur). Las entidades de las secuencias nucleotídicas obtenidas fueron comparadas con las almacenadas en bancos de datos de la National Center For Biotechnology information (NCBI). El alineamiento de las bases fue realizado por medio del programa clusteal W y el análisis y correlación con el programa MEGA 6®. Las inferencias filogenéticas fueron obtenidas por medio de distancia y máxima parsimonia de Neighbor-joining con prueba bootstrap (1.000 réplicas). Los árboles para el análisis filogenético de las secuencias fueron reconstruidas con el programa MEGA 6.0®
Análisis Estadístico
Con los resultados se estableció el criterio de normalidad con la prueba de Shapiro Wilks. Posteriormente, se realizó un ANOVA para la densidad de BE (UFC/g de tejido) y tolerancia a MP mediante un DCA con arreglo factorial 3x3x3x5 y 2x4x182 respectivamente. Las diferencias estadísticas se determinaron con la prueba de Tukey (HSD) (p-valor≤ 0,05). Todos los ensayos se realizaron por triplicado y procesados en el software InfoStat versión libre.
RESULTADOS Y DISCUSIÓN
Identificación del material vegetal
Las tres especies colectadas corresponden a Neptunia oleracea Lour, Eichhornia crassipes (Mart.) Solms y Paspalum repens Bergius. E. crassipes es una planta acuática flotante, aunque es considerada maleza, se ha empleado en procesos de fitorremediación, por poseer gran capacidad de crecer en aguas altamente contaminadas por MP (Mahamadi, 2011). Algunas especies de Paspalum son importantes a nivel económico por ser considerado un excelente pasto (Ortiz et al., 2015). Pérez et al. (2016), aislaron BE de P. arundinaceum con capacidad de tolerar hasta 400 mg/L de Hg.
Densidad poblacional de BE
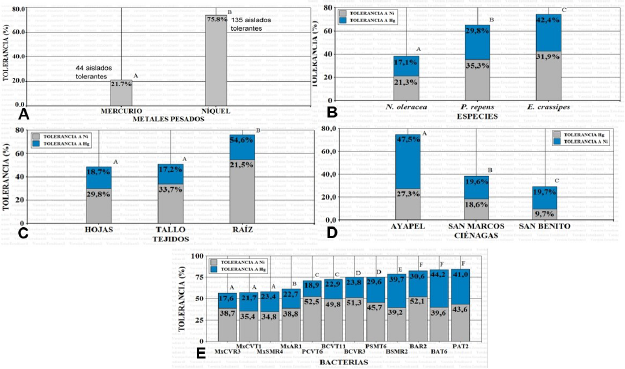
Un total de 182 morfotipos de BE fueron aislados de las diferentes plantas colectadas en las tres ciénagas muestreadas. El ANOVA indica diferencias significativas entre las especies vegetales, el tipo de tejidos analizado y las ciénagas evaluadas, así como entre sus interacciones (figura 1), hallando los mayores promedios de densidad poblacional de BE en la especie E. crassipes con 4,0x1010 UFC/g de tejido y en menor medida en P. repens con 2,8 x1010 UFC/g de tejido (figura 1. A). Referente a los tejidos, los niveles más altos los mostraron las hojas con 4,1x1010 UFC/g de tejido y por último las raíces con 2,1 x1010 UFC/g de tejido (figura 1. B).Con respecto a las ciénagas, la densidad más alta fue en San Benito Abad con 4,9x1010 UFC/g de tejido, seguida de San Marcos con 2,7x1010 UFC/g de tejido y finalmente Ayapel con 2,1x1010 UFC/g de tejido (figura 1. C).
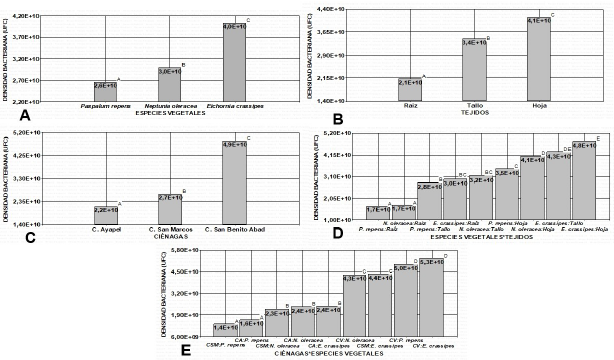
Figura 1 Densidad poblacional de BE. A. Por especies vegetales. B. Por tejidos vegetales. C. Por ciénagas (San Marcos (CSM), Ayapel (CA), Ciénaga de San Benito Abad (CV). D. Interacción entre especie vegetal y tejido. E. Interacción entre ciénagas y especies vegetales.
En la interacción especies vegetales y tejidos no se hallaron diferencias significativas entre los tallos y las hojas de E. crassipes mostrando este último los mayores promedios con 4,8x1010 UFC/g de tejido (figura 1. D). Por último, la interacción entre las ciénagas y las especies vegetales no se hallaron diferencias estadísticas entre P. repens y E. crassipes de San Benito Abad (CV), sin embargo, esta última especie, evidenció los mayores promedios de densidad bacteriana con 5,3x1010 UFC/g de tejido (figura 1. E).
Evaluación in vitro de la tolerancia a Hg y Ni de BE
Los resultados de la prueba de tolerancia de BE a diferentes concentraciones 50, 100, 150 y 200 mg/L para Hg y Ni respectivamente, muestran diferencias significativas entre los MP, las especies vegetales, sus tejidos, las ciénagas y los morfotipos bacterianos. Se evidencia que del total de las BE aisladas (182 morfotipos), fueron tolerantes en su mayoría a concentraciones de 75,8% Ni (135 morfotipos) a diferencia de Hg 21,7% (44 morfotipos) (figura 2. A); sin embargo, se aislaron BE tolerantes a los dos metales (44 morfotipos) . Las BE procedentes de E. crassipes fueron en general más tolerantes (31,9% crecieron en Ni y 42,4% en Hg) y los morfotipos menos tolerantes procedían de N. oleracea (21,3% crecieron en Ni y 17,1% Hg) (figura 2. B). Con respecto a los tejidos, los morfotipos bacterianos aislados de raíces mostraron mayor tolerancia (21,5% crecieron en Ni y 54,6% en Hg), aunque no se hallaron diferencias entre el tallo y las hojas (figura 2. C). Con respecto a la ciénagas, los nieveles de tolerancia mas altos fueron de aislados procedentes de Ayapel, seguidos de los originarios de San Marcos y San Benito Abad, con niveles de crecimiento en Ni de 47,5%, 19,6% y 19,7% respectivamente (figura 2. D). Asimismo, de el total de aislados (182 morfotipos), solo 3 presentaron los mejores promedios de tolerancia en los MP evaluados (Ni y Hg), correspondientes a los morfotipos BAR2, BAT6 y PAT2; en los cuales, no se hallaron diferencias significativas. Sin embargo; BAT6 fue el más tolerante a Hg con 44,2% y BAR2 a Ni con 52,1% (figura 2. E).
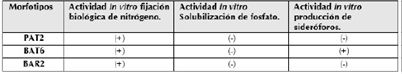
Determinación in vitro de la APC de las BE.
Los resultados de la APC de los morfotipos más tolerantes se muestran en la siguiente tabla.
Análisis molecular
Los resultados muestran homología del 100% entre el asilado BAT6 con la especie Lysinibacillus fusifomis y BAR2 con el género Enterobacter y homología del 96% entre PAT2 y Burkholderia cepacia (figura 3).
L. fusifomis (BAT6) habita en suelo y ha sido aislada como BE, es considerada control biológico para enfermedades que se presentan en el cacao (Melnick et al., 2011). PAT2 corresponde a B. cepacia, la cual es ubicua del suelo y agua (Glowicz et al., 2018) y BE de Lupinus luteus con resistencia a Co, Cu, Cd, Hg, Ni, Pb y Zn, destacando la capacidad para ayudar a su hospedadora a adaptarse a condiciones desfavorables (Ma et al., 2016). Además, posee APC mediante la fijación de nitrógeno, sideróforos, solubilización de fosfato, biocontrol de fitopatógenos y biorremediación (Mathew et al., 2014; Ghosh et al., 2016; Rojas et al., 2018).
BAR2 pertenece al género Enterobacter, cuyas especies tienen la capacidad para remediar Hg2+(Sinha et al., 2012) y específicamente E. cloacae en consorcio remueve Cd, Cu, Pb y Zn (Ojuederie y Babalola, 2017). Numan et al. (2015) señalaron que especies de Enterobacter poseen APC como ACC desaminasa, SF, producción de IAA y PS demostrando que estas bacterias desempeñan un papel en la mejora de la eficiencia de la fitorremediación de los suelos degradados por MP.
CONCLUSIONES
Tres morfotipos bacterianos mostraron alta capacidad de tolerar In vitro diferentes concentraciones de mercurio y níquel con 84,6% para PAT2, 83,8% para BAT6, 82,7% para BAR2. Así mismo, los aislados que presentaron tolerancia en los dos metales evaluados fueron identificados como Enterobacter sp, Lysinibacillus fusifomis y Burkholderia cepacia. Por tal motivo, se propone su capacidad para asistir los procesos de fitorremediación y de esta manera, ser optimizados.
En este estudio se reportan por primera vez la presencia de Lysinibacillus fusifomis y Burkholderia cepacia asociadas a macrófitas en cuerpos cenagosos de Sucre y Córdoba.