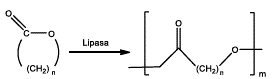
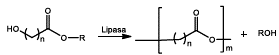INTRODUCCIÓN
La síntesis enzimática de polímeros ofrece ventajas como la eficiencia catalítica, alta enantio-, quimio- y regio-selectividad, versatilidad en las condiciones de reacción (temperatura, medio de reacción), además, dado que las enzimas provienen de fuentes renovables su uso conlleva un impacto ambiental mínimo (Gross et al., 2001). Entre los diferentes tipos de enzimas, las lipasas han sido las más ampliamente usadas en síntesis de materiales poliméricos, esto es debido al carácter polifacético de este tipo de enzimas el cual se ve influido por el tipo de organismo del que se obtienen (Salihua & Alama, 2015), por ejemplo, una muestra de lipasa aislada de Talaromy-ces thermophilus puede usarse en condiciones de pH 911 y entre 50-60°C para hidrólisis de ácidos grasos y conserva su actividad en la presencia de surfactantes (Romdhane et al., 2010), mientras que otra lipasa obtenida de Candida rugosa puede usarse en condiciones de pH ácido (<4) para la hidrolisis del 2-cloroetil éster del Ketoprofeno (Liu et al, 1999). Una diferencia entre las lipasas y otras enzimas es que pueden conservar o incluso mejorar su actividad enzimática con respecto a una reacción específica en disolventes orgánicos, estas ventajas han sido explotadas por industrias como la alimentaria (Ahmed et al., 2010; Fickers et al., 2011; Mhetras et al., 201 0; Park et al., 2011; Pérez et al., 2011; Van Kempen et al., 201 2), farmacéutica (Fickers et al., 2011; Hor-chani et al., 2012; Liu et al., 1999; Piotrowska & Sob-czak, 2015), de biodiesel (Li & Yu, 2014; Mander et al., 2012; Yoo et al., 2011), detergentes (De Lourdes Moreno et al., 2009; Romdhane et al., 2010) entre otras. La síntesis enzimática de polímeros tuvo origen en una casualidad, en 1983 mientras se investigaba en la hidrólisis enzimática de aceite de castor, se evidenció la aparición de dímeros y trímeros del ácido ricinoleico (Sususmo Okumura et al., 1983), cabe resaltar que no fue sino hasta 1985 cuando se sintetizó el primer polímero por vía enzimática, a partir del Ácido 10-hidroxidecanoico catalizado por lipasa de Pseudomonas fluorescens modificada con polietilenglicol (PEG) (Ajima et al., 1985), en los años siguientes se harían las primeras síntesis de polímeros catalizado por lipasas de origen animal como la Lipasa de páncreas porcino (PPL) con la cual se hicieron avances en cuanto a polimerización de ω-hidroxiésteres y 6-caprolactona para obtención de polímeros lineales (Knani et al., 1993; Shuai, Jedlinski, et al., 1999a), desde sus inicios hasta la actualidad ha habido numerosos avances en la síntesis enzimática de polímeros tales como el uso de enzimas inmovilizadas (Miranda et al., 2014; Ferreira et al., 2018), la modificación de organismos mediante ingeniería genética, la utilización en conjunto con técnicas químicas o la búsqueda de materias primas renovables como sustratos. Este trabajo es una recopilación de los desarrollos más significativos en cuanto a la síntesis enzimática de polímeros catalizada por lipasas y pretende dar una perspectiva tanto del desarrollo actual como del futuro posible en esta área de la química.
PRIMEROS AÑOS
Como en todo campo de investigación la información para la síntesis enzimática de polímeros en un principio era limitada, así que los primeros artículos al respecto consolidan la utilidad de la nueva técnica para la formación de polímeros lineales y ramificados en 3 tipos de reacciones 1) Trans-esterificación de diácidos con dioles, 2) Trans-esterificación de hidroxiácidos y 3) Polimerización por apertura de anillo de lactonas. Una limitación grande para los primeros investigadores fue la fuente de lipasas ya que eran pocas las opciones comerciales que se tenían en la época, a su vez dada la especificidad de la relación enzima-sustrato es necesario tratar cada reacción como una síntesis diferente en la que se estudian parámetros como el rendimiento, solubilidad, facilidad de recuperación, entre otros. En esta sección se muestran los primeros avances en la química enzimática de polímeros catalizada por lipasas.
ÉSTERES
En 1986 se empleó ácido 12-hidroxioctadecanoico, ácido 12-hidroxi-cis-9-octadecenoico, ácido 16-hidroxihexa-decanoico y ácido 12-hidroxidodecanoico y mediante una reacción a 35°C en agua, hidrocarburos alifáticos o benceno con lipasa de Candida cylindracea (lipasa CC) como catalizador, se obtuvieron oligómeros con peso molecular promedio en número alrededor de(
 ) 1000g/mol y rendimientos tan altos como el 99%, a su vez se evidenció que la reacción ocurría a mayor velocidad y el producto tenía mayor peso molecular en los sustratos que poseen un grupo hidroxilo secundario (Matsumura & Takahashi, 1986).
) 1000g/mol y rendimientos tan altos como el 99%, a su vez se evidenció que la reacción ocurría a mayor velocidad y el producto tenía mayor peso molecular en los sustratos que poseen un grupo hidroxilo secundario (Matsumura & Takahashi, 1986).
Dos investigaciones llevadas a cabo en 1992, emplearon hidroxiácidos para polimerización enzimática, en la primera Knani et al. (1993), emplearon hidroxiácidos de cadenas de 5 y 6 carbonos, los cuales fueron exitosamente polimerizados a temperaturas de 30°C y 70°C, usando PPL como catalizador, la influencia de la temperatura se observó en el grado de polimerización, obteniendo polímeros
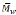 de alrededor de 250 dalton independientemente del disolvente utilizado para la primera temperatura, mientras que a 70°C el
de alrededor de 250 dalton independientemente del disolvente utilizado para la primera temperatura, mientras que a 70°C el
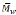 varía notablemente al usar diferentes disolventes, obteniendo valores de 200 y 295 para acetonitrilo y benceno respectivamente; valores máximos de 1130 en isooctano y 1035 en diisopropil éter, lo cual probó la influencia tanto del disolvente como de la temperatura para esta reacción, la dependencia de la actividad catalítica de las enzimas sobre la polaridad de los disolventes es atribuida mayoritariamente a la habilidad de los disolventes para cambiar la forma tridimensional de la enzima. O'Hagan & Zaidi (1993) estudiaron el comportamiento de la polimerización en hidroxiácidos de cadenas entre 6 y 12 carbonos, a 55°C con la implementación de tamices moleculares en el medio de reacción y catalizado por Lipasa CC, esta enzima no polimeriza los sustratos de cadena corta, mientras que se obtienen polímeros de 12 unidades para el ácido 12-hidroxidodecanoico y de 52 unidades para el ácido 10-hidroxidecanoico, lo cual lleva a la conclusión de que para el sitio activo de esta enzima una longitud de cadena de 10 unidades es ideal.
varía notablemente al usar diferentes disolventes, obteniendo valores de 200 y 295 para acetonitrilo y benceno respectivamente; valores máximos de 1130 en isooctano y 1035 en diisopropil éter, lo cual probó la influencia tanto del disolvente como de la temperatura para esta reacción, la dependencia de la actividad catalítica de las enzimas sobre la polaridad de los disolventes es atribuida mayoritariamente a la habilidad de los disolventes para cambiar la forma tridimensional de la enzima. O'Hagan & Zaidi (1993) estudiaron el comportamiento de la polimerización en hidroxiácidos de cadenas entre 6 y 12 carbonos, a 55°C con la implementación de tamices moleculares en el medio de reacción y catalizado por Lipasa CC, esta enzima no polimeriza los sustratos de cadena corta, mientras que se obtienen polímeros de 12 unidades para el ácido 12-hidroxidodecanoico y de 52 unidades para el ácido 10-hidroxidecanoico, lo cual lleva a la conclusión de que para el sitio activo de esta enzima una longitud de cadena de 10 unidades es ideal.
Ohya et al. (1995), estudiaron sistemáticamente la síntesis enzimática de polímeros de 4 α-hidroxiácidos, ácido glicólico, ácido láctico, ácido 2-hidroxiburírico y ácido málico, diferentes condiciones, sustratos, disolventes, 8 enzimas fueron probadas y se llegó a la conclusión de que el mejor rendimiento (53%) para enzimas no modificadas se obtuvo con ácido glicólico en ciclohexanona, lo que indica que el disolvente ideal proporciona una buena solubilidad de los sustratos y no es miscible con el agua, entre las 8 hidrolasas probadas se logró la mayor conversión al usar lipasa de Aspergillus niger, adicionalmente se monitoreo la reacción al usar etil-glicolato en lugar de ácido glicólico, logrando incrementos en la conversión con 6 de las 8 enzimas. Por otra parte, se hicieron ensayos con enzimas modificadas con PEG, esta técnica de modificación permite una mayor solubilidad y los resultados indican que la conversión aumenta alcanzando una conversión del 65% cuando se utiliza etil-glicolato y estearasa de hígado de cerdo modificada con PEG de bajo peso molecular.
El ácido poliláctico (PLA) se sintetiza a partir de ácido láctico también hace parte de este tipo de reacciones, pero debido a su alto impacto se menciona en una sección posterior.
TRANS-ESTERIFICACIÓN DE DIÁCIDOS Y SUS DERIVADOS CON DIOLES.
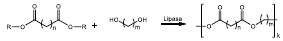
Esquema 2 Reacción general de polimerización por condensación de diácidos o sus derivados con dioles.
Wallace & Morrow (1989a, 1989b), investigaron en la síntesis de polímeros ópticamente activos a partir del ácido trans-β-hidromucónico, un diácido, previamente activado con 2,2,2-tricloroetanol en presencia de N,N-diciclohexilcarbodiimida (DCC) y 1,4-butanodiol, la reacción se llevó a cabo a temperatura ambiente en éter etílico catalizada por PPL, para el sustrato quiral se realizó la epoxidación del diácido con ácido m-cloroperoxibenzoico (m-CPBA) produciendo una mezcla racémica, la polimerización se llevó a cabo con atmósfera de nitrógeno durante 3.5 días aun cuando el 1,4-butanodiol se consumió a las 6 h de reacción, al finalizar la reacción se obtuvieron 2 productos, los resultados fueron que el producto 1 corresponde en un 95% al diéster dextrógiro
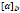 = +12.3° mientras que el producto 2 es el polímero formado con una pureza enantiomérica del 96%, un
= +12.3° mientras que el producto 2 es el polímero formado con una pureza enantiomérica del 96%, un
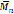 = 5300 y un
= 5300 y un
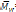 „.= 7900. En otro ensayo la polimerización enzimática del ácido trans-β-hidromucónico activado con 2,2,2-tricloroetanol y 1,4-butanodiol se realizó con las mismas condiciones del ensayo anterior exceptuando el paso de la epoxidación, pero la reacción no se llevó a cabo completamente a pesar de que se hizo reaccionar por 14 días.
„.= 7900. En otro ensayo la polimerización enzimática del ácido trans-β-hidromucónico activado con 2,2,2-tricloroetanol y 1,4-butanodiol se realizó con las mismas condiciones del ensayo anterior exceptuando el paso de la epoxidación, pero la reacción no se llevó a cabo completamente a pesar de que se hizo reaccionar por 14 días.
Binns et al. (1993), realizaron una polimerización de un sistema de ácido adípico/ 1,4- butanodiol sobre el cual se implementaron dos tipos de enzimas diferentes dejando como resultado un buen proceso inicial de esterificación tanto para PPL como para Lipasa Mucor Meihei, con la particularidad de que pasadas las 21 h de reacción PPL es insuficientemente resistente al daño mecánico por lo tanto se inactiva completamente después de ese tiempo de reacción, caso contrario el comportamiento que presenta la Lipasa Mucor Meihei la cual no reporta daño mecánico, no se inactiva y a temperatura ambiente genera oligómeros de peso molecular promedio Mn = 527 en un tiempo de 70 h, cabe resaltar que para la elección del disolvente se pensó prioritariamente desde el punto de vista de solubilidad, ya que este tiene la particularidad de prevenir la deshidratación de la enzima, esto debido a que la enzima necesita cierta cantidad de agua para mantener su estructura, por tal motivo se emplea un disolvente apolar y un tamiz molecular en la reacción de polimerización, además de que al aplicarle una temperatura optima entre 40-44°C se incrementa la relación de poliesterificación sin favorecer la volatilidad del disolvente (Binns, et al., 1993).
O'Hagan & Zaidi (1994) llevaron a cabo la polimerización de ácido 11- hidroxiundecanoico utilizando como catalizador una lipasa Candida Cylindracea (CC), la mencionada polimerización se realizó en hexano, con una temperatura de reacción de 55°C empleando como agente desecante los tamices moleculares y un tiempo de reacción de 103 h, el poliéster obtenido tiene un peso molecular de Mw = 22430 siendo bastante elevado aunque no alcanzando el peso molecular objetivo de Mw = 35000 que se habían obtenido de poliésteres sintetizados en trabajos anteriores, cabe resaltar que lo interesante del proceso de polimerización en donde se obtienen poliésteres de peso molecular tan alto, es una especie de dos etapas o al parecer un intermediario de reacción; en donde el reactivo de partida se polimeriza formando oligómeros de bajo peso molecular los cuales gracias a su bajo peso molecular y la disposición de los grupos funcionales facilita la condensación de los oligómeros en reacción con relación 1:1 (Alcohol: Ácido) permitiendo la formación de los poliésteres de alto peso molecular cercanos a los pesos moleculares objetivos.
A través del tiempo el avance en la síntesis enzimática de polímeros fue mejorada con el fin de mejorar los pesos moleculares a obtener, tanto así que en 1996 se desarrolló una polimerización quimio enzimática de oligómeros a partir de ácido cólico el cual tiene como particularidad que presenta actividad biológica, además el proceso de condensación catalizado por una lipasa deja como resultado polímeros tipo peine (comb-polymers), estos polímeros son obtenidos a partir de la reacción del ácido cólico y el ácido 11-metacriloilaminoundecanoico el cual reacciona con uno de los tres grupos hidroxilos que presenta el ácido cólico, debido a que de los tres hidroxilos solo uno se encuentra en posición ecuatorial con este hidroxilo se da la reacción de esterificación gracias a que el catalizador en este caso la lipasa Candida Antártica favorece esto por disposición espacial del hidroxilo, ya producido el monómero mediante síntesis enzimática este reacciona químicamente con AIBN (2,2-azoisobutironitrilo) el cual funciona como un iniciador radicalario para promover la formación del polímero en peine, presentado un peso molecular promedio de
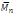 = 33000 y un rendimiento de reacción del 52%, el polímero sintetizado al presentar actividad biológica es de potencial valor para la industria farmacéutica y biomédica (Noll & Ritter, 1996).
= 33000 y un rendimiento de reacción del 52%, el polímero sintetizado al presentar actividad biológica es de potencial valor para la industria farmacéutica y biomédica (Noll & Ritter, 1996).
En 1997 sabiendo que los polímeros tenían un alto potencial en la industria farmacéutica Noll y Ritter sintetizaron un polirotaxano utilizando como disolvente Tetrahidrofurano (THF) el cual es de mediana polaridad, lo que era muy poco probable hasta la fecha. Teniendo en cuenta de que los esfuerzos por desarrollar nuevas macromolé-culas funcionalizadas, se integran en la química de los polímeros los rotaxanos los cuales debido a su estructura tipo mancuerna poseen diversas aplicaciones y pueden ser muy útiles en la industria, la reacción de esterificación dada entre el ácido 12-hidroxilaurico y el ácido 11-metacriloilaminoundecanoico en presencia de THF, para la cual se empleó como catalizador Novozym®435 generó oligoésteres, la oligocondensación y el alargamiento de la cadena fueron favorecidos gracias a la presencia de la lipasa, los oligómeros copolimerizan radicalariamente con metilmetacrilamida (MMA) para generar los polímeros tipo peine, estos seguidos se condensan con N-(4-aminobutanoil)-4-trifenilmetilanilina en presencia de 2,6-dimetil-ciclodextrina y 1-etil-3-(3-dimetilaminopropil)-carbodiimida (EDC) para producir los polirotaxanos, los cuales presentan una estructura polimérica tipo mancuerna garantizando de que por cada unidad de la cadena estén presentes anillos de la ciclodextrina. El alargamiento de la cadena de manera lateral garantiza una parte del tapón de la estructura tipo mancuerna de los rotaxanos y la otra parte del tapón es el grupo voluminoso de la N-(4-aminobutanoil)-4-trifenilmetilanilina el cual condensado funciona como barrera para evitar la salida de la ciclodex-trina, el interés en este tipo de polímeros radica en su potencial uso en el campo de la electrónica molecular (Noll & Ritter, 1997).
De acuerdo a lo publicado en (O'Hagan & Parker, 1998) la síntesis de poliésteres de tipo A-B enantioméricamente selectivos fue posible gracias a que utilizaron la lipasa de tipo Candida Rugosa, ya que esta favorece la producción de un monómero estéreo- y regioselectivo, esto con el objetivo de obtener un poliéster enriquecido enantioméri-camente, para verificar esta propuesta O'Hagan y H. Parker optaron por esterificar una mezcla racémica de ácido 1 0- hidroxiundecanoico durante 6 h y 55°C de temperatura empleando como disolvente hexano y como agente secante tamices moleculares, el resultado de la mencionada polimerización fue: peso molecular Mw = 1000 y una distribución de pesos moleculares PDI = 1,3; con un exceso enantiomérico del 60% para el enantióme-ro (S) y 33% para el enantiómero (R), esto es logrado gracias a la capacidad de la enzima para permitir el ataque nucleofílico de las especies monoméricas (S), teniendo en cuenta que en el instante de formación del complejo enzima - acilo proveniente de la acilación de la mezcla racémica del ácido 10- hidroxiundecanoico no se distingue el centro estereogénico del enantiómero (S) ó (R), pero en el momento de la des-acilación y formación del polímero prefiere que el ataque nucleofílico sea realizado por el grupo hidroxilo del enantiómero (S) de ahí el 60% de exceso enantiomérico. La enzima al facilitar la formación del complejo enzima-acilo hace mucho más estereo-selectivo y regioespecífico la poliesterificación del ácido 10-hidroxiundecanoico dejando como resultado poliésteres enriquecidos enantioméricamente de tipo A-B.
Shuai, et al. (1999b), promovieron la síntesis de poliésteres desde ácido 3-hidroxibutirico (3-HBA) y ácido-12-hidroxidodecanoico (12-HDA), el proceso de homo-polimerización enzimática fue catalizado por Lipasa Pancreática Porcina (PPL) empleando diferentes disolventes, además se realizaron procesos de polimerización con y sin tamiz molecular, esto con la finalidad de comprobar si el agua afecta tanto en el rendimiento de reacción como en el porcentaje de conversión del monómero, en el proceso de síntesis también se estudió la influencia del tiempo y la temperatura sobre el peso molecular promedio y el rendimiento de reacción, dejando como resultado que a mayores tiempos y temperaturas altas de reacción la policondensación es mejorada, por tanto, pesos moleculares elevados son obtenidos del poliéster respectivo; de acuerdo al estudio de síntesis realizado Shuai (1999b) et al., llegaron a la conclusión de que el disolvente ideal para el proceso de polimerización era el hexano, ya que favorece el proceso de eliminación del agua y su evaporación necesita menor gasto energético, la temperatura de 55°C fue la seleccionada como optima ya que se obtuvieron buenos rendimientos del poliéster, además de que mejora la policondensación del ácido 3-hidroxibutirico y ácido-12-hidroxidodecanoico aumentando la posibilidad de ciclación. Debido a que es catálisis enzimática, la participación en la producción del poliéster de la PPL notablemente favorece la policon-densación de los grupos terminales hidroxilo y carboxilo además el efecto de usar lipasa disminuye la energía de activación necesaria para la esterificación de los grupos terminales, de ahí que los polímeros obtenidos de (3-HBA) y de (12-HDA) dejaron corno resultado pesos moleculares promedio
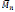 = 660 y
= 660 y
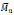 = 1200 respectivamente, lo novedoso del trabajo es que en estudios anteriores la poliesterificación con esta lipasa y en este tipo de disolvente no era para nada posible por la baja reactividad de los productos iniciales.
= 1200 respectivamente, lo novedoso del trabajo es que en estudios anteriores la poliesterificación con esta lipasa y en este tipo de disolvente no era para nada posible por la baja reactividad de los productos iniciales.
En el año 2000 se publicó la síntesis de poliésteres alifáticos a partir de policondensación de ácidos dicarboxílicos y glicoles, lo interesante del trabajo es que la polimerización es llevada a cabo en sistemas libres de disolvente. Para la experimentación se emplearon diferentes tipos de lipasas (MM, PC, PF, PPL y CA) con el objetivo de observar que tipo de lipasa favorecía la esterificación de mejor manera con la particularidad de una sistema libre de disolventes, también se realizó el estudio de los efectos de las condiciones de reacción (Temperatura y tiempo); la lipasa CA fue la enzima que arrojó los mejores resultados en cuanto a rendimiento y peso molecular promedio (56% y Mn = 3800 respectivamente) además en lo relacionado con las condiciones de reacción el tiempo y temperatura a la cual se obtuvo ese rendimiento y peso molecular fue de 8 h y 60°C, de ahí en más se marcó un inicio en la síntesis enzimática de polímeros teniendo en cuenta conceptos de química verde relacionado con los medios benignos de reacción, de este modo provee un acercamiento inicial a la Química verde de polímeros. (Hiroshi Uyama et al., 2000)
POLIMERIZACIÓN POR APERTURA DE ANILLO.
La polimerización de lactonas catalizada por lipasas ha sido ampliamente estudiada, en general, la reacción produce tanto productos lineares como cíclicos. Entre los primeros en experimentar con esta síntesis se encuentran Uyama, H. & Kobayashi, S. (1993) quienes realizaron la síntesis enzimática de polímeros a partir de ε-caprolactona y δ-valerolactona, en la cual probaron 3 lipasas: Pseudomonas fluorescens (PF), PPL y Lipasa CC, la reacción se llevó a cabo exitosamente en bulk a 60°C por 10 días, entre las lipasas utilizadas la mejor conversión para la ε-caprolactona se obtuvo con Pseudomonas fluorescens, la cual produjo un polímero de
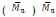 = 7000, la δ-valerolactona también se polimeriza en estas condiciones con una mayor conversión pero menor peso molecular en el producto.
= 7000, la δ-valerolactona también se polimeriza en estas condiciones con una mayor conversión pero menor peso molecular en el producto.
Otras lactonas de con anillos de entre 4 y 16 miembros también fueron estudiadas y polimerizadas con condiciones suaves por diferentes autores en los años subsecuentes (Shuhei Namekawa et al., 1996; Suichi Matsumura et al., 1996), las lipasas de la familia Pseudomonas permitieron observar que los sustratos de menor tensión en el anillo fueron polimerizados con mejores resultados. En la síntesis en bulk de poly(ß-propiolactona) con Lipasa CC se logró obtener un polímero de
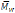 = 5000.
= 5000.
Otra síntesis que llamó la atención de la comunidad científica fue la polimerización de ß-butirolactona puesto que esta produce poly(ß-hidroxibutirato) (PHB), en algunos organismos el PHB se sintetiza in vivo y se emplea como una sustancia de almacenamiento de energía. La síntesis en bulk de PHB catalizada por PPL a temperatura ambiente produjo un polimero de
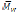 = 1000, mientras que a temperatura más altas se obtuvieron pesos moleculares mayores con lipasa CC y lipasa PF. (Geoffrey AR Nobes et al., 1996; Huan Dong et al., 1998).
= 1000, mientras que a temperatura más altas se obtuvieron pesos moleculares mayores con lipasa CC y lipasa PF. (Geoffrey AR Nobes et al., 1996; Huan Dong et al., 1998).
Suichi Matsumura et al. (1996), realizaron la síntesis de poly(ácido málico) a partir de bencil-ß-malolactona catalizado con PPL y Novozym®435, esto es importante debido a la naturaleza biodegradable del poly(ácido málico) que lo hace útil en industria y farmacia. La reacción se llevó a cabo primero por vía enzimática para obtener poly (bencil ß-malato) (PBM), acto seguido, mediante hidrogenación catalítica se obtuvo el poly(ácido màlico). El peso molecular máximo obtenido fue
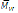 = 7000 independientemente de la enzima utilizada, mientras que el mejor rendimiento se obtuvo con PPL. 3 años más tarde se mejoró la síntesis al añadir ß-propiolactona en 17% mol con respecto al monómero obteniendo un nuevo copolímero con
= 7000 independientemente de la enzima utilizada, mientras que el mejor rendimiento se obtuvo con PPL. 3 años más tarde se mejoró la síntesis al añadir ß-propiolactona en 17% mol con respecto al monómero obteniendo un nuevo copolímero con
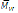 = 32000 (Suichi Matsumura et al., 1999).
= 32000 (Suichi Matsumura et al., 1999).
Un año después, se utilizó lipasa CA y lipasa PF para la polimerización de lactonas de 6, 11 y 12 miembros con la consideración de que en esta ocasión las lipasas fueron inmovilizadas, la lipasa CA inmovilizada se consigue comercialmente como Novozym-435 y la lipasa PF fue inmovilizada previamente en zeolitas lo cual permitió que se usara sólo un 1% p/p de enzima comparado con valores que alcanzan el 50% usados en la síntesis con enzimas libres, esta síntesis permitió formar polímeros de hasta
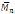 = 7000. Adicionalmente, se demostró que la polimerización se mejora en presencia de pequeñas cantidades de 1-octanol aumentando la velocidad de conversión hasta en 4 veces (Hiroshi Uyama et al., 1997). En un estudio similar se notó que la polimerización alcanza mayores pesos moleculares y produce mayor cantidad de polímero lineal cuando se hace en bulk, mientras que la polimerización en disolventes orgánicos produjo principalmente oligómeros cíclicos (Córdova et al., 1998).
= 7000. Adicionalmente, se demostró que la polimerización se mejora en presencia de pequeñas cantidades de 1-octanol aumentando la velocidad de conversión hasta en 4 veces (Hiroshi Uyama et al., 1997). En un estudio similar se notó que la polimerización alcanza mayores pesos moleculares y produce mayor cantidad de polímero lineal cuando se hace en bulk, mientras que la polimerización en disolventes orgánicos produjo principalmente oligómeros cíclicos (Córdova et al., 1998).
Otra molécula de interés polimerizada exitosamente mediante lipasas es la 1,2-dioxan-2-ona, el polímero que se obtiene se conoce como PDO poly-(1,2-dioxan-2-ona), este presenta buenas propiedades físicas y su biocompatibilidad lo hace un candidato para uso en suturas quirúrgicas, pero además puede ser utilizado en películas, recubrimientos, adhesivos, entre otros. El peso molecular más alto alcanzado en la síntesis con Lipasa CA fue de
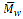 = 41 000 (Nishida eí al., 2000).
= 41 000 (Nishida eí al., 2000).
Investigadores de la Universidad de Kioto sintetizaron copolímeros de lactonas, diésteres y dioles con lipasa CA y lipasa PF (Namekawa et al., 2000). El objetivo de este ensayo fue determinar si diferentes tipos de polimerización, en este caso, polimerización por apertura de anillo de lactona y policondensación podían llevarse a cabo en un mismo recipiente, el producto de reacción no fue una mezcla de homopolímeros, sino, un copolí-mero que incluía a todos los monómeros indicando que los 2 tipos de polimerización enzimática se desarrollaron simultáneamente.
Bisht et al. (1998), desarrollaron la polimerización de ε-caprolactona y trimetilencarbonato (TMC) con el iniciador multifuncional etilglucopiranósido, la síntesis se realizó en bulk, a 70°C por entre 48 y 96 h, el producto obtenido fue un poliéster amfifílico cuya porción glucosídi-ca se unió regioselectivamente por el grupo hidroxilo primario sin necesidad de protección/desprotección. Este tipo de moléculas son atractivas para la síntesis de surfactantes biodegradables.
La polimerización por apertura de anillo de lactida catalizada por lipasa PS inmovilizada en zeolita y No-vozym-435 se llevó a cabo alcanzando pesos moleculares de
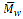 = 270000 y
= 270000 y
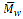 =
126000 respectivamente (Matsumura et al., 1997, 1998). También se pudo ver que la polimerización tiene mejores resultados cuando se utiliza la D,L-lactida comparado con los otros enantiómeros. En el mismo estudio se investigó en la hidrólisis del PLA formado con diferentes enzimas, pero no se encontró una relación directa entre el tipo de enzima, la degradabilidad y la polimerización enzimática.
=
126000 respectivamente (Matsumura et al., 1997, 1998). También se pudo ver que la polimerización tiene mejores resultados cuando se utiliza la D,L-lactida comparado con los otros enantiómeros. En el mismo estudio se investigó en la hidrólisis del PLA formado con diferentes enzimas, pero no se encontró una relación directa entre el tipo de enzima, la degradabilidad y la polimerización enzimática.
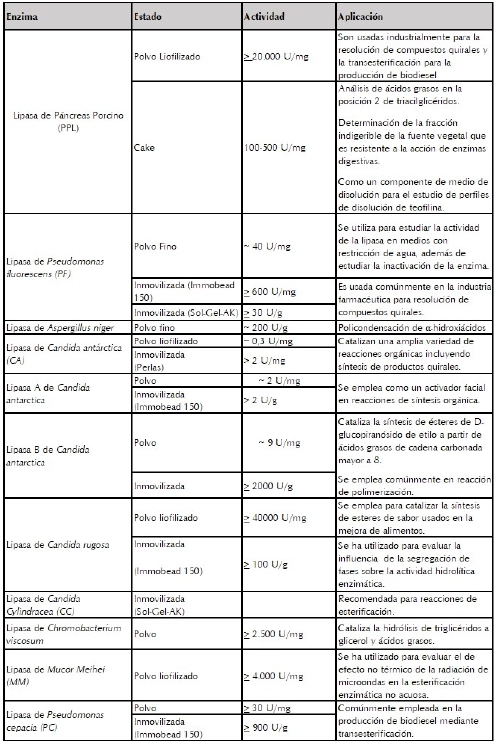
LIPASAS COMERCIALES
La investigación en síntesis enzimática de polímeros se vio considerablemente mejorada por la masificación en la producción de lipasas, actualmente se cuenta con un buen número de lipasas, de fuentes diferentes, que están disponibles en el mercado (ver tabla 1). Esto hizo posible que diferentes investigadores alrededor del mundo incursionaran en el campo de la síntesis enzimática de polímeros y se abrió la puerta para la investigación en nuevos métodos, el uso de diferentes sustratos y por consiguiente nuevas aplicaciones para estos materiales.
Si lo que se desea es ver la aplicación de estas lipasas en síntesis de polímeros, un resumen detallado de condiciones de reacción, sustratos y resultados se puede encontrar en (Gross et al., 2010).
CONCEPTOS NUEVOS Y QUÍMICA VERDE DE POLÍMEROS.
La química verde de polímeros se basa en 3 principios, 1) Uso de materiales de partida renovables, 2) métodos de síntesis verdes y 3) biodegradabilidad en productos de reacción (Kobayashi, 2017).
Entre los métodos verdes de síntesis se encuentra, por supuesto, la síntesis enzimática catalizada por lipasas, diferentes sustratos son susceptibles a ser polimerizados como se vio en la sección anterior. Dentro de las fuentes renovables de sustratos encontramos la celulosa, almidón, aceites vegetales, residuos industriales de origen vegetal o alimentario, entre otras.
Entre los sustratos más utilizados se encuentra el sorbitol, el cual se obtiene por hidrólisis de celulosa o almidón seguido de una hidrogenación para convertir la glucosa en sorbitol, entre los autores que han utilizado este sustrato resaltan los trabajos de (Fu et al., 2003; Kumar et al., 2003) quienes realizaron la síntesis de polímeros de sorbitol y 1,8-octanodiol con ácido adípico, por 48 h, en bulk, con vacío y a 90°C. Se observó que al variar la relación sorbitol:1,8-octanodiol del 0 al 100% se obtuvo polímeros con propiedades físicas diferentes, los pesos moleculares superan en todos los casos los
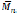 = 7000 y con excepción del polímero con 1 00% de sorbitol (PSorA) son semicristalinos, el PSorA es amorfo, el punto de fusión decrece al aumentar la cantidad de Sorbitol en los polímeros.
= 7000 y con excepción del polímero con 1 00% de sorbitol (PSorA) son semicristalinos, el PSorA es amorfo, el punto de fusión decrece al aumentar la cantidad de Sorbitol en los polímeros.
Una aplicación de este tipo de materiales se puede ver en (Gustini et al. (2015), quienes sintetizaron polímeros de sorbitol, 1,10-decanodiol con diferentes diácidos para obtener polímeros con pesos moleculares entre 4 y 7 Kg/mol, además observaron que estos materiales tenían propiedades adecuadas como resinas de revestimiento, para esto modificaron el polímero con di- y poliisocianatos obteniendo un poliuretano con buena resistencia a los disolventes y buenas propiedades mecánicas.
El ácido furan-2,5-dicarboxílico (FDCA) es otro derivado de interés ya que puede reemplazar al ácido tereftálico en la síntesis de poliésteres (Moreau et al., 2004). Este derivado se obtiene usualmente a partir de Fructosa que se convierte por deshidratación en diferentes disolventes en hidroximetilfurfural, el HMF se convierte vía oxidación catalítica en (FDCA).
El glicerol, actualmente, debido a la alta demanda de biocombustibles y a la expansión del mercado del biodiesel (de los cuales es un subproducto) se ha convertido en una materia prima de costo mínimo, y su versatilidad hace que pueda utilizarse en síntesis de polímeros en su estado normal o con modificaciones químicas previas como su bioconversión en 1,3-propanodiol (43), otro derivado del glicerol, el ácido glicólico, produce productos análogos al PLA, y cuando se usa en conjunto con ácido láctico para la síntesis de PLGA empleando Novozym 435 se sintetizan copolímeros con alto peso molecular (
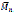 = 44800 g/mol) aptos para aplicaciones biomédicas (Lassalle et al. , 2008).
= 44800 g/mol) aptos para aplicaciones biomédicas (Lassalle et al. , 2008).
El ácido láctico es una molécula comercialmente producida por fermentación de glucosa con microorganismos, su principal uso es la producción del Ácido poliláctico (PLA), este material posee propiedades mecánicas similares y superiores en algunos aspectos al poliestireno y su utilidad en el almacenamiento de alimentos es comparable a la del tereftalato de polietileno (PET), una caracterización detallada de este material fue realizada en Vink et al., 2003.
El ácido succínico se puede obtener mediante fermentación de glucosa por microorganismos recombinados E. coli y ha sido empleado en la síntesis de polímeros por metodología química convencional con isosorbida, donde se obtuvo polímeros ramificados de peso molecular
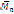 = 2500 g/mol. (Noordover eí al., 2006)
= 2500 g/mol. (Noordover eí al., 2006)
También en años recientes se han hecho ensayos de polimerización utilizando lipasas en conjunto con ultrasonido. Tomke et al. (2017), sintetizó exitosamente poli-etilenglutarato, polietilenmalonato y polietilenftalato en condiciones libres de disolvente. El proceso consta de 2 periodos de sonicación de 0.5 h a 100W y 53kHz precedidos de 3 h de baño maría para obtener en el mejor de los ensayos se alcanzó un grado de polimerización de 7. Una tabla detallada de las reacciones, sustratos y condiciones para síntesis asistida por lipasas y ultrasonido se puede encontrar en (Bansode & Rathod, 2017).
Métodos quimioenzimáticos añaden las ventajas de la síntesis química tradicional al permitir construir materiales poliméricos con una estructura deseada específica (polímeros block, brush, comb y graft). Los polímeros sintetizados por vía enzimática poseen buenas características en cuanto a biodegradabilidad y biocompatibili-dad, la combinación con métodos químicos mejora la complejidad macromolecular de los materiales y amplía el grupo de productos posibles (Yang et al., 2014).
CONCLUSIONES
La síntesis enzimática de polímeros es un área reciente de la química de polímeros y que, debido a sus ventajas en cuanto a facilidad de reacción, condiciones suaves, selectividad, inocuidad y facilidad en la recuperación y reutilización del catalizador se ha convertido en una herramienta fuerte en la síntesis de polímeros amigables con el medio ambiente.
La gran versatilidad de estas reacciones nos ha dejado una gran gama de nuevos materiales que aún están siendo estudiados para diferentes y variadas aplicaciones.
A futuro se tienen como retos mejorar ciertos aspectos de la síntesis para llevarla a una escala mayor, como reducir la cantidad de enzima empleada, lo cual ayudaría en particular a separar el catalizador en reacciones con un medio de reacción altamente viscoso, desarrollar catalizadores (enzimas inmovilizadas) que sean aptos para los diferentes procesos y dispositivos a escala industrial y la búsqueda nuevas enzimas que permitan emplear diferentes monómeros o mejorar propiedades específicas como la estabilidad térmica a altas temperaturas y la resistencia a disolventes.