INTRODUCCIÓN
Lippia origanoides H.B.Ka. es una planta aromática perteneciente a la familia Verbenaceae, conocida comúnmente como "Orégano criollo" y se distribuye en forma silvestre en América Central, el norte de América del Sur y de las Antillas (Pascual et al., 2001; Hennebelle et al., 2008). En Colombia, esta planta se encuentra en altitudes entre 500 y 800 msnm en los departamentos de Guajira, Magdalena, Cauca, Cundinamarca, Norte de Santander, Santander y Nariño (Albesiano et al., 2003; Ruiz et al., 2007; Stashenko et al., 2008). La especie ha sido ampliamente investigada debido a la alta cantidad de compuestos fenólicos como el timol, el carvacrol y derivados (Ribeiro et al., 2014). La mayoría de las investigaciones sobre las actividades biológicas del orégano se han enfocado en determinar los efectos antibacterianos y antifúngicos de diversos extractos y aceites esenciales contra microorganismos patógenos de humanos, animales y plantas, sin embargo, a la fecha existen pocas investigaciones de bacterias endófitas aisladas de Lippia origanoides, razón que ha despertado el interés del uso de las bacterias endófitas asociadas a estas plantas aromáticas, las cuales pueden ser una alternativa valiosa para el tratamiento de diversas enfermedades en los cultivos a nivel mundial, ya que éstas pueden aumentar la capacidad de crecimiento y absorción de nutrientes del suelo, solubilizar fosfato, fijar nitrógeno, remover contaminantes y se usa como control biológico, garantizando no sólo el margen de seguridad alimentaria, sino además la sostenibilidad y la conservación ambiental. Razón por lo cual el presente estudio tuvo como objetivo evaluar in vitro la capacidad de promoción de crecimiento vegetal de bacterias endófitas de Lippia origanoides en el municipio de Sincelejo-Sucre, Colombia.
MATERIALES Y MÉTODOS
Sitio de muestreo
Se colectaron aleatoriamente 10 plantas completas de Lippia origanoides en la granja Asoproagros, localizada en el corregimiento de Segovia, municipio de Sincelejo-Sucre, Colombia, a los 9°13'53.13"N y 75°22'41.59"O a 114 msnm, las cuales fueron transportadas para los análisis microbiológicos al laboratorio de investigaciones microbiológicas de la Universidad de Sucre.
Aislamiento de bacterias endófitas (BE).
El aislamiento de bacterias endófitas se llevó a cabo utilizando la metodología descrita por Cordero et al. (2010).
Determinación in vitro de la promoción de crecimiento vegetal de las BE
Solubilización de fosfato (SF)
La capacidad de SF fue determinada por inoculación de cada aislamiento en medio NBrip y SRS, las cepas se incubaron durante 2 días a 28 °C (Franco-Correa et al., 2010).
Fijación biológica de nitrógeno (FBN)
La FBN de bacterias endófitas se realizó en medio Burk carente de nitrógeno siguiendo el protocolo propuesto por Pérez-Cordero et al. (2014).
Producción de sideróforos (PS)
La evaluación cualitativa PS se llevó a cabo mediante la siembra directa de cada morfotipo en la superficie del medio cromo azurol-S (CAS) propuesto por Schwyn y Neilands (1987).
Producción de ACC Deaminasa
Se realizó siembra por estrías en medio mínimo Dworkin y Foster (DF) (Belimov et al., 2001; El-Tarabily, 2008) suplementado con 0.3 g/L de ácido 1-aminociclopropano carboxílico (ACC) como única fuente de nitrógeno. Las placas se incubaron por 5 días a 30 °C.
Identificación molecular de las BE
Para la identificación de bacterias endófitas con actividad positiva para la promoción de crecimiento vegetal, se realizó la extracción de ADN mediante el método de fenol-cloroformo y las condiciones de amplificación para cada reacción se basaron en el protocolo descrito por Oliveira et al. (2013). Los productos fueron purificados y enviados a secuenciar a la empresa Macrogen®. Las secuencias obtenidas fueron comparadas con las almacenadas en el banco de datos NCBI, el alineamiento de las bases se realizó en el programa Clustal W® y, el análisis y corrección con el programa Mega7.0®. Las inferencias filogenéticas fueron obtenidas por el método de distancia y máxima parsimonia de Neighborjoining con test de bootstrap.
Análisis estadístico
Las diferencias entre la densidad poblacional (UFC/g de tejido) de bacterias endófitas en función al tipo de tejido fueron analizadas por ANOVA mediante un diseño completamente al azar con arreglo factorial. Se utilizó la prueba Tukey (p-valor < 0.05), para establecer diferencias por separado entre comunidades de bacterias endófitas (UFC/ g de tejidos) con relación al tipo de tejido colonizado. Todos los tratamientos se realizaron por triplicado y los datos se analizaron en el software InfoS-tat® versión libre.
RESULTADOS Y DISCUSIÓN
Densidad poblacional de BE
Un total de 20 morfotipos de BE fueron aisladas de plantas de Lippia origanoides. Los resultados del análisis de varianza infieren diferencias estadística significativas (p-valor <0,05) entre los tejidos analizados, indicando mayores densidades poblacionales en raíces con 2,0 x 1010 de tejido y menores densidades en las hojas con 9,2 x 109 /g tejido (Figura 1).
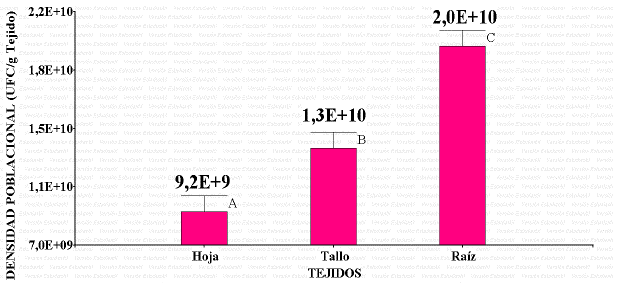
Figura 1 Densidad poblacional de bacterias endófitas asociadas a tejidos de Orégano de monte (Lippia origanoides) del municipio de Sincelejo- Sucre, Colombia.
La densidad poblacional de las bacterias endófitas que colonizan a las plantas es altamente variable, ya que depende de la especie de la bacteria y del genotipo de la planta hospedera, además del estado de desarrollo de la planta, la densidad del inóculo y las condiciones ambientales (Chaudhary et al., 201 2; Ding et al., 2013).
Estudios realizados por Pérez et al. (2013), sobre diversidad poblacional de bacterias endófitas, indican que la mayor colonización de bacterias fue en las raíces con respecto a tallo, hojas, hoja bandera y panícula entre las variedades de arroz que fueron estudiadas. También Doncel et al. (2016), reporta en pasto colosoana valores mayores en raíz (1x1011 g/raíz), seguida del tallo (1.82x1010 g/tallo) y menor densidad en hojas (1.15x1010 g/hoja). Así mismo Alvíz et al. (2017), encontraron que la densidad poblacional de bacterias endófitas asociadas a la especie L. origanoides en raíces fue de 4.1x108 /g tejido y en menor cantidad en hojas 2.3x106 /g tejido, confirmando que la población de bacterias varía significativamente para cada tipo de tejido analizado, siendo mayor la densidad poblacional en las raíces con relación a las otras partes de la planta, ya que este tejido es el sitio de entrada de las bacterias a la planta (Mano y Morisaki, 2008), además la colonización endofítica por bacterias está sujeta a la regulación de las plantas, siendo más estricto a medida que el órgano se separa del suelo (Hunter et al., 2010).
Identificación molecular de BE y evaluación in vitro de la promoción de crecimiento vegetal
De los 20 morfotipos de bacterias endófitas que fueron aisladas de L. origanoides, dos de ellos presentaron capacidad de promover crecimiento vegetal in vitro (Tabla 1).
Tabla 1 Promoción de crecimiento vegetal in vitro de los morfotipos TL05 y RL04. T: Tallo, R: Raíz. LO: Lippia origanoides. (+): Actividad positiva, (-): Actividad negativa.
| Morfotipos | SF | FBN | PS | ACC Deaminasa | |
|---|---|---|---|---|---|
| Medio NBrip | Medio SRS | ||||
| TL05 | (+) | (+) | (+) | (+) | (+) |
| RL04 | (-) | (-) | (+) | (+) | (-) |
La muestra de ADN genómico de los aislados RL04 y TL05 que presentaron actividad positiva para la promoción de crecimiento vegetal, fueron amplificados con el par de oligonucleótidos FBLS342 (325-342), CAGCA-GTAGGGAATCTTC y R1 392 (1 392-1406), ACGGGCGGTGTGTACA, perteneciente al filo Firmicutes. Los resultados mostraron un porcentaje de identidad de 100% con Bacillus cereus (Figura 2).
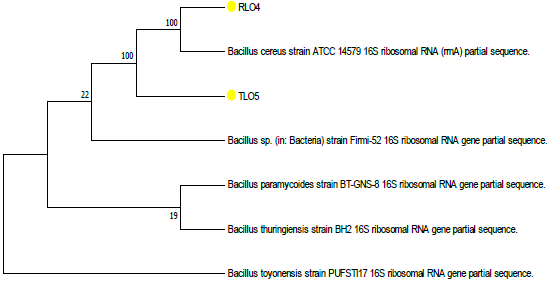
Figura 2 Arbol filogenético derivado del análisis de la secuenciación del gen 16 Sr DNA empleando primers FBLS342 y R1392 de los morfotipos RL04yTL05 con secuencias homologas obtenidas desde NCBI.
El género Bacillus, es de gran interés por su amplio perfil de diversidad fisiológica (Restrepo-Franco et al., 2015), que le confiere la interacción en los diferentes hábitats, ya sea acuáticos como terrestres de manera directa, actuando como agente rizosférico, degradador de sustratos derivados de la fauna y flora, compuestos orgánicos, puede estar involucrado en la producción de antibióticos, crecimiento vegetal e indirectamente como antagonista de patógenos (Angulo-Cortes et al., 2012). Bacillus cereus, aislada de L. origanoides posee actividad promotora de crecimiento mediante la fijación de nitrógeno, sideroforos, solubilización de fosfato y actividad ACC deaminasa, así como ha sido encontrada en plantas de arroz como bacteria endófita con capacidad de promover el crecimiento vegetal (0kunishi et al., 2005). Kifle y Laing (2011), señalaron que Bacillus presentan la capacidad de incrementar el contenido de nitrógeno en la plantas, siendo un aporte fundamental en los sistemas naturales para evitar la aplicación excesiva de fertilizantes en los cultivos, debido a que estos compuestos contaminan el medio ambiente. En estudios realizados por Andrade et al. (2014), señalaron que bacterias endófitas del género Bacillus son solubilizantes de fosforo de alta eficiencia. Igualmente, Matos et al. (2017), lo reportan como solubilizador de fosforo en medios sólidos cuando se utilizaron Ca3 (P04)2 como fuente de fosforo. Estas bacterias se caracterizan por su capacidad de incrementar la movilización de fosfato a través de diferentes mecanismos, que permiten captar las formas insolubles de fosfato, liberarlo, y así generar un efecto benéfico en campo para las plantas debido a su aporte, estimulando su crecimiento y aumentando la fertilidad de los suelos.
Estrada et al. (2013), demuestran que B. pumilus presenta la capacidad de solubilizar el hierro del medio, favoreciendo la absorción de este metal en las plantas y B. cereus interactúa con los microorganismos de la rizosfera de algunas plantas, proporcionando protección contra el ataque de algunos patógenos (Jensen et al., 2003), produciendo metabolitos secundarios antimicrobianos o quelantes de hierro (sideróforos), los microorganismos que producen este tipo de compuesto presentan una ventaja al no dejarlo disponible para comunidades microbianas patógenas (considerado un mecanismo de biocontrol), despertando gran interés a su potencial antimicrobiano, por jugar un papel importante en la promoción de crecimiento vegetal y por su habilidad de hacer disponible el hierro para plantas en ambientes carentes de este elemento (Radzki et al., 2013). Así mismo, este género también ha sido reportado como productor de ácido indolacético, solubilizador de fósfato tricálcico y poseedor de actividad ACC deaminasa (Luna Martínez et al., 2013). Las bacterias endófitas han sido reportadas como productoras de la enzima de origen microbiano 1-amino ciclopropano-carboxilato deaminasa (ACC), clave en el metabolismo de α-ketobutirato y amoniaco y de ese modo disminuyen los altos niveles de etileno en las plantas hospederas (Seessitsch et al., 2005; Sun et al., 2009), brindándole resistencia frente a diversos tipos de estrés (Chaudhary et al., 2012).
CONCLUSIONES
Los morfotipos TL05 y RL04 aislados de Lippia origanoides fueron identificados como Bacillus cereus, con actividades promotoras del crecimiento vegetal mediante las pruebas de fijación de nitrógeno, solubilización de fosfato, producción de sideróforos y ACC deaminasa; ésto indica que esta especie podría ser utilizada como alternativa biológica. Actualmente, en la base de datos de bibliografías especializadas no se reporta la presencia B. cereus como endófita asociada a plantas de L. origanoides, convirtiéndose en el primer reporte en Colombia.














