INTRODUCCIÓN
La familia Asparagaceae incluye a los géneros, Calibanus, Beaucarnea Dasylirion y Nolina y más de 50 especies adaptadas a las zonas áridas y semiáridas de México (Hernández 1992). Algunas especies de la familia Asparagaceae tienen varios usos; de acuerdo a Poinar (2001), Dasylirion y Nolina formaron parte de la dieta de naturales americanos, aunque no especifica a que grupo étnico se refiere. Las hojas del género Nolina son empleadas como materia prima para fabricar escobas de paja, canastos y techado de casas o bien para la fabricación de sotol como es el caso de Dasylirion (Reyes, et al., 2013). La especie Nolina cespitifera se explota para la obtención de fibra usada para cordelería, actividad que representa un renglón sumamente importante para la economía de habitantes de la zonas áridas y semiáridas de sur de Coahuila y Nuevo León y norte de Zacatecas (Castillo, 2004), Otras con usos medicinales, farmacológicos y etnobotánicos otras tienen uso medicinal y etnobotánico (Gioanetto y Franco, 2004). El uso más común es ornamental, lo cual lo hace comercial (Hernández, 1992). En el caso de Calibanus hookeri, conocida como "sacametacate", "tinaja" se desconoce si aparte de ser decorativa tenga alguna otra utilidad. De acuerdo a Giral (1986) estudios de propiedades fitoquímicas de la especie, revelaron la presencia de una saponina que llamaron calibagenina, nada medicinal. Es una planta fascinante caudiforme de los desiertos del norte de México, endémica de los estados de Hidalgo, Tamaulipas y San Luis Potosí; forma un caudex grande que alcanza diámetros y alturas de hasta 90 cm (Hernández-Sandoval (2020). Encima del caudex brotan hojas muy angostas de color verde grisáceo que parecen hierba. Cada roseta de hoja cultivada a partir del caudex se cree que es una planta independiente producida vegetativamente que muere después de la fructificación para ser remplazada por una nueva. Su aspecto la hace atractiva como una planta rara, decorativa y por ser una planta de tolerancia a zonas áridas o semiáridas (Trelease 1911; Hernández-Sandoval, 2020, rarepalmseeds 2021). Estas características pueden provocar saqueo irracional a tal grado que la ponga en peligro en su hábitat natural causando que sus poblaciones estén disminuyendo de manera preocupante de tal manera que en México está ubicada en la categoría de amenazada (NOM-059-SEMARNAT-2010). Calibanus hookeri es una planta que en el mercado nacional llega tener un precio de hasta $2,000.00 MN y en los Estados Unidos de América un precio de entre 50 hasta 70 USD (1,000.00 y 1,400.00 MN). El valor de la planta está determinado por la altura del caudex (Figura 1) de tal forma que a mayor tamaño así será el costo. Esto pudiere explicar el por qué las plantas jóvenes y adultas son extraídas de manera irracional e ilegal causando la disminución o inclusive la desaparición de las poblaciones silvestres.
Calibanus hookeri, hasta donde sabemos, solamente se propaga por semilla (Figura 1), pero el desarrollo de la semilla, no es constante, es errática; sin embargo, cuando existe la simiente, la depredación ilegal impide la conservación de la especie en su hábitat natural (Franco 1995). La planta es vendida en el mercado europeo, según Tropical Centre, es de entre 144 a 157 € (3,653 a 3995 MN); en el mercado asiático (Bangkok,BA, Tailandia) de acuerdo a eBay, en marzo de 2017, Calibanus hookeri considerada como planta exótica, tiene un costo de 77.77 USD (1,513.00 MN). En cuanto a la semilla (según Tropical Centre y Rarepalmseeds) se vende en el mercado europeo, a un costo de entre 50 y 75 libras esterlinas (1.442.5 a 2. 163.75 MN). En consecuencia, es una planta con alto valor comercial y de este ángulo se establece el interés que existe por esta planta en el mundo.
Los factores pastoreo, factor económico por la venta de planta y semilla, han limitado la regeneración natural de la planta y provocado la reducción e incluso la desaparición de las poblaciones silvestres (López 1986). La amenaza y pérdida de especies es especialmente grave cuando las especies son endémicas como es el caso de Calibanus hookeri (Reyes-Silva et al., 2013). En estas circunstancias existe la necesidad de implementar métodos eficientes de propagación que permitan su conservación y mantenimiento para la restauración de las poblaciones naturales. Sin embargo, se tienen que resolver, por un lado, como conocer la capacidad germinativa de la semilla, sobre todo porque, según Pence (2011), Calibanus hookeri no se puede multiplicar asexualmente y mucho menos lograr inducir la propagación masivamente de plantas. El problema de su reproducción se agudiza porque si bien la planta se puede propagar por semilla, también es cierto que no hay nada de información sobre cuál es la época de floración y la edad de planta para floración y por supuesto para fructificación que permita hacer recolectas de semilla. En este sentido, no hay información en la literatura disponible de esta especie desde el punto de vista científico; no obstante, Calibanus hookeri es muy apreciada como planta ornamental. Uno de los métodos de propagación menos usado y fomentado es la técnica de cultivo de tejido vegetal. Sin embargo, esta técnica empleada para fines de conservación ha cobrado poco a poco importancia; de acuerdo a Sarasan et al., (2006) y Sarasan (2010), en los años de 1995 a 2005, aún eran muy pocos los trabajos existentes al respecto. Una de las ventajas del cultivo in vitro radica en que es un proceso que no requiere de nuevo material biológico de campo cuando ya se tiene tejido u órganos bajo reproducción continua, por lo que es una herramienta que se puede aplicar como alternativa de conservación. Con estas consideraciones, en este trabajo se utilizaron citocininas para inducir la generación de brotes en explantes basales, puesto que estas citocininas controlan de la diferenciación celular regulando la formación y el desarrollo del tallo. Se evaluó el efecto de cuatro citocininas (BA, TDZ, K y 2iP) en tres concentraciones para conocer la capacidad de germinación de la semilla, así como el empleo de citocininas para estimular o inducir la generación de brotes que permita establecer un protocolo para la micropropagación de C. hookeri a partir de plántulas de semillas germinadas in vitro. Es importante mencionar que para esta especie no existen investigaciones o reportes previos sobre su cultivo y su propagación in vitro.
MATERIALES Y METODOS
Las semillas de Calibanus hookeri (Figura 1) utilizadas en la investigación fueron cosechadas en 2019 en el Jardín Botánico de la Facultad de Estudios Superiores Iztacala, UNAM, México y donadas por MC Marcial Pineda encargado del mencionado jardín y quien hizo la identificación de la planta. Este estudio se realizó en dos etapas: la germinación y la micropropagación a partir de las plántulas de semillas germinadas in vitro de C. hookeri. Para evaluar la viabilidad de la semilla se seleccionó el método de flotación en agua destilada y se emplearon sólo aquéllas que se observaron en el fondo de un vaso de precipitado. La investigación se desarrolló en el laboratorio de Embriogénesis perteneciente al Posgrado de Fruticultura ubicado en el Campus Montecillo del Colegio de Posgraduados en 2019.
Desinfección de la semilla
A las semillas seleccionadas se les retiró la testa con pinzas de punta fina y se lavaron con agua jabonosa por 10 minutos. Para la desinfección, las semillas se sumergieron en peróxido de hidrogeno al 3% v/v por cinco minutos y posteriormente se enjuagaron con agua de la llave, tres veces, por dos minutos. Se colocaron en cloro comercial (hipoclorito de sodio, 6% de cloro activo) más dos gotas de Tween 80 por cinco minutos. Se lavaron tres veces con agua bidestilada esterilizada en condiciones asépticas. Antes de la siembra, las semillas se impregnaron con B enomyl para controlar la posible presencia de hongos.
Germinación
Con la finalidad de obtener plántulas asépticas para inducir organogénesis y la multiplicación, las semillas se sembraron en tubos de ensayo con 20 ml de medio básico MS (Murashige y Skoog 1962) complementado con 2 mg L-1 de glicina, 100 mg. L-1 de myo inositol, 0.4 mg L-1 de tiamina-HCl, 0.5 mg.L de ácido nicotínico, 0.5 mg.L de piridoxina HCl, más 30 g.L-1 de sacarosa y se solidificó con 8g.L-1 de agar (Sigma-Aldrich) complementado con cuatro citocininas: benciladenina (BA), tidiazuron (TDZ), cinetina (K) y 6-ү, ү -dimetilalilaminopurina (2ip) en concentraciones de 2.5, 5.0 y 7.0 mg L-1 y el testigo sin hormonas. El pH del medio se ajustó a 5.7-5.8 con un potenciómetro digital (Apera Instruments AI521 PH800) y se esterilizó autoclave vertical a 1.5 kg cm2 a 120 oC por 15 min. Se sembró una semilla por tubo de ensayo de 150 x 25 mm en campana de flujo laminar previamente desinfectada y se realizaron 30 repeticiones por tratamiento y con el testigo para un total de 390 semillas. Los tubos de ensayo se incubaron en la cámara de crecimiento a 27 ± 1°C con una intensidad de 50 μmol m-2s-1 provisto por lámparas fluorescentes de luz blanca-fría y un fotoperiodo de 16 h de luz. Las semillas se monitorearon diariamente durante 28 días para registrar el porcentaje de germinación. Se consideró como semilla germinada cuando la radícula comenzó a emerger (Ranal y García de Santana, 2006). A los 28 días, las plántulas se sacaron del tubo para evaluar el número y longitud de los brotes, para posteriormente pasar esos brotes a medio MS sin hormonas para su enraizamiento.
Multiplicación
Cuando los brotes obtenidos de las semillas germinadas in vitro alcanzaron los 28 días de edad y un tamaño de 1 cm se sembraron verticalmente, pensando en no afectar la polaridad de los brotes, en el medio basal MS y con la finalidad de inducir o provocar la brotación múltiple se adicionaron las cuatro citocininas a las mismas concentraciones empleadas para la germinación. Se inocularon 30 tubos por tratamiento colocando un brote por tubo de ensayo. Las observaciones se hicieron mensualmente durante dos meses.
Enraizamiento
Para esta parte del trabajo se emplearon 50 plántulas de entre 5 cm 8 cm de longitud, aproximadamente, que se incubaron en medio MS sin hormona en condiciones 25 ±2 oC y luz continua por 45 días dentro de tubos de ensayo. Al final del tiempo se registró el porcentaje de enraizamiento. Las plántulas se transfirieron a macetas de plástico con una mezcla de tierra de monte con perlita en proporción de 1:1 y se sellaron con plástico transparentes, conservando la humedad relativa alta. Las macetas se mantuvieron en el cuarto de incubación. A la cubierta, después de una semana se le hicieron perforaciones, aproximadamente cinco o seis, con un alfiler. Este procedimiento se realizó haciendo más perforaciones hasta descubrir la caja por completo al mes
ANALISIS ESTADISTICO.
Las variables evaluadas fueron porcentaje de germinación, número y longitud de brotes. El diseño experimental empleado fue completamente al azar con 30 repeticiones para cada tratamiento, un tubo como unidad experimental; se usó como prueba de comparación de medias el número y longitud de brotes (Tukey, 0.05) con el programa estadístico SAS® (SAS Institute, 2000).
RESULTADOS Y DISCUSION
Germinación
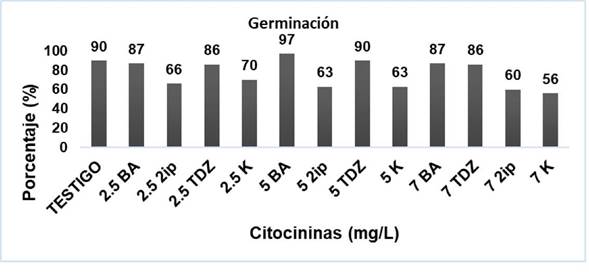
La observación de la germinación de la semilla se inició a los cuatro días después de la siembra y el proceso terminó hasta los 28 días. Los primeros brotes comenzaron a aparecer a los 7 días. Los tiempos de germinación son parecidos a los señalados por Reyes et al., (2013) quienes mencionaron que la germinación in vitro de las semillas de Beaucarnea gracilis, Dasylirion leiophyllum y Dasylirion serratofolium comenzó a observarse a los ocho días y hasta a los 28. Entre los12 y 15 días apareció la vaina cotiledonar que posteriormente dará origen al caudex en plantas adultas. Con relación a las hormonas de crecimiento, las tasas mayores de germinación se dieron con BA y TDZ primordialmente en las concentraciones de 5.0 mg L-1 con valores de 97% y 90%, respectivamente. Vadillo (2012) indicó que las semillas de Beaucarnea purpusii y B. compacta tuvieron porcentajes de germinación in vitro mayor al 90% en medio de cultivo MS semi-sólido. Guillén et al. (2015) con Beaucarnea inermis y Osorio- Rosales y Mata-Rosas (2005), en Beaucarnea gracilis y B. recurvata, reportan que después de 30 días de haber sembrado las semillas, se registraron porcentajes de entre 89 a 95% de germinación. La concentración de 2.5 mg L-1 de BA o TDZ dio valores de germinación de 87 %. Para la concentración con 7 mg L-1 el porcentaje con BA fue de 87 de germinación, seguido del tratamiento con TDZ con 86%. En cuanto a la K la mejor respuesta fue con 2.5 mg L-1 y una tasa de germinación de 70% y la de menor respuesta fue con 7.0 mg L-1 (56%). Por último, los tres tratamientos con 2ip dieron datos menores a 70%. De las cuatro citocininas ensayadas la que obtuvo mejores resultados en cuanto a germinación fue BA (Figura 2).
MULTIPLICACIÓN
Para la multiplicación se utilizaron las mismas citocininas que se emplearon en la germinación. Sin embargo, no todos los tratamientos fueron capaces de inducir la generación de brotes múltiples en Calibanus hookeri.
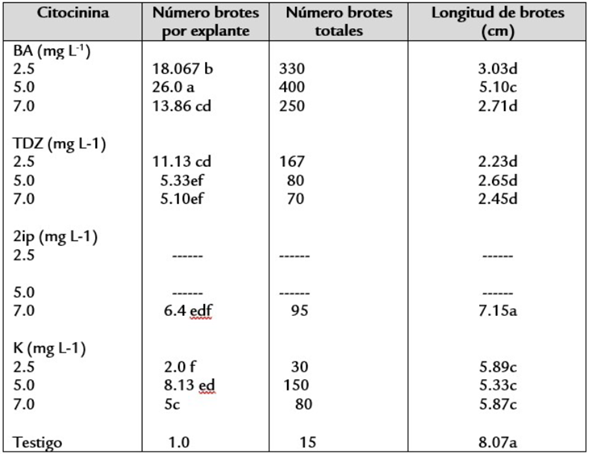
Después de los 28 días se observó que alrededor de 180 brotes dejaron de crecer y no continuaron su desarrollo, algunas de ellas estaban deformadas, posiblemente hiperhidratación, sin producción de brotes, debido a lo cual número de muestras inicial (30), solo quedaron 15 plántulas por tratamiento. En general, el número de brotes generados varió con las distintas citocininas. La prueba estadística demostró que existieron diferencias significativas en el efecto de las citocininas en el número de brotes. Se pueden observar las diferencias significativas entre las concentraciones de BA y el resto de las citocininas. Los tratamientos con BA fueron altamente eficientes produciendo 18, 26 y 13 brotes por explante en las concentraciones de 2.5, 5.0, y 7.0 de BA, respectivamente; el TDZ también mostró alta eficiencia en la formación de brotes, 11.3 por explante solamente en la concentración de 2.5 mg L-1; los resultados más bajos se observaron en 5.0 mg L-1 de K. Se pueden observar las diferencias significativas entre las concentraciones de BA y el resto de las citocininas. Los resultados para la variable número de brotes se muestran en la Figura 3 y en la Tabla 1.
Tabla 1 Efecto de la concentración de cuatro citocininas en el número y longitud de brotes de plántulas de Calibanus hookeri. letra diferente dentro de cada columna indica diferencias significativas (Tukey, α=0.05). BA= 6-benciladenina; 2iP= 2-isopentil adenina;TDZ= tidiazuron; K= cinetina
De acuerdo a los resultados obtenidos en esta investigación se encontraron respuestas similares a las mencionadas por diversos autores para especies de la Nolina y se coincidió que las mejores respuestas se observaron en los tratamientos con BA. Reyes et al., (2013) en la propagación in vitro de Nolinas mexicanas reporta que la mayor respuesta del número de brotes se observó con 3 mg L-1 de BA para Dasylirion leiophyllum, donde se produjeron en promedio más de 10 brotes por explante. La menor respuesta se observó en Beaucarnea goldmanii, que en su mejor tratamiento generó casi cuatro brotes por explante con BA.
Osorio-Rosales y Mata-Rosas (2005) experimentando con varias concentraciones de BA señalaron que con 5 mg L-1 en Beaucarnea gracilis en explantes basales de produjeron 5.4 brotes/explante y en, los explantes fueron inoculados en 3 mg L-1 y la producción fue de 1.9 brotes/explante. Vadillo (2012) encontró que el tratamiento más efectivo para la propagación de Beaucarnea compacta fue el medio de cultivo semi-sólido adicionado con 5 mg L-1 de BA y Aureoles-Rodríguez et al. (2008), en Agave inaequidens indujeron 11.8 y 11.7 brotes en concentraciones de 6 y 8 mg L-1 de BA, respectivamente. Castañeda y Santacruz (2008) reportan para Beaucarnea recurvata L, a una concentración de 7.5 mg L-1 un promedio de 5.8 brotes por explante y Guillén et al. (2015), encontraron que a una concentración de 6 mg L-1 de BA + 0.5 mg L-1 de ANA para la inducción de brotes en hoja produjo 8 brotes en promedio. Con relación al TDZ, los resultados de Reyes et al. (2013), señalan que esta hormona, que es una citocinina sintética de alta actividad y que es usada sobre todo en especies leñosas (Huetteman y Preece, 1993) generan, en las especies de los géneros Beaucarnea y Dasylirion, brotes con hojas curvas y deformes, y en menor cantidad con respecto a 2ip (Reyes et al., 2013). Esto significa que este compuesto tiene efectos no deseables en las especies de Nolinaceae. En C. hookerii se observó el mismo efecto que reporta Reyes et al. (2013), pero solamente en concentración de 7.0 mg L-1 de TDZ, los brotes no desarrollaron hojas y cuando se formaron se deformaron, por lo que este tratamiento se excluyó. En algunas especies de Agave se ha visto que el TDZ resulta más eficiente para la generación de brotes respecto a otras citocininas (Domínguez-Rosales et al., 2008). Sin embargo, para Luna et al. (2014), la proliferación in vitro de brotes de Agave americana var. oaxacensis, se estableció diversas concentraciones de benciladenina (BA) desde 2 hasta 10 mg L-1. El hecho es que las citocininas que se emplearon en este trabajo causen diferentes efectos pudiere deberse a su concentración y a su origen ya que mientras unas son naturales como el 2iP otras son sintéticas como el BA, TDZ y la K (Lu, 1993; Strnad, 1997). Es importante mencionar que no existen antecedentes de la micropropagación de Calibanus hookerii, por lo tanto, es la primera evidencia que con el protocolo establecido en esta investigación es posible lograr su multiplicación masiva.

Figura 3 Respuesta de semilla de C. hookerii a los tratamientos con diferentes citocininas. A. 2.5 mgl_-1 de BA. Formación de tallos adventicios; B. 2.5 mgl_-1 de K germinación con formación de hojas C. 5 mgl_-1 de BA desarrollo de tallos adventicios múltiples; D. 7 mgl_-1 de 2ip. Formación de tallos; E. 7 mgl_-1 de BA. Regeneración de múltiples tallos; F. 2.5 mgl_-1 de TDZ Formación del caudex y raíz; F. Testigo C. Plantas regeneradas de 8 meses con plántulas adventicias mostrando el caudex (flecha) y plantas de 25 meses.
Longitud de brote
Las pruebas estadísticas demostraron que, para la longitud del brote, no hubo diferencias significativas entre las cuatro citocininas. Las mejores respuestas fueron con 7 mg L-1 de 2ip con un promedio de 7.15 cm; la longitud de brotes 5.59 cm se logró con 2.5 mg L-1 de K y con 5 mg L-1 de BA la longitud fue 5.10 cm y 5 mg L-1 de K con 5.33 cm, sin embargo, hay una tendencia que indica que la concentración de 7 mg L-1 de 2ip con un promedio de 7.15 cm es ligeramente más eficiente de los demás tratamientos. Los datos comparativos de las cuatro citocininas se presentan en la tabla 1. Cabe mencionar que la concentración de 7 mg L-1 de 2ip (7.15 cm) fue la única de todas las citocininas ensayadas en donde se observó una respuesta similar al testigo para la longitud de los brotes. En general, la longitud de los brotes varió con las distintas citocininas. La prueba estadística muestra que existen diferencias cuantitativas significativas en el efecto de las citocininas (Tabla 1).
Para Calibanus hookerii, al adicionar K al medio MS, a concentración de 2.5 mg L-1 esta fue de las más bajas en cuanto a la producción de brotes por semilla (2 brotes en promedio), pero fue una de las más altas en cuanto a la talla del brote (5.89 cm). En la concentración con 5 mg L-1 se contó un promedio de 8 brotes por semilla y una la longitud de 7.15 cm que fue la más altas con respecto a los demás tratamientos y similar al testigo. En las observaciones cualitativas la concentración de 5 mgL -1 no regeneró formación de raíz, parece ser y de acuerdo a lo reportado por Vázquez (2001) la K inhibe el desarrollo de raíces.
Es importante mencionar que no existen antecedentes de la micropropagación de Calibanus hookerii, por lo tanto, es la primera evidencia que con el protocolo establecido en esta investigación es posible lograr su multiplicación masiva.
CONCLUSIONES
Se establecieron los protocolos tanto para la aceleración de germinación como para la micropropagación masiva de plantas a partir de brotes obtenidos de semilla de Calibanus hookeri. La adición de las citocininas contribuyó a incrementar la germinación de la semilla de Calibanus hookeri lográndose valores significativos en el porcentaje de germinación en comparación con el testigo. La adición de BA y TDZ fueron de alta eficiencia en la producción de brotes; Sin embargo, las concentraciones de BA fueron muy relevantes en la formación de brotes; el tratamiento con 2.5 mg L-1 de K fue la concentración con menor generación de brotes (30). Los brotes generados, producto de la germinación de las semillas, se pueden emplear perfectamente como planta madre para la micropropagación intensiva de plántulas y para establecer como un procedimiento comercial con una tasa de producción alta. El establecer el protocolo para la producción masiva de plántula se magnifica debido a la dificultad de conseguir semilla. Los resultados confirman que las cuatro citocininas empleadas fueron eficientes y con efecto positivo en el germinación y multiplicación de las plántulas, sin embargo, el uso de BA fue fundamental para inducir la mayor cantidad de brotes y por supuesto para la propagación masiva de Calibanus. Con los resultados observados en esta investigación se muestra que las citocininas estimulan la formación de brotes.