INTRODUCCIÓN
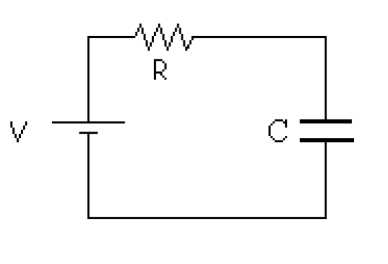
La supervisión de procesos biológicos busca la disminución de tiempo, los costos de proceso y de producción, así como mejorar la exactitud en términos de concentración de biomasa en tiempo real. El proceso de crecimiento de L. casei ATCC 393 es de gran importancia, ya que la caracterización de éstos y la medición de su velocidad de crecimiento en sus diferentes etapas, permite tener el control en los procesos de fermentación ácido láctica. Dado que el método de medición directa por conteo en placa, además de costoso y dispendioso, impide la cuantificación de la biomasa y monitorización en tiempo real, se busca que la aplicación de un método indirecto como la técnica de medición de la bioimpedancia eléctrica disminuya significativamente el tiempo y los costos del proceso (Ivora, 2002). La bioimpedancia eléctrica define dos métodos de aplicación en microbiología: la microbiología de impedancia (MI) y la espectroscopia de impedancia eléctrica (EIE). En MI se monitorea, mediante dos electrodos de metal sumergidos en un medio de cultivo inoculado, los cambios de conductancia del medio o de capacidad de interface, a una frecuencia fija, durante el tiempo de actividad metabólica y crecimiento de los microorganismos presentes (Felice et al., 1988). La EIE mide las propiedades dieléctricas del medio en función de la frecuencia, principalmente en la zona de relajación β, donde se da la carga y descarga de la capacidad de la membrana celular de microorganismos vivos o células viables. Estas determinaciones se basan en el comportamiento eléctrico de la membrana celular, ante el paso de una corriente alterna a través de ella en cada célula viva o reactancia capacitiva. Las aplicaciones de la técnica de MI y EIE en la monitorización de microorganismos, ha permitido correlacionar con aceptable precisión según el modelo de circuito equivalente apropiado (figura 1), parámetros como la magnitud de la impedancia eléctrica, el ángulo de fase, resistencia, capacitancia e inductancia a diferentes frecuencias y voltajes con las características de diferentes medios y tejidos.
El L. casei tiene gran importancia comercial por sus productos metabólicos secundarios (Escobar, 2008) y por su efecto benéfico para la salud como promotores del crecimiento (Rosmini et al., 2004), como probiótico o microorganismo vivo que actúa sobre bacterias patógenas Gram-negativas en el tubo digestivo, por competición de nutrientes y por secreción de bacteriocinas. El L. casei se encuentra de forma natural en vegetales fermentados, leche, carne, intestino, boca y ambiente (Collins et al., 1989), ha sido estudiado in vivo e in vitro y utilizado en procesos de fermentación a partir de varios sustratos (Sumano y Ocampo, 2006), para la producción de biomasa (Montes, 2013) y otras aplicaciones ya que permite analizar las propiedades eléctricas de materiales, biológicos, al inducir señales eléctricas alternas a diferentes frecuencias y medir las señales de respuesta. Se ha utilizado para determinar la madurez en frutos, identificar adulteraciones en productos cárnicos y lácteos, determinar propiedades físico-químicas en todo tipo de matrices alimentarias, incluso para cuantificar microorganismos presentes en alimentos y en superficies de trabajo. Esta técnica es segura, no invasiva, rápida, portátil, de bajo costo y fácil de usar, lo que la convierte en un método con un gran potencial para ser usado en la industria de alimentos, con el fin de monitorear y controlar los procesos de calidad (Caicedo-Eraso et al., 2020).
Por su importancia comercial y para cerrar la brecha tecnológica entre la microbiología clásica y las técnicas de detección rápida, el objetivo principal del presente trabajo fue monitorear en tiempo real, muestras líquidas (caldo de cultivo inoculado) para determinar y comparar la cinética de crecimiento de L. casei ATCC 393, por las técnicas de conteo en placa y EIE en un sistema de crecimiento cerrado.
MATERIALES Y MÉTODOS
Se describe el material y equipo experimental usado, se detalla cómo se realiza la cinética de crecimiento microbiano mediante la cuantificación de la técnica de recuento en placa de células y EIE. Posteriormente, se explica la obtención de los datos experimentales mediante la EIE ajustados a los modelos matemáticos de crecimiento de Gompertz y Boltzman (1825) descritos por Kirkwood (2015). Adicionalmente se explica el diseño experimental y el análisis estadístico.
Cinética de crecimiento microbiano
Como material biológico se utilizó una cepa probiótica de L. casei ATCC 393 en presentación liofilizada y conservada en crioviales con glicerol al 1%.
La cepa de L. casei ATCC 393 liofilizada fue reactivada al ser pre-inoculada en 50 mL de caldo MRS (Scharlau, S.L España) e incubada a 37 °C en condiciones microaerofílicas durante 48 horas. Posteriormente, este pre-inóculo fue transferido a 500 mL de caldo MRS para dar inicio al estudio cinético de crecimiento durante 24 horas.
La cinética de crecimiento se desarrolló en un bioreactor con los 500 mL de caldo MRS bajo condiciones anaeróbicas, agitación lenta (50 rpm) y temperatura constante de 37°C durante 24 horas. Fue monitoreada a partir del tiempo cero (adición del inóculo) en periodos de 1 hora mediante EIE y recuento en placa. Cada estudio cinético se realizó por triplicado.
Recuento en placa
Se realizó el recuento de células partiendo de diluciones seriadas de 1,0 mL de caldo inoculado, en 9,0 mL de agua de peptona tamponada al 0,1 % p/v (pH 7,2±2) homogeneizado en vórtex (Boeco V1 Plus, Alemania). Un volumen de 100 μL de dilución fue sembrado en superficie sobre medio MRS con azul de anilina (0,1 %) e incubado en condiciones microaerofílicas a 37 °C por 48 horas. Los recuentos fueron realizados por duplicado y expresados como UFC/mL.
EIE
Para las mediciones de EIE se utilizó un impedanciómetro (3522-50 LCR Hitester, HIOKI, Japón, 2006). Las mediciones de impedancia para monitorear el crecimiento de L. casei se realizaron tomando 35 mL de muestra cada hora desde el tiempo cero hasta las 24 horas posteriores. Las lecturas realizadas fueron: impedancia (|Z|), ángulo de fase (Deg), reactancia capacitiva (Xc), capacitancia (Cs, Cp) y resistencia en serie y en paralelo (Rs, Rp), en un rango de frecuencias de 1 hasta 1000 KHz. Para la medición se utilizaron 2 electrodos de acero inoxidable (Dentaurum) de 3,5 cm de longitud, con diámetro de 0,9 mm y una separación entre ellos de 2 cm. Los electrodos se sumergen a 2,5 cm de la superficie de la solución (caldo de cultivo con L. casei ATCC 393 inoculadas). Se utilizó un analizador de respuesta en frecuencia (Hioki, Japón) cubriendo un rango de frecuencia de 1 hasta 1000 KHz. A modo de no inducir respuestas no lineales en el sistema, una señal de voltaje alterno de amplitud de 20 mV (menor al voltaje térmico), fue aplicada entre los extremos de los electrodos de acero inoxidable (MacDonald, 1992). El analizador se acopló a un computador por medio de una interfaz RS-232 (9593-01, Hioki Corporation, Japón), la cual cuenta con el respectivo programa para adquisición de datos LCR Sample Program (Ver 4.03E, Hioki Corporation, Japón).
Mediante un ajuste por mínimos cuadrados y con los datos experimentales de impedancia, para cada muestra, se obtuvieron los mejores valores para la resistencia y capacitancia del sistema. Adicionalmente, con los datos experimentales se construyó la curva de crecimiento, la cual fue ajustada por medio de un modelo de crecimiento de donde fueron extraídos los parámetros del crecimiento.
Resultados y discusión
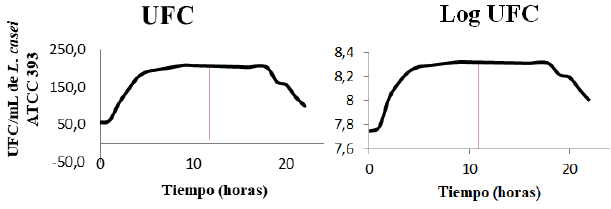
Mediante la técnica de recuento en placa (figura 2), se presenta la fase exponencial o de máximo crecimiento de L. casei a las 9 horas (4,30 E+10 UFC/mL) durante una cinética de crecimiento de 24 horas. En esta fase el microorganismo mostró su velocidad máxima de crecimiento otorgado por su máximo consumo de nutrientes. Entre las 9 y 18 horas entra a una fase estacionaria o de agotamiento de nutrientes, donde quedan probablemente sustancias de desecho liberadas durante la fase exponencial, lo que hace que el medio sea inhóspito para la continuidad del crecimiento microbiano. Desde las 18 hasta las 24 horas se observa un decremento de la población bacteriana en concordancia con lo reportado por Bikandi (2014) y Jurado (2014). Se observa que las tendencias de crecimiento son similares a las que presenta el incremento de |Z|, y la forma opuesta del comportamiento del ángulo de fase.
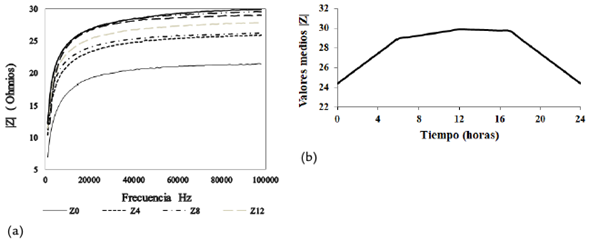
La figura 3a muestra el comportamiento característico del valor absoluto medio de la impedancia en función de la frecuencia en función del tiempo para las muestras analizadas y la figura 3b muestra los valores medios a las frecuencias características durante las 24 horas. La impedancia total crece con el incremento de la frecuencia (figura 3a) y con el aumento de la población de microorganismos, desde 6,2 Ω hasta 29,91 Ω. En la figura 3b se observa que la impedancia media tiene un comportamiento de crecimiento similar al de la población bacteriana de las 0 a las 16 horas. De la hora 16 hasta la hora 24, la impedancia media decrece en el tiempo, siguiendo el mismo comportamiento que el decrecimiento de la población bacteriana. Este comportamiento es atribuible a la mayor cantidad de productos metabólicos, así como al aumento en la cantidad de biomasa con comportamiento capacitivo conforme con Yang et al., (2003).
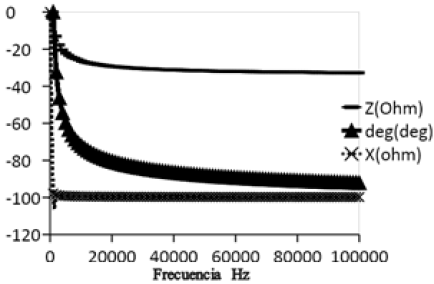
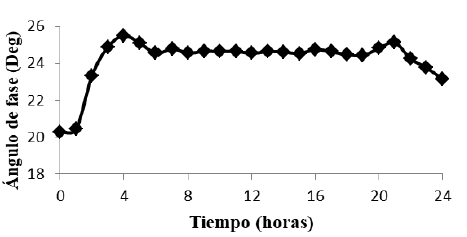
Con base en el circuito RC (figura 1), propuesto como circuito equivalente de elementos distribuidos, se espera que a frecuencias cercanas a cero la mayor contribución a la impedancia sea capacitiva y a altas frecuencias sea resistiva, dado que sobre los electrodos se forman capas iónicas de carga eléctrica alternativamente opuesta. Estas capas se mantienen en equilibrio estacionario con la composición química del medio. Pequeñas modificaciones en el mismo, producidas por el metabolismo microbiano, inducen la redistribución de las capas, y una modificación de la impedancia del electrodo. La figura 4 muestra que existe un decremento en el ángulo de fase con la frecuencia y la figura 5 muestra el comportamiento en el tiempo a las frecuencias características, con un incremento rápido desde la hora 0 y hasta la hora 4 pero a partir de ésta se mantiene constante hasta la hora 21 donde vuelve a descender lentamente, lo que indica un comportamiento tipo capacitivo que se evidencia por el decrecimiento en la reactancia capacitiva como se observa en la figura 6. El cambio es notorio por encima de 40 Hz, límite de la zona de relajación beta. El comportamiento de las figuras de los parámetros eléctricos se atribuye a la existencia de una cantidad mayor de microorganismos viables o con células íntegras, en concordancia con los resultados de Bragós et al. (2006), el valor inicial de éste depende de la cantidad de microorganismos existentes en el medio de cultivo en el momento de inicio.
El comportamiento de la cinética de crecimiento según conteo en placa (figura 2), según el modelo de Gompertz, ecuación 1 (Kirkwood, 2015) y según el modelo de Boltzmann, ecuación 2 (Kirkwood, 2015), se muestran en la tabla 1, siendo el modelo de Gompertz, el que mejor predice el comportamiento. La tabla 2 muestra los valores medios de las capacitancias en faradios (F) y resistencias en ohmios (Ω) a las frecuencias características.
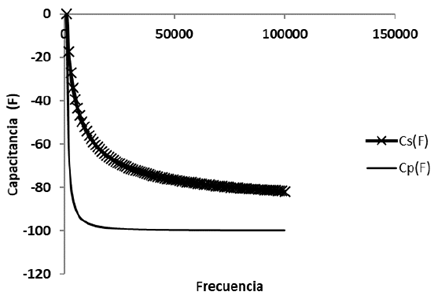
Figura 6 Comportamiento capacitivo a diferentes frecuencias. Cs: capacitan cia en serie, Cp: capacitancia en paralelo.
Tabla 1 Comparación del comportamiento cinético de crecimiento de L. casei ATCC 393.
| Modelo | Pendiente | Intercepto | r2 |
|---|---|---|---|
| Recuento placa | 9 | 5 | 0,99 |
| Gompertz | 7 | 24 | 0,99 |
| Boltzmann | 0,157 | 1,58 | 0,96 |
y = exp{ - exp[ μm/ A (λ - t) + 1 ]} (Ecuación 1 )
Donde μm representa crecimiento máximo y es la pendiente de la tangente en el punto de inflexión; λ es el tiempo de retardo, y se define como el intercepto de esta tangente sobre el eje horizontal y.
y = A2 +( A1-A2) /(1 +e (x-x)/∆x ) (Ecuación 2)
Donde A1, A2, X0 y AX representan un valor inicial, un valor final, el centro y una constante de tiempo, respectivamente.
Para los datos obtenidos de la EIE e igualmente del modelo, el tiempo de la fase de retardo es de 0 a 6 h; la fase de crecimiento exponencial desde la hora 6 hasta la hora 9, fase con tendencia estacionaria hasta la hora 17 y descenso desde la hora 17 hasta la hora 24.
Tabla 2 Valores medios de los parámetros eléctricos en el tiempo
| Tiempo | Cs | Cp | Rs | RP |
|---|---|---|---|---|
| (Hora) | (F) | (F) | (Ω) | (Ω) |
| 0 | 1,65x10« | 3,21 x108 | 7,50x102 | 750,54 |
| 2 | 1,66x10« | 3,22x108 | 7,50x102 | 7,51 x102 |
| 4 | 1,49 x 10-« | 2,86x10-8 | 6,24x102 | 6,25x102 |
| 6 | 1,65x10-« | 3,13x108 | 6,26 x 102 | 6,26x102 |
| 8 | 1,78x106 | 3,21 x108 | 6,06x102 | 6,07x102 |
| 12 | 1,59x10-« | 3,02x108 | 4,77x102 | 4,77x102 |
| 14 | 1,91 x10« | 2,65x108 | 7,20x102 | 7,21 x102 |
| 16 | 1,77x106 | 2,70x108 | 8,66x102 | 8,67x102 |
| 18 | 1,86x106 | 2,90x10-8 | 8,72x102 | 8,72x102 |
| 20 | 1,74 x 106 | 2,87x108 | 4,57x102 | 4,57x102 |
| 22 | 1,35 x10 « | 2,21 x108 | 8,29x102 | 8,30x102 |
| 24 | 1,62x10-« | 2,83x108 | 4,62x102 | 4,63x102 |
CONCLUSIONES
La espectroscopia de impedancia eléctrica fue utilizada para monitorear el crecimiento de L. casei ATCC 393; los valores de la tasa de cambio de impedancia máxima (|Z| máx.) permiten el uso del método de la EIE y el parámetro de impedancia para realizar la evaluación de forma más fácil y rápida.
El crecimiento microbiano puede ser registrado y valorado en corto tiempo con el apoyo del modelo de Gompertz con gran exactitud y aproximación, dado el valor del parámetro de correlación. Las zonas de acondicionamiento y crecimiento rápido determinadas según el modelo de Gompertz, al igual que los puntos de inflexión corresponden con los hallados por recuento en placa. Se considera más ajustado el aporte de la resistencia que el de la capacitancia, dada la interacción electrodo-medio, por lo cual se puede estrechar el rango de frecuencias hasta la zona de relajación beta.
Se ha demostrado que EIE es una herramienta de gran relevancia para el sector biotecnológico, no sólo para agilizar la detección cuantitativa de la máxima concentración de biomasa para una mejor estandarización de formulaciones en la producción de matrices alimentarias funcionales, sino también como un elemento más para el control de calidad de este tipo de productos alimenticios.