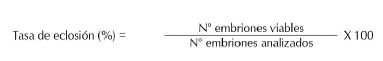INTRODUCCIÓN
Bocachico Prochilodus magdalenae, especie endémica y el principal recurso de la pesquería continental colombiana, fue catalogada como vulnerable a la extinción (Mojica et al., 2012). En los últimos cuarenta años, su captura ha disminuido aproximadamente 67%, pasando de 38000 ton en 1978 a 12728 ton en 2017 (De la Hoz et al., 2017). Entre las principales causas de este declive se señalan la degradación ambiental, la pérdida de conectividad de los ríos, pérdida de planos inundables así como la fuerte presión pesquera. También se le considera una alternativa para la piscicultura de recursos económicos limitados y de seguridad alimentaria por las ventajas que representa su hábito detritívoro, ya que sus cultivos no son dependiente de las dietas comerciales.
La crioconservación de semen de peces es una importante herramienta biotecnológica que se destaca por su contribución al establecimiento de bancos de recursos genéticos, disminución de la presión pesquera sobre las poblaciones silvestres y conservación de especies amenazadas o en peligro de extinción (Boskurt, 2018; Kumar & Betsy, 2015; Atencio-García et al., 2015; Bobe & Labbé, 2009; Medina-Robles et al., 2005). También la criopreservación permite el aseguramiento de semen de calidad, libre de enfermedades y por tanto se considera un método seguro para el suministro de alevinos a la industria piscícola (Cabrita et al., 2014). Además, ayuda a la reducción de los costos en las granjas productoras de alevinos, ya que permite el transporte de semen entre diferentes granjas evitando el traslado de reproductores (Cabrita et al., 2010; Martínez-Páramo et al., 2017; Judycka et al., 2019) y permite reproducciones en cautiverio cuando se presenta asincronía en la maduración gonadal entre machos y hembras (Boskurt, 2018).
Para criopreservar semen es necesario proteger a la célula con sustancias conocidas como crioproptectores que de acuerdo a, su capacidad para penetrar la membrana plasmática pueden ser permeables o impermeables (Xin et al., 2017). Los crioprotectores permeables deben ser hidrosolubles y de baja toxicidad para minimizar los daños criogénicos y evitar la formación de hielo intracelular (Kumar & Betsy, 2015; Moskovtsev et al., 2012).
El semen de bocachico se ha criopreservado utilizando dimetilacetamida (DMA), (Atencio-García et al., 2013) y dimetilsulfóxido (DMSO) (Atencio-García et al., 2015). En ambos estudios el crioprotector permeable estuvo acompañado de yema de huevo (YH) y glucosa como diluyente. Sin embargo, los protocolos de crioconservación son específicos y deben ser optimizado para cada especie (Atencio-García et al., 2014; Glogowsky et al., 1999). Por esta razón hay un interés de buscar protocolos alternativos de criopreservación más eficientes. Un crioprotector interno o permeable que ha sido evaluado con éxito en semen de peces es el etilenglicol (EG) un polialcohol, de bajo peso molecular (62,07 g/mol) y alta permeabilidad celular (Choez, 2016). En el bagre Sorubim cuspicaudus, el semen criopreservado con EG mostró una tasa de eclosión similar a la obtenida con semen fresco (Atencio-García et al., 2014).
Entre los crioprotectores no permeables más usados en la criopreservación de semen de peces se destaca la yema de huevo, en combinación con glucosa como diluyente (Viveiros & Gondinho, 2009). Sin embargo, a pesar de los beneficios de la yema de huevo, su uso podría generar problemas de bioseguridad (riesgo sanitario) que incluyen la producción de metabolitos y toxinas perjudiciales y el riesgo de infección, resultando en la reducción de la calidad del semen (Akhter et al., 2012; Yildiz et al., 2013). Por otro lado, no siempre es posible combinarla con algunos crioprotectores permeables (Maria et al., 2006).
Una alternativa de reemplazo de la yema de huevo es la leche en polvo; cuyas micelas de caseína, interactúan con las proteínas de la membrana plasmática del espermatozoide protegiendo y evitando la remoción de fosfolípidos y colesterol de la membrana (Bergeron & Manjunath, 2006). También se ha sugerido que la caseína tiene un efecto antioxidante y por lo tanto confiere protección a los espermatozoides durante la congelación (Salomon & Maxwell, 2000).
Por tanto el objetivo de este estudio fue evaluar la inclusión de diferentes porcentajes de etilenglicol (6, 8, 10%) y leche en polvo descremada (3, 5, 7%) en la criopreservación de semen de P. magdalenae mediante la determinación de su calidad seminal y capacidad fecundante.
MATERIALES Y MÉTODOS
Obtención del semen
El semen fue obtenido de reproductores de P. magdalenae de dos años de edad (n=23, 0,21±0,02 kg) mantenidos en cautiverio, en estanques en tierra (0,5 kg/m2) en el Instituto de Investigaciones Piscícolas de la Universidad de Córdoba, CINPIC (Montería, Colombia) mediante inducción con extracto pituitario de carpa (EPC, Argent, USA) en dosis única de 4,8 mg/kg de peso vivo (Atencio-García et al., 2013). El semen fue colectado seis horas post-inducción e inmediatamente evaluado con el software SCA® (Microptic, Vet 01, España). Para las pruebas de fertilidad, hembras maduras (n=8, 0,23±0,03 kg) fueron inducidas a razón de 6 mg EPC/kg de peso vivo, en dos aplicaciones, la primera correspondiente al 10% de la dosis total y 12 horas después el 90% restante (Atencio-García et al., 2013).
Tratamientos y criopreservación de semen
El semen fue criopreservado con etilenglicol (EG) (Sigma Chemical, USA) como crioprotector interno, a tres porcentajes de inclusión (6, 8 o 10%) y leche en polvo descremada liofilizada (LP) como crioprotector externo, a tres inclusiones (3, 5 o 7%) para un total de nueve tratamientos, cada uno por triplicado (tabla 1). Como diluyente se utilizó glucosa 6% (0,33 M) previamente calentada a 60°C; luego se adicionó el EG y la LP a los diferentes porcentajes de inclusión. El semen fue diluido en la solución crioprotectora a razón de 1:3 (semen: solución) y envasado en pajillas de 0,5 mL a temperatura de 28±1°C.
Tabla 1 Tratamientos para la crioconservación de semen de Prochilodus magdalenae con etilenglicol (EG) y leche en polvo (LP).
| Etilenglicol (EG) | Leche en polvo (LP) | ||
|---|---|---|---|
| 3% | 5% | 7% | |
| 6% | EG6+LP3 | EG6+LP5 | EG6+LP7 |
| 8% | EG8+LP3 | EG8+LP5 | EG8+LP7 |
| 10% | EG10+LP3 | EG10+LP5 | EG10+LP7 |
El semen envasado en las pajillas fue introducido en un termo de vapores de nitrógeno de 4 L (MVE, SC 4/2v, USA) durante 30 minutos para su congelación. Posteriormente, las pajillas fueron trasladadas a un termo de almacenamiento de 34 L (MVE, XC 34/18, Alemania) hasta su evaluación. Las pajillas se descongelaron por inmersión directa en baño de agua a 35ºC durante 60 segundos, con la ayuda de un baño María serológico programable (Mermmert, WNB 7, Alemania).
Evaluación de la calidad seminal
Volumen seminal y color. El volumen seminal se expresó en ml, se midió en viales aforados y permitió calcular la cantidad de diluyente a preparar. El color del semen se evalúo con el circulo cromático de ROSE y sirvió para evidenciar la posible presencia de sustancias contaminantes como heces, orina o sangre (Atencio-García et al., 2014).
Movilidad total, tipos de movilidad, velocidad y progresividad espermática. Se estimaron con el software SCA® (Microptic, Vet 01, España) y un microscopio óptico de contraste de fase (Nikon, E50i, Japón) con objetivo 10x; para lo cual 0.25 µl de semen se colocaron en una cámara Makler (Sefi Medical Instruments, Israel) y se activaron con 75 µl de agua destilada (dilución 1:300). Se consideró como movilidad rápida (tipo a) al porcentaje de espermatozoide (sptz) con velocidades mayores a 100 µm/s, media (tipo b) a los espermatozoides con velocidades menores de 100 µm/seg pero mayor de 50 µm/s y lenta (tipo c) al porcentaje de espermatozoides con velocidades menores de 50 µm/s (Atencio-García et al., 2013; Atencio-García et al., 2014). El software SCA® también estimó la velocidad curvilínea (VCL); la cual se definió como la distancia recorrida en función del tiempo (µm/s) en la trayectoria real del espermatozoide entre dos puntos; mientras que, la velocidad lineal (VSL) se consideró como una trayectoria lineal del espermatozoide entre el primer y el último punto (Atencio-García et al., 2013).
Tiempo de activación (duración de la movilidad). En una cámara Makler fueron colocados 0.25 µl de semen y activados con 75 µl de agua bidestilada (dilución 1:300). El tiempo de activación se midió desde el instante en que se adicionó la solución activadora hasta que alrededor de 90% de los espermatozoides dejó de moverse, observando en un microscopio óptico de contraste de fase a 10x (Nikon, E50i, Japón).
Concentración espermática. En un Eppendorf de 2 ml se diluyó 1 µl de semen en 699 µL de glucosa 6% (dilución 1:700), la mezcla se homogenizó durante cinco segundos en un vortex a 1200 rpm (Velp Scientifica, Zxclasic, China). Se tomaron 10 µl de la dilución y se colocaron en la cámara Makler para la estimación de la concentración mediante el SCA®. Este procedimiento se realizó por triplicado para obtener un valor promedio de la concentración espermática de la muestra de semen analizado.
Fertilidad y eclosión
Para la evaluación de las tasas de fertilización y eclosión, se tomaron entre 0,5 y 1 g de ovocitos (~ 1500 ovocitos/g) los cuales fueron inseminados con semen criopreservado a dosis de 320000 sptz/ovocito de acuerdo con lo sugerido por Atencio-García et al. (2015). Los volúmenes seminales se adicionaron a los ovocitos con una micropipeta (Transferpette®, CE704174, Alemania) y se activaron con 10 ml de agua destilada a temperatura ambiente (28°C); luego se aumentó el volumen del agua a 50 ml para la hidratación de los ovocitos. Finalmente se depositaron en incubadoras experimentales de flujo ascendente de 2 l de capacidad conectadas a un sistema cerrado de recirculación de agua.
Tasa de fertilización. Se evaluó a las seis horas post-fertilización (HPF), cuando los huevos se encontraban al final de la gastrulación (cierre del blastoporo); con la ayuda de una pipeta de vidrio de 0,5 cm de diámetro se tomó una muestra al azar de por lo menos 50 embriones. Los embriones viables se observaron traslúcidos y de apariencia normal; mientras que, los inviables se observaron opacos y/o blanquecinos. Este conteo se realizó tres veces en cada unidad experimental y luego se estimó un valor promedio para cada unidad. La tasa de fertilidad se calculó utilizando la siguiente ecuación (Espinosa, 2013):
Tasa de eclosión. Se evaluó a las 11 HPF, cuando los embriones se encontraban en fase de faringulación, tomando una muestra al azar de mínimo 50 embriones (por triplicado por incubadora), considerando como viables los embriones traslucidos y con movimiento e inviables aquellos opacos y/o blanquecinos. La tasa de eclosión se estimó utilizando la siguiente ecuación (Espinosa, 2013):
Los procedimientos empleados en la manipulación de los animales, se realizaron utilizando como referencia las normas y procedimientos para el uso de animales en laboratorio, señaladas por el Committe on Care and Use of Laboratory Animal Resources (Janet-Garber, National Research Council, USA 2010).
ANÁLISIS ESTADÍSTICO
Se utilizó un diseño completamente aleatorizado con arreglo factorial 3x3, es decir dos factores (nivel de inclusión de EG y nivel de inclusión de LP), cada uno con tres niveles. Todos los datos, previamente transformados (arcsen), fueron sometidos a pruebas de normalidad (test de Shapiro Wilk) y de homogeneidad de varianza (test de Bartlett), cumplidos estos supuestos se realizó un análisis de varianza (ANAVA) y finalmente para identificar diferencias entre los tratamientos se realizó una prueba de rango múltiple de Tukey (p<0,05). Mediante el análisis factorial se determinó el efecto de cada uno de los factores de manera independiente y su interacción sobre cada una de las parámetros evaluados. Los resultados fueron expresados en media ± desviación estándar (DS). Los análisis se realizaron con ayuda del Software estadístico R, versión R Studio 3.0.1.
RESULTADOS Y DISCUSIÓN
Característica del semen de bocachico. Las características del semen de bocachico obtenido por inducción hormonal con EPC se muestran en la tabla 2. El semen de color blanco, con volumen seminal (mayor de 2 ml) por encima de los reportes previos para la especie por inducción hormonal (0,7-1,3 mL) (Montes, 2018; Atencio-García et al., 2013), con alta movilidad (> 90%), alta progresividad (> 70%), bajo porcentaje de espermatozoides inmóviles, tiempo de activación y concentración espermática dentro del rango reportado para la especie (Montes, 2018; Atencio-García et al., 2013).
Tabla 2 Características del semen de bocachico Prochilodus magdalenae obtenido por inducción hormonal con extracto pituitario de carpa (n=23).
| Características | Media ± DS |
|---|---|
| Volumen (ml) | 2,3±0,4 |
| Concentración espermática (x106/ml) | 18838,8±7271,4 |
| Movilidad total (%) | 94,5±3,4 |
| Tiempo de activación (s) | 28,5±1,5 |
| Rápidos (%) | 55,8±18,8 |
| Medios (%) | 29,7±18,6 |
| Lentos (%) | 10,2±9,3 |
| Inmóviles (%) | 4,2±5,0 |
| Progresividad total | 70,5±10,0 |
| Velocidad curvilineal (µm/s) | 136,0±40,6 |
| Velocidad lineal (µm/s) | 65,0±18,6 |
Efecto de factores e interacción. La tabla 3 registra el efecto de cada factor y su interacción. El porcentaje de inclusión de EG (factor A), en el rango evaluado (6-10%) no afectó significativamente (p>0,05) ninguna de los parámetros de calidad seminal analizadas excepto la tasa de eclosión (p<0,05). Mientras que, la LP (factor B) tuvo efectos significativos sobre el porcentaje de espermatozoides estáticos (p<0,05) y muy significativos sobre las tasas de fertilización y eclosión (p<0,01). De igual forma la interacción de los factores solo afectó significativamente el porcentaje de espermatozoides estático (p<0,05). Los resultados sugieren que la LP es un factor crítico en la capacidad fecundante del semen descongelado de bocachico.
Tabla 3 Efecto de etilenglicol (EG) y la leche en polvo (LP) y su interacción sobre la calidad seminal de espermatozoides de Prochilodus magdalenae.
| Parámetros | Factores | Interacción | |
|---|---|---|---|
| EG | LP | EGxLP | |
| Mt | ns | ns | ns |
| Rápidos | ns | ns | ns |
| Medios | ns | ns | ns |
| Lentos | ns | ns | ns |
| Estáticos | ns | * | * |
| VCL | ns | ns | ns |
| VSL | ns | ns | ns |
| Pt | ns | ns | ns |
| Fertilidad | ns | ** | ns |
| Eclosión | * | ** | ns |
Mt, movilidad total; VCL, velocidad curvilínea; VSL, velocidad lineal; Pt, progresividad total; *, significativo (p<0,05); **, muy significativo (p<0,01); ns, no significativo.
Calidad del semen descongelado. En la tabla 4 se presenta la calidad seminal del semen descongelado. Los resultados del presente estudio, sugieren que el proceso de criopreservación y descongelación ocasionó una disminución de la movilidad total, progresividad, espermatozoides rápidos y medios y un incrementó de los espermatozoides estáticos. Las menores movilidades totales (22,0-24,6%) se obtuvieron cuando el EG se incluyó al mayor porcentaje de inclusión (10%) y la LP a 5% o menos (EG10+LP3 y EG10+LP5). Pero cuando EG se incluyó a 6 u 8% a cualquier inclusión de la LP (3-7%) las movilidades totales (27,8-34,3%) fueron similares a las reportadas (~31%) por Atencio-García et al. (2013) cuando criopreservó semen de bocachico con DMA (8 o 10%) y yema de huevo 12%. En el presente estudio, los menores valores de progresividad total (0,7±0,5%) y velocidades espermáticas (VCL entre 21,7±2,8 y 23,0±2,2 µm/s; VSL entre 5,0±1,1 y 5,3±2,1 µm/s) se obtuvieron cuando EG se incluyó a 10% y la LP a 5% o menos.
Tabla 4 Calidad del semen descongelado de bocachico Prochilodus magdalenae criopreservado con etilenglicol y leche en polvo liofilizada.
| Parámetro | Tratamientos | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| EG6+LP3 | EG6+LP5 | EG6+LP7 | EG8+LP3 | EG8+LP5 | EG8+LP7 | EG10+LP3 | EG10+LP5 | EG10+LP7 | |
| Mt (%) | 28,0±5,4ab | 31,9±9,6ab | 31,1±10,5ab | 27,8±4,8ab | 28,7±15,7ab | 34,3±18,1ab | 22,0±2,0b | 24,6±3,4b | 38,4±18,4a |
| Rápidos | 1,2±0,7ab | 0,9±0,8ab | 0,7±0,8ab | 0,5±0,4b | 0,7±0,7ab | 3,8±8,3a | 0,4±0,2b | 0,3±0,3b | 1,2±1,3ab |
| Medios | 3,3±1,5ab | 6,0±4,6a | 3,7±3,0ab | 3,4±1,1ab | 3,2±4,1ab | 5,3±6,6ab | 1,1±0,7b | 1,3± 0,8b | 5,6±5,0a |
| Lentos | 23,5±3,7ab | 25,0±5,5ab | 26,7±8,8ab | 23,9±3,8ab | 24,9±11,4ab | 25,0±5,4ab | 22,3±5,5b | 22,4±3,1b | 31,5±12,1a |
| Estáticos | 72,0±5,4a | 68,1±9,6ab | 69,0±10,5a | 72,3±4,8a | 71,3±15,7a | 45,6±25,9c | 74,5±6,7a | 49,2±29,1bc | 61,7±18,4abc |
| VCL (µm/s) | 29,1±4,2ab | 31,3±7,4ab | 28,5±6,1ab | 26,7±3,0ab | 26,3±6,0ab | 35,9±23,9a | 23,0±2,2b | 21,7±2,8b | 26,6±6,2ab |
| VSL (µm/s) | 9,5±2,2abcd | 12,9±6,7a | 9,2±3,6abcd | 6,3±1,1bcd | 8,1±5,0abcd | 10,7±7,3ab | 5,0±1,1d | 5,3±2,1cd | 10,6±6,3abc |
| Pt (%) | 3,0±1,5ab | 4,8±4,4ab | 2,7±2,0ab | 1,3±0,9ab | 2,7±3,9ab | 5,9±10,4a | 0,7±0,5b | 0,9±0,4ab | 4,8±5,0ab |
Letras diferentes en una misma fila indican diferencia estadística significativa (p<0,05). EG, etilenglicol (los números indican el porcentaje de inclusión); LP, leche en polvo liofilizada (los números indican el porcentaje de inclusión); Mt, movilidad total; VCL, velocidad curvilínea; VSL, velocidad lineal; Pt, progresividad total.
El EG también ha sido utilizado en la criopreservación de semen de bagres como Sorubim cuspicaudus a inclusiones entre 6 y 10% con registros de movilidades inferiores a 30% (Espinosa, 2013). Atencio-García et al. (2014) reportaron que la mejor movilidad total del semen criopreservado de S. cuspicaudus se obtuvo con EG 5% (36,9±9,1%) y sugirieron una relación inversa entre la movilidad total y los porcentajes de inclusión de EG. Herrera-Cruz et al. (2019) obtuvieron movilidades entre 22,2 y 10,3% cuando criopreservaron semen de Pseudoplatystoma magdaleniatum con EG incluido a 5 o 10%.
La movilidad han sido considerado el parámetros más utilizado para evaluar la calidad del semen fresco como criopreservado . La movilidad del espermatozoide generalmente presenta una correlación positiva con la capacidad de fertilización, porque afecta la capacidad del espermatozoide para alcanzar el ovocito para una fertilización exitosa (Rurangwa et al., 2004). Está ampliamente demostrado que la criopreservación disminuye la actividad metabólica y calidad de espermatozoide criopreservado (Cabrita et al., 2014; Xin et al., 2020). Una de las principales razones de la disminución de la actividad metabólica y la baja calidad de los espermatozoides descongelado es la alteración de las estructuras mitocondriales y la membrana en la parte media durante la criopreservación (Figueroa et al., 2017). Estas alteraciones afectan la función mitocondrial, incluyendo los procesos bioquímicos involucrados en la producción de ATP (Figueroa et al., 2015) y por tanto disminuyen la energía disponible para la movilidad. Los espermatozoides requieren ATP para cumplir con múltiples funciones celulares y eventos bioquímicos, tales como el mantenimiento de la motilidad y la activación de la fosforilación para la fertilización exitosa (Miki, 2010).
Otras de las causas que afectan la movilidad espermática es el daño a la membrana espermática; lo cual ocasiona pérdida de algunos componentes internos de la célula y reducen su actividad enzimática (Dietrich et al., 2015). Martínez-Páramo et al. (2012) consideran que los procesos de congelación y descongelación inducen alteraciones en la bicapa lipídica de la membrana del espermatozoide, ocasionando su desestabilización y la pérdida de componentes celulares. Estas alteraciones no sólo afectan la movilidad y la viabilidad espermática sino también aumentan la peroxidación lipídica y el porcentaje de espermatozoides estático.
Algunos estudios reportan que las proteínas, que generalmente se disminuyen en los espermatozoides durante la criopreservación están asociadas a la disponibilidad de energía para el movimiento como las de actividad catalítica y al ATP (Dietrich et al. 2015; Nynca et al. 2015). Se ha reportado la disminución de la β-enolasa y de la subunidad β de la ATP sintasa mitocondrial, miembros de una superfamilia de enzimas glucolíticas, que se sugieren asociadas a la reducción de movilidad espermática y viabilidad en el proceso de congelación y descongelación, ya que estas enzimas desempeñan un papel principal en las vías metabólicas, como la gluconeogénesis y la glucólisis (Xin et al. 2018).
Otras causas que se reportan como causas de la disminución de la movilidad del semen descongelado, es el criodaño sobre las proteínas citoesqueléticas, como la dineína y la tubulina, que actúan en la movilidad celular (Nynca et al. 2015). Se ha encontrado que las proteínas del citoesqueleto son muy sensibles a los choques térmicos durante el proceso de congelación y descongelación (Xin et al., 2020).
Tasas de fertilidad y eclosión
En el presente estudio, a medida que aumentó la inclusión de la LP disminuyeron las tasas fertilidad y eclosión (figura 1). Los resultados permiten inferir que el porcentaje de inclusión de los crioprotectores (EG y LP) afectan la capacidad fecundante del semen descongelado. Cuando la LP se incluyó a 7% y se combinó con EG, a cualquiera de los porcentajes evaluados (6, 8 o 10%), se obtuvieron las menores tasas de fertilización (19,1-23,5%) y eclosión (13,2-17,7%); pero cuando EG se incluyó a 6 u 8% y la LP a 3%, se obtuvieron los mejores porcentajes de fertilización (54,3-64,2%) y eclosión (47,7-57,5%). Estos resultados sugieren que el crioprotector EG debería incluirse a 6 u 8%; pero la LP no debería incluirse a más de 3%.
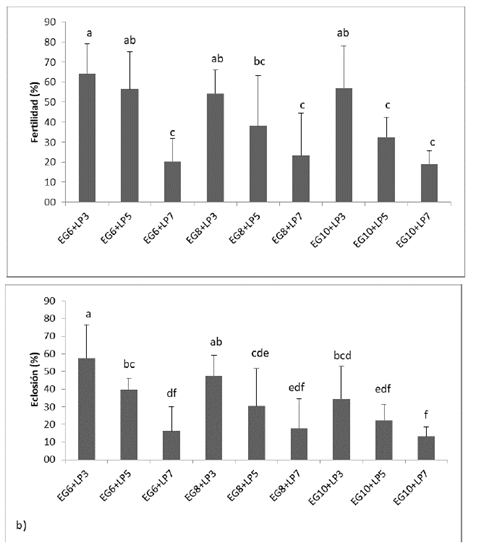
Figura 1 Porcentajes de fertilización (a) y de eclosión (b) con semen descongelado de Prochilodus magdalenae criopreservado con etilenglicol (EG) y leche en polvo (LP) a tres porcentajes de inclusión. Letras diferentes en columnas indicas diferencia significativa (p<0,05). Valores mostrados como media ± DS.
En otros estudios, el semen criopreservado de bocachico con DMSO 10% registró tasa de eclosión de 48,6±4,2% (Atencio-García et al., 2015) y con DMA 8% de 50,1±9,8% (Atencio-García et al., 2013), en ambos caso combinados con yema de huevo 12%. Tasas de eclosión similares a las obtenidas en el presente estudio, con semen criopreservado con EG 6 u 8% combinado con LP 3%.
También, el semen descongelado de S. cuspicaudus mostró adecuada tasa de eclosión (38,6±13,9%) cuando se criopreservó con EG 5% y se observó que inclusiones por encima del 5% disminuyen su capacidad fecundante (Atencio-García et al., 2014); lo cual resalta la importancia de ajustar las inclusiones de los crioprotectores a la particularidad de cada especie.
Por otra parte, a pesar de las bajas movilidades (<28%) obtenidas con EG incluido a 6 u 8% combinado con LP 3%, en el presente estudio, se registraron adecuadas tasas de fertilidad y eclosión. Se ha sugerido que, no siempre altas movilidades, garantizan la viabilidad del espermatozoide durante el proceso de reproducción (Morris et al., 2012). Algunos estudios han reportado bajas tasas de fertilizaciones (<20%) en Anguila anguila (Asturiano et al. 2007) y Acipenser ruthenus (Boryshpolets et al. 2011) con semen descongelado con altas movilidades (~50%). Ramírez-Merlano et al. (2011) con semen descongelado de Pseudoplatystoma metaense sin movilidad (0%) obtuvieron una fertilización del 10%. Algunos autores sugieren que parte de los espermatozoides inmóviles (estáticos) conservan intacta la estructura cromosómica, la cual está contenida en el núcleo de la cabeza, lo que permite la fecundación efectiva (Andrade et al., 2001; Grassiotto et al., 2001). Según Rana et al. (1990) esto es posible porque algunos factores de los ovocitos pueden activar a los espermatozoides inmóviles. Además, Iwamatsu (2000) y Babin et al. (2007) consideran que factores ambientales junto con los factores liberados por los ovocitos, como pequeñas moléculas de polipéptidos sintetizados en el folículo de la célula y acumuladas en el corión, pueden producir hiperactividad de la movilidad espermática en algunas especies de peces.
Por tanto, la capacidad fecundante del espermatozoide más que una buena movilidad o un parámetro en particular, requiere del bienestar integral del espermatozoide o por lo menos en la mayor parte de sus parámetros (Martínez & Pardo, 2010).
A pesar de que la combinación EG10%+LP3%, muestra una tasa de fertilización que no difiere estadísticamente (p<0,05) de las mejores combinaciones (EG6%+LP3% y EG8%+LP3%) del semen descongelado; incluso no difiere de la combinación EG6%+LP5% (figura 1 a). Sin embargo, solo cuando se utilizó semen criopreservado con EG 6 u 8% combinado con LP 3% se obtuvieron las mejores tasas de eclosión. Es importante anotar que la tasa de fertilización se midió a las 6 HPF y en este momento aún falta por expresarse daños a nivel de DNA ocasionados en el proceso de criopreservación y descongelación, que son más visibles en la mayoría de los casos, cuando se mide el porcentaje de eclosión a las 11 HPF. En otros estudios se ha reportado bajas tasas de eclosión en huevos fertilizados de trucha arco iris Oncorhynchus mykiss (Cabrita et al., 2001) y carpa común Cyprinus carpio (Zhou et al., 2006) que mostraron altos niveles de fragmentación del DNA. Entonces, es importante resaltar que la capacidad fecundante del semen criopreservado es más real cuando se evalúa más distante del momento de la fertilización.
CONCLUSIONES
Los resultados del presente estudio permiten sugerir que la solución crioprotectora compuesta por EG 6%, glucosa al 6% y leche en polvo descremada al 3% es una alternativa viable para la crioconservación de semen de bocachico. Concentraciones de LP mayores a 3% pueden tener efecto negativo sobre el espermatozoide de Prochilodus magdalenae, causándole disminución de su capacidad fertilizante.