INTRODUCCIÓN
En los últimos años se ha observado una extensión de la frontera agrícola hacia el oeste semiárido de Argentina (Demaría et al., 2016; Veneciano, 2016), provocando la remoción irracional de flora nativa por la fuerte presión del desmonte (Veneciano et al., 2005). El análisis del estado actual del deterioro de los recursos naturales de Argentina muestra datos cuantitativos respecto a la pérdida de productividad, cambios de estructura en la vegetación y aceleración de procesos erosivos del suelo en las diferentes regiones del país (Casas y Albarracín, 2015 citado en Blanco et al., 2019). Con respecto a San Luis la cuarta parte de los pastizales pampeanos presenta porcentajes de suelo desnudo superiores al 30 % (Demaría, 2015).
Una de las especies presentes en los pastizales pampeanos es Leptochloa crinita (Lag.) P.M. Peterson & N. Snow, especie forrajera clave en los sistemas pastoriles. Esta es una de las especies forrajeras más importantes en las regiones fitogeográficas del Monte y Chaqueña. Se destaca por su buena calidad forrajera, ofreciendo forraje de mediana a alta palatabilidad y con altos rendimientos (Gabutti et al., 2011). Esta especie estival es tolerante a la defoliación, a la sequía y a la salinidad y su presencia en los pastizales es indicadora de buena condición forrajera (Gutiérrez et al., 2016). Estas características ecofisiológicas y productivas la convierten en una especie interesante para conservar y usar su germoplasma en procesos de mejoramiento genético. Las técnicas del cultivo in vitro de tejidos vegetales son una alternativa para conservar y propagar esta especie en peligro de extinción (Laguna, 2019).
Según los antecedentes recopilados con respecto al cultivo in vitro de Poáceas con aptitud forrajera nativa de la provincia de San Luis, se han logrado avances promisorios para establecer protocolos adecuados en la micropropagación. Algunos trabajos relevantes son: Cenchrus ciliaris L. (Carloni, 2016; Lopez Colomba, 2011), Schizachyrium plumigerum (Verdes, 2000); optimización de las condiciones de cultivo in vitro de Sorghastrum pellitum para la obtención de callos (Suarez Follari et al., 2003), el establecimiento in vitro de Eustachys retusa (Morbidelli y Verdes, 2009), establecimiento in vitro de Piptochaetium napostaense (Verdes et al, 2005). En L. crinita, Verdes et al. 2011 establecieron los parámetros ambientales, aspectos nutricionales y asépticos para lograr una tasa de germinación in vitro. Por otra parte, L. crinita cv. Chamical INTA (INTA, 2013) es la primera variedad forrajera nativa obtenida por mejoramiento tradicional y Mora (2007) evaluó la producción de semillas bajo riego y determinando altos rendimientos (724 kg/ha y 1.220 kg/ha), en zonas degradadas de Mendoza.
Considerando la importancia forrajera de esta especie y las posibilidades biotecnológicas para su mejoramiento genético y propagación, el presente trabajo tiene como objetivos evaluar la organogénesis y callogénesis in vitro de L. crinita (Lag.) P.M. Peterson & N. Snow, a través de distintos tratamientos con reguladores de crecimiento y observar la respuesta de diferentes tipos de explantos en esos tratamientos.
MATERIALES Y METODOS
El material biológico que se utilizó fue L. crinita (Lag.) P.M. Peterson & N. Snow “pasto de hoja”. Los explantos utilizados fueron: fruto-semilla maduras, hojas, inflorescencias, meristemas, raíces. Los explantos se desinfectaron individualmente con alcohol 70 %, hipoclorito de sodio 40 % (25 g/l Cl activo) Carbendazim (2-metoxicarbamoil) benzimidazol 5 % (Tabla 1).
Tabla 1 Metodologías de desinfección, tiempos de exposición de los explantos de L. crinita en los desinfectantes.
Para la obtención de callogénesis y organogénesis se evaluaron los efectos de ocho tratamientos que surgen de combinaciones de los reguladores de crecimiento: ácido naftalen acético (ANA), ácido 2,4-diclorfenoxiacético (2,4-D), cinetina, y un tratamiento testigo (Tabla 2). El medio nutritivo utilizado fue Murashige y Skoog (1962) al 50 %. Para cada tipo de explantos y tratamiento se realizaron cinco repeticiones con 5 explantos por repetición.
Tabla 2. Combinación de reguladores de crecimiento, para la obtención de callogénesis y morfogénesis a partir de diferentes explantos de L. crinita.
| Tratamientos | Reguladores de crecimiento (mg l-1) | ||
|---|---|---|---|
| ANA | 2,4-D | Cinetina | |
| I | 0 | 2 | 0 |
| II | 0 | 6 | 0 |
| III | 0 | 12 | 0 |
| IV | 1 | 0 | 0 |
| V | 1 | 0 | 1 |
| VI | 2 | 0 | 1 |
| VII | 0 | 1 | 2 |
| VIII | 0 | 0 | 2 |
| IX | 0 | 0 | 0 |
Nota. El tratamiento IX hace referencia al testigo.
En cada tratamiento se evaluaron la tasa de formación de callos y la presencia/ausencia de organogénesis directa o indirecta. El diseño experimental fue completamente al azar. La normalidad se verificó con la prueba de Kolmorogof-Smirnov, para muestra mayor a 30 o test de Shapiro-Wilks para muestras menores o igual a 30 y la homogeneidad con la prueba de Bartlett. Cuando no se cumplieron uno o los dos supuestos mencionados, se procedió a aplicar un test no paramétrico (Kruskal Wallis) (Sokal y Rohlf, 1995). Las diferencias se determinaron a posteriori con el software R (librería PMCMR). Para el análisis de presencia/ausencia de organogénesis se usó la prueba de Chi cuadrado. Los datos fueron analizados en el software estadístico R 3.5.0 versión libre.
RESULTADOS Y DISCUSIÓN
Con respecto a la desinfección de los explantos, el tratamiento BL fue el único que no presentó ningún tipo de contaminación, tampoco presencia de oxidación ni de necrosis en los explantos, aspectos sí observados en el Tratamiento AL.
De todos los explantos evaluados, solo se obtuvo callogénesis y organogénesis en los explantos fruto-semilla. Para el caso de callogénesis, el test de Kruskal-Wallis arrojó que hay diferencia significativa (p=0.000) entre los tratamientos. Mediante la prueba de Bonferroni-Dunn se determinó entre qué tratamientos se presenta esta diferencia. No se encontraron diferencias significativas entre el tratamiento II y los Tratamientos I y VII (p=0.58956, p=0.41462, respectivamente), y si con el resto de los tratamientos (Gráfico 1). Se puede observar que el tratamiento II obtuvo una media más elevada, determinando que es el tratamiento que tuvo mejor comportamiento con respecto a la variable en estudio.
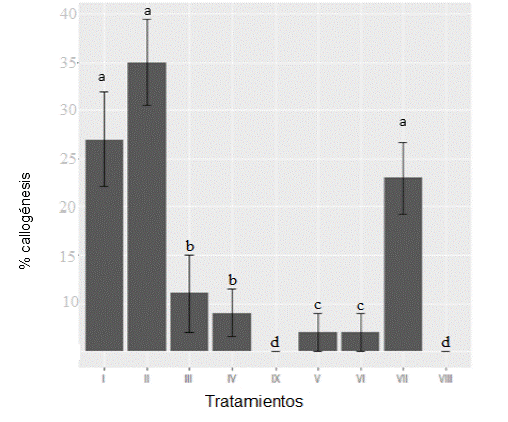
Figura 1 Callogénesis en L. crinita: comparación entre los tratamientos en los cuales letras iguales no presentan diferencias significativas.
Para la variable organogénesis se aplicó un test de Chi cuadrado de independencia y se determinó que la presencia o ausencia de brotes es dependiente del tratamiento (p= 0.000).
Margara (1986) indica que la estimulación de la brotación en cultivo in vitro frecuentemente observado, resulta del empleo de citocininas, eventualmente asociadas a las auxinas. Según este autor, el ANA actúa en una mayor gama de concentraciones y es muy eficaz a dosis débil. En cambio, el 2,4-D favorece la callogénesis y su acción sobre la neoformación de yemas resulta menos ineficiente. Esta afirmación coincide con lo observado en los tratamientos IV, V, VI, VII y VIII, donde la combinación de auxinas con citocininas promovió la organogénesis (En el Gráfico 2 se observa lo descripto). Mientras que en los tratamientos con 2,4-D (I, II, III) se observó la presencia de callos no organogénicos. En un estudio de P. napostaense (Speg.) Hack la combinación de auxinas y citocininas promovió el número de macollos y el tamaño de los mismos, esto fue significativo en medios nutritivos que contenían ANA (1 mg l-1) en combinación con 6-bencilaminopurina (1 mg l-1) (Verdes et al. 2005). Margan (1986), también hace referencia a que la brotación in vitro de las Poáceas es extremadamente variable según especie y variedad, la edad de la planta o de los órganos utilizados, así como el origen y la naturaleza del explanto. Este último factor determinante de la callogénesis y/u organogénesis in vitro estableció que en L. crinita solo en el fruto-semilla se obtuvo respuesta favorable respecto del resto de explantos evaluados.
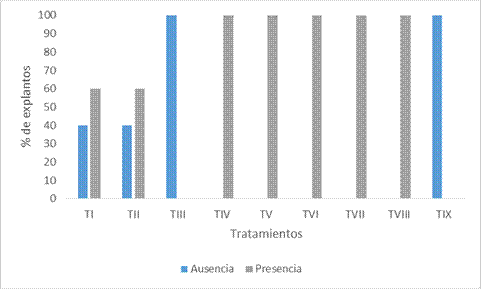
Nota. Desde el TI al TVIII son los tratamientos con reguladores de crecimiento y el TIX es el testigo.
Figura 2 Porcentaje de la presencia o ausencia de la morfogénesis en L. crinita.
En la Figura 3A y la Figura 3B se puede observar la respuesta de L. crinita en el Tratamiento II (2,4-D 2 mg l-1), con presencia de callos amarillentos y morfogénesis indirecta. En el Tratamiento VI (ANA 2 mg l-1; cinetina 1 mg l-1) se presentó la formación de múltiples de macollos y escasa cantidad de callos (Figura 1 C). A su vez en la Figura 1 D se muestra el detalle de la respuesta en el Tratamiento VII (cinetina 2 mg l-1; 2,4-D 1 mg l-1), donde se observa la formación de callos de un color blanquecino y la formación indirecta de hojas y raíces.

Figura 3 Callogénesis inducida a los 40 días de incubación en frutos semilla maduro de L. crinita; A)-B) distintos estadios de callogénesis en el Tratamiento TII. C) Formación de múltiples macollos en L. crinita a los 40 días de incubación Tratamiento TVI ANA: 2 mg l -1 y Cinetina: 1 mg l -1 Luz. D) Morfogénesis indirecta en el Tratamiento VII.
Estas observaciones coinciden con las funciones fisiológicas que cumplen los reguladores de crecimiento en la célula vegetal. Las auxinas producen elongación celular, expansión de los tejidos, división celular (formación de callos) y formación de raíces, inhibición de la formación de vástagos axilares y adventicios. Las citocininas generalmente estimulan la división celular, sobre todo si van acompañada de una auxina, también promueven la formación de vástagos axilares, porque disminuyen la dominancia apical (Pierick, 1990).
CONCLUSIONES
Se establecieron los protocolos de desinfección y para todo los explantos el tratamiento con 10’ en hipoclorito de sodio 40 %, 10’ alcohol 70 % y 24h Carbendazim (2-metoxicarbamoil)-benzimidazol puede iniciar el establecimiento in vitro de L. crinita, sin comprometer la viabilidad de sus explantos. El fruto-semilla como explanto permitió los procesos de callogénesis (6 mg l-1 de 2,4-D) y morfogénesis en los tratamientos que presentaban auxinas combinadas con citocininas. Los resultados obtenidos en el presente trabajo realizan un aporte preliminar y significativo en el desarrollo de biotécnicas para la domesticación, propagación y mejoramiento de especies nativas con valor forrajero para las regiones áridas y semiáridas.















