INTRODUCCIÓN
Ganoderma lucidum (Curt.: Fr.) P. Karst es una especie de la clase Basidiomycetes, que pertenece a la familia Polyporaceae del orden Aphyllophorales (Chang y Miles, 2004). Es un hongo de pudrición blanca conocido por sus atributos medicinales, como generador de longevidad y promotor de vitalidad (Chen, 2005). Contiene numerosos compuestos bioactivos con propiedades anticancerígenas y antitumorales, las cuales parecen estar sustentadas en un fortalecimiento de la respuesta inmunológica del hospedante, más que en un efecto citocida directo (Kim y Kim, 2002; Chang y Wasser, 2017; Montoya et al., 2020; El Sheikha, 2022). G. lucidum como hongo de pudrición blanca es productor de enzimas lignocelulolíticas, lo que le permite degradar una gran variedad de materiales lignocelulósicos por medio de las enzimas que excreta (Asantiani et al., 2008). Las ligninasas como la lacasa (Lc), manganeso peroxidasa (MnP) y otras, son las enzimas responsables de la degradación de la lignina del complejo lignocelulósico y permiten que las hifas del hongo accedan a la celulosa como fuente de energía (Baldrian y Valaskova, 2008; Du et al., 2019). No obstante, G. lucidum hace parte de los hongos que degradan selectivamente la lignina, por lo que utilizan como fuente de energía inicial, otros azúcares diferentes a la celulosa como la hemicelulosa, almidones y otros carbohidratos presentes en los medios de cultivo (Manavalan et al., 2015; Montoya et al., 2020).
La eficiencia biológica (EB) en el cultivo sólido de hongos macromicetos es definida como la relación entre la masa de hongos frescos cosechados y la masa de sustrato seco al momento de la siembra expresada en porcentaje, como una medida del rendimiento del cultivo. La EB de G. lucidum reportada por investigadores y productores comerciales ha sido tradicionalmente baja, entre el 16 % y 18 % aproximadamente (Stamets, 2000; Montoya et al., 2013). Por lo anterior, es una necesidad buscar alternativas para incrementar la EB del hongo. El uso de suplementos en los sustratos es una de las alternativas importantes que se pueden explorar. Es así como en la actualidad se están realizando estudios de suplementación de los sustratos para el cultivo del hongo G. lucidum con sales de minerales y aceites de origen vegetal; así como evaluación de efectos lumínicos (Montoya et al., 2018), especialmente para determinar su efecto en las actividades enzimáticas y capacidad de degradación sobre diferentes colorantes (Levin et al., 2002).
Diferentes enzimas de los hongos de pudrición blanca requieren de la presencia de metales como cobre, hierro, manganeso, molibdeno y zinc, los cuales son activadores o mejoradores de su acción sobre los sustratos objetivo (Elisashvili et al., 2008). El cobre y el manganeso participan directamente en el proceso de degradación de la lignina; el manganeso participa en el ciclo de reacción de la enzima manganeso peroxidasa (MnP) y el cobre sirve como un cofactor en el centro catalítico de la enzima lacasa (Hölker et al., 2004). Sin embargo, la presencia de estos metales debe ser controlada, ya que pueden resultar tóxicos, causando disminución en las tasas de crecimiento y desarrollo en las fases vegetativa o reproductiva y cambios morfológicos en su micelio (Baldrian y Gabriel, 2002; Baldrian, 2003).
Por todo lo anterior, en el Centro de Desarrollo Tecnológico Planta de Bioprocesos y Agroindustria de la Universidad de Caldas (Manizales, Colombia) se han llevado a cabo varias investigaciones relacionadas con la búsqueda del incremento de la EB de diferentes especies de macromicetos de importancia industrial, entre los que se encuentra el G. lucidum. Para este propósito, se han desarrollado diferentes formulaciones de sustratos empleando suplementación química diferenciada con sales de cobre, manganeso y germanio en la búsqueda de incrementar la EB en cultivo de las diferentes especies de macromicetos y mejorar la actividad de varias de las enzimas producidas por estos hongos, como es el caso de las enzimas ligninolíticas (Montoya et al., 2015).
Por lo tanto, este estudio busca cuantificar la actividad de las enzimas lacasa y manganeso peroxidasa (MnP) sobre dos formulaciones de medio de cultivo sólido con sulfato de manganeso (II) y una formulación testigo sin adición de la sal de manganeso. Asimismo, se evaluó el efecto de la adición de sal de manganeso sobre el ciclo productivo de G. lucidum y su eficiencia biológica en relación con la variación de sus actividades enzimáticas.
MATERIALES Y MÉTODOS
Esta investigación se ejecutó en el centro de Desarrollo Tecnológico Planta de Bioprocesos y Agroindustria ubicada a 2280 msnm con una temperatura anual promedio de 17 °C y humedad relativa de 78 %. La determinación de fibras se llevó a cabo en el laboratorio de Nutrición Animal y Vegetal de la Universidad de Caldas, ubicadas en Manizales - Caldas, Colombia.
MICELIO
Se utilizó la cepa de G. lucidum WC806, obtenida de Pensylvania State University Mushrroom Culture Collection (EUA) y mantenida en Agar Papa Dextrosa (APD) (Sharlau, España) a 4 °C con transferencias periódicas, hasta cuatro generaciones de la cepa original.
PRODUCCIÓN DE SEMILLA DE G. lucidum
La producción de la semilla, inóculo o blanco se realizó en dos etapas según la metodología desarrollada por Montoya et al. (2020). La primera etapa consistió en la fase de adaptación del micelio del hongo, para lo cual se inocularon cinco unidades de 1 cm de lado de micelio extendido en APD sobre 200 g de granos de trigo previamente hidratado hasta 40 %, empacado en bolsas de polipropileno biorientado calibre dos y esterilizado por 40 minutos a 121 °C con posterior incubación a 25 °C en penumbra hasta colonización completa. La segunda etapa consistió en la transferencia del micelio adaptado, a unidades de 500 g del mismo cereal hidratado hasta 40 % de humedad, con el mismo procedimiento de la primera etapa y llevadas a incubación hasta colonización completa a 25 °C, con relevos de aire de una hora por día y penumbra.
PREPARACIÓN E INOCULACIÓN DE LOS MEDIOS DE CULTIVO PARA FRUCTIFICACIÓN
La formulación del medio de cultivo en base seca utilizada fue: 50 % aserrín de roble (Colombiana de Barriles S.A.S, Colombia), 27 % cascarilla de café (Compañía cafetera Mesetas S.A., Colombia), 20 % salvado de maíz (empresa Trilladora Granos de Oro, Colombia), 2 % carbonato de calcio comercial (empresa Pulverizar S.A.S., Colombia) y 1 % azúcar comercial.
La mezcla de cada tratamiento se llevó a una humedad entre 60 y 65 %, y se empacó en bolsas de polipropileno biorientado con un tapón de algodón en la parte superior de la bolsa como filtro para facilitar el intercambio de aire. Para la evaluación de variables relacionadas con el ciclo productivo del hongo se emplearon 60 kg de sustrato por tratamiento por triplicado, distribuidos en unidades de 2 kg. Adicionalmente, se utilizaron 5 kg de sustrato por tratamiento y por triplicado, distribuidos en unidades de 200 g (25 unidades por tratamiento y por repetición), con el fin de realizar el muestreo destructivo semanal para las pruebas de laboratorio.
Los sustratos se esterilizaron en autoclave a vapor de 2 m3 de capacidad a 121 °C durante 2 horas. Posteriormente, se inocularon con el 4 % (p/p) de semilla empleando una cabina de flujo laminar (marca Streamline, modelo SCV-6A2 y serie 90517). Las bolsas inoculadas se llevaron a una sala de cultivo piloto con capacidad de 200 kg de sustrato. Los experimentos fueron mantenidos bajo condiciones controladas de humedad relativa, temperatura, intercambio de aire e intensidad de luz requeridas para el crecimiento y desarrollo del hongo.
DISEÑO EXPERIMENTAL
Se realizó un diseño experimental completamente aleatorizado a dos vías. El primer factor, fue la adición de una sal sulfato de manganeso (II) monohidratado (MnSO4 .H2O) (Panreac, Estados Unidos) a tres niveles en %p/p (0 %, 0,05 % y 0,1 %) y el segundo factor, el tiempo de incubación a 14 niveles (una muestra por semana durante 98 días). De acuerdo con lo anterior se realizaron tres tratamientos: (i) tratamiento uno con 0,05 % (500 ppm) MnSO4 .H2O; (ii) tratamiento dos con 0,1 % (1.000 ppm) MnSO4 .H2O y (iii) control con 0 % MnSO4 .H2O. Los tratamientos se realizaron por triplicado dando lugar a nueve experimentos. Los experimentos se realizaron entre el 2017 y 2018. Se seleccionó como unidad experimental 5 g de sustrato colonizado y como variable de respuesta la actividad de enzimas ligninolíticas. Los muestreos se realizaron semanalmente.
DETERMINACIÓN DE ACTIVIDADES ENZIMÁTICAS LIGNINOLÍTICAS
La determinación de las actividades enzimáticas se realizó durante todo el ciclo de crecimiento del hongo (fase vegetativa y reproductiva) correspondiente a 14 semanas. En cada tiempo de evaluación se prepararon extractos enzimáticos usando muestras de 5 g sustrato (por tratamiento y por repetición). La muestra se suspendió en 15 mL de agua destilada, y se sometió a agitación magnética durante 10 minutos a 200 rpm con posterior filtración al vacío. A partir del extracto obtenido se determinaron las actividades enzimáticas ligninolíticas.
Lacasa (E.C.1.10.3.2). Se utilizaron 0,5 mM de ABTS (2,2 '-azinobis (3-etilbenztiazoline-6-sulfonato) (C18H24N6O6S4) (Alfa Aesar, Estado Unidos) en solución 0,1 M de buffer acetato de sodio (preparado con acetato de sodio (CH3COONa3H2O) (carlo Erba, Italia) y ácido acético glacial (Carlo Erba, Italia)) de pH 3,6 como sustrato, según método de Paszczynski y Crawford (1991) en el cual se determinó la absorbancia a 420 nm (å420=36/mM cm) luego de tres minutos de reacción a 30 °C. Una unidad de actividad lacasa (UE) se definió como la cantidad de enzima requerida para oxidar 1 Imol de ABTS en 1 minuto.
Manganeso peroxidasa (E.C.1.11.1.13) (MnP). Se utilizó como sustrato una solución 0,01 % de rojo fenol (C19H14O5S) (Panreac, Estados Unidos) en buffer succinato de sodio (preparado con acetato de sodio (Carlo Erba, Italia) y ácido succínico (Merck, Alemania)) 0,1 M, sulfato de manganeso (II) (MnSO4 .H2O) (Panreac, Estados Unidos) (0,22 g/L), pH 4,5 y peróxido de hidrógeno (H2O2) (Sigma-Aldrich, Estados Unidos) 0,2 mM como iniciador de la reacción. La reacción se detuvo adicionando una solución de NaOH (Panreac, Estados Unidos) 5 N después de 10 minutos de reacción a fin de determinar la absorbancia a 610 nm (å610=22/mM cm).
Una unidad de actividad enzimática (UE) se definió como la cantidad de enzima necesaria para oxidar 1 Imol de rojo fenol en 1 minuto (Paszczynski et al., 1988).
Determinación del contenido de lignina en los medios de cultivo
La determinación del contenido de lignina se realizó a partir de las muestras recolectadas semanalmente durante los 98 días de duración del proceso. La evaluación se realizó mediante el método de Leterme (2010) en el cual se emplea la muestra seca del sustrato, la cual somete a tres hidrólisis en serie (cada una de 75 min): i) hidrólisis con lauril sulfato de sodio (C12H25NaO4S) (Carlo Erba, Italia); ii) hidrólisis en solución de bromuro de amonio (NH4Br) (Carlo Erba, Italia) en ácido sulfúrico (H2SO4) (Merck, Alemania) 1 N; iii) hidrólisis con ácido sulfúrico (H2SO4) (Merck, Alemania) al 72 % (p/v). Al finalizar cada hidrólisis, las muestras fueron lavadas con acetona (C3H6O) (J.T. Baker, Estados Unidos) y secadas a 105 °C hasta peso constante y posterior pesaje de estas. El contenido de fibra se calculó por diferencia de peso para cada hidrólisis.
DETERMINACIÓN DEL CICLO PRODUCTIVO Y LA EFICIENCIA BIOLÓGICA (EB) DEL CULTIVO DE G. lucidum
El ciclo productivo de G. lucidum se definió a través de la duración en días de las diferentes etapas de desarrollo del hongo. Se evaluaron las etapas de crecimiento y desarrollo, incubación, formación de primordios, crecimiento y maduración de los cuerpos fructíferos, durante cada semana por 98 días. Las condiciones ambientales del cultivo en cada etapa se describen en la Tabla 1.
Tabla 1 Condiciones ambientales del cultivo sólido de C. lucidum para los tres tratamientos de estudio.
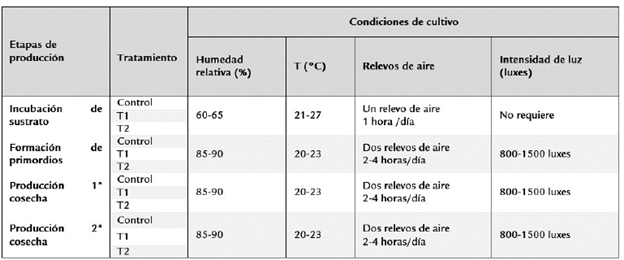
Tratamientos: T1: 0,05% de MnSO4; T2: 0,1% de la sal sulfato de manganeso (II) monohidratado.
La recolección de los cuerpos fructíferos se hizo de forma manual con un bisturí estéril y el peso de los cuerpos fructíferos se determinó inmediatamente después de su cosecha, empleando una balanza de precisión (Kern). Este procedimiento se realizó durante dos cosechas. La producción de los basidiomas (cuerpos fructíferos) se expresó a través del porcentaje de eficiencia biológica (EB) (Ecuación 1), mediante la relación del peso en gramos de los hongos frescos producidos con respecto al peso de sustrato seco al momento de la siembra (Stamets, 2000; Chang y Miles, 2004).
DETERMINACIÓN DEL CONTENIDO DE MANGANESO EN CUERPOS FRUCTÍFEROS Y SUSTRATOS AGOTADOS
La determinación del contenido de manganeso en los carpóforos de G. lucidum y los sustratos iniciales y agotados del cultivo fue realizada utilizando el método de espectrofotometría de absorción atómica de llama según la norma AOAC (Helrick, 1990). Las mediciones se realizaron a muestras secas de los cuerpos fructíferos del hongo y al sustrato agotado de cada tratamiento.
ANÁLISIS ESTADÍSTICO
Se utilizó el programa estadístico Statgraphics® Versión Centurion XVI.II para el análisis de los datos, con un nivel de confianza del 95 %. Inicialmente se realizó verificación de los principales supuestos de la estadística paramétrica como normalidad y homocedasticidad. Posteriormente, se realizó un análisis de varianza y en los casos donde se encontraron diferencias estadísticas significativas entre los tratamientos, se realizó la prueba de Tukey (prueba de comparaciones múltiples) para identificar los tratamientos diferentes entre sí. En el análisis de la EB se empleó el programa estadístico Sigmaplot 14.0.
INFLUENCIA DE LA ADICIÓN DE SAL DE MANGANESO EN LAS ACTIVIDADES ENZIMÁTICAS LIGNINOLÍ- TICAS LACASA Y MANGANESO PEROXIDASA EN CULTIVO SÓLIDO DE G. lucidum
Las actividades enzimáticas ligninolíticas lacasa (Lc) y MnP fueron medidas en los dos tratamientos con sal de manganeso (0,05 % y 0,1%) y el tratamiento control. Estas determinaciones fueron realizadas durante 98 días con muestreos una vez por semana. De las medidas experimentales de actividades enzimáticas obtenidas para los tres tratamientos, en la actividad de Lc no se encontraron diferencias estadísticamente significativas entre los tres niveles del factor, obteniéndose el mayor valor para la actividad en el día 42 de la fermentación con 4,1760 UE/g s.s. para el tratamiento 1 (Figura 1a). La actividad enzimática de la MnP presentó diferencias estadísticamente significativas en uno de los niveles del factor (tratamiento uno) con un valor-p < 0,05. Así, el mayor valor obtenido para este tratamiento en la actividad de la MnP fue de 0,7299 UE/g s.s. a los 35 días de fermentación (Figura 1b).
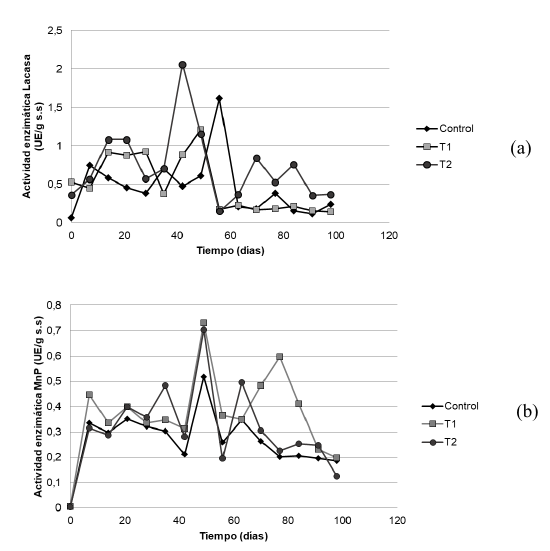
Figure 1 Progreso en el tiempo de las actividades enzimáticas ligninolíticas de Ganoderna lucidum: (a) actividad enzimática de Lacasa (Lc), (b) actividad enzimática de manganeso peroxidasa (MnP)
La actividad de la enzima Lc en el tratamiento uno se mantuvo en ascenso hasta el día 35 del proceso con posterior sostenimiento en los valores hasta el día 70; luego se observó un descenso sostenido de esta actividad hasta el final del proceso. Del mismo modo, para el tratamiento dos se observó un ascenso de la actividad de la Lc hasta el día 42 de la fermentación con 3,70 UE/ g s.s y posteriormente un descenso sostenido hasta el final del proceso. En contraste en el tratamiento control la actividad de Lc no mostró grandes diferencias en los tiempos del proceso que fueron evaluados. El mayor valor reportado para el tratamiento control fue de 2,28 UE/g s.s en el día 63 del proceso, con un posterior descenso hasta finalizar el proceso después del día 77 de la fermentación (Figura 1a).
En la Figura 1b se muestra el progreso de la actividad enzimática de la enzima MnP en los tres tratamientos de estudio. Se aprecia el comportamiento diferenciado entre las actividades de la enzima para los tratamientos uno y dos (formulados con la sal de manganeso II) en el período de 35 a 70 días del proceso, en comparación con el tratamiento control, que para este mismo período mantuvo la actividad de la enzima MnP entre 0,3 UE/g s.s y 0,35 UE/g s.s. Lo anterior, demuestra el efecto directo de la suplementación de los medios de cultivo con la sal de manganeso sobre la actividad enzimática MnP de G. lucidum.
Las actividades enzimáticas Lc y MnP mostraron en común la disminución en su actividad al finalizar el proceso, especialmente después del día 77 en los tres tratamientos evaluados (Figura 1a-1b).
La degradación de la lignina en el tiempo del proceso para los tres tratamientos de estudio se muestra en la Figura 2. Así, la variación del contenido de lignina en los sustratos para los tres tratamientos durante el tiempo de cultivo sólido del hongo fue de 70,4 %, 67,1 % y 28,3 % para los tratamientos 1, 2 y control respectivamente.
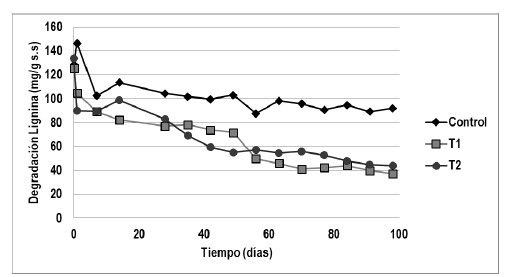
Figura 2 Progreso de la degradación de lignina en el tiempo del proceso para los tres tratamientos de estudio.
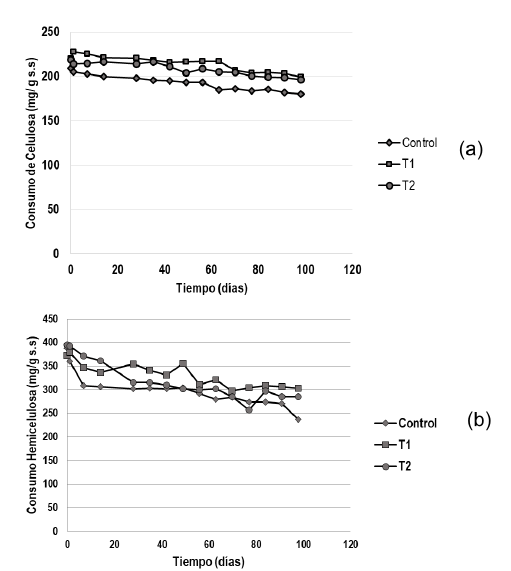
El consumo de celulosa y hemicelulosa presentes en el medio de cultivo sólido de G. lucidum para los tres tratamientos de estudio durante los 98 días de proceso se muestran en la Figura 3. En la Figura 3 (a) se observa la variación del consumo de celulosa en el tiempo para los tres tratamientos, encontrando que el consumo de celulosa para cada uno de los tratamientos control, 1 y 2 fue de 13,85 %, 9,49 % y 10,33 % respectivamente. En la Figura 3 (b) se observa el consumo de hemicelulosa por el hongo en los tres tratamientos control, 1 y 2 durante los 98 días de proceso: 38,86 %, 18,61 % y 27,84 % respectivamente.
CICLO DE PRODUCCIÓN EN CULTIVO SÓLIDO DE G. lucidum SOBRE MEDIOS DE CULTIVO SUPLEMENTADOS CON SAL DE MANGANESO
En este trabajo se realizó el seguimiento del cultivo sólido de G. lucidum en todas las etapas de producción para los tres tratamientos de estudio (dos formulaciones suplementadas con sal de manganeso y el tratamiento control) hasta la determinación de la eficiencia biológica (EB) del cultivo. Para ello, se realizó seguimiento a las etapas de incubación, formación de primordios, crecimiento y desarrollo de los basidiomas en primera y segunda cosecha. En el ciclo de producción del cultivo sólido de G. lucidum en los tres tratamientos de estudio se evidenció que uno de los mayores efectos de la adición de sal de manganeso a los medios de cultivo fue la disminución en los tiempos de duración del ciclo de producción (Tabla 2) y el incremento de la EB (Tabla 3) de los dos tratamientos suplementados con la sal de manganeso en comparación con el tratamiento control. Así, los tratamientos uno y dos exhibieron un ciclo total de cultivo de 83 y 95 días respectivamente en contraste con los 117 días de ciclo total de cultivo para el tratamiento control.
Tabla 2 Duración del Ciclo productivo del cultivo sólido de C. lucidum para los tres tratamientos de estudio.
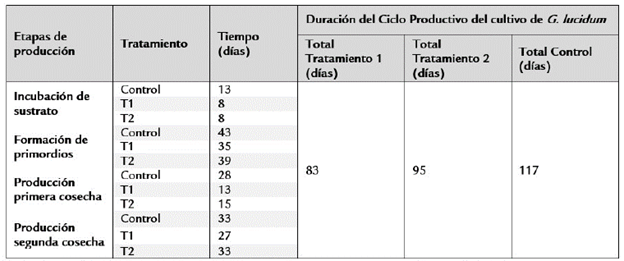
Tratamientos: 11: 0,05% de MsSO4, 12: 0,1% de la sal sultato de manganeso (II) monohidratado.
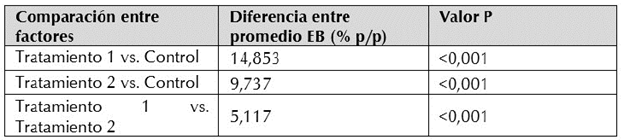
Tabla 3 Comparación entre factores en la variable Eficiencia biológica (EB) para los tratamientos de estudio en cultivo sólido de C. lucidum.
De este modo, la etapa de colonización de los sustratos se completó a los ocho días de la inoculación para los dos tratamientos con sal de manganeso, en contraste con el tratamiento control que para este tiempo aún el micelio del hongo no completaba la colonización (Figura 4a-4c). Para las demás etapas del cultivo, la formación de primordios (Figura 4d-4f) y el crecimiento y desarrollo de los basidiomas (Figura 4g-4i) se observó el mismo comportamiento que para la primera etapa de colonización. Finalmente, se obtuvieron cuerpos fructíferos de los tres tratamientos con diferencia en la productividad para cada tratamiento (Figura 4j-4l).
La EB obtenida para los tratamientos uno y dos fue de (25,90 ± 2,12) % y (20,76 ± 1,52) % respectivamente, en contraste con la EB para el tratamiento control con (11,04 ± 0,71) %. Como se aprecia, la formulación del tratamiento uno presentó el mayor incremento en la EB y menor tiempo en el ciclo de producción total (83 días) (Tabla 2). No obstante el tratamiento dos, también presentó una EB competitiva con (20,76 ± 1,52) % mayor a la obtenida por el tratamiento control.
En el análisis estadístico de los datos de EB, se usó una probabilidad de rechazo de no diferencia entre los tratamientos del 0,05 para todas las pruebas. El test de Shapiro-Wilk mostró el ajuste de los datos a una distribución normal; igualmente el test de Brown-Forsythe mostró homogeneidad de varianzas. El análisis de varianza (ANOVA) usando el método de Tukey mostró diferencias entre el tratamiento 1 y el control, así como el tratamiento 2 frente al control. Igualmente, se apreciaron diferencias estadísticas significativas entre los tratamientos 1 y 2 (Tabla 3).
Para completar la evaluación del efecto de la suplementación de los medios de cultivo para la producción de G. lucidum, se determinó el contenido de manganeso en los cuerpos fructíferos obtenidos y en los sustratos agotados a fin de verificar cuánto manganeso migró a los basidiomas y cuánto permaneció en los sustratos durante el proceso (Tabla 4). Los contenidos de manganeso en los basidiomas se encontraron por debajo de los niveles permitidos de Mn en alimentos con cantidades entre 2,8 y 2,9 ppm. Del mismo modo, el contenido de manganeso en los sustratos agotados (Tabla 4) dejó en evidencia que el metal no se acumuló en los basidio-mas, confirmando la acción de los hongos de pudrición blanca, ya que el Mn es utilizado como cofactor durante la acción de la enzima Mn-Peroxidasa. Es de aclarar que las concentraciones iniciales de sal de manganeso de los medios de cultivo en los tratamientos uno, dos y control medidas para corroborar en laboratorio fueron de 400 ppm, 600 ppm y 350ppm respectivamente, lo que no corresponde con los contenidos presentes en los sustratos agotados de los dos tratamientos y el control. No obstante, en las fermentaciones en fase sólida es frecuente la disparidad en los datos de concentraciones de diversos componentes, debido a la heterogeneidad de los procesos, lo que se afecta según la toma de muestras. Adicionalmente, durante los ciclos de actividad de las enzimas ligninolíticas, los metales que actúan como cofactores, pueden desaprovecharse o inutilizarse por la acción de otras reacciones que se generan durante el metabolismo del hongo o por la acción de las sustancias que se producen por la misma actividad metabólica. El sustrato agotado con menor contenido de Mn fue el de tratamiento control con 181,3 ppm.
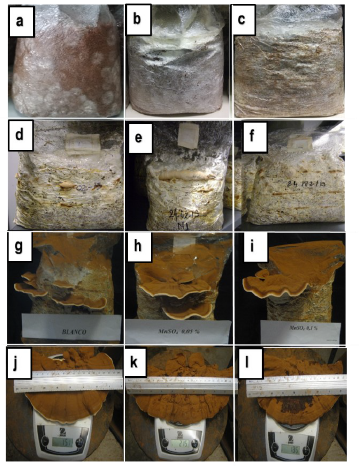
Figura 4 Ciclo productivo de G. lucidum para los tratamientos control, uno y dos de izquierda a derecha, a, b, c: colonización sustrato con ocho días de incubación; d, e, f: sustratos en inicio de formación de primarios; g, h, i: cuerpos fructíferos del macromiceto formados en crecimiento; j, k, l: cuerpos fructíferos de primera cosecha.
DISCUSIÓN
La actividad de las enzimas ligninolíticas presentan dependencia de varios metales que participan como cofactores o activadores de ellas, por lo que en este trabajo se observó una mayor actividad de la enzima cuando los medios de cultivo se suplementaron con los dos niveles de la sal de manganeso. Asimismo, en este estudio no se realizó evaluación de los genes que codifican la enzima MnP, por lo que no es apropiado hacer esta referencia en la discusión.
Las enzimas Lc y MnP cumplen una función determinante en el ciclo de cultivo sólido de los hongos de pudrición blanca que las contienen para la degradación de la lignina. En este trabajo, la acción de estas dos enzimas se evidenció para los tres tratamientos de estudio con una mayor actividad en los primeros 60 días del proceso (Figuras 1a-1b). Asimismo, en la Figura 2 se aprecia que el hongo degradó mayor contenido de lignina en los medios de cultivo suplementados con sal de manganeso (tratamientos I y II) en comparación con el tratamiento control. De hecho, Blanchette (1984) encontró que varios hongos de pudrición blanca como G. tugsae, G. applanatum y otros presentaron una gran capacidad de degradación de maderas con acumulación de manganeso, lo que abrió el camino para nuevas investigaciones relacionadas con la acción que tienen diferentes metales sobre las enzimas ligninolíticas de estos hongos. Asimismo, otros investigadores como Palmieri et al. (2000) realizaron un estudio de la inducción de las isoenzimas de lacasa de Pleurotus ostreatus con Cu II en el medio de cultivo, obteniendo como resultado una respuesta positiva de dicha inducción. Del mismo modo, reportes del efecto de los metales sobre el incremento en la degradación de lignina por diferentes hongos de pudrición blanca fue reportada por investigadores como Levin et al. (2002), y Montoya et al. (2015), quienes encontraron un efecto importante de la presencia del cobre en los medios de cultivos de los hongos de pudrición blanca Trametes trogii, T. versicolor, P. ostreatus y Lentinus edodes en el incremento en la capacidad de degradación de la lignina. Zhang et al., (2019) apreciaron que la adición del ión manganeso en el sustrato incrementó la actividad de MnP de G. lucidum, promoviendo el crecimiento micelial, el rendimiento, y los metabolitos en los cuerpos fructíferos como triterpenoides, manganeso total, principalmente.
De otro lado, en este trabajo se demostró la característica que tiene el basidiomiceto G. lucidum como degradador de lignina en los medios de cultivo donde se desarrolla. Esto consiste en la degradación que las hifas del hongo hacen de un alto porcentaje de la lignina antes de acceder al polímero celulosa, utilizando como fuente de energía otros polisacáridos de cadenas más cortas, como las hemicelulosas, almidones, glucomananos, entre otros. Este hecho ha sido también estudiado por otros investigadores (Mata et al., 2005; Du et al., 2019; Montoya et al., 2020). En la presente investigación se evidenció que el consumo de celulosa por el hongo G. lucidum en los tres tratamientos de estudio fue bajo como se muestra en la Figura 3 (a), con el 13,85 % como máxima cantidad consumida en el tratamiento control durante los 98 días de proceso. Mientras que, el consumo de hemicelulosa fue 38,90 % para el mismo período y el tratamiento control. Por lo tanto, los resultados hallados en este estudio muestran que en un período de cultivo amplio (98 días) del hongo G. lucidum hay un consumo bajo de celulosa y mayor de hemicelulosa y un porcentaje de degradación de lignina considerablemente alto, lo que confirma los hallazgos de otros investigadores.
La calidad obtenida de los cuerpos fructíferos de cada tratamiento fue comparable con lo reportado por Zhou et al. (2012), Hapuarachchi et al. (2018), y Montoya et al. (2020). Sí bien los hongos cosechados de los tres tratamientos presentaron diferencias en tamaño, todos fueron homogéneos en el color marrón y en la forma típica para los diversos usos de los cuerpos fructíferos de G. lucidum. De este modo, en este estudio se logró identificar las diferencias desde el desarrollo micelial durante la fase vegetativa del hongo hasta los basidio-mas listos para cosecha (Figuras 2a-2l) en los tres tratamientos evaluados, concluyendo que las diferencias se presentaron en la velocidad de crecimiento micelial, el tiempo de formación de los cuerpos fructíferos y la cantidad de carpóforos producidos y no en la calidad. Igualmente, en otras investigaciones se ha demostrado el efecto del manganeso en las variables de crecimiento y desarrollo de G. lucidum. En trabajo realizado por Kurd-Anjaraki et al., (2022) se demostró el efecto de varios sustratos en el peso seco, rendimiento vegetativo y de fructificación y la cantidad de elementos minerales en el cuerpo fructífero, de diferentes cepas de G. lucidum. El mayor contenido de nitrógeno en el cuerpo fructífero se apreció en las cepas provenientes de Irán y China (5,88 y 6,25 mg/100 g de materia seca) empleando el sustrato combinado de astillas de madera de álamo y harina de soya (70:30) suplementado con óxido de nano manganeso. El mayor peso fresco total de las cepas iraní y china (109,60 y 127,66 g respectivamente) se obtuvo en el sustrato de astillas de madera de álamo con salvado de trigo (70:30) enriquecido con sulfato de manganeso.
En esta investigación el Mn detectado en basidiomas en los tres tratamientos no debería presentar problemas para la salud, debido a que el contenido promedio en cada tratamiento no excede los niveles máximos de Mn en los alimentos, teniendo en cuenta que una cantidad de ingesta apropiada en una dieta típica es de aproximadamente 1-10 mg/día según la Agencia para Sustancias Tóxicas y el Registro de Enfermedades (2016). Asimismo, con este trabajo se demuestra la capacidad que tiene el G. lucidum para utilizar Mn para incrementar la EB del cultivo sin que ocurra una adsorción importante del metal a los basidiomas. Sin embargo, este mismo atributo se ha utilizado por otros investigadores como Mleczek et al., (2017) y Rzymski et al. (2016) para la producción de suplementos nutricionales y alimentos enriquecidos con elementos esenciales, suplementando los medios de cultivo de G. lucidum y otros macromicetos para alcanzar dicho propósito. Adicionalmente, Siwulski et al. (2017), realizaron un trabajo en el que se comparó la capacidad de bioacumulación de elementos traza por diferentes especies de Ganoderma y en el que se encontró que las especies con mayor capacidad de bioacumulación de metales fueron G. pfeifferi y G. sinense; mientras que en la bioacumulación para especies cultivadas de G. lucidum se encontraron diferencias importantes según la suplementación de los medios de cultivo o el contenido de elementos traza. Sin embargo, en este trabajo se determinó la capacidad que tiene el hongo G. lucidum para retener el metal en el sustrato, ya que a los sustratos agotados se les reportó un contenido del metal similar al de los sustratos iniciales para cada tratamiento. Por lo tanto, se considera promisorio continuar estudios que contribuyan a la verificación del efecto o no de bioacumulación de metales por especies de Ganoderma spp.
En referencia al contenido de Mn que se reportó en los sustratos agotados para los tres tratamientos de estudio es bastante mayor para los tratamientos uno y dos (Tabla 4), por lo que G. lucidum es un hongo promisorio para ser utilizado en tratamientos de biorremediación de suelos o materiales contaminados con Mn. En efecto, hay estudios de otros investigadores con varias especies de hongos de pudrición blanca que están siendo utilizados para tratamientos de biorremediación o micorremediación de colorantes sintéticos, metales pesados y radioactivos (Kuhar, 2013; Chen et al., 2018; Pavel, 2019).
CONCLUSIONES
La tendencia de los resultados permitió evidenciar en la medida de la actividad enzimática MnP que la concentración de 0,5% de sal de manganeso tuvo diferencias estadísticas significativas con relación al control, lo cual demostró que la suplementación del medio de cultivo para G. lucidum con sal de manganeso en esta concentración genera un efecto positivo en esta actividad enzimática.
La adición de MnSO4H2O en niveles de 0,05 % y 0,1 % a los medios de cultivo sólido para la producción de cuerpos fructíferos de G. lucidum incrementó la velocidad de colonización del micelio del hongo, disminuyó el tiempo de inicio de formación de primordios e incrementó la EB en aproximadamente el doble, respecto a la obtenida para el tratamiento control. Asimismo, el Mn adicional en los medios de cultivo de los tratamientos uno y dos no migró a los cuerpos fructíferos obtenidos; hecho que permite inferir que esta clase de suplementaciones se convierte en un aspecto promisorio para la industria de producción de cuerpos fructíferos de G. lucidum.