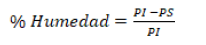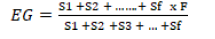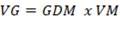INTRODUCCIÓN
El germoplasma vegetal es esencial para la protección de ecosistemas, pero están sujetos a presiones antrópicas, y ambientales debido al cambio climático (FAO, 2014).
Durante la segunda mitad del siglo XX, la necesidad de conservar los bosques de las regiones tropicales se volvió cada vez más evidente. Se realizaron esfuerzos para prevenir la erosión genética, y fueron dirigidos a conservar las diferentes especies de interés mediante el uso de técnicas biotecnológicas que comprendieron la micro-propagación, la criopreservación, el almacenamiento in vitro y la selección in vitro (FAO, 1980).
En el caso del algarrobo, su acelerada deforestación ha llevado a la disminución de individuos que en muchos casos eran catalogados como excelentes árboles semilleros, originándose una importante erosión genética. A esto debe sumarse el hecho de que según Hunziker et al. (1986), las variaciones morfológicas y genéticas observadas en el género incrementadas por el sistema reproductivo, son debidas a fenómenos de hibridación e introgresión por presentar un sistema de fecundación cruzada ya que sus flores son protóginas (Burkart,1976), y a un sistema de autoincompatibilidad, responsable parcialmente de la alta variabilidad (Neff et al., 1977; Simpson, 1977; Simpson et al., 1977; Palacios y Bravo, 1981; Genise et al., 1990), causas que originan semillas de menor valor genético.
Estas variaciones, que se producen en forma natural provocan la disminución de la calidad del bosque reforestado naturalmente, obteniéndose ejemplares de mala calidad maderable, con fustes cortos, torcidos y con una ramificación de baja altura (Conny, 1996; Felker et al., 2001; López et al., 2001). En consecuencia, para mejorar la productividad forestal es necesario lograr y conservar material genético que contenga la mejor combinación de genes para satisfacer la demanda de los programas de forestación y reforestación en el establecimiento de bosques productivos.
El género Neltuma se distribuye desde el sureste de Asia, África tropical y América. En este último continente abarca desde el suroeste de EE.UU. hasta la Patagonia Argentina y Chile. De un total de 31 especies Sudamericanas, 11 son endémicas de Argentina (Burkart, 1976; Hunziker et al., 1986).
La especie N. alba es de elevado interés comercial y ecológico por su importancia como fijadora de nitrógeno, restauradora de suelos y calidad de su madera.
El objetivo del presente trabajo fue analizar diferentes métodos para la conservación ex situ y la propagación in vitro de germoplasma de N. alba Griseb.
MATERIALES Y MÉTODOS
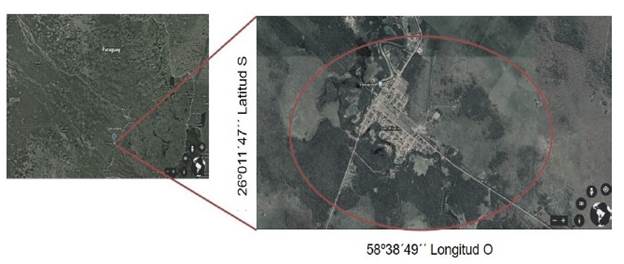
Localización y selección de los ejemplares: Los ejemplares fueron muestreados en la localidad de San Hilario en el Departamento Formosa de la Provincia de Formosa (26°011 '47'' Lat S, 58°38'49'' Long O), Argentina. Según Morello et al. (2012), se localizan en la Ecorregión Chaco Húmedo, Sub-región: Chaco de bosques y cañadas: Complejo Oriental del Bajo Rio Paraguay (Figura 1). Se seleccionaron al azar 10 fenotipos, teniéndose en cuenta las características fenotípicas establecidas en FAO (1980): Fuste: Recto, bifurcado en el tercio superior, sin anomalías, altura entre 8 y 10 m, sin evidencia de ataque de agentes patógenos, diámetro a pecho (DAP) ≥ 25 cm. La georreferenciación de los ejemplares se llevó a cabo con un GPS (Garmin Etrex 10) (Figura 1).
Recolección, extracción y secado de semillas: La recolección de frutos frescos maduros del árbol se realizó durante la segunda quincena del mes de diciembre. Las semillas fueron separadas de los frutos en forma manual. Para reducir el contenido de humedad fueron secadas, aplicándose dos métodos: Silica gel (SG) y secado natural durante 24 h (SN) para evitar daños por congelación al ser sometidas a bajas temperaturas.
El procedimiento de secado se realizó con base en las Normas Internacionales para Bancos de Germoplasma (IPGRI/FAO, 1993; ISTA, 2015).
El contenido de humedad de la semilla fue calculado con la fórmula:
Donde:
PI= Peso Inicial
PS= Peso Seco
Almacenamiento y conservación de germoplasma: Las semillas fueron colocadas en tubos crioviales y sometidas a tres condiciones de temperatura: Nitrógeno Líquido (-196°) (NL) sin crioprotectores; Congelamiento: (18°) (C) y Temperatura Ambiente (24°-30°) (TA) en oscuridad durante 3 meses.
Ensayos de germinación en vivero: Se partió de un total de 400 semillas, que fueron sometidas a un escarificado mecánico para ablandar la cubierta seminal utilizando papel de lija#100 (Zeberio y Pérez, 2020).
Posteriormente, se sembraron en sustrato conformado por tierra de monte y aserrín en una relación 3:1 y fueron sometidas a riego por aspersión en invernadero a 27°± 2°C.
Se registró el porcentaje de germinación, energía germinativa, vigor germinativo, número de plántulas normales y anormales.
La energía germinativa se determinó mediante la fórmula:
Donde:
S1: N° de semillas germinadas él 1 er día. S2:
N° semillas germinadas al 2do día. Sf:
N° semillas germinadas en el día f.
El índice de vigor germinativo se calculó utilizando la fórmula:
Donde:
VG= Indice de Vigor Germinativo
GDM= Germinación Diaria Media.
VM = Valor Máximo de germinación.
La GDM es igual al cociente entre el número total de semillas germinadas y el número total de días que dura el ensayo, y el VM es el cociente máximo que se obtiene dividiendo diariamente la germinación acumulada por el número de días correspondiente (Czabator, 1962).
Evaluación de plántulas provenientes del germoplasma conservado: Con las especificaciones determinadas para el género Robinia, basándose en las definiciones del ISTA (2015), se definieron cinco categorías. 1. Plántulas normales: Sistema radicular y un tallo bien desarrollado, número específico de cotiledones, hojas primarias verdes y extensibles. 2. Plántulas anormales: Raíces defectuosas, con daños, manchas necróticas, grietas. 3. Semillas duras: Las que no absorbieron agua a causa de la impermeabilidad de su tegumento. 4. Semillas frescas no germinadas: Aquellas que permanecieron viables, incluso después de un tratamiento apropiado para interrumpir la latencia y semillas muertas. 5. Semillas que no han produjeron gérmenes al finalizar el periodo de ensayo prescripto.
Tabla 1 Poder, energía y vigor germinativo de semillas de N. alba conservadas y deshidratadas según diferentes métodos.
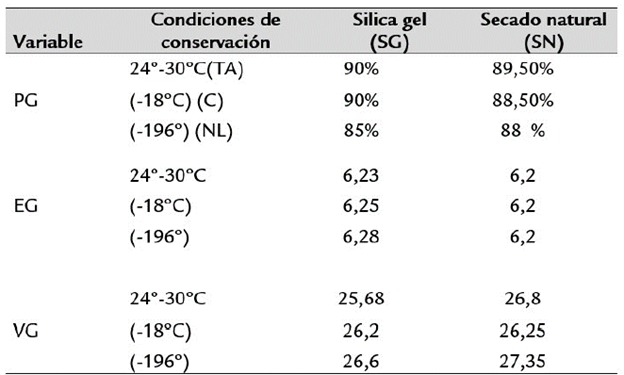
PG = Poder Germinativo; EG = Energía Germinativa; VG = Vigor Germinativo
Regeneración in vitro del germoplasma conservado: Las microestacas obtenidas de plántulas de vivero de 1,5 a 2 cm de longitud conteniendo una yema lateral fueron desinfectadas en alcohol 70% durante 3 minutos, hipo-clorito de sodio (Na OCl) al 2% durante 30 minutos más dos gotas de Tween, y se enjuagaron 3 veces con agua destilada esterilizada.
Posteriormente, se cultivaron en tubos de 25 x 150 mm que contenían 20 ml de MS suplementado con 3 mg L-1 AIB (ácido indolbutirico) y 0,05 mg L-1 CIN (cinetina) durante 7 días. El pH fue ajustado a 5,8 y los medios de cultivos fueron esterilizados en autoclave a 1 atm de presión y 120°C durante 30 minutos (Castillo de Meier et al., 1999; Sánchez Sotomayor, 2021).
La siembra se llevó a cabo en Cámara de Flujo Laminar. Cuando las yemas elongaron, se seccionaron en segmentos nodales de aproximadamente 2,0 cm de longitud, de acuerdo a la metodología descrita por Castillo de Meier et al. (1999); Noguera et al. (2013); Rivera Curi (2020), cultivándose posteriormente en medio basal (Murashige y Skoog, 1962) a un 1/3 de concentraciones de sales sin reguladores de crecimiento.
Se emplearon 30 tubos de ensayo (150 x 25 mm) con 10 ml de medio de cultivo y un explante por tubo, los cuales se incubaron en cámara de incubación a 27°C ± 2°C, bajo luz blanca fluorescente continua de 150 mmol.m-2.s-1 con un fotoperíodo de 16:8 h de luz: oscuridad.
Análisis Estadístico: Ensayos de germinación en vivero: Se utilizó la prueba no paramétrica de Kruskal-Wallis con un nivel de significación del 5%. Se analizaron las variables independientes: Efecto de los métodos de conservación, y efecto de los métodos de deshidratación.
Las variables dependientes fueron: Poder Germinativo (PG), Energía Germinativa (EG), Vigor Germinativo (VG).
Las variables: número de plantas normales (PN), número de plantas anormales (PA), número de semillas duras (SD), número de semillas frescas (SF) y número de semillas muertas (SM) fueron analizadas a través de un ANO-VA paramétrica.
Se aplicó también, un Análisis de Correlación para determinar la relación existente entre las variables estudiadas, para determinar algún tipo de correlación, es decir si ambas se correlacionaban positivamente (aumentando a la par) o negativamente (aumentando una y disminuyendo la otra), dependiendo de los valores numéricos medidos.
Ensayos de regeneración in vitro: Se utilizó un diseño experimental completamente al azar. Se analizaron las variables independientes: Efecto de los métodos de conservación, y efecto de los métodos de deshidratación. La variable dependiente considera fue: Porcentaje de microestacas enraizadas.
Los diferentes métodos de deshidratación y conservación aplicados no afectaron de manera significativa a los parámetros de germinación, evidenciándose una buena respuesta a la deshidratación y almacenamiento.
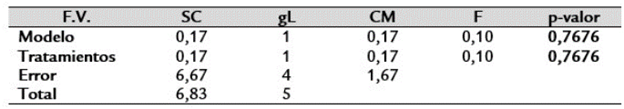
Prueba de Kruskal Wallis: No se registraron diferencias significativas entre las variables evaluadas (PG=0,1875; EG= 0,2721; VG=0,5141) (p < 0,05).
Evaluación de plántulas provenientes del germoplasma conservado: A los diez días después de la siembra se procedió al recuento final de plántulas normales y anormales (Figura 2a y 2b).
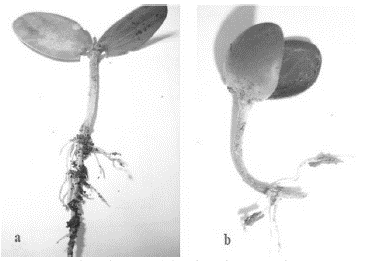
Figura 2 a) Plántula normal, b) Plántula anormal provenientes de semillas de N. alba crioconservadas (NL) y secadas en silica gel.
Se observó un elevado número de plántulas normales (174 a 176) en los diferentes tratamientos realizados (174-177), escaso número de plantas anormales (2 a 4), y número de semillas muertas (20 a 23) según el tipo de conservación y temperatura aplicada (Tabla 2).
Los datos obtenidos fueron analizados a través del software InfoStat versión 2017 (Di Rienzo et al., 2017).
RESULTADOS
Ensayos de parámetros de germinación: Los contenidos de humedad alcanzados por medio de los métodos de desecación empleados oscilaron entre un 4,23% (SG) y 5,79 % (SN).
La germinación inició a partir del 4° día de haberse sembrado las semillas y finalizó al 9° día. El mayor porcentaje de germinación se alcanzó al 6° día de haberse realizado la siembra. Los porcentajes de germinación oscilaron entre un 8,50% en SG-NL y un 90% en SG-TA y SG-C.
Prueba de ANOVA paramétrica: No se registraron diferencias significativas entre tratamientos (p (0,7676 ≥0,05) (Tabla 2).
En la Tabla 3 se registraron los resultados del Análisis de Correlación entre las variables número de PN, PA, PG, EG y VG.
Tabla 3 Matriz de correlación de las variables plantas normales (PN), plantas anormales (PA), semillas muertas (SM), poder germinativo (PG), energía germinativa (EG), vigor germinativo (VG).
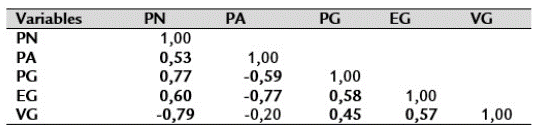
PN= Plantas Normales, PA= Plantas Anormales, SD= Semillas Duras, SF= Semillas Frescas, SM= Semillas Muertas, PG= Porcentaje de semillas germinadas, EG= Energía Germinativa, VG" Vigor Germinativo.** La correlación es significativa al nivel 0,01 (bilateral).
La matriz de correlaciones indicó que existen correlaciones lineales leves (|r| > 0,4), donde la relación predominante es positiva de carácter creciente y a medida que crece una variable, su parámetro correlacionado crece conjuntamente con él, tal como ocurrió con PN y PA (0,53), PN y PG (0,77). PN y EG (0,60), PG y EG (0,58), PG y VG (0,45), EG y VG (0,57).
La energía germinativa varió de 74,1% en SN-TA y SG-C a 75,45% en SN-NL y SG-NL (Tabla 1). El mayor VG se obtuvo cuando las semillas fueron sometidas al SN y conservadas en NL (27,35). Al finalizar el ensayo (9° día) no se observaron semillas duras en ninguno de los tratamientos, detectándose entre 20 y 23 semillas muertas en todos los tratamientos (Tabla 1).
Paralelamente se halló que existen correlaciones bajas y negativas como, por ejemplo, PN y VG (-0,79) indicando que mayores PN suelen estar asociadas con bajos VG. A la vez, se observó que mayores PA se correlacionaban con bajos PG (-0,59) y bajos VG (-0,77).
Las correlaciones más significativas, fueron PN con PG (0,77) y PN con EG (0,60).
Regeneración in vitro del germoplasma conservado: En la fase de multiplicación se obtuvieron entre 4 a 5 segmentos nodales por tubo dependiendo del crecimiento de cada explante.
Sé observó un elevado porcentaje de microestacas enraizadas (87 y 90%). El análisis estadístico con la Prueba de Kruskal Wallis no registró diferencias significativas (p ≤ 0,8015) entre tratamientos (Tabla 4 y Figura 3).
DISCUSIÓN
El almacenamiento del material a conservar en forma de semillas constituye una de las estrategias más importante para preservar y propagar, especies que se hallan amenazadas y/o que su hábitat natural esté ampliamente transformado (Cárdenas et al., 2015).
El entorno, y la temperatura de almacenamiento establece la longevidad máxima para una muestra de semillas. Se recomienda la temperatura de -18 °C para el almacenamiento a largo plazo, para ello se deberá mantener la temperatura de almacenamiento dentro de un rango de ± 3°C respecto de la temperatura fijada (FAO, 2014).
FAO (2014), establece que las condiciones de secado deben determinarse utilizando las isotermas de adsorción de agua que muestran la relación entre la cantidad de agua en las semillas, y su humedad relativa.
Para el almacenamiento a corto plazo, las semillas deben secarse a la temperatura a la que se hayan almacenado (FAO, 2014).
Las condiciones óptimas para el almacenamiento de semilla según el IPGRI (1993) son temperaturas bajas (18°C) y un rango de humedad de las semillas de 3 a 7%, valores que concuerdan con los resultados obtenidos en el presente trabajo (4,23 y 5,78%). De igual modo, investigaciones realizadas por Joseau et al., (2021) informan que en el Banco Nacional de Germoplasma de Neltuma, las semillas de N. alba, N. nigra, N. flexuosa, N. chilensis, N. caldenia Burkart, N. ferox Grisebach, N. hassleri Harms, N. kuntzei Harms, y N. affinis Grisebach Sprengel, son almacenadas en envases plásticos herméticos, con una bolsa que contiene sílice gel para mantener la humedad entre 6-9 % en condiciones de congelamiento a (-18°C).
Estos resultados de tolerancia a la desecación confirmaron que las semillas de N. alba presentan un comportamiento ortodoxo, confiriéndole la capacidad de tolerar la deshidratación hasta 5% del contenido de humedad.
Los Bancos de Germoplasma tienen por objetivo almacenar semillas para mantenerlas con vida el tiempo suficiente para su distribución a los usuarios. Pero, el aumento de la longevidad mediante el secado tiene un límite, debido a que la máxima longevidad para la temperatura de almacenamiento se alcanza a un nivel crítico de humedad, a partir del cual el secado no incrementa la longevidad de las semillas (FAO, 2014).
En el presente estudio, como en N. ruscifolia (79% Abdala et al., 2020), y N. laevigata (60% Muñoz Gutiérrez, 2022) se han obtenido elevados porcentajes de germinación de semillas con plántulas normales.
Cuando las semillas fueron almacenadas a (-18°C) se registraron los mismos porcentajes de germinación (95%) que en el tratamiento anterior. Valores diferentes fueron informados por Spoljaric y Ojeda (2009), quienes llevaron a cabo análisis de semillas de N. alba conservadas en cámara de frio (-18 °C) por más de diez años, obteniendo una disminución de la Energía y Capacidad Germinativa con el tiempo, sumado al deterioro de las mismas debido al ataque de microorganismos. Sin embargo, Verzino et al. (2019), afirmaron que las semillas de N. chilensis pueden permanecer viables hasta por 25 años en condiciones óptimas.
Otras leguminosas como Albizia lebbeck (L.) Benth., y Bauhinia purpurea L. pierden drásticamente su viabilidad entre los 2 y 9 meses después de almacenadas (Molina y Navarro, 2021).
Además de conservar el material vegetal en Bancos de Germoplasmas, se debe realizar la propagación clonal in vitro del mismo, debido a que dicha técnica reviste cada día mayor importancia para propagar especies de interés económico en forma rápida y a gran escala.
En especies del género Neltuma la organogénesis directa se puede iniciar con secciones nodales provenientes de semillas germinadas in vitro y de plantas silvestres de 5 y 20 años de edad, lográndose el enraizamiento en medio de cultivo MS suplementado con AIB 0,5 mg L-1 o ANA (Ácido 1 naftalenacético) 0,1 mg L-1 (Castillo de Meier y Bovo, 2000).
Por otro lado, Rivera Curi (2018), sostiene que la propagación de N. pallida (Willd.) Kunth, se puede lograr en MS sin reguladores de crecimiento, debido a la presencia de auxinas en las yemas apicales, y para evitar que las altas concentraciones de iones amonio, nitrato, cloruro molibdato generan toxicidad en las plántulas por ser una especie recalcitrante.
Los resultados alcanzados en el enraizamiento de micro-estacas, empleando como material inicial plántulas de semillas provenientes del germoplasma almacenado estuvieron en el orden del 87 y 100%.
Estos resultados concuerdan con los obtenidos en otras especies: N. hassleri (73% Castillo de Meier, 2004; 9094% Castillo de Meier y Vega, 2008), N. cineraria (87% Venkatachalam et al., 2017); N. pallida (67% Rivera Curi et al., 2020); N. limensis (94,8% Sánchez Sotomayor et al., 2021), quienes lograron obtener elongación y enraizamiento de vástagos provenientes de material juvenil.
CONCLUSIONES
Los resultados de este trabajo determinaron que el almacenamiento de semillas a 24°-30°C resulta ser el más apropiado para alcanzar altos porcentajes de germinación. Estos resultados resultan de importancia para viveristas, confirmando la posibilidad de almacenamiento de semillas de N. alba en medios de baja tecnología.
El alto porcentaje de germinación de semillas almacenados a -196°C indica tolerancia de las mismas a temperaturas bajo cero.
La regeneración de plántulas provenientes de semillas conservadas a mediano (-18 °C), y largo plazo (-196 °C), a través del cultivo in vitro de tejidos vegetales es factible partiendo de segmentos nodales indicando la alta calidad fisiológica de las semillas y vigorosidad de las plantas donantes.