INTRODUCCIÓN
La salinización es un problema ambiental global que actúa como una fuerza selectiva en los ecosistemas acuáticos de agua dulce (Kefford et al., 2016) por el estrés salino que afecta la supervivencia, el desarrollo, la reproducción, el comportamiento y la fisiología de la biota (Hassell et al., 2006; Santos et al., 2007; Rind et al., 2017; Dornelas et al., 2020). Aunque en Colombia, se tiene mayor seguimiento al exceso de sodio (sodización) en suelos y la disminución de productividad vegetal (Flórez et al., 2018), es poco lo que se conoce sobre su impacto en los sistemas acuáticos de agua dulce.
El cloruro (Cl−) es uno de los principales aniones inorgánicos del agua, se distribuye ampliamente en la naturaleza, generalmente como sales de sodio (NaCl) y potasio (KCl), formando aproximadamente el 0,05% de la litosfera (Pal y Chakraborty 2017). Su presencia en aguas dulces se asocia a la erosión de las rocas y a la entrada de agua subterránea salina (Schuler et al., 2019). Actividades antropogénicas como descarga de aguas residuales domésticas, prácticas de riego inadecuadas, remoción de vegetación para la agricultura, la minería, los residuos industriales y la aplicación de fertilizantes contribuyen con la salinización del agua dulce (Cañedo-Argüelles et al., 2013, 2016), siendo un tensor adicional a los ya conocidos y con impactos negativos sobre la biota acuática. La toxicidad que puede ejercer el NaCl u otras sales en ecosistemas acuáticos de agua dulce puede tener efectos en un número sustancial de especies. Es por tanto importante proyectar investigaciones que evalúen los efectos de sustancias químicas sobre diferentes biomodelos acuáticos que permitan monitorear el impacto de la contaminación en sistemas acuáticos tropicales.
En ecotoxicología acuática el aseguramiento de la calidad analítica de estos ensayos es un componente fundamental ya que evalúa las condiciones de manejo, sensibilidad de los organismos de experimentación y construcción de cartas control con tóxicos de referencia, con metales como cromo, cadmio, cobre, zinc y/o compuestos orgánicos (Karntanut & Pascoe, 2002; Buratini et al., 2004; Díaz- Báez et al., 2004). Se propone en este trabajo el uso de cloruro de sodio (NaCl) como una alternativa más segura, pues su manipulación posee bajos riesgos y evalúa la reproducibilidad de los ensayos bajo condiciones de laboratorio (Santos et al., 2007; Barrera et al., 2019). Por tanto, las pruebas ecotoxicológicas contribuyen con la evaluación de riesgos ambientales y en este caso predecir las consecuencias ecológicas del estrés salino en los ecosistemas de agua dulce en las regiones tropicales (Dornelas et al., 2020).
Los hidrozoos son un grupo de cnidarios preferencialmente marinos con una amplia gama de estrategias de ciclo de vida (Bouillon et al., 2006), aunque existen pocas especies de agua dulce, siendo el género Hydra el más conocido (Goffredo & Dubinsky, 2016). Las hidras presentan principalmente, reproducción asexual por gemación, lo que permite que en cortos periodos de tiempo y en condiciones favorables se alcance una alta densidad poblacional, se reporta que luego de alcanzar una densidad representativa exhiben estrategias de reproducción sexual que les permite regular la población, incluso cuando la cantidad de alimento no se altera (Kaliszewicz & Lipińska, 2013). Establecer las condiciones óptimas de alimentación para las hidras es clave para realizar pruebas de ecotoxicidad posteriores, pues una alimentación inadecuada puede disminuir la tolerancia al estrés tóxico (Tökölyi et al., 2014) y/o generar sobreestimación en las evaluaciones ecotoxicológicas. Esto evidencia que la tolerancia al estrés en poblaciones de Hydra se modula dinámicamente en respuesta a señales sociales (densidad), ambientales y nutricionales del entorno (Tökölyi et al., 2014; 2016).
Hydra vulgaris Pallas 1766 (conocida también como H. attenuata) (Anthoathecata: Hydridae) se ha utilizado para evaluar la toxicidad de numerosos contaminantes (MacKinley et al., 2019) como desreguladores endocrinos, nanomateriales, compuestos metálicos, efluentes industriales, agua potable y agua cruda (Blaise & Kusui, 1997; Trottier et al., 1997; Díaz et al., 2004; Quinn et al., 2012; Murphy & Quinn, 2018; Espinosa, 2018; Barrera et al., 2019; Auclair et al., 2020). Mientras que Hydra viridissima Pallas 1766 es preferida en evaluaciones de fármacos, nanomateriales y mezclas de contaminantes (Tökölyi et al., 2014; Prouse et al., 2015; Venâncio et al., 2020; Lee et al., 2020).
Este trabajo evaluó la sensibilidad de H. vulgaris a la toxicidad al NaCl comparativamente con H. viridissima, la última posee una asociación mutualista con el alga simbionte Chlorella vulgaris Beijerinck 1890 (Kawaida et al., 2013; Kobayakawa, 2017), con el propósito de identificar respuestas diferenciadas a los estresores ambientales a nivel de género (Lee et al., 2020). Se obtuvo información sobre la tasa de crecimiento (como medida del crecimiento de la población) y las concentraciones: efectiva media (CE50) y letal media (CL50) como respuesta a concentraciones crecientes de NaCl con valoración por cambios morfológicos de tentáculos y columnella.
MATERIALES Y MÉTODOS
Aclimatación y mantenimiento de biomodelos. Este trabajo se desarrolló en el laboratorio ECOTOX del grupo de investigación Unidad de Ecología en Sistemas Acuáticos (UDESA) de la Universidad Pedagógica y Tecnológica de Colombia (UPTC sede Tunja), donde se propagaron las cepas de las especies H. viridissima e H. vulgaris bajo condiciones controladas: fotoperiodo (16h:8h) e iluminación (800 luxes), temperatura (20 ± 2°C). Los cultivos se desarrollaron en agua potable embotellada con las siguientes condiciones físicas y químicas; dureza (45,6 mg/l CaCO3; n=3), alcalinidad (93,56 mg/l CaCO3; n=3), pH (7,14 unidades; n= 3), oxígeno disuelto (4,5 mg/l; n=3). Con alimentación con nauplios de Artemia salina recién eclosionados, según lo sugerido por Blaise & Kusui (1997) y Díaz et al. (2004).
Tasa de crecimiento (K). Se separaron cinco individuos adultos y diariamente se registró el número de yemas o hidrantes obtenidos durante una semana con alimentación constante (Díaz et al., 2004). La tasa de crecimiento se calculó al graficar el logaritmo natural del número de organismos obtenidos por cada día de observación, para así determinar la pendiente de la ecuación de la recta que corresponde a (K), y el tiempo de duplicación de las poblaciones (Td) mediante la ecuación: (Blaise & Kusui, 1997).
Ensayos de sensibilidad con NaCl. En microplacas de doce pozos, se evaluaron cinco concentraciones diferentes de cloruro de sodio y un control negativo (agua embotellada potable), cada ensayo se realizó por triplicado y con un total de nueve individuos adultos sin yema por especie según lo establecido por Blaise & Kusui (1997), referenciado en Díaz et al. (2004). Se realizaron ensayos preliminares teniendo en cuenta lo reportado por Santos et al., (2007) para establecer las concentraciones de NaCl a evaluar en cada especie. Para H. viridissima el intervalo de las concentraciones estuvo entre de 1,5 a 3,5 g/l de NaCl y para H. vulgaris de 0,3 a 1,5 g/l de NaCl, dada la sensibilidad diferenciada entre las especies. El tiempo de exposición fue de 96 h con observaciones diarias, sin alimentación y sin renovación de la solución acuosa según Blaise & Kusui (1997). Los puntos finales de las pruebas se reflejaron en alteraciones morfológicas subletales (bulbo-corto) y letales (tulipán-desintegrado) en H. viridissima e H. vulgaris (Figura 4).
Tratamiento de datos. Se calculó la CL50 y CE50 con el software Probit Analysis Program, version 1.5 desarrollado por la US Environmental Protection Agency (USEPA) y el software MedCalc versión libre. Los valores de CL50 y CE50 se graficaron (dichos valores van en la ordenada y el número del ensayo en la abscisa) con el fin de obtener la carta control de sensibilidad. Se calculó el promedio y dos veces la desviación estándar para establecer los límites superior e inferior de la misma (Díaz et al., 2004). Además, se calculó el coeficiente de variación de los ensayos de sensibilidad con NaCl.
RESULTADOS Y DISCUSIÓN
Tasas de crecimiento (K) y tiempo de duplicación
Los resultados de tasas de crecimiento indicaron una adecuado aumento poblacional para las dos especies (Tabla 1) a las condiciones de cultivo en el laboratorio, con tasas de crecimiento promedio (K) para H. vulgaris de 0,30 (n=3) y para H. viridissima de 0,32 (n=6), lo que señaló que el manejo y alimentación fueron adecuados para el mantenimiento, este valor refiere un crecimiento normal y condiciones fisiológicas óptimas según Trottier et al. (1997) y Díaz et al. (2004), quienes indican tasas para la especie de H. vulgaris entre 0,3 y 0,4 tal como se registra en la Tabla 1. Se observa un leve aumento en la tasa de crecimiento de H. viridissima, que puede ser favorecido por la endosimbiosis que presenta esta especie, tal como lo reporta (Ishikawa et al., 2016). Se resalta que en este trabajo se da el primer reporte de tasa de crecimiento para H. viridissima (se realizó una evaluación más amplia n=6), especie candidata para realizar ensayos de ecotoxicidad en las regiones tropicales. En la Figura 1 se observa que durante los primeros meses de aclimatación en condiciones de laboratorio se presentaron bajas tasas de crecimiento, pero con los ajustes realizados en la alimentación posteriormente se lograron aumentar y estabilizar.
Tabla 1 Tasas de crecimiento (K) y tiempo de duplicación en el tiempo de observación para H. viridissima e H. vulgaris.
| Especie | Variables | Mes 1 | Mes 2 | Mes 3 | Mes 4 | Mes 5 | Mes 6 | Promedio | Desv estándar |
|---|---|---|---|---|---|---|---|---|---|
| H. viridissima | Tasa de crecimiento (K) | 0.31 | 0.30 | 0.34 | 0.31 | 0.31 | 0.34 | 0.32 | 0.02 |
| Tiempo de duplicación (Td)* | 2.31 | 2.31 | 2.10 | 2.24 | 2.24 | 2.10 | 2.22 | 0.10 | |
| H. vulgaris | Tasa de crecimiento (K) | 0.30 | 0.30 | 0.30 | 0.30 | 0.00 | |||
| Tiempo de duplicación (Td)* | 2.31 | 2.31 | 2.31 | 2.31 | 0.00 |
*(Td, en días)
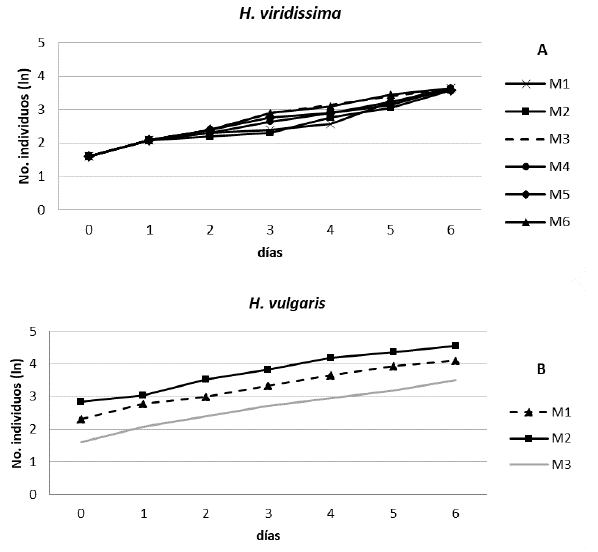
Figura 1 Curvas de crecimiento poblacional: A) H. viridissima (n=6) y B) H. vulgaris (n=3) para diferentes meses (M).
Las tasas de crecimiento y tiempos de duplicación estimadas (Tabla 1) se plantean como indicadores de adecuada aclimatación de los cultivos y en ensayos sub-crónicos y crónicos con estas especies podrían además ser valores de referencia para comparar la afectación a largo plazo de variables poblacionales, por ejemplo, en la evaluación de impactos por fármacos, desreguladores endocrinos o nanomateriales, lo que ampliaría las aplicaciones futuras en ecotoxicología con ambas especies de cnidarios.
Ensayos de sensibilidad con NaCl
Para H. viridissima se obtuvo una CL50-96h promedio de 2,6 g/l de NaCl con un intervalo de confianza del 95% entre 2,0 - 3,3 g/l NaCl (Figura 2A). En contraste, H. vulgaris presentó una CL50-96h de 1,0 g/l y un intervalo entre 0,8 - 1,2 g/l de NaCl (Figura 2B). Los coeficientes de variación (CV) fueron de 11,9% y 9,5% respectivamente. La CE50-96h promedio para H. viridissima fue de 2,0 g/l (1,4-2,5 g/l) de NaCl (Figura 3A) y para H. vulgaris 0,5 g/l (0,3-0,7 g/l) de NaCl (Figura 3B), en corchetes se señalan los intervalos de confianza del 95%. Se obtuvieron CV de 13,8% y 16,3%, respectivamente lo que indican que están dentro de la variabilidad natural de las especies, los coeficientes de variación por debajo del 25% señalan adecuada reproducibilidad de los ensayos, y entrenamiento adecuado del observador (USEPA, 1990; Díaz et al., 2004; Santos et al., 2007), factores clave en la implementación de ensayos de ecotoxicología y confirma que las condiciones de experimentación se cumplieron adecuadamente en esta investigación.
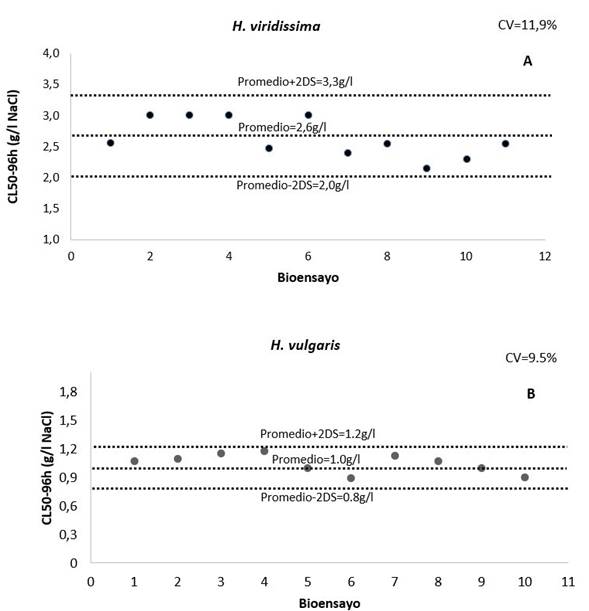
Figura 2. Carta control de sensibilidad al NaCl (Letalidad) para H. viridissima (A) y para H. vulgaris (B). CV: coeficiente de variación; DS: desviación estándar.
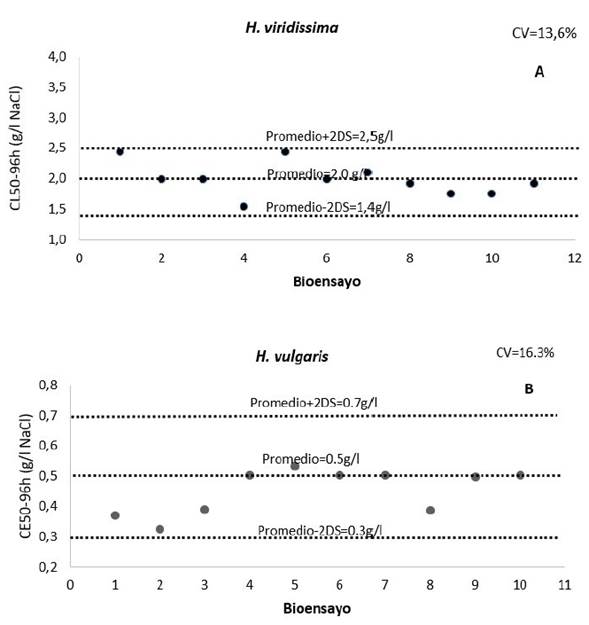
Figura 3 Carta control de sensibilidad al NaCl (Subletalidad) para H. viridissima (A) y para H. vulgaris (B). CV: coeficiente de variación; DS: desviación estándar.
Fue evidente la diferencia de sensibilidad respecto al NaCl entre las dos especies, siendo H. viridissima la más tolerante a esta sustancia. Se resalta que dentro de la relación endosimbiótica, C. vulgaris no solo proporcionaría beneficios como nutrientes, protección y energía a H. viridissima, sino que también podría alteran la fisiología y bioquímica, modificando su desarrollo y metabolismo químico secundario, y por lo tanto su tolerancia al estrés. (Hamanda et al., 2018). Se ha demostrado que H. viridissima a diferencia de H. vulgaris podía hacer frente al estrés oxidativo que causa daños, como la muerte celular, se afirma que los genes relacionados con el estrés oxidativo desempeñan un papel importante en la evolución de la endosimbiosis (Ishikawa et al.,2016).
La sensibilidad al cloruro de sodio para H. vulgaris estuvo por debajo de lo reportado por Santos et al. (2007) para la misma especie con una CL50-96h de 2,57 g/l (2,1- 2,9 g/l) y una CE50-96h 1,44 g/l (1,1 - 1,6 g/l), estas diferencias se podrían explicar porque estos autores usaron como medio de cultivo agua reconstituida (agua adicionada con 147 mg/l CaCl2, 110 mg/l Tes Buffer, pH: 7,0 +/- 0,1), condiciones que pueden disminuir la toxicidad de esta sustancia.
La USEPA (1988) informó que la concentración ambiental segura de cloruro para los organismos de agua dulce era de 0,23 g/l, concentración que coincide con los resultados obtenidos en esta investigación, ya que H. viridissima e H. vulgaris presentaron afectaciones subletales dentro del rango de 0,3 a 2,5 g/l NaCl y concentraciones superiores causaron la desintegración de los organismos.
En Hydra los cambios en la osmolaridad media alteran las contracciones corporales, que se disminuyen en medios hipertónicos, lo cual evidencia cambios dependientes de la osmolaridad en la actividad neuronal, la actividad muscular y las contracciones corporales (Yamamoto & Yuste, 2020). La superficie exterior del ectodermo de Hydra está cubierta por una estructura fibrosa denominada cutícula (menos rígida que en hidrozoos marinos) que presenta proteínas PPOD (peroxidasas) específicas para este género y que probablemente entraron en su genoma por transferencia horizontal de genes de bacterias, lo cual se pude relacionar con el momento en que Hydra evolucionó y realizó la transición al medio ambiente dulceacuícola (Hoffmeister‐Ullerich et al., 2002; Böttger et al., 2012). Pequeñas concentraciones de iones de sodio ambiental en presencia de calcio son requeridas para el adecuado crecimiento y desarrollo de Hydra, por ejemplo, la especie H. littoralis requiere aproximadamente 0,0006 g/l de NaCl para permanecer en condiciones óptimas (Lenhoff & Bovaird, 1960).
Sin embargo, durante el tiempo de exposición a diferentes concentraciones de NaCl, H. viridissima e H. vulgaris mostraron afectaciones evidentes en las células de sus tentáculos (Figura 4), lo cual permitió identificar de manera clara los efectos medidos. (Dornelas et al., 2020) resalta que el incremento en la concentración de sales en ecosistemas de agua dulce genera toxicidad letal y subletal en invertebrados acuáticos y puede tener consecuencias negativas para las poblaciones, fenómeno poco explorado ya que los trabajos en el campo de la ecotoxicología en Colombia son aún incipientes a pesar de la necesidad de documentar esta afectación sobre la biodiversidad acuática y proteger los ecosistemas de este tensor ambiental.
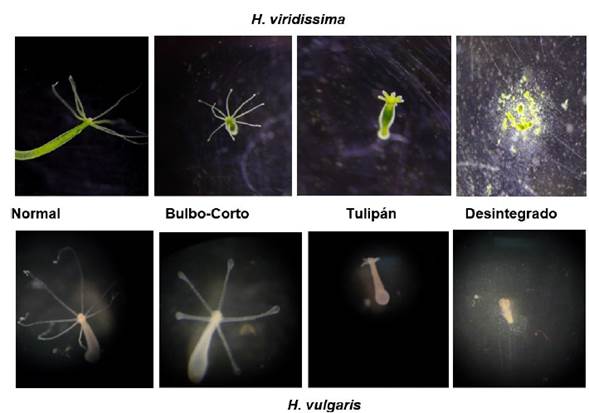
Figura 4 Estados de alteración morfológica de H. viridissima e H. vulgaris luego de la exposición al cloruro de sodio (NaCl). Toxicidad subletal (bulbos-cortos) y letal (tulipán-desintegrado).
Las respuestas medidas se explicarían porque en general los invertebrados de agua dulce mediante la osmorregulación equilibran las concentraciones ambientales de sal y agua, proceso que se altera con el incremento de la salinidad (Vander-Vorste et al., 2019), se genera un aumento potencial en los costos de energía y en consecuencia provoca alteraciones en el desarrollo, reproducción y supervivencia de estos organismos (Hassell et al., 2006; Santos et al., 2007; Rind et al., 2017; Folino-Rorem & Renken, 2018; Dornelas et al., 2020).
Hydra posee una capacidad alta para regenerarse, lo que permite su utilización en la evaluación de compuestos teratogénicos y así reconocer el impacto de los contaminantes en las células madre (Lee et al., 2020). Sin embargo, en la exposición a corto plazo frente a la presencia de sustancias tóxicas esta capacidad se pierde y se puede evidenciar el daño en el tejido de tentáculos y columnella como aquellos que se evidencian en la Figura 2 (Quinn et al., 2009; Blaise et al., 2018; McKinley et al., 2019). Lee et al., 2020 sugieren que las algas simbiontes protegen a la hidra de efectos tóxicos, por ejemplo, del triclosán, condición que se evidenció en este caso donde se obtuvo una menor sensibilidad de H. viridissima frente al NaCl, igualmente se podría especular que cada especie responde diferencialmente o biotransforma el cloruro y que este tiene diferentes mecanismos de acción entre las especies evaluadas.
Se evidenció la alta sensibilidad de ambas especies de hidra comparadas con organismos modelos convencionales en ecotoxicología como Daphnia magna Straus 1820 o Daphnia pulex Leydig 1860 que reportan CL50-96h entre los 3,0 g/l - 6,0 g/l de NaCl y para Ceriodaphnia dubia Richard 1894 alrededor de 2,6 g/l de NaCl (Cowgill & Milazzo, 1991), los dípteros de las especies Culex sp. Linnaeus 1758 y Chironomus attenuatus Walker 1848 reportan concentraciones de 10,3 g/l y 6,6 g/l de NaCl, respectivamente (Thornton & Sauer, 1972). Adicionalmente, para sensores íctiológicos de intoxicación aguda como Oncorhynchus mykiss Walbaum 1792 y Pimephales promelas Rafinesque 1820 muestran CL50-96h de 11,1 g/l y 7,6 g/l de NaCl (Adelman et al., 1976).
Es importante conocer el comportamiento de los organismos dulceacuícolas frente a los tensores actuales y que se pueden amplificar por los cambios ambientales que enfrentan los ecosistemas acuáticos, por ejemplo, el aumento de salinización y de esta forma iniciar una etapa temprana de evaluación de riesgos ecológicos en sistemas tropicales.
La toxicidad que puede ejercer el NaCl en ecosistemas acuáticos de agua dulce podría influenciar un número sustancial de especies, pulsos de salinidad pueden ser suficientes para inducir cambios estructurales en las comunidades o cambios en las relaciones tróficas (Schuler et al., 2019).
CONCLUSIONES
Este trabajo reportó información básica de cultivo y aclimatación de dos especies del género Hydra en condiciones de laboratorio, con estimación de tasas de crecimiento, tiempos de duplicación, indicadores esenciales para posterior aplicación de pruebas para detección de efectos tóxicos subcrónicos y crónicos en estas especies. Igualmente se determinó que la sensibilidad letal y subletal frente al NaCl en H. vulgaris fue más alta que para H. viridissima, probablemente porque la relación simbiótica con C. vulgaris podría generar un efecto protector en la última.
Se requiere proyectar investigaciones que evalúen no solo los efectos del NaCl, sino también de otros estresores que operan simultáneamente en el agua, y se monitoreé con mayor certidumbre el impacto sobre la funcionalidad de los ecosistemas acuáticos tropicales.















