INTRODUCCIÓN
La caña flecha (Gynerium sagittatum AUBL. BEAUV) es una planta perteneciente a las gramíneas que posee tallos o cañas con longitud aproximada a los 10 metros, diámetro de 2-8 cm y se caracteriza por habitar sitios húmedos y cercanos a fuentes hídricas (Suarez et al., 2017). Esta especie está ampliamente distribuida en América, desde México hasta Paraguay y en gran parte de las islas del Caribe (Hernández et al., 2018). La caña flecha, se encuentra en gran parte del territorio colombiano, incluyendo los departamentos de Sucre y Córdoba donde es utilizada por la comunidad indígena Zenú como materia prima para la elaboración de artesanías de gran valor económico y cultural (Casas 2010), entre las cuales se destaca el sombrero¨vueltiao¨, símbolo de identidad cultural colombiana (Rivera et al., 2008). Se estima que existen alrededor de 18.000 personas y 5.000 familias que dependen económicamente del trabajo artesanal de la caña flecha (López et al., 2021; DANE 2005).
Por otra parte, G. sagittatum es una especie con propiedades antiinflamatorias y fitorremediadora, ya que ha mostrado la reducción de la hiperplasia prostática benigna en roedores y la acumulación de metales pesados como el mercurio en raíce, tallos y hojas de la planta respectivamente (Domínguez et al., 2020; Ortega et al., 2011).
G. sagittatum es atacada fuertemente por plagas como el gusano barrenador o talador del tallo perteneciente al género Diatraea (Sehuanes y Flórez, 2004), hongos pertenecientes a los géneros Fusarium, Colletotrichum, Mucor y Curvularia (Hernández y Santos, 2010) y por condiciones medioambientales, como periodos intensos de verano (Aramendiz et al., 2005; Sehuanes y Flórez, 2004), al igual que la preferencia de los artesanos por el cultivar “Criolla” el cual se caracteriza por tener una fibra suave que facilita la labor artesanal (Araméndiz et al, 2005, Rivera et al., 2008) lo que ha ocasionado que las poblaciones naturales de este hayan tenido una disminución superior al 50%, afectando no solo a los artesanos al aumentar los costos de la fibra y reducir las ganancias por la venta de productos, sino que también tiene un impacto significativo en los ecosistemas de humedales asociados con la caña flecha (Gonzalez 1997; Araméndiz et al., 2009; López y Suárez, 2018).
Los protoplastos son células vegetales que han perdido la pared celular (Avila y Yeon, 2020). Estos son obtenidos a partir de métodos mecánicos en los cuales el tejido vegetal se mantiene en una solución ligeramente hipertónica produciendo plasmólisis y luego son liberados mediante cortes realizados sobre el tejido, mientras que los métodos enzimáticos consisten en la incubación del tejido vegetal en una solución compuesta por enzimas degradadoras de pared celular, reguladores osmóticos, estabilizadores de membrana y soluciones buffer que mantienen las condiciones adecuadas de las células aisladas (Mastuti y Rosyidah, 2018). Las enzimas que generalmente son utilizadas para el aislamiento de protoplastos son de origen fúngico con actividades de celulasa, hemicelulasa y pectinasa (Echeverri et al., 2019).
Los protoplastos se han convertido en sistemas exclusivos para distintos procedimientos experimentales (Park et al., 2013), como, por ejemplo, la hibridación somática (Tomiczak et al., 2017), transformación genética (Lin et al., 2018), sistemas de expresión génica (Xu et al., 2021), aislamiento de cloroplastos intactos (Lung et al., 2015), gracias a la ausencia de su pared celular.
Frente a estas problemáticas, y a las ventajas de obtener protoplastos, surge la necesidad de desarrollar métodos enzimáticos de aislamiento de protoplastos evaluando el efecto de las enzimas celulasa, macerozima y tiempo de incubación que contribuyen con el concimiento para la conservación y el mejoramiento de G. Sagittatum variedad Criolla frente a agentes fitosanitarios y ambientales que afectan la planta en la región Caribe colombiana.
MATERIALES Y MÉTODOS
Esta investigación se realizó en el Laboratorio de Cultivo de Tejidos Vegetales de la Universidad de Sucre, sede Puerta Roja, ubicado en el municipio de Sincelejo Sucre; con posición geográfica en Colombia de 9° 18’ de latitud norte y 75° 23’ de longitud oeste del meridiano de Greenwich (Díaz y Carmona, 2015).
Material vegetal para el aislamiento de los protoplastos
El tejido utilizado para el aislamiento de los protoplastos consistió en hojas jóvenes provenientes de vitroplantas de caña flecha, variedad criolla, con edades entre los 45 y 55 días de cultivo, mantenidas en medio Murashige y Skoog-MS (1962) (Osorio et al., 2010), con 0.1g/L de Myo-inositol, 30 g/L de Sacarosa, Tiamina 1 mg/L, y 6 g/L de Agar.
Aislamiento de los protoplastos
Para llevar a cabo el aislamiento de los protoplastos se evaluó el efecto de diferentes concentraciones de celulasa (1.5% y 2.0% p/v), macerozima (0.3%, 0.6% y 0.9% p/v), en distintos tiempos de incubación (3, 6 y 9 horas) Tabla 1. La escogencia de los factores y sus niveles se debió a la revisión científica de aislamiento de protoplastos en gramíneas, familia a la que pertenece la caña flecha.
Tabla 1 Efectos de los tratamientos enzimáticos sobre el aislamiento de protoplastos en G. sagittatum.
| Tratamientos | Celulasa % (p/v) | Macerozima % (p/v) | Tiempo (Horas) | Protoplastos/mL ± S.E | |
|---|---|---|---|---|---|
| T1 | 1.5 | 0.3 | 3 | 5 000 ± 280 | a |
| T2 | 1.5 | 0.3 | 6 | 17 250 ± 508 | abcdef |
| T3 | 1.5 | 0.3 | 9 | 75 000 ± 523 | ijk |
| T4 | 1.5 | 0.6 | 3 | 9 625 ± 319 | abc |
| T5 | 1.5 | 0.6 | 6 | 21 375 ± 606 | bcdefg |
| T6 | 1.5 | 0.6 | 9 | 53 375 ± 580 | hijk |
| T7 | 1.5 | 0.9 | 3 | 16 500 ± 545 | abcde |
| T8 | 1.5 | 0.9 | 6 | 31 375 ± 538 | defghij |
| T9 | 1.5 | 0.9 | 9 | 40 750 ± 459 | fghijk |
| T10 | 2.0 | 0.3 | 3 | 6 750 ± 364 | ab |
| T11 | 2.0 | 0.3 | 6 | 21 875 ± 442 | cdefgh |
| T12 | 2.0 | 0.3 | 9 | 83 000 ± 750 | jk |
| T13 | 2.0 | 0.6 | 3 | 13 125 ± 395 | abcd |
| T14 | 2.0 | 0.6 | 6 | 30 250 ± 424 | defghi |
| T15 | 2.0 | 0.6 | 9 | 45 750 ± 637 | ghijk |
| T16 | 2.0 | 0.9 | 3 | 12 875 ± 508 | abcd |
| T17 | 2.0 | 0.9 | 6 | 35 875 ± 424 | efghijk |
| T18 | 2.0 | 0.9 | 9 | 88 625 ± 538 | k |
Los valores representan la media±S.E (Error estándar). Diferencias estadísticas significativas cuando las medias no comparten letras en común. (Kruskal Wallis, p<0.05).
Los protoplastos fueron obtenidos a partir de hojas jóvenes de vitroplantas de G. sagittatum. El material vegetal fue cortado en pequeños fragmentos de 1 mm2 con cuchillas estériles, hasta obtener 50 mg-1 del tejido vegetal, los cuales fueron depositados en tubos eppendorf de 1.5 mL-1 que contenían medio de aislamiento de protoplastos, compuesto por: Manitol 0.4 M, CaCl2 5 mM, KH2PO4 0.8 Mm y las diferentes combinaciones enzimáticas a evaluar. El medio se ajustó a un pH de 5.5 con solución de NaOH 1N. Los tubos fueron puestos en agitación orbital a 100 rpm en oscuridad durante los distintos tiempos de incubación.
Una vez finalizado cada periodo de incubación del material vegetal en las soluciones enzimáticas, se filtraron con la ayuda de mayas de nylon de 60 µm de diámetros (Mota et al., 2018), luego se centrifugaron las muestras a 2.500 rpm por 5 minutos en una microcentrifuga de mesa con control de temperatura (Micro CL 2112). El pellet obtenido fue lavado dos veces con una solución compuesta de: Manitol 0.4 M, CaCl2 0.5 mM, KH2PO4 0.7 mM (Parihar et al., 2015) y pH ajustado a 5.5 con NaOH 1N.
Finalmente, el pellet resultante se resuspendió en un medio líquido de Sales MS (1962), Manitol 0.4 M, y pH 5.5 ajustado con NaOH 1N.
Los protoplastos aislados se contaron en una cámara de Neubauer (Boeco Germany), realizándo observaciones y conteos en un microscopio Leika- DM 500.
El número de protoplastos aislados en cada unidad experimental fue calculado mediante la siguiente ecuación, descrita por Escalante (2014).
Diseño experimental y análisis estadístico
El diseño empleado en este estudio fue un Diseño Completamente al Azar (DCA), con arreglo factorial, en el cual se evaluaron 18 tratamientos con 5 repeticiones cada uno para un total de 90 unidades experimentales. Cada unidad experimental consistió de un tubo eppendorf con medio de aislamiento de protoplastos y material vegetal de G. sagittatum. Los resultados obtenidos, se analizaron mediante pruebas no paramétricas de Kruskall Wallis, ya que los datos no cumplieron los supuestos de normalidad y homocedasticidad, y fueron aceptadas las diferencias estadísticas significativas cuando (p<0.05). Los análisis se realizaron con el software gratuito Infostat versión 17. Las predicciones para la obtención del mayor número de protoplastos entre las interacciones de los factores fueron realizados con el software estadístico Minitab 19 Versión gratuita.
RESULTADOS Y DISCUSIONES
El aislamiento de protoplastos en la especie G. sagittatum mostró diferencias estadísticas significativas entre los tratamientos enzimáticos con respecto al número de protoplastos aislados (p<0.05). Los mayores números de protoplastos se obtuvieron con los tratamientos enzimáticos T18, T12, T3 y T6 Tabla 1, sin diferencias significativas entre sí entre estos tratamientos. Resultados similares en cuanto al número de protoplastos obtenidos fueron reportados por Prasertsongskun (2004), quien obtuvo 8.4×104 protoplastos/mL en Vetiveria zizanioides (Nash) utilizando una combinación enzimática de 2.0% celulasa Onozuka R10, 2.0% de macerozima R-10, con una enzima adicional (pectinasa 0.5%) por 10 horas de incubación.
Según Ren et al. (2020), durante el proceso de obtención de estas células existen factores determinantes que afectan el número y la calidad de las mismas, por ejemplo, el tipo de enzima, la concentración del osmótico, el tiempo de incubación, el explante y su edad, entre otros; razón por la cual es difícil obtener constantemente altos rendimientos en la obtención de este tipo de células (Partovi et al., 2017; Aqeel et al., 2016; Assani et al., 2001).
Por otro lado, el tamaño de los protoplastos aislados fue variable, encontrándose células entre los 12.0 y 27.6 µm de diámetro Figura 1. Fernando et al. (1997), encontraron tamaños de protoplastos cercanos a los de esta investigación, entre 17.0 y 20.0 µm diámetro en Oryza sativa L. Silva et al. (2012), mencionan que el tamaño de los protoplastos en monocotiledóneas es menor a 30.0 µm de diámetro y que su tamaño depende la especie, el tejido analizado y el grado de vacuaolización.

Figura 1 Protoplastos aislados a partir del mesófilo de caña fleca. (A) aislados mediante el tratamiento T18, (B) T12, (C) T3 y (D) T6.
Efecto de la celulasa sobre el número de protoplastos aislados
Al evaluar los niveles del factor celulasa, se encontró que no hubo diferencias estadísticas significativas entre las diferentes concentraciones utilizadas (p>0.05) Figura 2A. En otras especies como Zea mays L., Triticum aestivum L. y Oriza sativa L. pertenecientes a las gramíneas, concentraciones de celulasa iguales y por encima a 1.5% son ideales a la hora de aislar altas cantidades de protoplastos (Sung et al., 2013). Al momento de aislar protoplastos en esta familia es importante disponer de una solución enzimática con altas concentraciones de celulasas, ya que los polisacáridos presentes en la pared celular de estas plantas presentan un alto grado de esterificación y al ser tratados con concentraciones bajas de estas enzimas es poco probable una actividad enzimática eficiente (Ishi y Mogi, 1983), sin embargo aumentos significativos pueden reducir la viabilidad celular, como lo reportado por Sivanandhan et al. (2021), quienes obtuvieron menor viabilidad en los protoplastos al aumental la concentración de 1.5% de celulasa a 2.0% en Brassica rapa ssp. Pekinensis.
La hidrólisis de la celulosa se basa en la degradación de un complejo enzimático compuestos por: endoglucanasas, exoglucanasas y β-glucosidasas o β-glucosidasa hidrolasas; donde las primeras cortan al azar el interior de la celulosa amorfa, generando oligosacáridos de varias longitudes y, en consecuencia, nuevos extremos de cadena, mientras las exoglucanasas actúan de una manera progresiva en los extremos reductores y no reductores de las cadenas del polisacárido, liberando glucosa (glucanohidrolasas) o celobiosa (celobiohidrolasas) y por ultimo las β-glucosidasas hidrolizan las celodextrinas solubles y la celobiosa a glucosa (Gutiérrez et al., 2015).
Efecto de la macerozima en el número de protoplastos aislados
Los niveles de macerozima R10 evaluados con respecto al número de protoplastos aislados no fueron significativos (p>0.05) Figura 2B. La macerozima es la enzima encargada de la digestión de la pectina, que es un componente principal en la laminilla media de la pared celular de los vegetales (Chawla 2002; Yamada et al., 1972).
En trabajos realizados en otras monocotiledóneas como Dioscorea alata L., se obtuvo que la concentración de 0.2% de macerozima permitió obtener mayor número de protoplastos 57.309 protoplastos/mL (Osorio et al., 2010), valor que se encuentra por encima a los reportados en este estudio en cada una de las concentraciones de macerozima evaluada. Sin embrago, se destaca la concentración de 0.3% de macerozima como óptima a la hora de aislar los protoplastos en G. sagittatum, ya que se logran obtener resultados similares a las concentraciones más altas evaluadas con menor cantidad de reactivo, generando reducción de costos al momento de proceso de aislamiento.
Efecto del tiempo de incubación sobre el número de protoplastos
El tiempo de incubación fue significativo sobre el número de protoplastos aislados en G. sagittatum (p<0.05) Figura 2C. El mayor número de protoplastos 64.416 protoplastos/mL se obtuvo a las 9 horas de incubación, este tiempo mostró diferencias con las 3 y 6 horas de incubación donde se aislaron 10.645 y 26.333 protoplastos/mL respectivamente. En la Figura 2C, se observa que a medida que aumenta el tiempo de incubación aumenta el número de protoplastos aislados a partir del mesófilo de caña flecha.
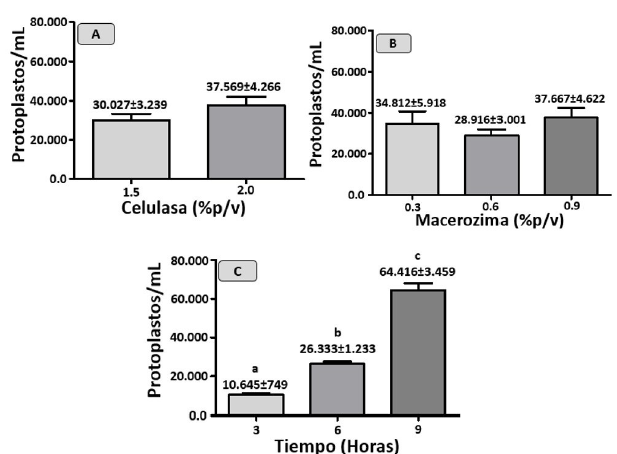
Figura 2 (A) Efecto de la celulasa, (B) macerozima y (C) tiempo de incubación sobre el número de protoplastos aislados en G. sagittatum. Los valores representan la media±S.E. Diferencias estadísticas significativas cuando las medias no comparten letras en común. (Kruskal Wallis, p<0.05).
El tiempo de acción de la solución enzimática sobre el tejido de la planta requerido para aislar protoplastos varía entre especies vegetales, así como también la concentración de enzimas y la composición de la solución de aislamiento (Tee et al., 2010; Adedeji et al., 2020). Por ejemplo, Nassour y Dorion (2002), mencionan que una concentración de enzima baja requiere un tiempo de incubación más prolongado para comportarse como el tiempo óptimo de incubación, aunque tiempos prolongados de exposición resultan ser dañinos sobre la membrana celular de los protoplastos (Kang et al., 2020).
Los resultados encontrados este estudio con respecto al tiempo de incubación se relacionan con los encontrados en la gramínea Vetiveria zizanioides L., donde se aisló la mayor cantidad de protoplastos en un tiempo de 10 horas de incubación del material vegetal en la solución enzimática compuesta por 2.0% celulasa Onozuka R10, 2.0% de macerozima R-10 y 0.5% de pectinasa (Prasertsongskun 2004). En otras especies como Echinacea angustifolia DC., también se logró obtener los mejores rendimientos 50.0 x104 protoplastos/g de tejido fresco durante un periodo de 8 horas de incubación del material vegetal en la solución enzimática (Liqing et al., 2005).
Interacciones entre los factores sobre el número de protoplastos aislados
Las interacciones entre los factores enzimáticos mostraron que una combinación de 2.0% de celulasa y 0.9% de macerozima permite obtener un número aproximado de 44.302 protoplastos/mL Figura 3A. Estos resultados sugieren que utilizando estas concentraciones y combinaciones de enzimas es posible una alta tasa de degradación de los componentes de la pared celular por parte de las enzimas y concentraciones empleadas. Algunos autores como Mukhtar et al. (2012), sugieren que tanto las concentraciones de enzimas como las combinaciones dependen de factores como la edad, el genotipo y la etapa de diferenciación del tejido del cual se aislarán los protoplastos. Por esta razón, se debe optimizar el tipo de explante fuente de los protoplastos y las condiciones enzimáticas para el aislamiento, ya que según Piwowarczyk y Pindel (2015), el establecimiento de una mezcla enzimática especifica no solo influye en el número de protoplastos obtenidos, sino también en sus reacciones morfogénicas durante las etapas del cultivo. Además, es importante destacar que la celulasa, macerozima y/o pectinasa comercialmente disponibles son utilizadas habitualmente en conjunto para el aislamiento de protoplastos en plantas superiores (Gupta y Reddy, 2018).
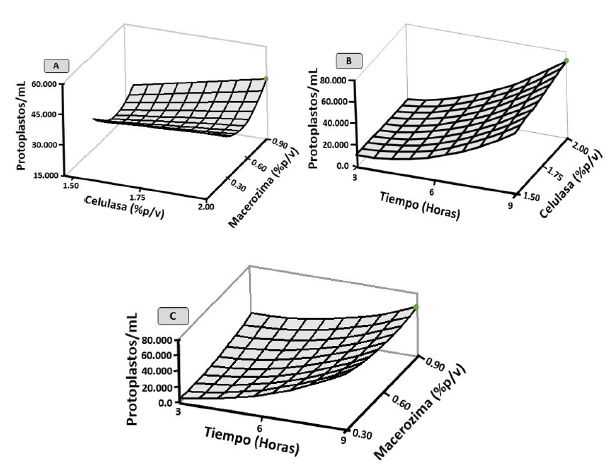
Figura 3 Aislamiento de protoplastos en G. sagittatum mediante la interacción celulasa-macerozima (A), tiempo-celulasa (B) y tiempo-macerozima (C).
Por otra parte, las interacciones entre los factores celulasa y tiempo de incubación mostraron que el mayor número de protoplastos que se puede obtener es 72.073 protoplastos/mL, con la utilización de 2.0% de celulasa por 9 horas de incubación Figura 3B. Estos resultados muestran que a medida que trascurre el tiempo de incubación y a una concentración de 2.0% de celulasa hay probablemente una mayor eficiencia de la enzima sobre el sustrato, aunque periodos extensos del material vegetal en la solución enzimática puede acarrear daños sobre los protoplastos (Mota et al., 2018).
Las interacciones entre los factores macerozima y tiempo de incubación muestran que es posible obtener un máximo de 71.212 protoplastos/mL utilizando una combinación de 0.9% de macerozima por 9 horas de incubación del tejido vegetal en la solución enzimática Figura 3C. Estos resultados evidencian que, al aumentar los tiempos de incubación del material vegetal en las soluciones enzimáticas, independientemente de la concentración de la enzima, se genera un efecto positivo del factor tiempo sobre el número de protoplastos aislados en caña flecha, aunque se debe evaluar la viabilidad de estos protoplastos con el fin de canocer su estado de funcionalidad, ya que cuando se somete el material vegetal a periodos extensos de actividad enzimática las células aisladas pueden presentar daños en su membrana celular a causa de lisis, que posteriormente traerá la liberación de enzimas hidrolíticas y compuestos oxidantes que pueden dañar al resto de los protoplastos presentes en la suspensión (Polci y Friedrich, 2004).
CONCLUSIONES
El aislamiento de los protoplastos en G. sagittatum es posible, empleando mezclas de enzimas comerciales como celulasa y macerozima a diferentes tiempos de incubación. Un periodo de incubación de 9 horas es ideal para la obtención de 64.416 protoplastos/mL, además sesultó ser un factor crítico a la hora de obtener protoplatos en G. sagittatum. Los valores de predicción establecen que una combinación de 2.0% de celulasa y 0.9% de macerozima permite obtener 44.302 protoplastos/mL, mientras que con un tiempo de 9 horas de incubación combinado con 2.0% de celulasa y 0.9% de macerozima se pueden obtener 72.073 y 71.212 protoplastos/mL respectivamente. Es importante evaluar la viabilidad de los protoplastos obtenidos mediante este método, ya que esta condición es indispensable para seguir las etapas de cultivo, transformación, hibridación y regeneración de nuevas plantas de caña flecha. Adicionalmente, esta investigación contribuye a iniciar los estudios de mejoramiento genético de la caña flecha a través del cultivo in vitro de tejidos vegetales.















