INTRODUCCIÓN
Los hongos macromicetos se destacan por la amplia variedad de actividades biológicas comprobadas atribuidas a la presencia de proteínas y metabolitos como ácidos grasos, triterpenos, alcaloides, flavonoides, polisacáridos, entre otros (Bhambri et al., 2022). Estas cualidades, además de la comestibilidad que tienen algunos de ellos y su alto valor nutricional, han despertado el interés de la comunidad científica por desarrollar herramientas que permitan aumentar la eficiencia de su cultivo, en términos de producción de biomasa y composición (Das et al., 2021; Okuda, 2022).
Entre estas herramientas se encuentra el cultivo biotecnológico a través de fermentaciones en estado líquido (FEL) el cual, a diferencia de otras metodologías como el cultivo tradicional o la fermentación en estado sólido, facilita la variación de diferentes condiciones o factores que impactan directamente el desarrollo del hongo (Berovic et al., 2022). El cultivo en biorreactor permite controlar variables como la temperatura, la cantidad de inóculo y de fuente de nutrientes, la relación C/N, el pH, el tiempo de la fermentación, la agitación y la aireación (Petre y Petre, 2015). Estos dos últimos son factores determinantes para garantizar que la cantidad de oxígeno disuelto necesaria esté efectivamente disponible, así como que exista un balance entre la transferencia de oxígeno y el esfuerzo cortante en el medio. En caso de que esto no ocurra, no se dará el crecimiento optimo de las células fúngicas, causando una reducción en la cantidad de biomasa producida y por ende en los metabolitos que esta contenga (Bakratsas et al., 2021).
El objetivo de esta investigación fue evaluar el efecto de condiciones como la agitación y la aireación sobre la generación de biomasa y de metabolitos de mediana y baja polaridad del hongo Lentinula edodes cultivado en biorreactor. Los resultados de este trabajo, además de contribuir al conocimiento químico del macromiceto objeto de estudio y de su producción biotecnológica, permitieron determinar el potencial de la biomasa del Lentinula edodes para su posible uso en diferentes áreas de la industria alimenticia y/o de nutracéuticos.
MATERIALES Y MÉTODOS
Material Fúngico
Se utilizó una cepa foránea (EE. UU.) de Lentinula edodes de tipo comercial, donada al Laboratorio de Química de Hongos Macromicetos de la Universidad Nacional de Colombia. Para su activación, se cultivó en agar Papa Dextrosa (PDA), a una temperatura de 25 ± 1°C, en una incubadora WISD modelo WIG-155, en total oscuridad durante un periodo de 10 a 15 días (Suárez, 2012).
Posterior a la activación desde la cepa madre, se realizaron diferentes repliques en cajas de Petri, utilizando PDA como medio de cultivo y manteniendo las condiciones anteriormente descritas para su incubación.
Obtención del preinóculo
El cultivo por fermentación en estado líquido se llevó a cabo en Erlenmeyer de 250 mL, utilizando como volumen de trabajo 100 mL con el medio GPY (Glucosa 20 g/L, peptona 2.5 g/L y extracto de levadura 2.5 g/L). Se ajustó el pH inicial a 5,0 y se inoculó con 15 discos de 0,5 a 1,0 cm de diámetro colonizados por micelio provenientes del proceso de activación de la cepa. Posteriormente los Erlenmeyer fueron llevados a un agitador orbital marca VWR modelo Incubating mini shaker, por un periodo de 15 días a una temperatura de 25 + 1°C y 180 rpm, según las condiciones de cultivo preestablecidas (Chegwin-Angarita y Nieto-Ramírez, 2014).
Obtención del inóculo
Para producir los inóculos para la fermentación en estado líquido en biorreactor se preparó medio GPY, el cual se inoculó con 1,5 g del micelio fresco obtenido en el paso anterior por cada 100 mL de medio líquido, para su posterior incubación en el agitador orbital, a una temperatura de 25 ± 1°C y 180 rpm durante 5 días. Se emplearon cuatro Erlenmeyer con micelio desarrollado para la inoculación del biorreactor y los tres restantes se cosecharon, filtraron y se almacenó la biomasa para su posterior liofilización, con el objetivo de determinar el peso seco inicial usado para cada experimento.
Cultivo en biorreactor
Se empleó un biorreactor Applikon Biotechnology, equipado con un agitador Rushton, medidor y controlador de temperatura y una capacidad de 3 L, usando como volumen de trabajo 2,5 L. Para cada una de las diferentes condiciones evaluadas, el equipo se esterilizó vacío durante una hora y el medio GPY, fue esterilizado por 30 minutos en un autoclave eléctrico, adicionando posteriormente 2,1 L de medio fresco y 400 mL de inóculo obtenido según la descripción del punto anterior y en las cantidades mencionadas en la tabla 1 para cada condición de cultivo. Este procedimiento se realizó en una cabina de flujo laminar ESCO modelo LHS-5CG-F9, para asegurar las condiciones de asepsia.
De acuerdo a los resultados obtenidos de la cinética de crecimiento por (Vega-Oliveros, 2019) con la misma cepa y bajo las mismas condiciones de cultivo, el proceso de cultivo se mantuvo durante 5 días.
Determinación de la producción de biomasa
El producto de la fermentación en estado líquido bajo cada una de las condiciones analizadas, se filtró, la biomasa se lavó y se almacenó a -4°C durante un día, luego a -80°C para ser liofilizada en un equipo LABCONCO FreeZone 2,5 a 0,12 mBar y -50°C, pesada y conservada hasta su posterior análisis.
Los cálculos de rendimiento y productividad del proceso se obtuvieron de acuerdo al trabajo de Kirsch et al., (2016). El rendimiento fue expresado en gramos de biomasa micelial producida por gramos de sustrato inicialmente presente en el medio de cultivo (g g−1), según la ecuación 1 donde Xf y Xi corresponden a la concentraciones final e inicial de biomasa y Si a la concentración de azúcar inicial. La productividad de biomasa fue expresada en gramos de biomasa micelial por el tiempo (g L−1 h−1), siendo t el tiempo del cultivo (ecuación 2).
Diseño Experimental
Los experimentos llevados a cabo en el biorreactor siguieron un diseño factorial con dos factores (flujo de aire y velocidad de agitación) en dos niveles para cada uno, con el objetivo de determinar las condiciones más adecuadas tanto para el crecimiento del hongo como para favorecer la biosíntesis de metabolitos de interés. Después de evaluar diferentes fuentes bibliográficas (Agudelo-Escobar et al., 2017; Domingos et al., 2017; Enman et al., 2008; Özdemir et al., 2017), se ajustaron los rangos de las variables de estudio de la siguiente manera: flujo de aire entre 0.5 vvm a 1.0 vvm y velocidad de agitación entre 80 rpm y 200 rpm, con lo cual se definieron seis experimentos elaborando un diseño central compuesto, tal como se puede apreciar en la tabla 1.
Tabla 1 Rendimiento y productividad de la biomasa de L. edodes cultivada bajo diferentes condiciones de aireación y agitación.
| Ensayo | Agitación (rpm) | Aireación (VVM) | Cantidad de inóculo (g/L) | Biomasa final (g/L) | Rendimiento (g biomasa/g glucosa) | Productividad (g biomasa/L*h) |
|---|---|---|---|---|---|---|
| 1 | 80 | 0,50 | 0,14 | 0,66 | 0,0260 | 0,00433 |
| 2 | 80 | 1,00 | 0,15 | 0,64 | 0,0245 | 0,00408 |
| 3 | 200 | 0,50 | 0,19 | 0,53 | 0,0170 | 0,00283 |
| 4 | 200 | 1,00 | 0,18 | 0,60 | 0,0210 | 0,00350 |
| 5 | 140* | 0,75 | 0,09 | 0,57 | 0,0240 | 0,00400 |
* Es el promedio aritmético de dos réplicas.
Análisis de la composición de las biomasas
Proceso de extracción
Las biomasas liofilizadas y maceradas con nitrógeno se extrajeron usando diclorometano y ultrasonido en un baño marca Elma modelo E 30H, por 30 minutos a temperatura ambiente. Las biomasas remanentes posteriormente se extrajeron con etanol (96% de pureza) y ultrasonido durante 30 minutos y una temperatura de 40°C. Las biomasas finales se extrajeron con agua en ebullición (95°C), posterior precipitación de los polisacáridos con etanol frío y centrifugación con refrigeración (8°C) a 10000 rpm por 10 min (Koutinas et al., 2003).
Perfiles de los extractos en diclorometano por CG-EM
Los extractos en diclorometano de las biomasas obtenidas bajo cada condición de operación del biorreactor, se analizaron en un cromatógrafo Hewlett Packard modelo HP 6890 con una columna marca Zebron ZB1, usando como gas de arrastre helio a un flujo de 1,1 mL/min, con inyección en modo Split relación 10:1. La temperatura de inyección fue de 300 °C, programando una rampa de calentamiento que inició en 60 °C manteniendo esta temperatura durante 1 minuto, para luego calentar a una velocidad de 7,4 °C/min hasta lograr una temperatura de 310 °C durante 10 minutos. La temperatura de la interfase fue de 250 °C y la del cuadrupolo de 150 °C. Este cromatógrafo está acoplado a un espectrómetro de masas 5973 con una fuente de ionización de 70 eV. El análisis de los espectros de masas se realizó usando tanto las librerías del grupo de investigación como las del espectrómetro, estas últimas tomando los espectros de masas que tuviesen un porcentaje de similitud superior al 90%. En cuanto a las áreas relativas, los porcentajes se calcularon con base en los resultados obtenidos desde el cromatograma total de iones (TIC).
Determinación del contenido de proteína
A las biomasas secas se les realizó un análisis elemental (Microanalizador Flash 2000) para determinar el porcentaje de N y posteriormente se calculó el contenido de proteína con el factor de 4,38 empleado para hongos (Smiderle et al., 2012).
Determinación del contenido de esteroles totales
Se empleó el método colorimétrico de Lieberman- Burchard (Mubbasher Sabir et al., 2003), a partir de una curva de calibración con estigmasterol (Sigma®). Las lecturas de las soluciones de los extractos en diclorometano se realizaron espectrofotométricamente a una longitud de onda de 640 nm en un espectrofotómetro Thermo scientific Evolution 201.
Determinación del contenido de azúcares totales
El contenido de azúcares totales se determinó empleando el método colorimétrico de Dubois modificado (Ávila et al., 2012), utilizando una curva de calibración con glucosa a 490 nm.
Análisis estadísticos
Los datos experimentales fueron normalizados para la realización de múltiples regresiones lineales, con el objetivo de medir el impacto de las variables estudiadas sobre la producción de biomasa, porcentaje de esteroles y azúcares. Esto fue posible mediante un análisis de varianza de cada uno de los modelos estudiados, con un valor de significancia estadística p < 0.05.
RESULTADOS Y DISCUSIÓN
Como se mencionó anteriormente, la agitación y la aireación se encuentran entre los factores de mayor relevancia al momento de diseñar un proceso de cultivo en biorreactor de un macromiceto (Bakratsas et al., 2021). Con el objetivo de determinar el efecto sobre la producción de biomasa y el perfil químico de hongo L. edodes cultivado, para cada una de las combinaciones de condiciones ensayadas, se cuantificó la biomasa, se analizó el perfil cromatográfico de los extractos en diclorometano por CG-EM, se cuantificó el contenido de proteína por análisis elemental, y el de esteroles y azúcares por un método espectrofotométrico.
Efecto de la agitación y la aireación sobre la producción de biomasa
Del análisis de la tabla 1 se puede concluir que el hongo L. edodes tiene su máxima producción de biomasa tanto en términos de productividad (0,00433 g biomasa/L*h) como de eficiencia de la conversión de biomasa (0,0260 g biomasa/g glucosa) a una agitación de 80 rpm y un flujo de aire de 0,50 vvm (ensayo 1). Se observa claramente que el aumento en la velocidad de agitación (ensayos 1 y 3, 2 y 4), genera un efecto negativo sobre el rendimiento y la productividad. Esto debido posiblemente a una ruptura de las hifas causada por el agitador tipo Rushton, teniendo en cuenta que las células de los hongos son generalmente sensibles al esfuerzo cortante. Una manera de confirmar si este fenómeno está ocurriendo, es con la medición de la viscosidad del fluido, puesto que un incremento en la producción de hifas se relaciona con un medio de cultivo más viscoso. De igual forma, una disminución en la longitud de las hifas tendrá como consecuencia una reducción de la viscosidad. En el caso de la formación de pellets, la agitación también tiene un efecto directo: estudios muestran una aparente relación entre la intensidad de la agitación y el tamaño del pellet, pues con el incremento en la velocidad de agitación se obtienen pellets más pequeños y compactos (Gibbs et al., 2000).
Efecto de la aireación y agitación sobre la composición de las biomasas
Contenido de proteína
Los hongos macromicetos se caracterizan por tener no solo un alto contenido proteíco, por lo que se destacan como una excelente fuente alimenticia para personas vegetarianas o veganas, sino que adicionalmente dichas proteínas se han destacado por poseer importantes actividades biológicas (Xu et al., 2011). En el presente estudio se determinó que el contenido de proteína del micelio de L. edodes cultivado en biorreactor no varía significativamente al cambiar la agitación y la aireación, teniendo un máximo de producción a 140 rpm y 0,75 vvm con un porcentaje del 33.41% (Figura 1).
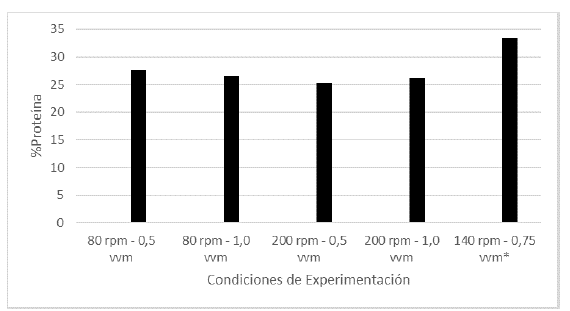
Figura 1 Porcentaje de proteína en cada uno de los tratamientos realizados en las fermentaciones (*Promedio aritmético de dos réplicas).
Los resultados obtenidos del porcentaje de proteína de la biomasa cultivada en biorreactor son superiores a los valores obtenidos por cultivo en Erlenmeyer, como se reporta en el trabajo publicado por Vega-Oliveros et al. (2019), donde de acuerdo a la cinética de crecimiento evaluada, a los 6 días se obtuvo un contenido de proteína de 8% aproximadamente y a 10 días de 8,1%, demostrando de esta manera que el uso de tecnologías como los biorreactores aumentan el valor nutricional de este organismo, además del aporte medicinal sustentado en los reportes de las actividades biológicas de las proteínas aisladas de hongos (Xu et al., 2011).
Por otro lado, la mayoría de estudios reportan el contenido proteico en los sombreros y estípites de los cuerpos fructíferos de Lentinula edodes. Li y colaboradores (2018) determinaron en el sombrero un contenido de proteína de 28,4% y en el estípite de 18,9%, Çaǧlarirmak, (2007) menciona un rango entre 20,7% y 29,4%, y López y colaboradores (2013) valores de 22,7% y 23,4%, para las fructificaciones cultivadas con dos tratamientos diferentes. De esta manera, la estrategia de cultivar Shiitake en un biorreactor produce contenidos de proteína ligeramente mayores a los que se logran en el cultivo tradicional, en menor tiempo y bajo condiciones controladas de una manera más eficiente.
Determinación de Esteroles
Los esteroles hacen parte de los metabolitos secundarios más ampliamente distribuidos en el reino fungi, responsables de diferentes actividades biológicas reportadas para estos organismos (Kour et al., 2022). El estudio del efecto de la aireación y la agitación sobre la producción de este grupo de metabolitos, permitió determinar que con una agitación de 80 rpm y una aireación de 0.5 vvm, se alcanza una concentración de esteroles del 89.32%, y a su vez un alto nivel de aireación y de agitación resultan en un decrecimiento en la producción de los metabolitos, particularmente, el aumento en la agitación genera disminuciones cercanas a un 20%. De igual forma, el aumento en el flujo de aire reduce aproximadamente en un 10%, con respecto al máximo, la capacidad del hongo de producir esteroles (Figura 2).
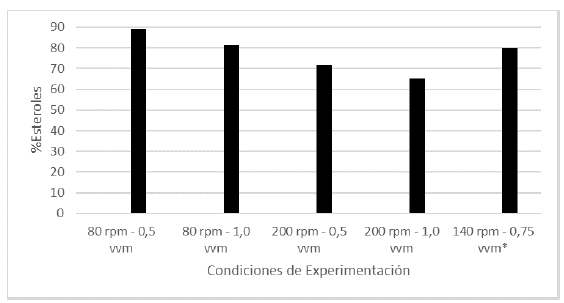
Figura 2 Porcentaje de esteroles en cada uno de los tratamientos realizados en las fermentaciones (*Promedio aritmético de dos réplicas).
No es posible hacer una comparación directa de estos resultados con estudios previos, debido a que no hay reportes de investigaciones similares. No obstante, resultados como el reportado por Jasinghe y Perera (2005), quienes calcularon el porcentaje de ergosterol en diferentes partes del hongo Shiitake, con valores en las láminas del sombrero del 10,6%; en la capa externa del sombrero un 5,34% y en el tallo de la seta un 2,97%, permiten establecer que el procedimiento de cultivar micelio del L. edodes en biorreactor es más eficiente que el cultivo tradicional.
Determinación de polisacáridos
Los hongos son considerados por la medicina moderna una fuente ilimitada y poco explorada de polisacáridos con un alto potencial terapéutico debido entre otras a sus propiedades antitumorales e inmunoestimulantes (Wasser S. 2002; Maity P. et al., 2021). Por esta razón, evaluar el efecto de variables del proceso como en el caso de la presente investigación, sobre la producción de este grupo de metabolitos, genera un aporte valioso al conocimiento de la biotecnología y la bioprospección fúngica. En la figura 3 se puede apreciar el efecto de variar la agitación y la aireación sobre los azucares totales presentes en las biomasas del L. edodes. Del análisis de los resultados se puede concluir que, a diferencia de la producción de esteroles, la aireación es un factor que se debe tener en cuenta si se quiere producir una mayor cantidad de polisacáridos. Con cualquier nivel de agitación, al tener un mayor flujo de aire se logra obtener una mayor cantidad de polisacáridos, un 15% más al variar la aireación de 1,0 a 0,5 vvm. Se han reportado porcentajes de azúcares totales para L. edodes del 14,2%; 38,3% en polvo; 111,6% en el sombrero y 125,0% en el estípite.
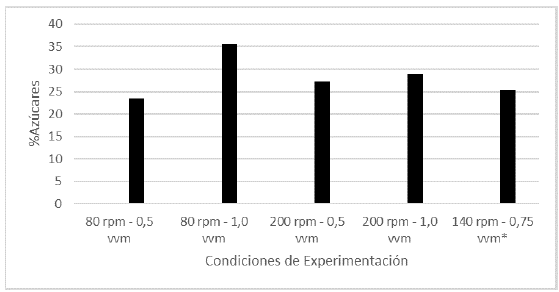
Figura 3 Porcentaje de azúcares totales en cada uno de los tratamientos realizados en las fermentaciones. (*Promedio aritmético de dos réplicas).
Generalmente, el contenido total de azúcares en los hongos varía ampliamente entre el 5 y el 25% del peso seco (Kalač, 2016). Para el biorreactor de estudio, una óptima producción de azúcares se encontraría en los 80 rpm de agitación y 1,0 vvm de aireación. Los datos obtenidos se encuentran entre los rangos reportados en literatura, en este sentido se puede afirmar que el biorreactor no promueve una mayor generación de polisacáridos comparado con el cultivo en estado sólido o sumergido. No se encuentra en la literatura un análisis del contenido de polisacáridos totales del micelio del hongo cultivado en biorreactor, los evaluados se centran en la determinación de exopolisacáridos, por lo que esta investigación da a conocer nuevos datos de referencia para futuros trabajos en la determinación de polisacáridos con bioactividad producidos en un biorreactor.
Con los resultados obtenidos en términos de cantidad de biomasa y de composición se procedió a realizar los análisis estadísticos para determinar la correlación de las condiciones estudiadas con las respuestas.
Análisis estadístico del diseño central compuesto
Como se describió en la metodología, se realizó un análisis (ANOVA) generando un modelo de regresión con una significancia estadística del 95%. En la tabla 2 se resumen cada uno de los modelos probados, con su respectivo análisis de varianza mostrando los valores F y P para la toma de decisión (relación con significancia estadística entre las variables, valor p<0,05). Para cada variable de respuesta, biomasa y porcentaje de esteroles, no hay un efecto significativo de la aireación o la agitación, ni una combinación de primer orden, ni una de segundo orden representan el modelo trabajado.
Tabla 2 Resultados del análisis de varianza, para cada uno de los modelos evaluados.
| Modelo | Y = Biomasa | Y = %Esteroles |
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CAi = Componente de agitación, CAri = Componente de aireación
Si se escogiera el mejor de cada caso, para la producción de biomasa podría ajustarse una línea recta, la cual explicaría tan solo el 28,05% de la variabilidad de los datos, de acuerdo al valor de R2 ajustado, el cual es más apropiado para comparar modelos con diferentes números de variables independientes (Agudelo-Escobar et al., 2017). En el caso del porcentaje de esteroles podría emplearse una ecuación lineal con efecto de ambos parámetros explicando el 55,43% de la variabilidad en la respuesta.
No se generan modelos estadísticamente confiables para un posterior proceso de optimización. Una posible razón por la cual no fue posible detectar un efecto considerable de las variables pudo ser debido a que los rangos de agitación y aireación escogidos eran demasiado grandes como para obtener diferencias significativas en cada una de las fermentaciones. Como se discutió anteriormente, niveles altos de agitación provocan una disminución en el rendimiento en cuanto a producción de biomasa y metabolitos. Así, se consideraría la posibilidad de diseñar experimentos para los rangos menores y así confirmar esta hipótesis. Aunque los resultados obtenidos muestran que existe un punto de máxima producción de biomasa, no hay una confiabilidad estadística para generar modelos que permitan predecir y/o representar el comportamiento de la fermentación realizada.
Finalmente, el estudio de los perfiles obtenidos por cromatografía de gases acoplado a espectrometría de masas permitió evaluar el efecto de las variaciones en los factores sobre la variedad de metabolitos de mediana polaridad presentes en las biomasas.
Análisis de los perfiles de los extractos por CG-EM
Los análisis de los cromatogramas y espectros de masas de los extractos obtenidos del micelio en diclorometano para cada una de las condiciones evaluadas, permitieron determinar los compuestos presentes y su porcentaje de área relativa.
A partir del análisis de la tabla 3, se puede evidenciar que los esteroles conforman la mayor parte de los metabolitos presentes en los extractos analizados, representados en su mayoría por el ergosterol, corroborando los resultados obtenidos de la determinación espectrofotométrica discutida anteriormente y reforzando el potencial que tienen los procesos biotecnológicos en biorreactor para el cultivo de una biomasa fúngica con un alto potencial en bioprospección, debido a la variedad de actividades biológicas atribuidas a este grupo de compuestos (Cheung, 2010; Prajapati et al., 2021).
Tabla 3 Compuestos determinados bajo cada una de las condiciones evaluadas en los extractos en DCM de las biomasas de Lentinula edodes cultivadas en el biorreactor.
Cantidades relativas calculadas a partir del área del pico (%) + < 1%, 1% < ++ < 5% , 5% < +++ < 10%, 10% < ++++ < 20%, 50% < +++++, - = No detectado
El segundo grupo de constituyentes mayoritario es el ácido linoleico y sus ésteres. Los ácidos grasos juegan un rol importante en el metabolismo del hongo, encontrándose en forma de ácidos libres y ésteres, particularmente del glicerol, funcionan como metabolitos almacenadores de energía mientras que los fosfolípidos son constituyentes de la membrana celular del hongo (Cheung, 2009). Se han identificado más de 40 ácidos grasos en varias especies de hongos, los cuales son en su mayoría alifáticos y monocarboxílicos, además, los ácidos insaturados presentes son de configuración cis (Cheung, 2010). Otros estudios como el de Mohammad Rahman y colaboradores reportan la presencia de ácidos grasos en cuerpos fructíferos de Lentinula edodes como el ácido oleico y linoleico, resaltando que este último tiene propiedades antiarterioscleróticas al disminuir los niveles de lipoproteínas de baja densidad (LDL) en la sangre (Rahman et al., 2018). P. Miles reporta diferentes porcentajes de composición de ácidos grasos totales en cuerpos fructíferos de diferentes cepas de Shiitake, encontrando niveles de ácido linoleico entre 53,62% y 76,25%, y composiciones elevadas de ácido mirístico del 11,31% al 20,94% (Miles & Chang, 2004), concluyendo de esta manera que el cultivo en biorreactor de este hongo macromiceto también es una fuente importante de ácidos grasos insaturados, los cuales son esenciales en la dieta, además, el ácido linoleico contribuye enormemente al sabor de los hongos debido a su rol como precursor del 1-octen-3-ol, el cual es el principal compuesto aromático conocido como alcohol fúngico (Cheung, 2010), lo que da la apertura a diferentes aplicaciones culinarias del micelio seco como alimento, especia y/o potenciador de sabor.
CONCLUSIONES
El cultivo en biorreactor es una metodología que permite obtener biomasa de L. edodes, aumentando la eficiencia y eficacia del proceso. Debido a las pocas investigaciones llevadas a cabo con hongos macromicetos cultivados en biorreactor, este estudio amplio la información disponible.
Se evidencia que el cultivo de micelio en biorreactor aumenta la producción frente a los cultivos elaborados a nivel laboratorio en Erlenmeyer, llegando a un óptimo de producción de biomasa de 0,66 g/L a las condiciones de 80 rpm y 0,5 vvm. La producción de esteroles es máxima a las mismas condiciones, llegando a un porcentaje en el extracto de 89,32%. Lo contrario ocurre para la biosíntesis de polisacáridos, un aumento en el nivel de aireación promueve su producción. El mayor porcentaje de azúcares totales se encuentra a 80 rpm y 1,0 vvm, obteniendo un 35,58%. Finalmente, para la proteína total se evidencia nuevamente las mejores condiciones para una buena producción proteica son 80 rpm y 0,5 vvm, con un porcentaje de proteína total del 27,66%. Las biomasas cultivadas se caracterizan por tener un alto contenido de esteroles y de igual forma, se aprecia la formación de ácidos orgánicos como el ácido linoleico, y sus ésteres.
Finalmente, es importante resaltar la novedad de la presente investigación debido a la escasez de información y de reportes que puedan dar un mejor entendimiento a los procesos que se llevan a cabo al cultivar el L. edodes en biorreactor, con el fin de escalar la producción a niveles incluso industriales.















