INTRODUCCIÓN
La Proteína Verde Fluorescente, (GFP por sus siglas en inglés, Green Fluorescent Protein) es ampliamente utilizada en áreas de la bioquímica, biología molecular y celular. En 1963, la GFP se aisló desde la medusa Aequorea victoria (Shimomura, Johnson y Shaiga, 1962), y posteriormente se logró su expresión en un sistema heterólogo (Chalfie et al. 1994), conduciendo a la generación de variantes con características de utilidad biotecnológica mediante mutagénesis dirigida (Tsien et al., 1995). Desde entonces, se han desarrollado múltiples aplicaciones para la GFP como proteína reportera, marcador celular o indicador de dimerización, entre muchas otras (Remington, 2011).
El éxito de la GFP se debe a su particular estructura que contiene una secuencia de aminoácidos específica suficiente para emitir fluorescencia, a diferencia de otras proteínas que requieren cofactores externos para fluorescer. Adicionalmente, posee un bajo peso molecular (27 kDa) que favorece su solubilidad en medios acuosos, ofreciendo ventajas para su uso biotecnológico (Stepanenko et al., 2013). Estructuralmente, la GFP se compone de 238 residuos de aminoácidos organizados en un barril β, en cuyo interior una α hélice contiene al cromóforo, el cual se produce mediante un proceso auto-catalítico de ciclación que requiere la presencia de oxígeno molecular para completarse (Flores et al., 2013, Arpino et al., 2012).
Mediante mutagénesis dirigida se ha modificado la secuencia primaria de la proteína, alterando aminoácidos específicos que han derivado en proteínas fluorescentes con cambios en su espectro de excitación y emisión, termo-estabilidad y sensibilidad a cambios de pH (Patterson et al., 1997; Zacharias y Tsien, 2006). La GFP-enhancer (EGFP por sus siglas en inglés, Enhancer GFP), posee un peso molecular aproximado de 28 kDa y dos mutaciones puntuales que incrementan 35 veces la intensidad de la fluorescencia. Así, el cambio S/T 65 promueve la ionización del cromóforo, aumentando la señal emitida, mientras que la sustitución F/L 64 estabiliza el plegamiento de la proteína (Zhang et al., 1996).
Aunque la detección de la GFP se realiza in-situ, frecuentemente es necesario implementar su detección indirecta, lo cual implica el uso de anticuerpos para amplificar la señal o reconocer la proteína en extractos desnaturalizados como los empleados en ensayos de Western blot o Dot blot, entre otros.
Dada la utilidad de la GFP a nivel biotecnológico y al alto costo de los productos disponibles comercialmente para su detección indirecta, se presenta la producción de la proteína recombinante 6xHisEGFP y su implementación como antígeno para la producción de anticuerpos policlonales aviares (IgY), reduciendo costos y brindando una alternativa de producción nacional para este tipo de herramientas moleculares.
MATERIALES Y MÉTODOS
Expresión y purificación de la proteína recombinante EGFP en sistema heterólogo Escherichia coli
Se realizó la amplificación de la secuencia codificante de la GFP a partir del vector pSP72RαneoαGFP (Atayde et al., 2012), donado por la Doctora María Marcela Camacho de la Universidad Nacional de Colombia, utilizando la proteína Phusion® High-Fidelity DNA Polymerase (New England Biolabs) y los oligonucleótidos Fw GFP pET100 5´-CACCATGGTGAGCAAGGGCGAGGA-3´ y Rv GFP pET100 5´-TACTTGTACAGCTCGTCCATGCCG-3´. El amplificado obtenido se purificó utilizando el kit Wizard SV Gel and PCR Clean-Up System (PROMEGA) y se clonó en el vector pET100/D-TOPO (Invitrogen) el cual otorga una etiqueta de histidinas (6xHis) a la proteína recombinante en su N-terminal. Se realizó transformación por choque térmico en E. coli TOP10 (ThermoFisher Scientific) y selección a 37 °C durante toda la noche en medio LB+Amp (LB: triptona 1%, extracto de levaduras 0.5%, NaCl 1%). Se verificaron los clones positivos por PCR de colonia, empleando los primers mencionados. Mediante lisis alcalina se obtuvieron los vectores pET100/EGFP y se transformaron en la cepa de expresión E. coli BL21 STAR DE3 (Invitrogen). La expresión se indujo en medio LB+Amp (0.1 mg/mL) empleando isopropil-β-D-1-tiogalactopiranósido (IPTG) 1.4 mM a 37 °C (Villamil-Silva et al., 2021).
Posteriormente, se realizó una centrifugación a 8000 rpm durante 5 minutos (Heraeus Megafuge 16R, ThermoFisher), para luego descartar el sobrenadante y proceder con la purificación de la proteína del paquete celular (ver siguiente párrafo). El proceso se monitoreó por SDS-PAGE 12%, utilizando azul de Coomassie e inmunodetección (Sambrook y Russell, 2001). Para confirmar la presencia de la proteína 6xHisEGFP, el western blot se realizó sobre una membrana PVDF (polifluoruro de vinilideno) utilizando como anticuerpo primario α-GFP producido en conejo (Molecular Probes, ThermoFisher) y como anticuerpo secundario α-conejo biotinilado acoplado a fosfatasa alcalina (Sigma) en dilución 1:8000, de acuerdo con la metodología propuesta por Liu y colaboradores (2014).
Para la purificación de la proteína recombinante se realizó lisis celular del cultivo inducido. Para ello, se ejecutaron procesos de lisis enzimática y mecánica. Para la primera, se utilizó buffer de lisis (pH 8.0) compuesto por 50 mM NaH2PO4, 500 mM NaCl, 2 mM MgCl2, glicerol 1% (v/v), 10 mM imidazol, lisozima (0,5 mg/mL) y coctel inhibidor de proteasas (Sigma P8340). Este fue añadido en proporción 7 mL / gramo de peso húmedo celular y se incubó durante 1.5 horas a 4 °C y en agitación constante. Después, se realizó la lisis mecánica mediante sonicación, en ciclos de 15 segundos de sonicación y 45 segundos de reposo, para un total de 3 minutos de sonicación. Finalmente, se llevó a cabo una centrifugación a 14000 rpm por 30 minutos a 4 °C (Heraeus Megafuge 16R, ThermoFisher). De este modo, se obtuvo tanto la fracción soluble como la insoluble, a partir de las cuales se purificó la proteína 6xHisEGFP.
Los procedimientos de purificación se llevaron a cabo siguiendo la metodología propuesta por Contreras et al., 2015. Inicialmente, se realizó la purificación de la fracción soluble por medio de una cromatografía de afinidad a cobalto (Qiagen). En ella, se tomaron 36 μL de resina previamente equilibrada en buffer de lisis por cada mililitro de sobrenadante. La mezcla se incubó por 1 hora sobre hielo. Seguido, se centrifugó a 2000 rpm durante 3 minutos a 4°C (Heraeus Megafuge 16R, ThermoFisher). El pellet que contenía la resina y la proteína se lavó con buffer de lisis y se centrifugó a 2000 rpm por 2 minutos a 4 °C. El pellet se lavó nuevamente, utilizando buffer de lisis con imidazol 20 mM. Después, se transfirió a la columna cromatográfica y se realizaron lavados utilizando buffer de lisis con imidazol 70mM. Posterior, se realizaron 3 eluciones, utilizando imidazol 300mM. El proceso de purificación se monitoreó por SDS-PAGE 12%.
Por otro lado, la fracción insoluble se purificó a partir de cuerpos de inclusión, de acuerdo con metodologías estandarizadas (Palmer et al., 2012). De este modo, se homogenizó el pellet en buffer de lavado (tris-HCl 100 mM pH 7.0, EDTA 5mM, ditiotreitol 5 mM, urea 2 M y tritón X-100 2%), se llevó a cabo una centrifugación a 12000rpm por 30 minutos a 4°C, repitiendo esto 3 veces. Después, se homogenizó el pellet en buffer de lavado (Tris-HCl 100 mM pH 7.0, EDTA 5 mM y DTT 5 mM) y se centrifugó a 12000 rpm por 30 minutos a 4°C. El pellet obtenido se homogeneizó en buffer de extracción (Tris-HCl 50 mM pH 7.0, EDTA 5 mM, DTT 5 mM y guanidina-HCl 8 M) y se centrifugó a 14000 rpm por 1 hora a 4°C. Después, se recolectó el sobrenadante y se sometió a diálisis durante 2 horas con buffer de diálisis (Tris-HCl 50 mM, NaCl 150mM) con agitación constante y sobre hielo utilizando una membrana de 10 kDa de MWCO (Molecular Weight Cut-Off). Se centrifugó a 12000 rpm por 20 minutos y los pellets se cargaron en SDS-PAGE preparativo. Luego, la fracción del gel que contenía la proteína de interés se maceró y eluyó con agua MilliQ a 37 °C. Finalmente, se realizó una centrifugación a 5000 rpm por 5 minutos y se obtuvo la proteína en el sobrenadante. La proteína purificada tanto de la cromatografía de afinidad como a partir de los cuerpos de inclusión se cuantificó mediante el método de Bradford (Hammond & Kruger, 1988) y se utilizó para la inoculación de gallinas, con el fin de producir anticuerpos policlonales anti 6xHis-EGFP.
Obtención de los anticuerpos policlonales contra EGFP (α6xHis-EGFP-IgY) empleando modelo aviar
Se emplearon gallinas de la raza Hy-line Brown de 56 semanas, la inoculación se realizó siguiendo el protocolo previamente estandarizado en nuestro grupo de investigación (Moreno-González et al., 2013). Se realizó un total de 4 inoculaciones durante un periodo de 36 días, cada una empleando 150 μg de la proteína 6xHisEGFP purificada. En la primera inoculación se empleó el adyuvante completo de Freund (Sigma, F5881) en relación 1:1 para emulsificar el antígeno, mientras que, en las posteriores se usó el adyuvante incompleto. El volumen final del inóculo en cada caso fue de 300 μL. Se empleó un individuo como control, empleando PBS en lugar de inmunógeno. Los huevos se colectaron diariamente durante todo el proceso. Igualmente, se tomaron 4 sangrías en los días 0, 8, 16 y 24 para la evaluación de sueros preinmunes e inmunes. Las gallinas se mantuvieron y manipularon en el bioterio de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional de Colombia, sede Bogotá.
Purificación de los anticuerpos α6xHis-EGFP-IgY
Este protocolo se basa en reportes previos para la purificación de IgY (Pauly et al., 2011). A partir de los huevos colectados se extrajo la yema, la cual se transfirió a un tubo plástico de 50 mL. A cada una se le añadió PBS 1X (NaCl 0.138 M, KCl 3mM, Na2HPO4 8.1 mM, KH2PO4 1.5 mM, pH 7.4) en una relación 1:1. Se procedió a purificar los IgY, tomando inicialmente alícuotas de 1 mL del volumen total de la solución. La delipidación de la muestra se realizó con PEG6000 3.5 % (p/v). La fracción soluble resultante, se sometió a procesos de precipitación fraccionada con PEG6000 8.5% y 12%, purificando selectivamente las inmunoglobulinas presentes. Estos pasos se realizaron agitando por 10 min y centrifugando a 14000 rpm por 20 min a 4 °C en rotor HIGHConicTM (Heraeus Megafuge 16R, ThermoFisher). El pellet obtenido luego de la purificación se resuspendió en 400 μL de PBS 1X y se almacenó a -20 °C. El proceso se analizó por SDS- PAGE 12% (Laemmli, 1970).
A partir de las sangrías colectadas se realizó la extracción de IgY, para ello se procedió a coagular la sangre por 30 min a 37 °C. Posteriormente, se centrifugó a 12000 rpm por 20 min a 4 °C en rotor HIGHConicTM (Heraeus Megafuge 16R, ThermoFisher). Luego, se recolectó el sobrenadante (suero), el cual se almacenó con glicerol 20 % a -80 °C. Para evaluar anticuerpos α6xHisEGFP-IgY presentes en los sueros, se realizó un western blot en reconocimiento del antígeno (6xHisEGFP purificada) usando como anticuerpo primario cada uno de los sueros en una dilución de 1:3000. Se utilizó αIgY-fosfatasa alcalina 1:10000 (Sigma) como anticuerpo secundario (Moreno-González et al., 2013).
Con el objetivo de purificar los anticuerpos α6xHis-EGFP-IgY a partir de los sueros extraídos, se utilizó el método de afinidad al antígeno. Para ello se cargaron 250 μg de la proteína recombinante purificada en SDS-PAGE 12% y se transfirió a una membrana de PVDF (200mV, 2 h). La porción de la membrana que contenía la proteína 6xHis-EGFP (Banda de 30 kDa), visualizada con rojo Ponceau, se extrajo, se lavó con TBST por 10 min y se bloqueó con TBST leche 5 % por 1 h. El exceso de leche se retiró realizando 3 lavados con TBST durante 10 min. Después, la membrana se cortó en cuadros pequeños (2 x 2 mm), los cuales se incubaron con 500 μL de suero durante toda la noche (O.N). El suero con los anticuerpos no unidos se retiró de los tubos mediante pipeteo y se almacenó a -20 °C. Los cuadros de membrana se trataron con TBST hasta que los lavados extraídos presentaran una absorbancia menor a 0,1 a 280 nm. La elución de los anticuerpos α6xHis-EGFP-IgY se realizó adicionando 150 μL de glicina 100 mM pH 2,5 incubando durante 10 min en agitación constante. Seguido, el pH de los eluidos se neutralizó agregando 15 μL de Tris HCl 2 M pH 8.5. Finalmente, los α6xHis-EGFP-IgY se almacenaron a -20°C.
Evaluación de los anticuerpos α6xHis-EGFP-IgY
Para evaluar los anticuerpos obtenidos a partir de la yema de huevo, se realizó un ensayo ELISA indirecto, en donde se usaron placas de 96 pozos. Se adicionaron 100 μL de 6xHis-EGFP 10 μg/mL en buffer carbonatos pH 9.6 por pozo, y se incubó durante 1h a 37°C, y luego toda la noche a 4 °C. Durante la incubación la placa se mantuvo sellada con una capa plástica (vinipel) y una de papel aluminio. Posteriormente, se bloquearon los pozos con 200μL de PBS leche 5 % 2 h a 37 °C. El anticuerpo primario α6xHis-EGFP-IgY se adicionó en una dilución de 1:500 en PBS por 2 h a 37 °C. Se realizaron 3 lavados con PBS. El anticuerpo secundario αIgY-HRP (Sigma) en una dilución 1:8000 en PBS se incubó por 2 h a 37 °C, y se repitieron los lavados. Finalmente, se realizó el revelado empleando 2,2’ azino-bis (3-etilbenzotiazolina-6-ácido sulfónico) (ABTS-Sigma) y peróxido de hidrógeno en buffer citrato-fosfato 100 mM pH 5.0, incubando 1 h a 37 °C. La lectura del ELISA se realizó midiendo la absorbancia a 405nm.
Con base en los resultados obtenidos en el ELISA, se seleccionaron los huevos con mayor concentración de anticuerpos (correspondientes a la mayor absorbancia a 405nm). De los huevos seleccionados se purificaron las IgY a partir de la totalidad de la yema solubilizada en PBS 1X, empleando la precipitación con PEG6000 y afinidad al antígeno, como se describió anteriormente (Pauly et al., 2011). Se comparó el reconocimiento entre los anticuerpos obtenidos a partir de sueros y de yemas de huevo (dilución 1:3000) mediante Western blot. Se utilizó el anticuerpo secundario αIgY-fosfatasa alcalina en una dilución 1:10000 (Gallus Inmunitech). Finalmente, se evaluó la especificidad de los anticuerpos por la 6xHisEGFP mediante western blot, utilizando la proteína recombinante 6xHis-RBD, el anticuerpo primario α6xHis-EGFP-IgY purificado anteriormente (dilución 1:3000) y el anticuerpo secundario αIgY-fosfatasa alcalina (1:10000). Como control de inmunodetección se utilizó el anticuerpo primario α6xHis comercial (1:5000, 6x-His Tag Monoclonal Antibody (HIS.H8) Invitrogen) y el anticuerpo secundario αMouse acoplado a fosfatasa alcalina (1:10000, Anti-Mouse IgG−Alkaline Phosphatase antibody produced in goat, Sigma).
RESULTADOS
La proteína recombinante 6xHisEGFP se purificó desde fracciones solubles e insolubles del sistema heterólogo de expresión
El vector de expresión pSP72RαneoαGFP se utilizó como plantilla para la amplificación por PCR del fragmento egfp de interés (~719pb) (Figura 1A). El fragmento amplificado se purificó y clonó en el plásmido pET100/D-TOPO, obteniéndose el vector de expresión pET100-EGFP. La expresión de la proteína recombinante 6xHisEGFP en E. coli BL21 STAR DE3, incrementó conforme el tiempo de inducción, observándose la expresión prominente de una banda del peso esperado para la proteína 6xHisEGFP (~30 kDa) (Figura 1B y C).

Figura 1 Producción de la proteína recombinante 6xHis-EGFP. A. Clonación-amplificación del fragmento correspondiente a la región codificante para la EGFP (719 pb) a clonar en pET100/D-TOPO. Electroforesis en gel de agarosa 1 % (P/V) TAE 1X y tinción con bromuro de etidio (0,5 μg/mL). B. Expresión de la 6xHis-EGFP (~30 kDa) en células E. coli BL21 STAR DE3 inducidas con IPTG 1,4 mM por 4 horas y toda la noche (16 horas). SDS-PAGE 12%. Revelado mediante tinción con Azul de Coomassie. C. western blot empleando una membrana PVDF y el anticuerpo primario α-GFP (1:3000) y el secundario α-Mouse acoplado a fosfatasa alcalina (1:8000). M: Marcador de peso molecular (GeneRuler 100bp DNA ladder, Pierce™, Unstained Protein MW Marker, Thermo Scientific). EGFP: amplificación del gen codificante para la EGFP. (-): Control negativo (H2O como plantilla). N.I.: células No Inducidas. 4h: Células inducidas por 4 horas. O.N.: células inducidas durante toda la noche. Flecha verde: bandas en el peso esperado.
Una vez seleccionadas las colonias que expresaron la proteína recombinante 6xHisEGFP y establecidas las condiciones de inducción, se escaló el cultivo a 500 mL. Las bacterias se colectaron y se lisaron para obtener dos fracciones: soluble e insoluble (cuerpos de inclusión), las cuales permitieron la purificación tanto de la proteína recombinante 6xHisEGFP en su estado nativo como desnaturalizado, mediante cromatografía de afinidad a metales inmovilizados (IMAC) y extracción a partir de SDS-PAGE preparativo, respectivamente (Figura 2). La proteína de interés purificada constituye el primer paso para la producción y posterior evaluación de los anticuerpos policlonales α6xHis-EGFP-IgY.
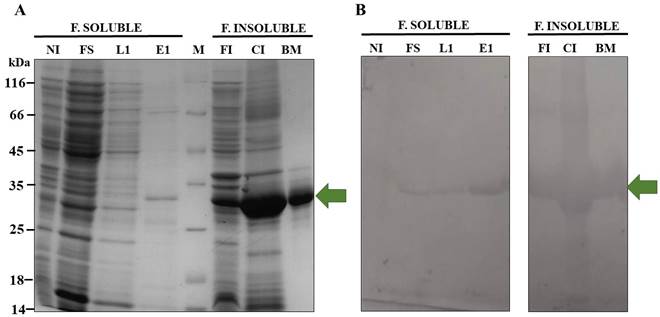
Figura 2 Purificación de la proteína 6XHis-EGFP a partir de la fracción soluble e insoluble, mediante IMAC y SDS-PAGE preparativo, respectivamente. A. SDS-PAGE 12%, tinción con Azul de Coomassie. B: western blot empleando una membrana de nitrocelulosa, anticuerpo primario α-GFP (1:5000) y anticuerpo secundario α-Mouse acoplado a fosfatasa alcalina (1:10000). La flecha verde corresponde a la banda ~30 kDa de peso esperado para la proteína 6xHis-EGFP. F. SOLUBLE: Fracción soluble; F. INSOLUBLE: Fracción insoluble NI: células no inducidas; FS: Fracción soluble; L1: Lavado 1; E1: Eluido 1; M: Marcador de peso molecular en kDa; FI: Fracción insoluble; CI: cuerpos de inclusión; BM: Banda Media del gel preparativo.
Los anticuerpos policlonales α6xHis-EGFP-IgY producidos son funcionales y específicos
La proteína recombinante 6xHisEGFP purificada tanto desde la fracción soluble como insoluble, se empleó como antígeno durante la inmunización, para producir anticuerpos policlonales, que reconocieran tantos epítopos estructurales nativos, como desnaturalizados. La recolección de huevos y sangrías de las gallinas inmunizadas permitió monitorear la producción de los anticuerpos α6xHis-EGFP-IgY durante el programa de inmunización, obteniéndose anticuerpos IgY en ambas muestras a lo largo del proceso. La concentración de IgYs totales presentes en los huevos colectados con respecto al programa de inmunización, incrementa hacia las dos últimas inoculaciones, aunque se observó un dato atípico para la muestra número 4 (Figura 3).
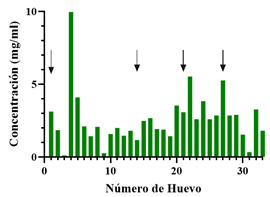
Figura 3 Cuantificación de las IgY totales de las yemas de huevo recolectadas durante la inmunización. La cuantificación se completó por el método de Bradford. Las flechas negras corresponden a los días en donde se realizó la inmunización.
Con el propósito de evaluar la respuesta inmune ante el antígeno 6xHisEGFP, se realizó el ensayo ELISA indirecto con las muestras colectadas, lo cual permitió seleccionar específicamente los huevos que presentaban una mayor concentración de anticuerpos específicos α6xHis-EGFP-IgY, para realizar la purificación total del solubilizado de yema inicial. En este experimento se utilizó una dilución 1:500 de los anticuerpos, puesto que ensayos ELISA preliminares en los que se utilizaron diferentes diluciones, indicaron la utilidad de esta. Los huevos seleccionados para obtener el lote final de anticuerpos correspondieron a aquellos que exhibieron mayor absorbancia a 405 nm (Figura 4). La prueba estadística aplicada indicó una diferencia significativa entre la primera fase (inmunizaciones 1 y 2), para la cual no se espera gran cantidad de IgYs específicos, en comparación con la segunda fase (inmunizaciones 3 y 4). Teniendo esto en cuenta, se utilizó un huevo de esta última (huevo 29) para los siguientes ensayos de inmunodetección.
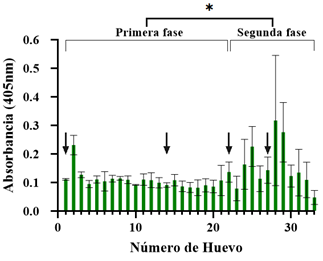
Figura 4 Evaluación de los anticuerpos α6xHis-EGFP-IgY mediante ELISA. La proteína recombinante 6xHis-EGFP se empleó como antígeno y las IgY generadas durante la inmunización y purificadas por el método de precipitación diferencial con PEG6000, se utilizaron como anticuerpo primario (1:500). Anticuerpo secundario α-IgY-HRP (Sigma) (1:8000). El revelado se realizó empleando 2,2’ azino-bis (3-etilbenzotiazolina-6-ácido sulfónico) (ABTS, Sigma) y peróxido de hidrógeno. Primera fase: huevos recolectados posterior a las primeras dos inmunizaciones. Segunda fase: huevos recolectados posterior a las últimas dos inmunizaciones. Los datos representan promedio ± desviación estándar (n = 2). El asterisco corresponde a una diferencia significativa entre las absorbancias registradas en la primera fase y las registradas en la segunda. Las flechas negras corresponden a los días en donde se realizó la inmunización.
Por su parte, los sueros obtenidos de las sangrías se evaluaron utilizándolos como anticuerpos primarios en un ensayo de inmunodetección por western blot, empleado la proteína previamente purificada. Se observó que las sangrías recolectadas reconocen específicamente el antígeno sin exhibir reacción cruzada contra la proteína control del ensayo de inmunodetección (BSA), indicando la especificidad de los anticuerpos obtenidos. Adicionalmente, aunque todas las sangrías detectaron el antígeno 6xHis-EGFP, a excepción de la sangría pre-inmune, las sangrías inmunes finales (3 y 4) exhibieron la señal más intensa, como era de esperarse (Figura 5).
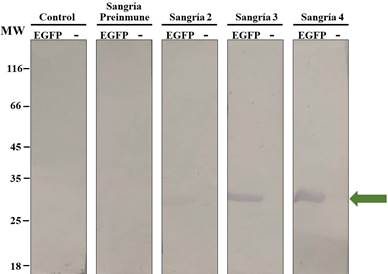
Figura 5 Evaluación de los anticuerpos α6xHis-EGFP-IgY a partir de sueros mediante western blot. Se analizaron las 4 sangrías colectadas durante la inmunización y el control no relacionado. (-): BSA (150ng); EGFP: 6xHisEGFP (250 ng). Anticuerpo primario: sangrías colectadas (1:3000). Anticuerpo secundario: α-IgY acoplado a fosfatasa alcalina (1:10000). Control: cuarta sangría de individuo inmunizado con PBS. Sangría preinmune: Sangría recolectada previa a la inmunización con 6xHisEGFP. La flecha verde corresponde a la banda ~30 kDa de peso esperado para la proteína 6xHis-EGFP. Membranas de nitrocelulosa.
Los anticuerpos α6xHis-EGFP-IgY obtenidos tanto de huevos como de sueros sanguíneos que presentaron mayor reconocimiento del antígeno, se evaluaron paralelamente mediante western blot. Se observó que existe un reconocimiento selectivo al antígeno, detectándose una señal más intensa con los sueros inmunes en comparación con los anticuerpos provenientes de las yemas de los huevos (Figura 6).

Figura 6 Evaluación comparativa de anticuerpos α6xHis-EGFP-IgY purificados por afinidad a partir de yemas y sueros mediante western blot. Empleando los anticuerpos purificados, se evaluó el reconocimiento de estos frente a la proteína recombinante y a un control negativo (BSA). Anticuerpo primario α6xHis-EGFP-IgY purificado (1:3000, suero o yema) y anticuerpo secundario α-IgY acoplado a fosfatasa alcalina (1:10000). M: Marcador de peso molecular en kDa. (-): BSA (150ng); EGFP: 6xHisEGFP (250ng). La flecha verde corresponde a la banda ~30 kDa de peso esperado para la proteína 6xHis-EGFP. Membranas de nitrocelulosa.
Finalmente, se comprobó por medio de western blot que los anticuerpos α6xHis-EGFP-IgY son específicos dado que no reconocen la etiqueta de Hexa-histidinas (Figura 7).
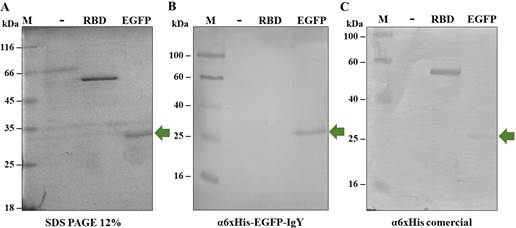
Figura 7 Evaluación de la especificidad de los anticuerpos α6xHis-EGFP-IgY. Se empleó la proteína recombinante 6xHis-RBD (control de 6xHis). A. SDS-PAGE 12% donde se cargaron las 3 proteínas de prueba para el experimento de inmunodetección. Tinción con Azul de Coomassie. B. Western blot empleando como anticuerpo primario α6xHis-EGFP-IgY purificado de sangría (1:3000) y como anticuerpo secundario α-IgY acoplado a fosfatasa alcalina (1:10000). C. Western blot empleando como anticuerpo primario α6xHis-IgG comercial (1:5000; Invitrogen) y como anticuerpo secundario α-Mouse acoplado a fosfatasa alcalina (1:10000; Sigma). M: Marcador de peso molecular (Opti-Protein Express Marker, abm); (-): BSA, 150 ng; RBD: 6xHis-RBD (proteína recombinante purificada), 250 ng; EGFP: 6xHisEGFP, 250 ng. Membranas de PVDF.
DISCUSIÓN
La producción local de la EGFP y un anticuerpo policlonal contra esta, dos herramientas de amplio uso en investigación y docencia se abordó en este trabajo, integrando herramientas moleculares y bioquímicas. Para ello se partió del vector pSP72RαneoαGFP para amplificar y clonar la región codificante para la EGFP (Figura 1A). El vector recombinante obtenido pET100-6xHisEGFP, permitió expresar una proteína de ~ 30kDa, cuyo N-terminal presenta la etiqueta 6xHis. Se ha reportado que la localización de esta etiqueta en el extremo N-terminal, específicamente para la variante GFPuv, no afecta la fluorescencia de la proteína e incrementa los niveles de expresión, manteniendo su solubilidad en E. coli (Park et al., 2015). Por esta razón se eligió posicionar la etiqueta en este extremo de la proteína.
La expresión en el sistema heterólogo se estableció evaluando la concentración de inductor y tiempo de inducción. Se observó que una mayor concentración de inductor (IPTG 1.4mM) junto con un periodo de inducción prolongado (ON) favorecen la expresión abundante de la proteína recombinante (Figura 1B). Asimismo, se notó que las bacterias transformadas que no fueron tratadas con IPTG (células no inducidas), expresaron la proteína 6xHisEGFP como se evidencia en el ensayo de western blot (Figura 1C). La posible explicación para esta señal es el proceso de autoinducción, en el cual la disminución de glucosa en el medio de cultivo durante incubaciones prolongadas promueve la transcripción del operón lac a través de la proteína reactiva C (CRP), en respuesta al incremento de AMPc (Crowley et al., 2019). Este comportamiento puede limitarse mediante el suplemento de glucosa en el medio de inducción.
Otras posibilidades atribuyen la autoinducción a mutaciones puntuales del represor que disminuyen su afinidad por la secuencia de ADN, o bien afectaciones en el equilibrio conformacional del represor (Almond, 2014). Para los propósitos de este acercamiento metodológico la autoinducción podría constituir una estrategia para inducir la expresión en ausencia de inductor reduciendo los costos de producción. Sin embargo, este fenómeno de autoinducción no ocurre en todos los casos, siendo uno de los factores principales el volumen de cultivo: a escala piloto (10 mL, Figura 1C) se evidenció autoinducción, pero a mayor volumen (500 mL, Figura 2) no se observa la proteína de interés en las células no inducidas.
La proteína recombinante se encontró en la fracción soluble y en la insoluble, lo cual permitió desarrollar dos estrategias para su purificación (Figura 2). El protocolo IMAC, empleando una resina de cobalto para la purificación de la proteína soluble, aprovechando la presencia de la etiqueta 6xHis en el extremo amino terminal, indicó un mayor grado de pureza en el eluido 1 (Figura 2) obtenido con buffer de elución en presencia de 75 mM de imidazol. En lavados previos, la preparación contenía impurezas (e.g. lavado 1 (Figura 2A)), por lo que se determinó que los eluidos 1 y 2 constituyen óptimas soluciones de la proteína soluble y mayoritariamente purificada, con concentraciones de 0,29 y 0,1 μg/μL. Lo anterior, se confirmó mediante western blot (Figura 2B).
Con respecto a la fracción insoluble, se determinó que es donde se ubica la mayor cantidad de proteína recombinante. Si se considera el peso total de las bacterias del cultivo inicial 500 mL (2.5 mg) y la masa obtenida de proteína recombinante 6xHis-EGFP desde cada proceso de purificación, (0.5 mg IMAC y 4.1 mg SDS-PAGE preparativo), podemos estimar que cerca del 89% se acumuló como cuerpos de inclusión. La presencia mayoritaria de los cuerpos de inclusión puede explicarse por distintas razones. En primer lugar, la sobreexpresión inducida con altas concentraciones de IPTG puede generar concentración excesiva de la proteína recombinante, resultando en la agregación de esta (Singh et al., 2015). Aunque la GFP es una proteína altamente soluble, el promotor T7 que regula el vector pET100, es un promotor fuerte que generalmente se relaciona con la formación de cuerpos de inclusión. Esto constituye una ventaja para la generación de anticuerpos, dado que se pueden emplear como antígeno.
En cuanto al rendimiento de purificación, expresado en mg de 6xHis-EGFP / g de bacteria, se obtuvo 0.20mg/g para la purificación desde la fracción soluble y 1.64mg/g para la purificación desde la fracción insoluble, siendo el rendimiento total de la purificación de 1.84 mg de 6xHis-EGFP / g. En cuanto a los mg obtenidos de proteína recombinante (4.6 mg), estos corresponden a los rangos reportados (McRae et al., 2005).
La purificación por SDS-PAGE preparativo a partir de los cuerpos de inclusión permitió aislar la proteína 6xHis-EGFP en concentración 0.43 μg/μL desde la banda media del gel. Las proteínas purificadas por IMAC y SDS preparativo sirvieron para la generación de anticuerpos policlonales diversos, dirigidos tanto a epítopos conformacionales como desnaturalizados, capaces de reconocer la proteína nativa y desnaturalizada.
La cinética de producción de los IgY se determinó mediante cuantificación de la concentración de IgYs provenientes de la yema de huevo, en relación con el esquema de inmunización (Figura 4). Se observó un ligero incremento de las inmunoglobulinas hacia las dos últimas inoculaciones (segunda fase). Esto debido posiblemente al reto y a la memoria inmunológica generada en la primera fase (primera y segunda inmunización). Adicionalmente, algunas muestras como el huevo 4 indicaron un comportamiento atípico propio de la variabilidad intrínseca de los sistemas biológicos.
La evaluación mediante ELISA de los anticuerpos específicos sobre la proteína recombinante 6xHis-EGFP, indican que los mayores valores de absorbancia que se registran dada la presencia de anticuerpos α6xHis-EGFP-IgY, corresponden a los huevos recolectados después de la tercera y cuarta inoculación. Esto se debe al desarrollo de una respuesta inmune humoral en la primera fase de inmunización (Müller et al.,2015).
En los sueros evaluados mediante ensayos de inmunodetección (Figura 6), se observó que las sangrías recolectadas en las últimas fases de la inoculación (sangrías 3 y 4) exhibieron una mayor señal en el western blot. Esto coincide con los resultados obtenidos para los anticuerpos purificados a partir de las yemas de huevo. En este punto, resulta importante aclarar que el gran interés de obtener IgYs está dado por la posibilidad de purificarlas no sólo a partir del suero inmune de los individuos, sino también desde las yemas de los huevos, ya que es un proceso no invasivo y altamente eficiente. Las IgY son el único isotipo de anticuerpos transferidos hacia los futuros embriones como mecanismo para responder ante patógenos circundantes, aún sin haber desarrollado su sistema inmune humoral, fenómeno denominado inmunidad vitelina (Montini et al., 2018; Criste et al., 2019). En complemento, los IgY son los anticuerpos más abundantes dentro de la gallina, constituyendo aproximadamente 75% de los anticuerpos totales, siendo equivalentes a los IgG de mamíferos (Müller et al., 2015). Se ha explorado el potencial de los anticuerpos de yema de huevo como herramienta de diagnóstico de enfermedades aviares, encontrándose que estos sirven para conocer el estado inmunológico de las aves, siendo equiparable a los exámenes realizados con anticuerpos de suero (Sá e Silva & Swayne, 2012; Abdelwhab et al., 2016). No obstante, también es posible realizar pruebas de reconocimiento específico (como western blot) a partir de sangrías, sin la necesidad de purificar los anticuerpos desde las yemas (Figura 4).
Es importante resaltar que los anticuerpos producidos fueron específicos exclusivamente para la 6xHisEGFP y no para otras proteínas con la misma etiqueta (Figura 7). De acuerdo con estudios previos en modelos murinos, se ha localizado una región de la proteína hacia el extremo C-terminal que presenta inmunogenicidad (Gambotto et al., 2000). En complemento, se realizó un análisis bioinformático utilizando el servidor EllisPro para identificar los posibles epítopos de la proteína (Ponomarenko et al., 2008). De esta manera, se encontraron 7 regiones peptídicas con potencial de epítopos lineales diferentes a la etiqueta de histidinas. Teniendo esto en cuenta, se puede evidenciar que los anticuerpos producidos reconocen estas regiones de la 6xHisEGFP en vez de su etiqueta en el N-terminal.
Comparando estos anticuerpos con aquellos obtenidos en los modelos mamíferos, encontramos ventajas para realizar estudios de diversa índole. En primer lugar, la posibilidad de purificar estos anticuerpos desde las yemas de los huevos constituye un método no invasivo y ofrece una ventaja en cuanto a la cantidad de anticuerpos producidos, siendo superior a aquella dada en conejos (Sheng et al., 2015). Adicionalmente, el uso de estos anticuerpos aviares ha abordado el desarrollo de metodologías de diagnóstico y producción de alimentos funcionales, debido a su potencial neutralizador. Aunque el mercado internacional ofrece multitud de anticuerpos, los altos costos y los tiempos de importación constituyen una limitante. Es importante desarrollar a nivel local la capacidad de generar herramientas moleculares que ofrezcan una solución a los requerimientos locales y que puedan ser una posibilidad innovadora y de apropiación en Colombia.
CONCLUSIÓN
Con el propósito de proyectar la academia en el sector productivo y beneficiar a la comunidad científica mediante la generación de dos herramientas de amplia utilidad, se obtuvo la proteína recombinante 6xHisEGFP de forma nativa y desnaturalizada, mediante la construcción de un vector recombinante de expresión en E. coli, permitiendo la producción de anticuerpos policlonales específicos α6xHis-EGFP-IgY, empleando el modelo aviar. Las herramientas moleculares desarrolladas en el presente trabajo pueden ser ampliamente utilizadas en investigación y docencia, por lo cual representan una apuesta a la búsqueda de insumos más asequibles para los laboratorios a nivel nacional.














