INTRODUCCIÓN
Las enfermedades cardiovasculares son la principal causa de muerte en el mundo según datos de la Organización Mundial de la Salud (World Health Organization, 2020), entre estas, existe una patología asociada a las enfermedades isquémicas del corazón, accidentes cardiovasculares y tromboembolismo llamada trombosis, la cual representa el mayor porcentaje de esta cifra (Barco et al., 2020)
Comúnmente, los tratamientos para las enfermedades cardiovasculares de este tipo consisten en dosis periódicas de algún medicamento como Warfarina o Heparina (Biswas et al., 2023), teniendo este último gran relevancia debido a su alta capacidad anticoagulante, sin embargo, en el caso de que un episodio de trombosis requiera el reemplazo del conducto vascular afectado, las alternativas existentes consisten en el acondicionamiento de un injerto vascular autólogo o la fabricación de un injerto vascular artificial.
En el caso de los injertos vasculares autólogos; la poca disponibilidad de tejido, el tiempo de espera para su acondicionamiento físico, el rechazo biológico y los problemas relacionados con la dilatación y estenosis del injerto, representan las principales limitaciones de estos (Suuronen & Ruel, 2015), por otra parte, la fabricación de injertos vasculares artificiales ha venido siendo una alternativa popular para el tratamiento de enfermedades cardiovasculares que requieran el reemplazo del conducto afectado, para lo cual se utilizan algunos materiales poliméricos como el politetrafluoroetileno expandido (Yan et al., 2021), polietilentereftalato (PET) (L. Wang et al., 2021), polivinil-alcohol (PVA) (Atlan et al., 2018), ácido poliláctico (Martin et al., 2019) y poliuretanos (Castillo-Cruz et al., 2019), y la fibroína de seda (Shi et al., 2019).
A pesar de las virtudes que ofrecen los biomateriales como alternativa para la fabricación de injertos vasculares artificiales, se ha documentado que la formación de plaquetas sobre la superficie de éstos ha sido el origen de las fallas en la mayoría de los casos (Qiu et al., 2017) (Koobatian et al., 2016), resultando necesario mejorar los materiales destinados a esta aplicación con el fin de inhibir dicha formación plaquetaria sobre su superficie, lo que se logra a través de la inmovilización de una sustancia anticoagulante como la heparina sobre la superficie del material que está en contacto con la sangre, de este modo, se garantiza que el injerto vascular artificial pueda tener un comportamiento similar al conducto vascular nativo, tanto por las propiedades mecánicas que brindan los polímeros previamente mencionados, como una mayor hemocompatibilidad dada por la biofuncionalización con heparina (Qiu et al., 2017).
Entre los materiales empleados para la fabricación de injertos vasculares, la fibroína ha venido despertando gran interés, Siendo esta una proteína de alta biocompatibilidad que puede ser extraída del capullo del gusano de seda Bombix Mory, cuya estructura química se caracteriza por la repetición de la secuencia de amino ácidos de glicina-alanina-glicina-alanina-glicina-serina (Gli-Ala-Gli-Ala-Gli-Ser), organizadas en una estructura de láminas-β antiparalelas, con formación de enlaces de hidrogeno y de fuerzas de van der Walls que le dan propiedades mecánicas (D. Wang et al., 2017), (Adalı et al., 2016). Además, la presencia de algunos aminoácidos reactivos en su estructura como serina, treonina, tirosina, ácido aspártico y ácido glutámico, le permiten ser modificada superficialmente mediante la inmovilización de heparina sobre su superficie utilizando diversas técnicas como son el acople de carbodiimida (Elahi et al., 2014), a través de sus grupos amino terminales, y con la cual se pueden fabricar injertos vasculares que permitan el crecimiento de células endoteliales (Tanaka et al., 2021).
Por otro lado, la fibroína puede integrarse con otros polímeros biocompatibles como el PVA a fin de complementar sus propiedades mecánicas (Allardyce et al., 2017; Song et al., 2019).
El objetivo de esta investigación fue evaluar superficies a base de fibroína para su potencial uso en la fabricación de implantes vasculares artificiales, para ello se prepararon diferentes formulaciones utilizando PVA y fibroína, para posteriormente biofuncionalizar las superficies con heparina y evaluar su capacidad antitrombogénica.
MATERIALES Y MÉTODOS
Preparación de las soluciones de fibroína y PVA
La solución de fibroína se preparó tomando fragmentos de aproximadamente 5 mm2 del capullo de gusano de seda adquiridos en la Corporación para el Desarrollo de la Sericultura del Cauca (CORSEDA), los cuales fueron inmersos en una solución de carbonato de sodio (Na2CO3) 0.01M a 60°C por 3 h para retirar la sericina y obtener la fibroína en madeja, la cual se sometió posteriormente a una solución ternaria de Cloruro de calcio - agua - etanol (CaCl2:H2O:C2H5OH) en relación molar 1:2:8 a 60°C bajo agitación magnética durante 2 h para solubilizar la fibroína, posterior a esto, la solución resultante fue puesta en diálisis contra agua destilada durante 4 d empleando membranas de acetato de celulosa con referencia CE70153003 y un tamaño de poro inferior a 40 nm. Una vez terminado este proceso, concentró la solución al 2% (p/v).
La solución de PVA (Sigma Aldrich, 130kD) fue preparada adicionando el polímero lentamente en agua a 80°C durante aproximadamente 2 h hasta llegar a una concentración del 8% (p/v), luego se dejó la solución reposando a temperatura ambiente.
Biofuncionalización de la fibroína
La fibroína solubilizada fue biofuncionalizada por dos metodologías: por acople de carbodiimida y por aprovechamiento de interacciones electrostáticas.
Para biofuncionalizar por acople por carbodiimida, se diluyó la heparina (5000 U.I/ml, Blau Farmacéutica Colombia S.A.S) en solución amortiguadora de ácido 2-etanosulfónico (MES) a pH= 6.0, luego, la heparina se activó haciéndola reaccionar con N-hidroxisuccinimida (NHS, peso molecular 115.09g/mol, Sigma-Aldrich) durante 10 min, una vez activa la heparina, ésta se hizo reaccionar con hidrocloruro de N-(3-dimetilaminopropil)-N∗-etilcarbodiimida (EDC, peso molecular 190.70g/mol, Sigma-Aldrich) y fibroína en solución a pH= 6.0 durante 6 h a temperatura ambiente, una vez finalizada la reacción, la fibroína biofuncionalizada fue puesta en diálisis contra una solución de Na2HPO4 0.1 M a pH= 6.0 durante 2 h para eliminar la heparina que no reaccionó, posteriormente fue puesta en diálisis contra una solución de NaCl 2M a pH= 6.0 durante 24 h para remover el Na2HPO4, finalmente, puesta en diálisis contra agua destilada durante 24 h para eliminar el NaCl. Una vez terminados todos los procesos de diálisis, se calculó la concentración final de la fibroína biofuncionalizada por gravimetría, obteniéndose soluciones al 2% (p/v).
Para biofuncionalizar por aprovechamiento de interacciones electrostáticas se mezclaron las soluciones de fibroína y heparina a pH 6.0 durante 6 h con el fin de garantizar en la diferencia de cargas de las moléculas presentes en la solución. La fibroína adquiere carga parcialmente positiva, mientras que los grupos ácidos carboxílicos en la heparina permanecerán protonados, y la carga negativa de esta molécula estará principalmente presente en los grupos sulfatados, de esta manera se logró mantener las condiciones similares a la biofuncionalización por acople de carbodiimida, luego de esto, se calculó la concentración de la solución de fibroína por gravimetría. obteniéndose soluciones de aproximadamente 2% (p/v).
Preparación de las películas
La preparación de las películas comenzó haciendo reaccionar la solución de PVA con glutaraldehído (Sigma Aldrich, solución 25% (p/v)) en relación PVA:glutaraldehído 100:0.8 (p/p) durante 10 min en agitación magnética, posterior a esto, se agregaron soluciones de fibroína y glicerol con proporción fibroína:glicerol 3:2 (p/p) y se mantuvo bajo agitación por 1 h, una vez homogenizada la mezcla se tomaron 10 ml y se depositaron en moldes antiadherentes y se llevaron a estufa a 30°C durante 96 h, finalmente, las películas fueron retiradas y almacenadas para los análisis posteriores. La fibroína empleada para las películas fue fibroína sin biofuncionalizar, fibroína biofuncionalizada por acople de carbodiimida, y biofuncionalizadas por aprovechamiento de interacciones electrostáticas.
Espectroscopía infrarroja por transformada de Fourier
Se analizaron la muestra de control, las muestras biofuncionalizadas por ambos métodos, y la heparina utilizada para la biofuncionalización en un equipo SHIMADZU IR-TRACER 100, y se barrió el rango espectral entre 4000 cm-1 y 400 cm-1 durante 24 ciclos.
Microscopía electrónica de barrido
Las muestras de control y biofuncionalizadas por ambos métodos fueron recubiertas con una fina capa de Oro (Au) por pulverización empleando un DENTON VACUUM Desk IV, y luego fueron observadas en el Microscopio Electrónico de Barrido (JOEL-JSM 6490 LV) operado a un voltaje de aceleración de 20 kV y se tomaron micrografías de la superficie de cada muestra a 500 aumentos.
Ángulo de contacto
Las muestras de control y biofuncionalizadas por ambos métodos fueron analizadas en un goniómetro DataPhysics OCA 15EC, utilizando gotas de 1µl de volumen y se determinó el ángulo de contacto de cada una de ellas con agua. Todas las muestras se midieron por triplicado y su resultado se expresó como el promedio de éstos con su desviación estándar.
Propiedades mecánicas
Las muestras de control y biofuncionalizadas por ambos métodos fueron analizadas según la norma ASTM D-638 (ASTM (D638-02a), 2003) en una máquina universal de ensayos Shimadzu UH-X, con 500 N de carga y usando una velocidad de 5 mm/min. Para cada película se evaluó la resistencia a la tracción, el porcentaje de elongación a la ruptura y el módulo elástico, realizando ensayos por triplicado y reportando el valor promedio de los resultados y su respectiva desviación estándar.
Prueba de coagulación
La prueba de coagulación de sangre para evaluar la capacidad antitrombogénica de los materiales biofuncionalizados consistió en interrumpir el mecanismo de coagulación de las muestras de sangre extraídas y posteriormente reactivarlas adicionando Ca2+. Las muestras se analizaron al instante en que se extrajo la sangre de los voluntarios y se hizo una segunda prueba 15 días después, para ello, bajo autorización del comité de ética de la Universidad de Antioquia, se extrajo sangre de tres voluntarios (con consentimiento informado y firmado), siguiendo el protocolo de extracción a través de un catéter venoso (Deschka, 2011), y se depositó en tubos especiales con citrato de sodio (Na3C6H5O7) para desactivar la cascada de coagulación, posteriormente, en un tubo que contenía un fragmento de aproximadamente 1 cm2 del material a evaluar se depositaron 400 µl de la sangre extraída, posteriormente a este sistema se le agregaron 40 µl de solución de Cloruro de calcio (CaCl2) 0.1 M para reactivar la cascada de coagulación en la sangre, finalmente, se retiró el material evaluado cada 10 min durante 60 min y se midió la masa total de coágulos adheridos a la superficie haciendo uso de una balanza analítica en los tiempos mencionados.
Las muestras se dejaron en contacto con la sangre durante 6 h y se midió la masa de coágulos adheridos en las muestras luego de este tiempo. Todas las mediciones se realizaron por triplicado para cada material con la sangre de cada voluntario, teniendo así un total de 9 réplicas por material. El resultado final se reportó como el promedio de masa de los coágulos adheridos a la superficie con su respectiva desviación estándar.
Para verificar la estabilidad de la bioactividad de la heparina inmovilizada, se tomaron fragmentos de aproximadamente 1 cm2 de las muestras y fueron puestos en incubación durante 15 d en una solución amortiguadora de fosfato (PBS) a pH=7.0, una vez pasado el tiempo de incubación, las muestras se retiraron y se realizó la prueba de recalcificación de sangre a todas ellas.
RESULTADOS Y DISCUSIÓN
Evaluación de antitrombogenicidad de los materiales biofuncionalizados
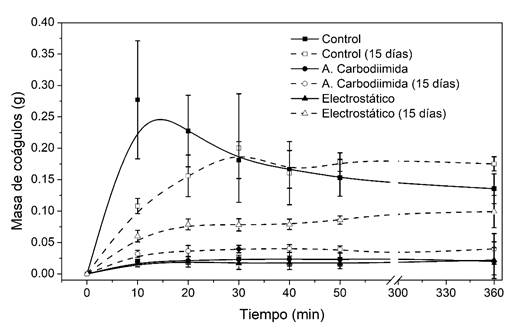
En la Figura 1 se muestran los resultados cuantitativos de la masa total de coágulos adheridos a la superficie de los diferentes materiales evaluados en función del tiempo.
En ésta se observa que a tiempo cero las muestras de control adquieren un máximo de masa de coágulos adheridos de aproximadamente 0.24 ± 0.06 g en los primeros 10 min de análisis, para finalmente estabilizarse luego de 6 h en aproximadamente 0.14 ± 0.03 g, lo que se explica debido a que estas muestras de control, al ser materiales extraños y sin biofuncionalizar, permiten que los coágulos formados se adhieran a su superficie hasta alcanzar una masa crítica que se da cuando dicha superficie está saturada de coágulos, luego estos se desprenderán hasta estabilizarse en la capacidad máxima que cada superficie pueda tener. Por otra parte, las muestras biofuncionalizadas por ambos métodos muestran un comportamiento diferente, alcanzando un máximo de masa de aproximadamente 0.024 ± 0.011 g y 0.022 g ± 0.020 para la muestra biofuncionalizada por acople de carbodiimida y aprovechamiento de interacciones electrostáticas respectivamente, destacando que estos valores permanecieron prácticamente iguales durante todo el tiempo de análisis.
Luego de 15 días de incubación en solución de PBS, se observa que una vez pasado este tiempo, las muestras biofuncionalizadas por ambos métodos continúan teniendo actividad antitrombogénica en comparación con la muestra de control, mientras que las muestras biofuncionalizadas por aprovechamiento de interacciones electrostáticas presentan una mayor presencia de coágulos sobre su superficie, lo que indica que luego del proceso de incubación en PBS, la heparina presente en la superficie del material migró hacia la solución, por lo tanto, se puede deducir que ésta perdió actividad rápidamente comparada con la muestra biofuncionalizada por acople de carbodiimida como muestran los resultados cuantitativos, donde se observa que estas últimas tienen una actividad antitrombogénica significativamente mayor, permitiendo una adhesión de coágulos aproximadamente 32 % superior luego de 15 d de incubación en PBS, sin embargo, la muestra biofuncionalizada por aprovechamiento de interacciones electrostáticas permite una adhesión de coágulos aproximadamente 429 % superior luego de pasar por el mismo tratamiento, es decir, luego de 15 d de incubación, las muestras biofuncionalizadas por acople de carbodiimida tendrán aproximadamente 13 veces más actividad antitrombogénica si se compara con las muestras biofuncionalizadas por aprovechamiento de interacciones electrostáticas. Estos resultados son debidos a que la heparina se ancla a la fibroína a través de enlaces covalentes, por lo que cualquier pérdida de actividad estará relacionada a la degradación del material, pero en el caso de la biofuncionalización por aprovechamiento de interacciones electrostáticas, la pérdida de actividad se dará tanto por la degradación del material, como por la migración de la heparina hacia la solución de PBS.
Microscopía electrónica de barrido
Con el fin de evaluar el efecto de la biofuncionalización sobre la estructura superficial del material, se analizaron las muestras de control y biofuncionalizadas por ambos métodos.
La Figura 2 muestra las micrografías obtenidas para la muestra de control (a), y las muestras biofuncionalizadas por acople de carbodiimida (b) y por aprovechamiento de interacciones electrostáticas(c).

Figura 2 Micrografías SEM para la muestra de control (a), bofuncionalizada por acople de carbodiimida (b) y por aprovechamiento de interacciones electrostáticas(c) a 500 aumentos.
La micrografía de la Figura 2a, correspondiente a la muestra control, la cual presenta una superficie homogénea sin evidencia de separación de fases entre la fibroína y el PVA, sin embargo, algunos defectos superficiales se notan como producto del proceso de evaporación de solvente en la preparación de la película. Mientras que las Figuras 2b y 2c, correspondientes a las muestras biofuncionalizadas por acople de carbodiimida y por aprovechamiento de interacciones electrostáticas respectivamente, muestran que el comportamiento anterior se conserva, además de notarse también los mismos defectos superficiales, teniendo las películas biofuncionalizadas por interacciones electrostáticas una leve separación como consecuencia de posibles coacervados de fibroína formados por la alta carga de sales de este proceso. Estos resultados muestran como la inmovilización de heparina sobre la fibroína no perjudica la estructura macroscópica del material final, y dado que no se observan sus fases separadas, se puede garantizar que la fibroína biofuncionalizada estará homogéneamente distribuida sobre el material, por lo tanto, éste tendrá actividad antitrombogénica a lo largo de toda su superficie.
Análisis espectroscópico
El cambio de la conformación estructural de la fibroína en los materiales se siguió respecto a los métodos de biofuncionalización, de este modo, los espectros infrarrojos de la muestra de control, biofuncionalizada por acople de carbodiimida, biofuncionalizada por aprovechamiento de interacciones electrostáticas y de la heparina se presentan en la Figura 3.
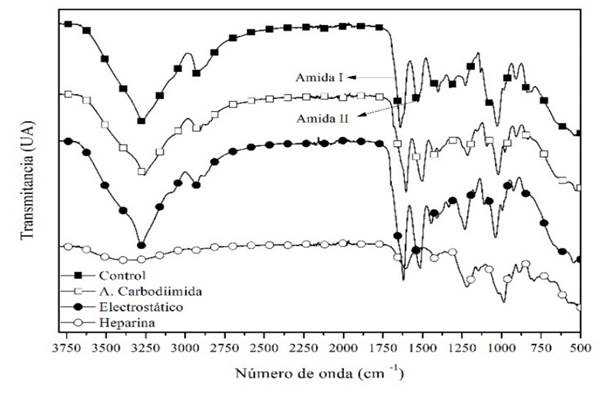
Figura 3 Espectros infrarrojo obtenidos para la heparina y las muestra de control, y las muestra biofuncionalizadas por acople de carbodiimida y por aprovechamiento de interacciones electrostáticas.
De acuerdo con los resultados mostrados en la Figura 3, la muestra de control presenta una banda de tensión correspondiente a los grupos -O-H en 3273 cm-1, la cual se desplaza a 3259 cm-1 para la muestra biofuncionalizada por acople de carbodiimida, y a 3280 cm-1 para la muestra biofuncionalizada por aprovechamiento de interacciones electrostáticas, estos resultados sugieren que la asociación de puentes de hidrógeno entre los diferentes componentes del material cambia cuando éste se biofuncionaliza, tal como lo reportó Kara (Kara et al., 2016; Pakzad et al., 2019), siendo el tipo de asociación diferente entre ambas muestras biofuncionalizadas.
La evidencia más importante para observar el efecto de la heparina en el material se encuentra en la zona de grupos carbonilos, en las cuales se reconocen las bandas de amida I y II, y que se presentan para la muestra de control a 1641 cm-1 y 1534 cm-1 respectivamente, y se desplazan a 1603 cm-1 y 1501 cm-1 para la muestra biofuncionalizada por acople de carbodiimida, y a 1620 cm-1 y 1515 cm-1 para la muestra biofuncionalizada por interacciones electrostáticas, esto puede explicarse dado que, cuando la heparina se integra al material, tanto a través del enlace diimida como por interacciones electrostáticas, la forma en que se producen los enlaces de hidrógeno también cambia, haciendo que la cantidad de láminas-β de la fibroína aumente, y finalmente se vea reflejado en el desplazamiento de las bandas de amida I y amida II de la fibroína a números de onda menores, tal como lo reportó Cestari (Cestari et al., 2014), por lo tanto, estos desplazamientos garantizan que la incorporación de la heparina en el material fue exitosa.
Por otro lado, se distinguen varios cambios entre la muestra de control y las muestras biofuncionalizadas asociados a la extensión de grupos -S=O presentes en la estructura molecular de la heparina, presentes en 1224 cm-1, 1017 cm-1 y 984 cm-1 en el espectro correspondiente a este polisacárido. De estas señales, la primera banda se ve desplazada hasta 1212 cm-1 en la muestra biofuncionalizada por acople de carbodiimida y hasta 1232 cm-1 para la muestra biofuncionalizada por interacciones electrostáticas, lo que sugiere que los grupos -S=O de la heparina están interactuando a través de enlaces de hidrógeno con los polímeros en el material en concordancia con lo encontrado por Cestari (Cestari et al., 2014), estos resultados se reafirman con las otras dos bandas características de la heparina, que se desplazan hasta 1092 cm-1 y 1022 cm-1 para la muestra biofuncionalizada por acople de carbodiimida, y hasta 1110 cm-1 y 1041 cm-1 para la muestra biofuncionalizada por interacciones electrostáticas, confirmando que la heparina se incorpora de forma exitosa en el material. Estos resultados, junto a los resultados de bioactividad a 15 días, muestran que dicha incorporación es más estable en la muestra biofuncionalizada por acople de carbodiimida, sugiriendo que el enlazamiento covalente entre la fibroína y la heparina fue exitoso.
Ángulo de contacto
Normalmente, la inmovilización de heparina lleva a materiales más hidrofílicos (Kara et al., 2016), de este modo, con el fin de estudiar el efecto de la biofuncionalización en la hidrofilicidad del material, se hicieron mediciones de ángulo de contacto de las muestras contra agua, lo anterior, teniendo en cuenta que la mojabilidad de los materiales destinados a la fabricación de conductos vasculares es una propiedad que contribuye a su biocompatibilidad, específicamente, las plaquetas en la sangre tienden a comportarse diferente cuando están en contacto con superficies hidrofílicas o hidrofóbicas, activándose menos en superficies hidrofílicas (Yang et al., 2006), sin embargo, la relación entre los dominios hidrofílicos e hidrofóbicos del material deben garantizar que pueden evitar la adsorción de proteínas, razón por la cual, las superficies con ángulos de contacto bajos, y alto grado de mojabilidad no necesariamente son más biocompatibles (Menzies & Jones, 2010)
En la tabla 1 se presentan los resultados de los valores de ángulo de contacto obtenidos en las muestras control y las muestras biofuncionalizadas por ambas técnicas.
Tabla 1 Ángulo de contacto para la muestra de control y las muestras biofuncionalizadas por acople de carbodiimida y por interacciones electrostáticas
| Muestra | Ángulo de contacto (°) |
|---|---|
| Control | 63.5 ± 2.8 |
| Carbodiimida | 50.0 ± 3.7 |
| Interacciones electrostáticas | 37.1 ± 7.1 |
Según estos resultados, hay un descenso en el ángulo de contacto desde 63.5° para la muestra de control hasta 50.0° para la muestra biofuncionalizada por acople de carbodiimida, y hasta 37.1° para la muestra biofuncionalizada por interacciones electrostáticas, lo que evidencia que ambos métodos de biofuncionalización dan como resultado superficies más hidrofílicas, lo cual es consecuencia de un aumento en la disponibilidad de grupos polares provenientes de la heparina tales como ácidos carboxílicos (-COOH) en la superficie, además, en el caso de la muestra biofuncionalizada por aprovechamiento de interacciones electrostáticas, se cree que la disminución en el ángulo de contacto se relacione a la alta densidad de carga superficial, lo que hará que esta muestra sea más hidrofílica que la muestra biofuncionalizada por acople de carbodiimida como se ha encontrado previamente (Meng et al., 2018). Estos resultados resultan interesantes, ya que el rango de hidrofílicidad que ofrecen se adecua bastante bien para aplicaciones relacionadas a los materiales destinados a contacto con sangre, las cuales requieren que el material en cuestión tenga preferiblemente un ángulo de contacto en el rango θ = 48 o a θ = 65 o , el cual garantiza un balance apropiado entre la hidrofilicidad e hidrofobicidad del material (Menzies & Jones, 2010), permitiendo mejor adhesión de células endoteliales, evita la adsorción de las proteínas presentes en la sangre y disminuye su coagulación (Song et al., 2019), por lo tanto, en términos de la hidrofílicidad, resulta más adecuado usar el acople de carbodiimida como técnica de biofuncionalización, ya que se ajusta mejor a este rango.
Propiedades mecánicas
En la Tabla 2 se presentan los resultados de las pruebas mecánicas realizadas a la muestra control y a las muestras biofuncionalizadas por acople de carbodiimida y por interacciones electrostáticas.
Tabla 2 Propiedades mecánicas obtenidas para la muestra de control y las muestras biofuncionalizadas por acople de carbodiimida y por interacciones electrostáticas.
| Muestra | Resistencia a la tracción (MPa) | Elongación a la ruptura (%) | Módulo elástico (MPa) |
|---|---|---|---|
| Control | 7.01 ± 0.33 | 93.11 ± 16.10 | 0.74 ± 0.14 |
| Carbodiimida | 6.64 ± 0.34 | 105.85 ± 13.63 | 0.44± 0.04 |
| Interacciones Electrostáticas | 7.12 ± 0.41 | 102.45 ± 18.35 | 0.60 ± 0.04 |
De acuerdo con los resultados mostrados en la Tabla 2, a excepción del módulo elástico, no se encuentra una diferencia estadística significativa en las demás propiedades mecánicas del material cuando se prepara con la fibroína biofuncionalizada por ambos métodos, estos resultados son similares a los encontrados por diferentes autores cuando se inmoviliza heparina sobre diferentes materiales (Zia et al., 2016), sin embargo, en el caso específico de la biofuncionalización de fibroína con heparina, una consideración importante a tener en cuenta es que la estructura molecular de la heparina podrá interactuar a través de puentes de hidrógeno con los demás componentes del material, de este modo, dado que la heparina se inmoviliza sobre la fibroína en solución previo a la preparación del material final, es probable que la cantidad de enlaces de hidrógeno que se formen no sea muy alta comparada con el material sin biofuncionalizar, y por lo tanto, estas interacciones no se vean reflejadas en las propiedades mecánicas del material biofuncionalizado, por otra parte, en el caso del módulo elástico, cuando la heparina se inmoviliza por un enlace covalente a la fibroína, esta última utiliza las aminas terminales de su estructura para formar dichos enlaces, y por lo tanto, la cantidad de puentes de hidrógeno que se formarán serán lo suficientemente menores como para afectar la rigidez del material, por lo tanto, a pesar de que la inmovilización de heparina no afecta drásticamente las demás propiedades mecánicas, su principal efecto se verá reflejado en módulo elástico del material final solo cuando se biofuncionaliza por acople de carbodiimida, teniendo como consecuencia que el material resultó menos rígido, por lo tanto, puede ser potencialmente útil en la fabricación de dispositivos para contacto con la sangre como injertos vasculares.
CONCLUSIONES
Se logró biofuncionalizar superficies de fibroína por dos métodos diferentes incorporando la heparina de manera adecuado para aumentar la hidrofilicidad y llevarla al rango requerido para poder usar este biomaterial en aplicaciones cardiovasculares.
Los procesos seguidos para realizar la biofuncionalización fueron adecuados tanto cuando se hace por acople de carbodiimida como por aprovechamiento de interacciones electrostáticas, sin embargo, la muestra biofuncionalizada por acople de carbodiimida presentó mayor estabilidad en el tiempo, lo que demuestra que dicha técnica resulta mejor a la hora de obtener el material con capacidad antitrombogénica.
El material producido y biofuncioanlizado resultó mostrar buena respuesta a la antitrombogenicidad, además de demostrarse que la biofuncionalización no alteró las propiedades mecánicas, lo cual puede ser una posibilidad de uso como material en la fabricación de implantes cardiovasculares.