INTRODUCCIÓN
El cultivo de caña (Saccharum officinarum L.) y la producción de sus derivados como el azúcar y la panela representan una actividad económica importante en Colombia, aportando al producto interno bruto agropecuario y promoviendo los avances industriales en el sector agroindustrial. Actualmente, Colombia es el segundo país con mayor producción de panela en el mundo, con 1,2 millones de toneladas anuales y un 16 % de participación (Agronet, 2021). El complejo Diatraea spp. denominado el complejo barrenador del tallo de la caña de azúcar es la limitante más importante del cultivo, generando pérdidas estimadas entre 90 y 100 kilogramos de azúcar o panela por hectárea por cada unidad porcentual de entrenudos barrenados (Vargas et al., 2018; Barreto-Triana et al., 2021). En Colombia, actualmente se ha reportado la presencia de un complejo conformado por más de ocho especies, incluyendo Diatraea saccharalis (la especie más estudiada), y algunas especies sin describir (Barrera et al., 2017; Vargas et al., 2018; Barreto-Triana et al., 2021).
El control biológico mediante el uso de hongos entomo-patógenos es una herramienta ampliamente usada en el manejo integrado fitosanitario y desde hace algunas décadas se ha convertido en pieza fundamental en las estrategias de manejo en caña tanto de azúcar como panelera (Cardona et al., 2015). El hongo entomopatógeno Beauve-ria bassiana juega un papel importante en el control biológico de poblaciones de diferentes plagas agrícolas, manteniendo las poblaciones por debajo de los umbrales de daño económico de diversos agroecosistemas alrededor del mundo (Alves et al., 2003). Particularmente en caña de azúcar, diferentes trabajos han demostrado el potencial de B. bassiana para el biocontrol de las poblaciones de Diatraea spp. (Arcas et al., 1999; Svedese et al., 2013; de Souza et al., 2022). En Colombia en trabajos previos, se desarrolló un prototipo de bioplaguicida concentrado emulsionable (CE) a base de un aislamiento de B. bassiana (Bv062) (García et al., 2018) con resultados de eficacia promisorios que alcanzaron hasta el 80% de control de D. saccharalis bajo condiciones semicontroladas de campo (García et al., 2021).
Sin embargo, el éxito de la aplicación de bioplaguicidas a base de hongos entomopatógenos depende de varias condiciones que determinan su viabilidad técnica y económica (Vargas, 2015). En este sentido, un bioplaguicida es considerado exitoso cuando: puede ser usado en un plan de manejo integrado de plagas, es estable en almacenamiento y durante el transporte, es biodegradable y menos tóxico que los agroquímicos, su desarrollo, escalamiento y aplicación son sencillos y es compatible con los agroquímicos y los equipos usados en el cultivo (Zaki et al., 2020). Esto último resulta ser una característica fundamental si se desea integrar productos biológicos en planes de manejo integrado de plagas (MIP). Estos programas son reconocidos y ampliamente aceptados como la mejor estrategia para hacer frente a los problemas fitosanitarios de diversos cultivos alrededor del mundo, la combinación del control químico con productos biológicos podría minimizar el impacto ambiental causado por los agroquímicos utilizados en la producción de alimentos (Torres y Bueno, 2018). Sin embargo, en algunos casos, la eficacia de los hongos entomopatógenos se ve afectada por la presencia de moléculas tóxicas contenidas en los agroquímicos más comúnmente empleados (fungicidas, herbicidas e insecticidas). Por esto, es necesario incluir estudios de compatibilidad de los bioplaguicidas previos a su aplicación en campo para entender el efecto de los agroquímicos y generar posibles recomendaciones de uso. Diferentes trabajos han reportado ingredientes activos de agroquímicos que causan un efecto deletéreo a las estructuras biológicas y reproductivas de microorganismos entomopatógenos, disminuyendo su eficacia bajo condiciones de campo (Vasquez et al., 2006; Garcia-Riaño et al., 2022), aunque también se han reportado casos exitosos en los que la combinación de un bioplaguicida y un agroquímico es compatible, y su aplicación combinada tiene alta efectividad en campo (de Oliveira et al., 2003).
En cultivos de caña de azúcar en Colombia, se utilizan diferentes moléculas enfocadas principalmente en el control de malezas, hongos fitopatógenos e insectos. Teniendo en cuenta lo anterior, el objetivo del presente trabajo fue evaluar el efecto de la exposición del biopla-guicida CE a base de B. bassiana, a los agroquímicos más utilizados en el cultivo de caña de azúcar en las características de germinación y eficacia de los conidios.
METODOLOGÍA
Microorganismo, producción y formulación
El microorganismo Beauveria bassiana codificado como Bv062 [contrato de acceso de recursos genéticos y derivados de Colombia RGE0229-2 (No. 168)]., fue obtenido a partir de una larva de Diatraea sp. colectada en el Departamento de Boyacá. Esta cepa se encuentra conservada en el Banco de Germoplasma de Microorganismos con Interés en Control Biológico de la Corporación Colombiana de investigación Agropecuaria (Agrosavia) (Garcia et al., 2021). Para su reactivación, este aislamiento fue cultivado en cajas de Petri con Agar Papa Dextrosa (PDA) suplementado con 0,1% de cloranfenicol, las cuales fueron incubadas durante 10 días a 25°C.
La producción masiva de conidios de la cepa Bv062 se realizó mediante fermentación semisólida en un sustrato a base de arroz, siguiendo la metodología descrita por Garcia et al. (2021). Para esto, se utilizaron bandejas de aluminio de 10,5 cm x 17,5 cm, donde se adicionaron 10 gramos de arroz partido molido y 80 mL de agua estéril. Las bandejas fueron esterilizadas y posteriormente, por cada bandeja, se colocó una tela de muselina del tamaño de la bandeja y se inoculó una suspensión de conidios preparado a una concentración de 1x106 conidios/mL en Tween 80 0.1%. Las bandejas fueron cubiertas con una película plástica y se incubaron a 25°C±2, 60%±10 HR durante 8 días. Pasado este tiempo, la tela de muselina fue retirada y la biomasa fue separada con ayuda de una espátula estéril y secada durante 5 días hasta obtener una humedad inferior al 5%. Los conidios secos fueron formulados como un concentrado emulsionable (CE), suspendiéndolos (1%) en un vehículo oleoso compuesto por la mezcla de un aceite vegetal (45%), aceite mineral (45%) y una mezcla de tensioactivos (9%). El bioplaguicida inmediatamente después de formularse presentó una concentración final 1x109 conidios/mL, una germinación de 92,7% y un contenido de contaminantes (hongos filamentosos, levaduras y bacterias) inferior a 1000 UFC/mL, los cuales se encuentran dentro de los parámetros de calidad establecidos para este producto. El formulado fue posteriormente almacenado a 4°C en recipientes herméticamente cerrados hasta su uso.
Cría de Diatraea saccharalis
Los experimentos se llevaron a cabo con larvas de segundo ínstar de Diatraea saccharalis provenientes de la colonia mantenida en la Unidad de Crías de Insectos de Agrosavia ubicada en Mosquera, Cundinamarca (Colombia), que se estableció con larvas donadas por Cenicaña (Centro Colombiano de Investigación de la Caña de Azúcar). La cría es mantenida en condiciones de temperatura de 25±5°C con una humedad relativa de 60 ± 10% y un fotoperíodo de 16 h de luz: 8 h de oscuridad. Para la alimentación de las larvas se utiliza la dieta artificial a base de germen de trigo, zanahoria, tusa de maíz, yagua de caña pulverizada, levadura seca, proteína de soya, azúcar, agar y conservantes, entre otros descritos por Lastra y Gómez (2006).
Agroquímicos y concentraciones
Para el ensayo de compatibilidad in vitro se seleccionaron los principales agroquímicos frecuentemente utilizados en los cultivos de caña de azúcar para en panela en Colombia (ICA 2022), los cuales consistieron en cuatro herbicidas, tres insecticidas y cuatro fungicidas (Tabla 1).
Tabla 1 Agroquímicos utilizados para estudiar la compatibilidad con el bioplaguicida a base de conidios de B. bassiana Bv062
*El valor de la concentración del agroquímico está presentada al doble de la dosis recomendada, los cálculos fueron realizados teniendo en cuenta una aplicación por hectárea de 200 L.
Compatibilidad del CE con agroquímicos
Preparación de los tratamientos: Tanto el bioplaguicida como los agroquímicos fueron reconstituidos en agua al doble de la dosis recomendada (Tabla 1). Cada agroquímico se mezcló en relación 1:1 con el bioplaguicida en un Erlenmeyer de 125 mL con un volumen final de 25 mL (Unidad experimental). Esta mezcla se agitó a 100 rpm a 25°C durante 120 minutos en un agitador. Se utilizaron tres Erlenmeyer por cada tratamiento (3 repeticiones) y cada 15 minutos se tomó una muestra de cada Erlenmeyer (tres muestras por tiempo por tratamiento), sobre la cual se evaluó la germinación de los conidios. La muestra final tomada después de 120 minutos de incubación fue utilizada para evaluar la actividad insecticida sobre larvas de D. saccharalis. Como control se utilizó el bioplaguicida reconstituido en agua a la concentración recomendada para su aplicación en campo.
Germinación de los conidios: muestras de 100 µL fueron retiradas de cada unidad experimental en cada tiempo de evaluación y se sembraron en cajas de Petri con medio Agar con extracto de malta 0,1% y Benomil 0,0005%. Las cajas fueron incubadas a 25°C durante 24 horas. Finalizado el tiempo de incubación, se cortó un cuadro de agar de 1cm2 y se le adicionó una gota de azul de lactofenol, enseguida, se cuantificó el número de conidios germinados y no germinados de al menos 100 conidios mediante observación en un microscopio de luz con un aumento de 40X (10 campos ópticos por unidad experimental). La variable de respuesta fue el porcentaje de germinación (%) de los conidios del bioplaguicida. Los conidios fueron considerados germinados cuando el tubo germinal tenía al menos el doble del tamaño de la cabeza del conidio (Garcia-Riaño et al., 2020).
Actividad insecticida frente a Diatraea saccharalis: Para la evaluación de la actividad insecticida se llevó a cabo un experimento en el que se tomaron muestras de 2 mL de cada Erlenmeyer por tratamiento después de 120 minutos de incubación. La muestra fue centrifugada a 12.000 rpm durante 10 minutos, el sobrenadante fue descartado y el sedimento correspondiente a los conidios fue lavado dos veces en agua destilada estéril y posteriormente suspendido en agua estéril y ajustado a una concentración de 2x107 conidios/mL. Este lavado se realizó para garantizar que la actividad biológica correspondiera efectivamente al hongo entomopatógeno y no al agroquímico, dado que algunos agroquímicos demostraron un efecto insecticida entre el 10 y el 100% sobre larvas de D. saccharalis (datos no mostrados).
A partir de cada muestra obtenida de cada Erlenmeyer después de 120 minutos de incubación (tres muestras correspondientes a tres Erlenmeyer por tratamiento), se montó un bioensayo siguiendo la metodología descrita por Garcia et al. (2021). Treinta larvas de segundo ínstar de D. saccharalis fueron inoculadas aplicando 2 µL del tratamiento en el dorso. Cada larva inoculada se dispuso en un vaso de plástico de media onza que contenía un grano de maíz; luego, se ubicaron en grupos de 10 en cajas Selloplus® de 700 mL (unidad experimental), para un total de tres cajas por tratamiento (triplicado). Las cajas se incubaron en un cuarto de bioensayos a una temperatura de 26±2°C y una humedad relativa de 70±5%. Se contó con un testigo absoluto, en el cual las larvas no fueron sometidas a ningún tratamiento. La mortalidad se evaluó cada tres días hasta que todos los individuos murieron o pasaron al estado de pupa. Se utilizó un diseño experimental completamente al azar con tres repeticiones por tratamiento y 10 larvas por repetición. Con los resultados de mortalidad se calculó el porcentaje de eficacia (mortalidad corregida) para cada tratamiento mediante la fórmula de Schneider-Orelli.
En donde T corresponde al tratamiento y Co al testigo absoluto.
Análisis estadístico: La normalidad de los datos se verificó mediante la prueba de Shapiro-Wilk (95%) y la ho-mocedasticidad se determinó mediante una prueba de Barlett (95%); análisis de varianzas mediante prueba ANOVA y comparación de medias mediante Tukey (95%). Para los datos que no cumplieron con el principio de homocedasticidad de varianzas, se realizó un análisis de estadística no paramétrica mediante la prueba de Kruskall Wallis (95%) utilizando el programa estadístico Statistix (8.1).
RESULTADOS
Efecto de la mezcla del CE a base de B. bassiana con agroquímicos
Se determinó el efecto de los diferentes agroquímicos sobre los conidios de B. bassiana, determinando las diferencias en germinación (Figura 1) y en la actividad insecticida sobre larvas de D. saccharalis, registrando la mortalidad de los individuos, así como la presencia de signos de infección fúngica para corroborar que la mortalidad haya sido ocasionada por el hongo. Las larvas presentaron sintomatología característica de infección fúngica; inicialmente, se observaron larvas completamente rígidas y con una coloración rosácea y posteriormente, se evidencio micelio blanco y esporulado característico de la infección por B. bassiana (Figura 2).
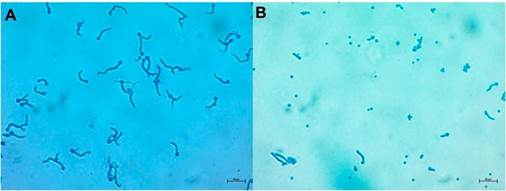
Figura 1 Germinación de conidios de B. bassiana Bv062 A) Conidios sin exposición a fungicidas. B) Conidios expuestos a fungicida. Observación en microscopio de luz, 40 x.
Fungicidas
Los conidios de Bv062 redujeron significativamente su germinación inmediatamente después de la mezcla con propiconazole, presentando valores de germinación inferiores al 10%, mientras que los conidios del CE mezclado con agua (control), presentaron una germinación superior al 90% (F=541, gl= 14, p<0,05) (Figura 3A). Un comportamiento similar fue obtenido con tebuconazole y trifoxystrobina, que redujeron la germinación a un 16% en los primeros 15 min de incubación y causaron un efecto mayor a través de los diferentes tiempos de exposición, alcanzando valores inferiores al 5% después de dos horas.
El benomil inhibió completamente la germinación de Bv062, no observándose ningún conidio germinado en los diferentes tiempos de evaluación. Por el contrario, el carbendazim no afectó significativamente la germinación de los conidios durante los primeros 15 minutos (86%) y aunque al aumentar el tiempo de exposición se presentó una reducción significativa (F= 3,95; gl= 26; P=0,0074) de la viabilidad, la germinación se mantuvo por encima del 70% hasta las dos horas de incubación (Figura 3A).
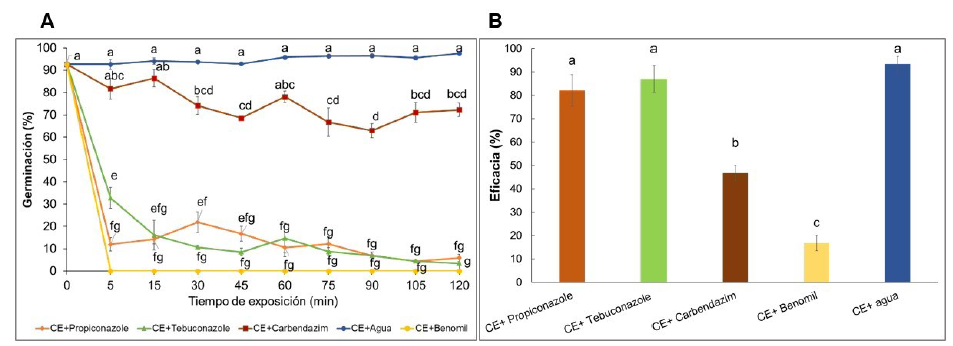
Las barras de error representan el error estándar de la media. Los tratamientos con letras diferentes presentaron diferencias significativas según análisis de varianza ANOVA (95%) y comparación de medias de Tukey (95%). El tratamiento CE+Benomil no se incluyó en el análisis estadístico debido a que se obtuvieron germinaciones con valor de 0 en todos los tiempos evaluados.
Figura 3 Efecto de fungicidas sobre la germinación de los conidios de Bv062 (A) y sobre la actividad biológica frente a larvas de D. saccharalis (B).
Con respecto a la actividad insecticida del CE sobre larvas de D. saccharalis, la mortalidad de larvas superó el 92% cuando el CE fue mezclado con agua (Figura 3B). Después de dos horas de exposición a los fungicidas, se evidenció que los conidios que habían sido expuestos a carbendazim y benomil causaron una mortalidad de larvas significativamente inferior (F=22, gl=14, p<0,001) en comparación con los conidios que no se expusieron a ningún agroquímico (Figura 3B), mientras que los conidios expuestos a tebuconazol y propiconazole presentaron una mortalidad similar a la obtenida con el tratamiento control (F= 0,29, gl=8, p=0,7557), con síntomas de infección como los descritos en la figura 2.
Insecticidas
Con respecto a los insecticidas evaluados, en general los principios activos Clorpirifos, Spinosad y Clorantranili-prole no afectaron negativamente la germinación de los conidios durante las dos horas de exposición, con valores similares a los presentados por el tratamiento control con agua, con excepción de clorpirifos después de 120 minutos que mostro una germinación significativamente menor que todos los demás tratamientos (F= 2,37; gl= 107; p= 0,001). Cabe destacar, que en todos los tratamientos junto con el control presentaron germinaciones superiores al 87% durante la duración del experimento (Figura 4A).
Después de la exposición de los conidios de Bv062 a los insecticidas, estos presentaron eficacias superiores al 95%, igual a la obtenida al utilizar del bioplaguicida CE reconstituido en agua (Figura 4B). Mas del 90% de las larvas muertas en los tratamientos presentaron síntomas típicos de la infección fúngica y abundante esporulación (datos no mostrados), lo que confirmó la causal de muerte debido al entomopatógeno y en consecuencia confirmó la viabilidad y patogenicidad de los conidios después de encontrarse en contacto con los insecticidas por 2 horas.
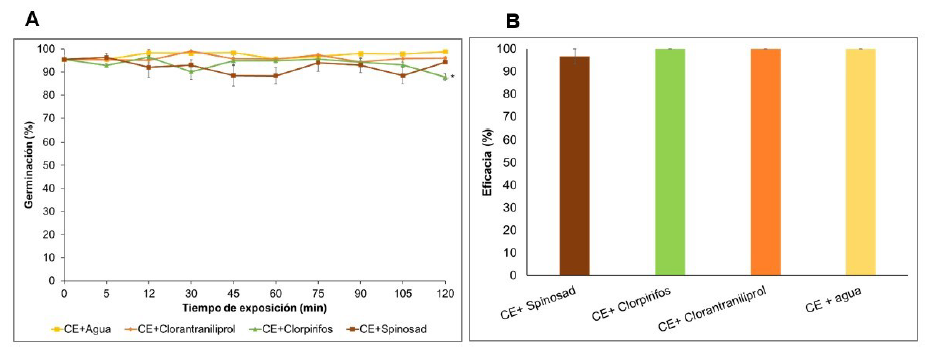
Las barras de error representan el error estándar de la media. El asterisco indica el único tratamiento que fue significativamente diferente a los demás según análisis de varianza ANOVA (95%).
Figura 4 Efecto de los insecticidas sobre la germinación de los conidios de Bv062 (A) y sobre la actividad biológica frente a larvas de D. saccharalis (B).
Herbicidas
Los conidios del CE a base de Bv062 expuestos durante las 2 horas a los diferentes herbicidas mantuvieron germinaciones superiores al 80%, valores que no fueron significativamente diferentes con respecto al control en ninguno de los tiempos de evaluación (F=2,35; gl=14, p=0,1247) (Figura 5A). Respecto a la actividad insecticida, todos los tratamientos causaron mortalidades de larvas similares a la causada por el CE reconstituido en agua (superiores al 90%) (Figura 5B). La esporulación de los cadáveres de las larvas en los tratamientos fue superior al 87% en todos los casos, confirmando que la mortalidad se debió a la infección fúngica.
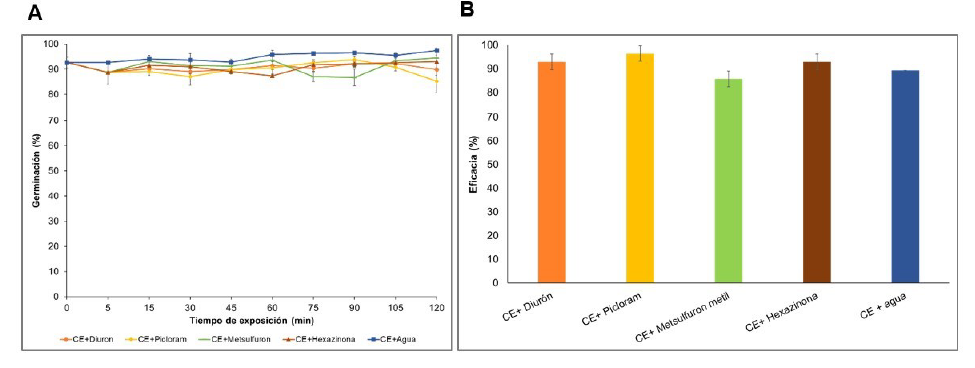
Las barras de error representan el error estándar de la media. Los tratamientos no presentaron diferencias significativas según análisis de varianza ANOVA (95%).
Figura 5 Efecto de los herbicidas sobre la germinación de los conidios de Bv062 (A) y sobre la actividad biológica frente a larvas de D. saccharalis (B).
DISCUSIÓN
El potencial del bioplaguicida utilizado en el presente trabajo para controlar la plaga en cultivos de caña de azúcar, fue demostrado en un trabajo previo, donde se obtuvo una mortalidad de larvas superior al 80% después de la aplicación foliar del producto (Garcia et al., 2021). Sin embargo, la factibilidad para la inclusión de este bioplaguicida en un programa de manejo integrado del cultivo depende de la posibilidad de su aplicación conjunta con agroquímicos requeridos para el manejo de otros problemas fitosanitarios. En este contexto, es de gran importancia determinar la compatibilidad de los bioinsecticidas con agroquímicos usados en el cultivo blanco, habiendo una carencia importante de información para el caso particular del cultivo de caña de azúcar. La mayoría de los reportes de literatura relacionados con la compatibilidad de hongos entomopatógenos con agroquímicos se basa en el efecto sobre las variables microbiológicas (germinación y esporulación, entre otras), que no necesariamente reflejan el efecto real sobre la actividad insecticida del hongo en condiciones de campo (Mejía y Espinel, 2022) y cuya extrapolación no puede ser directa a partir de resultados in vitro. Por tal razón, la medición de variables adicionales relacionadas con la patogenicidad y la virulencia, son necesarias para la toma de decisiones y generación de recomendaciones de uso.
Los fungicidas derivados del grupo químico de los triazoles (Propiconazol y Tebuconazol) evaluados en el presente estudio, causaron una reducción significativa de la germinación de los conidios de B. bassiana desde los primeros minutos de contacto), efecto debido posiblemente a la inhibición de la biosíntesis del ergosterol que causan estas moléculas (Reddy et al., 2018; da Silva et al., 2012). Resultados similares se han reportado para varios hongos entomopatógenos como B. bassiana, Leca-nicillium lecanii y Metarhizium anisopliae, para los cuales algunos fungicidas derivados del grupo de los triazoles han mostrado efectos altamente tóxicos, causando inhibiciones superiores al 90% de la germinación de conidios y del crecimiento micelial (Khan et al., 2012; Ali et al., 2013; Reddy et al., 2018; Garcia-Riaño et al., 2022). Sin embargo, cuando los conidios fueron separados del medio con fungicida y usados en un bioensayo después de dos horas de exposición, se obtuvo una mortalidad aproximada del 80% en las larvas de D. saccharalis. Estos resultados sugieren que el efecto de estas moléculas sobre los conidios del bioplaguicida durante dos horas de exposición fue fungistático y no fungicida. Dicho efecto fue reportado por da Silva et al. (2012), quienes observaron que algunos agroquímicos como triazoles inhibieron la germinación de los conidios de M. anisopliae después de 20 horas de incubación. Después de 48 horas, la germinación aumentó, evidenciándose un efecto fungistático pues los conidios no perdieron su viabilidad.
En contraste, el fungicida Benomil inhibió completamente la germinación de los conidios en todos los tiempos evaluados, lo que se correlacionó con una reducción significativa de la actividad insecticida (<20% mortalidad). De manera general, el fungicida Benomil es una de las moléculas con mayores efectos deletéreos sobre la actividad insecticida de hongos entomopatógenos, encontrando una inhibición total de la germinación de conidios de diferentes cepas de M. anisopliae y B. bassiana (Samuels et al., 1989; Khan et al., 2012; Faraji et al., 2016). Dicha inhibición puede estar relacionada con su modo de acción, ya que este fungicida interfiere con las funciones vitales de la célula fúngica lo que previene la división nuclear y suprime el crecimiento micelial (Mietkiewski et al., 1997), siendo posible que la viabilidad de B. bassiana Bv062 se haya visto afectada por el contacto con la molécula Benomil.
El fungicida Carbendazim también afectó a los conidios formulados de B. bassiana Bv062, reduciendo su germinación en un 25%, aunque este fungicida fue el menos deletéreo para la germinación del hongo. Esto podría deberse al modo de acción de la molécula, la cual interviene en el proceso de formación de la ß-tubulina, causando alteraciones en la división celular y afectando el crecimiento fúngico, pero no necesariamente afectando la germinación (Kim et al., 2009). En términos de actividad biológica, los conidios expuestos por dos horas al fungicida redujeron en un 47% la mortalidad causada sobre larvas de D. saccharalis con respecto al control, lo que evidencia que, aunque la mayoría de los conidios fueron capaces de germinar, algunos no fueron capaces de desarrollarse y causar la infección del hospedero. Cabe destacar que estos resultados contrastan con los encontrados por otros autores que reportan un 100% de inhibición de hongos como M. rileyi, B. bassiana y M. anisopliae cuando se expusieron a diferentes concentraciones de carbendazim (Prabhu et al., 2007; Patil et al., 2014; Melo et al., 2015).
Para el caso de los insecticidas, en el presente trabajo no se observó efecto significativo de la exposición del bioplaguicida durante dos horas a las moléculas evaluadas. Esta compatibilidad es interesante porque los insecticidas químicos aplicados junto con entomopatógenos podrían presentar un efecto sinérgico para el control de un insecto plaga. Es necesario realizar estudios que demuestren dicho efecto y después se requiere determinar las dosis mínimas efectivas de cada producto (insecticida y bioinsecticida) que al ser combinados produzcan efecto positivo en condiciones de campo. En trabajos previos, la molécula clorpirifos han demostrado toxicidad sobre hongos como M. anisopliae y B. bassiana, afectando de manera significativa parámetros como esporulación, crecimiento micelial y germinación (Samuels et al., 1989; Raj et al., 2011; Faraji et al., 2016), en contraste con lo encontrado en el presente trabajo. Por su parte, el insecticida clorantraniliprole, puede disminuir la capacidad germinativa del hongo B. bassiana y su actividad sobre larvas (Parjane, 2020), y podría ser considerada una molécula moderadamente compatible con el hongo. El insecticida spinosad ha demostrado ser uno de los menos perjudiciales para las características de hongos entomopatógenos, demostrando ser compatible o moderadamente compatible con varias cepas de B. bassiana (Amutha et al., 2010; Rajanikanth et al., 2010; Faraji et al., 2016).
En el caso de los herbicidas, se obtuvieron resultados similares en los que no se afectó la germinación ni la actividad insecticida de los conidios de B. bassiana formulados, después de la exposición dos horas a diferentes moléculas. Samuels et al. (1989) demostraron que los herbicidas Diurón y Trifluralina no causaron efecto sobre el crecimiento ni la germinación de M. anisopliae. Gardner y Storey (1985) evidenciaron que algunos herbicidas como Diurón, Pronamida, Simazina y Terbacil inhibieron la germinación de B. bassiana, pero inhibieron modera damente el crecimiento micelial, indicando una posible actividad fungistática en lugar de fungicida. Botelho y Monteiro (2010) evidenciaron un efecto tóxico de los herbicidas Diurón, Hexazinona+Diurón, Imazapir y Metsulfuron Metil sobre el crecimiento micelial, esporu-lación y viabilidad de M. anisopliae y B. bassiana.Celar y Kos (2016) también observaron alta sensibilidad de B. bassiana con todos los herbicidas estudiados. Según estos autores, la actividad fungicida de los herbicidas comerciales podría ser causada por el ingrediente activo, los excipientes o la interacción entre estos y con la especie microbiana.
Los insecticidas y herbicidas evaluados en el presente trabajo podrían ser utilizados de manera conjunta con el bioplaguicida debido a su compatibilidad, que puede estar relacionada con el modo de acción de estas moléculas, dirigido a puntos críticos del desarrollo y la supervivencia de insectos plaga y de plantas (Akbar, 2012; Garcia-Riaño et al., 2020).
La compatibilidad de B. bassiana Bv062 con los agroquímicos evaluados en el presente estudio, también podría estar relacionada también con la formulación oleosa del concentrado emulsionable. En esta formulación, los conidios se encuentran recubiertos (encapsulados) por una capa de aceite y tensioactivos que podría actuar como barrera, reduciendo la permeabilidad y contacto de las células y las moléculas activas. Este potencial efecto protector de la formulación le conferiría una ventaja competitiva al hongo cuando es formulado en este sistema de liberación y aplicado en campo junto con diferentes agroquímicos. Esto fue observado por Lopes et al. (2011), quienes evidenciaron que una base oleosa usada como formulación confirió protección a los conidios de M. anisopliae frente a productos con actividad fungicida o fungistática y además incrementó la virulencia sobre larvas de D. saccharalis. Por lo tanto, es necesario profundizar en estos resultados y elucidar las interacciones que se dan entre el hongo y las moléculas de los agroquímicos evaluados, cuando se emplea la formulación CE.
Con base en los resultados encontrados en el presente estudio, se sugiere como siguiente paso evaluar la compatibilidad de los agroquímicos promisorios en condiciones de campo, aplicándolos de manera conjunta o alternada con el fin de generar recomendaciones de uso dentro de un programa de manejo integrado del cultivo y evaluar su impacto ecológico. Los resultados permitirán generar algunas recomendaciones para la integración exitosa de estos agroquímicos y el bioplaguicida en programas de manejo en campo, ya que los estudios in vitro exponen el microorganismo a los agroquímicos en el escenario más agresivo, lo que no ocurre bajo condiciones de campo, donde varios factores actúan como barreras contra dicha exposición, protegiendo al entomopatógeno. El manejo del cultivo de caña de azúcar incluye el uso de herbicidas parea eliminar las malezas, el uso de fungicidas para controlar enfermedades limitantes como la roya naranja desde la semilla, y el uso de insecticidas químicos para disminuir los niveles de daño del complejo barrenadores de la caña Diatraea spp. y para controlar otros insectos perforadores y defoliadores (López, 2015). La utilización de un bioplaguicida a base de B. bassiana junto con las demás estrategias dentro un plan de manejo integrado, permitirán asegurar un mayor control manteniendo un umbral inferior al esperado o reduciéndolo a tal punto que no le cause pérdidas económicas al agricultor. Adicionalmente, la información sobre compatibilidad con agroquímicos complementa la ficha técnica del bioplaguicida con miras a su registro y adopción por parte de los productores de caña.