INTRODUCCIÓN
El aumento de una sociedad consumista ha desencadenado el detrimento en los ecosistemas provocando una insólita crisis ambiental, por lo que en la actualidad se tienen problemas con la calidad del aire, suelo, el agua y la temperatura (Klaram et al., 2022). El empoderamiento del modelo de desarrollo social basado en la producción y el consumismo ha generado que la actividad agrícola afecte el ambiente por el uso excesivo de productos fitosanitarios como fertilizantes y plaguicidas. Diversas investigaciones advierten un dinámico crecimiento poblacional en los próximos 30 años, por lo que las emisiones agrícolas se acrecentarán por más del 50 % para que la gente pueda adquirir alimentos en cantidad y calidad adecuadas (Fróna et al., 2019). Sin embargo, esto conlleva a una presión hacia el cambio climático extremo, el cual representa una amenaza para el abastecimiento de alimentos. Por lo que surge la necesidad de desarrollar e implementar nuevas alternativas para la producción agropecuaria que generen un menor daño al ambiente o en el mejor de los casos que logre revertir en cierta medida los estragos ya ocasionados. Una alternativa es el uso de microorganismos capaces de controlar enfermedades y fertilizantes orgánicos. Tales como el hongo filamentoso Trichoderma spp., este género de hongos saprófitos coexiste en diferentes tipos de sustratos, tienen importancia por su función en los ecosistemas al ser descomponedores de la materia orgánica y son fundamentales en el ciclo de nutrientes en el suelo (Pineda-Insuasti et al., 2017). Asimismo, algunas especies de Trichoderma tienen la capacidad de producir metabolitos secundarios, lo que les brinda posibilidad de utilizarse en la biotecnología agrícola (Rebolledo-Prudencio et al., 2020). Su efectividad según las evidencias está vinculada con el control de algún factor abiótico o con la reducción o mitigación de ciertos fitopatógenos, favoreciendo la tasa de crecimiento y desarrollo vegetal (Vicente et al., 2022). La evolución actual en el estudio de Trichoderma muestra resultados de cepas no solo de origen edafológico sino también provenientes de ambientes marinos demostrando su capacidad antagónica ante patógenos de importancia agrícola. Este género tiene capacidad de activar mecanismos de defensa y anticipar el ataque de patógenos mediante diversos elementos, como competencia de nutrientes, antibiosis, micoparasitismo o por la estimulación de sustancias como antibióticos, enzimas hidrolíticas o quelantes. También tiene un efecto promotor de crecimiento ya que segrega hormonas de crecimiento (Klaram et al., 2022). Con ello Trichoderma ha demostrado ser efectivo como bioestimulante en diversos cultivos como frijol (Sánchez-García et al., 2017), lechuga (Santana-Díaz y Castellanos, 2018), algunas gramíneas ( Vázquez-Martínez et al., 2019), tomate (Sharma et al., 2022), así como en frutales y especies forestales (Caporale et al., 2019). Sin embargo, se debe conocer la efectividad de cada cepa para la correcta aplicación, caracterización y el estudio de los mecanismos de acción que intervienen en cada proceso, por ser elementos básicos que se deben tomar en cuenta para tener resultados exitosos. No obstante, son pocos los reportes sobre la germinación de semillas, crecimiento radical y foliar, y la efectividad en la asimilación de nutrientes y agua y como todo ello contribuye a la sostenibilidad de los agroecosistemas. Lo que genera incertidumbre sobre su participación en el incremento en la calidad de los productos y rendimiento de las cosechas. Por otro lado, se ha sugerido que las bondades de este hongo filamentoso permiten aprovechar al máximo las propiedades del suelo reduciendo en gran medida la aplicación de fertilización química, y en cuanto al control de patógenos genera un equilibrio biológico evitando el uso masivo de productos fitosanitarios. Por lo anterior, el objetivo fue resumir los hallazgos bibliográficos del género Trichoderma que muestren su alta capacidad hacia el desarrollo sostenible de los agroecosistemas.
METODOLOGÍA.
Para realizar esta revisión, se consultaron y seleccionaron artículos científicos publicados en Academic Search Ultimate, BioOne, Acsess, Esmerald, Fuente Académica, PNAS, ScienceDirect y Springer, entre el 2000 y 2023, con dos o tres excepciones de años anteriores. Se analizaron 234 publicaciones utilizando la palabra clave “Trichoderma” y estuvieran relacionadas con la utilización de microorganismos benéficos en la producción agrícola, las posibles interacciones y su aplicación agrícola como promotor de crecimiento (Figura 1).

Figura 1 Temas relacionados con Trichoderma spp. incluidos y desarrollados como parte de la revisión bibliográfica.
GENERALIDADES DE Trichoderma spp.
El género Trichoderma fue postulado por primera vez en 1794 por Persoon. Posteriormente, Rifai (1969) definió nueve especies de acuerdo a sus características fisiológicas y morfológicas. Con el paso del tiempo, la clasificación de Trichoderma aumentó y alcanzó más de 200 especies de acuerdo a su origen, formación y desarrollo evolutivo. Las colonias son de coloración verde oscuro a claro y a veces amarillento dependiendo la especie, y suelen tener un aroma a coco, son de fácil aislamiento ya que se encuentran muy cerca de la rizosfera, en materia orgánica en descomposición y en las cortezas de los árboles (Swain et al., 2018). Presenta tres tipos de propágulos (hifas, clamidosporas y conidios), que muestran actividad antagónica a patógenos en diferentes fases, desde la germinación de esporas hasta la esporulación (Howell, 2003). Dichas estructuras son bastante resistentes, ya que sobreviven en condiciones climáticas extremas como es la radiación ultravioleta y zonas demasiado frías (congeladas) y desérticas (Cai et al., 2020). No obstante, su temperatura óptima de crecimiento está en un rango de 20 y 28 ºC, el contenido de humedad es de 92 % para desarrollo, mientras que para esporulación es de 93 a 95 %, se puede propagar en sustratos a base de maíz, sorgo, arroz y paja de trigo (Romero-Arenas, 2009; Pineda-Insuasti et al., 2017).
Trichoderma spp. COMO AGENTE DE CONTROL BIOLÓGICO
A través del tiempo las plantas han logrado evolucionar para crecer y desarrollarse en diversos ambientes donde existen numerosos factores de estrés, como el daño de plagas y patógenos relacionados con hongos, bacterias, virus, nematodos y herbívoros (Galletii et al., 2020; Ibrahim et al., 2020). Además de otros como la sequía, la salinidad y la deficiencia de nutrientes del suelo (Kamanga et al., 2018). Las estrategias de la agricultura convencional son el uso de productos químicos como los fungicidas y el desarrollo de variedades resistentes; no obstante, con el paso del tiempo han resultado poco útiles debido al desarrollo de resistencia de las plagas y las enfermedades. Por otra parte, aunque los resultados parecen favorables al principio, las desventajas son mayores a largo plazo, ya que aparte de los elevados costos de producción inducen cambios negativos al suelo y agua por su uso excesivo (Fu et al., 2017; Kamanga et al., 2018).
Los agentes biológicos son una alternativa efectiva y segura para el control de patógenos. El género Trichoderma se ha estudiado por más de siete décadas. Su efecto antagonista lo colocan como el favorito dentro del control de diversos patógenos y enfermedades que afectan a los cultivos de importancia agrícola y económica. Esto puede ser por antibiosis, competencia nutrimental y micoparasitismo (Figura 2; Konappa et al., 2022).
Antibiosis. Ocurre cuando un grupo de compuestos secretados por Trichoderma inhiben el crecimiento de otros microorganismos con los que establece relaciones espaciales. Estos agregados son metabolitos tóxicos volátiles y no volátiles llamados antibióticos y su producción depende de la especie y el tipo de aislado (cepa). Algunos de ellos pueden ser: ácido harziánico, acetaldehídos, alameticinas, tricholinas, peptaiboiles, antibióticos, 6-penthyl pirona, massoilactona, viridina, gliovirina, glisoperonas, ácido heptéldico, aldehído fórmico entre otros (Konappa et al., 2022).
Micoparasitismo. Está ligado a su velocidad de crecimiento y ocurre en cuatro etapas denominadas: quimiotropismo (Trichoderma detecta a distancia la dirección del patógeno por respuesta química). Reconocimiento (el hongo saprófito se adhiere con carbohidratos a lectinas en la pared celular del hongo parásito, lo invade enroscándose (enrollamiento) en el patógeno generando una red (Zeilinger y Atanasova, 2020; Shenouda y Cox, 2021). Posteriormente, ocurre la actividad lítica mediante la producción de enzimas líticas extracelulares por parte de Trichoderma (quitinasas, glucanasas y proteasas), que degradan las paredes celulares del patógeno dando origen a poros posibilitando la penetración de las hifas de Trichoderma y así alimentarse de su presa. Lo anterior propicia que la competencia por el espacio y nutrimentos sea favorable para el saprófito. Al tener mayor distribución y menos rivalidad hay más posibilidades de que Trichoderma tome minerales como el carbono, hierro y nitrato que es esencial para su metabolismo, con ello evita el crecimiento de otros agentes por limitación de nutrientes.
Una de las especies más reportadas por su rápido crecimiento es Trichoderma asperellum y por contrarrestar la presencia de fitopatógenos en tres días mediante la producción de enzimas como las glucanasas (Vargas-Hoyos y Gilchrist-Ramelli, 2015). Estudios recientes abordan los mecanismos moleculares del micoparasitismo de Trichoderma, refieren que de más de 300 especies solo ocho se han estudiado a nivel genético por su actividad micoparasitaria. Dentro de los mecanismos moleculares empleados por Trichoderma para la ofensiva y la virulencia se encuentran genes biosintéticos precisos. En la autodefensa se habla de pequeñas proteínas ricas en cisteína y metabolitos secundarios, así como diferentes genes reguladores como la metiltransferasa (MAPK) (Dou et al., 2022).
Actualmente se usa la mutagénesis estimulada por rayos gamma, para obtener aislados mutantes que generan más metabolitos inhibidores y poseen genes relacionados con el metabolismo secundario, el micoparasitismo y las interacciones con plantas. Dichas cepas se han probado en campos agrícolas teniendo resultados favorables contra patógenos como Sclerotium rolfsii en leguminosas (Mukherjee et al., 2019).
El género Trichoderma reduce las enfermedades ocasionadas por patógenos como: Fusarium oxysporum f. sp. dianthi, Fusarium oxysporum f. sp. lycopersici, Rhizoctonia solani, Pythium aphanidermatum, Sclerotinia sp. y Botrytis cinerea, entre otros con una eficacia comparable a la de productos fitosanitarios químicos (Nofal et al., 2021, Shenouda y Cox, 2021). Además, controla nematodos como Meloidogyne incógnita y Meloidogyne javanica inhibiendo la eclosión de huevos y en estados juveniles los inmoviliza hasta causar la muerte (Ibrahim et al., 2020). Otro atributo del saprofito está relacionado con el control de patógenos foliares de forma colateral. do Nascimento et al. (2017), reportan la posible aplicación de Trichoderma para bajar la incidencia de la hormiga cortadora de hojas como parte del antagonismo que muestran algunas cepas contra el basidiomiceto Leucoagaricus gongylophorus organismo mutualista de la hormiga cortadora.
También reduce los daños ocasionados por insectos mediante parasitismo directo ante hemípteros como Aphis gossypii: el pulgón del algodón (Nawaz et al., 2020) y ortópteros como la langosta migratoria (Locusta migratoria) (Laib et al., 2020). Asimismo, algunos aislados de Trichoderma tienen facultad para producir y liberar al entorno en el que se desarrollan MS con gran potencial insecticida como Trichoderma atroviride que produce MS con efecto repelente ante la mosca común de la fruta (Drosophila melanogaster) (Atriztán-Hernández et al., 2019).
Resistencia sistémica inducida (RSI) y adquirida (RSA). La resistencia sistémica intervenida por microorganismos se categoriza en resistencia sistémica adquirida (RSA) inducida por patógenos y resistencia sistémica inducida por rizobacterias no patógenas (RSI). De manera general, está documentado que las moléculas de microorganismos no patógenos precipitan la respuesta inmune de las plantas a través de la RSI, impulsada a través de las vías de señalización del ácido jasmónico (JA) y etileno (ET). Mientras que las moléculas de origen patógenico inducen la RSA impulsada por ácido salicílico (SA). Sin embargo, Trichoderma tiene la capacidad de mostrar los dos tipos de resistencia, un ejemplo lo describe el estudio de Alkooranee et al. (2017), donde la colonización de raíces por Trichoderma harzianum TH12 logro inducir RSI. Mientras que la aplicación de su filtrado libre de células indujo RSA a Sclerotinia sclerotiorum. En plantas de maíz, la inoculación con dos cepas de Trichoderma gamsii identificadas como IMO5 y B21 dieron como resultado en resistencia sistémica contra F. verticillioides y fue específica de cada cepa. La identificada como IMO5 mejoró la expresión de los genes marcadores ZmLOX10, ZmAOS y ZmHPL responsables de la producción de JA relacionado con la RSI. Por otra parte, la cepa B21 mejoró la expresión de los genes ZmPR1 y ZmPR5 respectivos de SAR (Galletti et al. 2020). Actualmente para hablar de este tipo de resistencia mediada por el género Trichoderma se usa la expresión respuesta de defensa inducida o RDI, para abarcar todas las formas de resistencia inducida, tanto local como sistémica, no obstante, por las rutas bioquímicas de señalización se puede identificar cuál de ellas es la que está presente (RSI y RSA) (Salwan et al. 2022).
La activación o RDI protege a la planta de enfermedades y diversos patógenos desde la zona donde se originó la simbiosis hacia todas las áreas de la planta. Como ejemplo en cultivo de algodón González-Soto et al. (2017), reportaron alta concentración de compuestos fenólicos (flavonoides) en el tejido foliar y una significativa actividad enzimática de la peroxidasa (POX) y fenilalanina amonioliasa (PAL) en plantas inoculadas en comparación a las no tratadas. Aluden con ello al estímulo de una respuesta de RSI por la inoculación de las semillas con la cepa de Trichoderma longibrachiatum ICA-4. Así mismo, se inhibe el crecimiento de los posibles fitopatógenos al entrar en contacto con los compuestos fenólicos presentes en los tejidos foliares, disminuyendo en gran medida la incidencia del ataque (Rodríguez-Maturino et al., 2015).
Ambos mecanismos se han relacionado con el desarrollo y crecimiento vegetal, por lo que, la aplicación de productos a base de Trichoderma eventualmente podrían reducir los gastos que genera el uso de productos fitosanitarios. Así como, impactar positivamente en los costos de producción y por supuesto disminuir el deterioro al ambiente derivados de la aplicación de sustancias de origen químico asociadas con la defensa de patógenos. El conocimiento de la especificidad de las cepas y las formas de respuesta de defensa desencadenadas en las plantas por patógenos abren nuevas vías biotecnológicas para la protección de cultivos. Sin embargo, hace falta validar en ensayos en condiciones de campo y laboratorio realizando pruebas dirigidas al balance costo-producción, en ambivalencia química Trichoderma, lo que permitirá demostrar a los productores que su uso es rentable.
Trichoderma spp. COMO BIOESTIMULANTE
Algunas cepas de Trichoderma han mostrado efecto bioestimulante directamente en los cultivos. En este sentido, las funciones trascendentales son que coadyuvan al aumento de la biomasa en raíz y en hojas. El efecto puede ser variable dependiendo el cultivo, los factores ambientales y la proporción del inóculo, así como el tipo de aplicación (Fu et al., 2017; Swain et al., 2018). Este potencial se debe a la estimulación en la asimilación de nutrimentos de las plantas y a la producción de ácidos orgánicos (glucónico, fumárico y cítrico) los cuales intervienen en la modificación del pH del suelo (Conte et al., 2022).
Por otra parte, produce compuestos como el ácido indolacético principal sustancia promotora del desarrollo radical y ácido giberélico, que son los principales agentes causantes del crecimiento de las plantas (Al-Askar et al., 2016; Sharma et al., 2022), influyendo directamente en altas tasas fotosintéticas (Harman, 2006). De igual manera, incrementa la longitud de las raíces, crecimiento de follaje, inducción de la germinación y floración entre otros (Sharma et al., 2022). Asimismo, tiene la capacidad de inducir la tolerancia de la planta hospedante a estrés abiótico, como la salinidad y la sequía, por lo que contribuye al crecimiento y desarrollo vegetal (Swain et al., 2018).
Ji et al. (2020), probaron su efecto bioestimulante como biofertilizante a base de un consorcio de esporas de cuatro cepas de Trichoderma (Trichoderma harzianum T18, Trichoderma asperellum T9, Trichoderma atroviride T14 y Trichoderma hamatum T19) en cultivo de col china en invernadero, sus resultados mostraron un aumento en la tasa de germinación en aproximadamente un 22,5 % en comparación con el control. Así como también incremento en la altura, el peso fresco, el rendimiento y un contenido bajo de especies reactivas de oxígeno en las plántulas. En este mismo contexto, estudios demuestran que el uso de bioproductos a base de Trichoderma promueven aún más el crecimiento y el desarrollo de los cultivos mejorando la productividad (Caporale et al., 2019). Se han realizado nuevas tecnologías y probado nuevas cepas en el desarrollo y validación de bioestimulantes, con resultados exitosos. No obstante, la aceptación y aplicación de esta biotecnología se verá amplificada, en proporción a su efectividad, bajo costo y al evidenciar sus bondades en los suelos agrícolas demostrando cero impactos nocivos al ambiente.
En Latinoamérica se vive una carencia y alto precio de los fertilizantes sintéticos como producto de la guerra en Ucrania (FAO, 2022). En un seminario celebrado en Santiago de Chile la Organización de las Naciones Unidas para la Alimentación (FAO) dio a conocer con expertos y autoridades de Brasil, Chile, Perú y el Caribe sus experiencias con el uso de bioproductos a base de mezclas de hongos, bacterias y levaduras. Así como el uso de compost, técnicas de rotación de cultivos y el uso de leguminosas que podrían en algún momento sustituir o complementar los fertilizantes químicos como estrategia para tener suelos más sanos encaminados a una agricultura resiliente (FAO, 2022). Sin embargo, aún es necesario valorar los balances económicos entre bioproductos y del global de gastos en una explotación agrícola para asegurar que son una alternativa ante crisis económicas. Hoy día, todavía la fertilización química suele resultar más barata que la orgánica.
En México existe programas que promueven la aplicación de biotecnologías, como el programa nacional de biofertilizantes enfocado a la agricultura sostenible a nivel nacional, con el propósito de capacitar y generar una autoproducción de bioproductos de uso agrícola por parte de las comunidades agrarias (Cruz-Cárdenas et al., 2021); sin embargo, aún no se han valorado sus resultados.
Mientras que, en la Unión Europea existe una normativa que certifica que el uso de los productos fitosanitarios comercializados no represente un riesgo para la salud humana y animal. Así como también no tiene consecuencias negativas para el medio ambiente. Esta ley de fertilizantes-bioestimulantes contemplada en el Reglamento 2019/1009; solo incluye microorganismos tipo micorrizas, bacterias fijadoras de nitrógeno y solubilizadoras de fósforo, aunque esta lista en un futuro pueda ser mayor. Además de indicar un listado de toda sustancia extraída de algún microorganismo para uso agrícola y por supuesto factible de ser comercializada, previamente sometidas a las pruebas presentadas en el reglamento CE Nº 1107/2009 y con ello llegar a su registro, autorización y comercialización, en este caso como producto fitosanitario. Con esta normativa en la región europea se ha perfilado una modulación en la valoración y toma de decisiones, estableciendo un proceso en el que los nuevos descubrimientos científicos se pueden ir incorporando en el sistema de evaluación. La aceptación de la sustancia activa a nivel comunitario es la plataforma para la evaluación, e instituye la toma de decisión por los Estados Miembros para la autorización de los distintos productos fitosanitarios que contienen alguna sustancia activa de microorganismos (Prados, 2019). En este caso el género Trichoderma tendría que ser evaluado en profundidad antes de ser aplicado, ya que la especificidad de producir ciertos metabolitos secundarios está relacionado con la variabilidad del asilado, aun entre especies análogas Todo lo anterior, posiciona a los bioestimulantes microbianos como una posible alternativa innovadora a ser considerada para la seguridad alimentaria del mundo, a medida que sean eficaces y se disminuya el uso de los químicos agrícolas en la agricultura convencional. Por lo que, los productos a base de Trichoderma se podrían considerar una alternativa en dirección a la sostenibilidad al mejorar la calidad del suelo, la absorción de nutrientes por la planta y en el mejor de los casos disminuir la translocación de plaguicidas a frutos.
MECANISMOS DE ACCIÓN DE Trichoderma
Existe una complejidad de interacciones entre los microorganismos y las plantas, que están delicadamente sincronizados y estimuladas por mensajes químicos intercambiados consecutivamente (Figura 2). Los microorganismos secretan como parte de su metabolismo compuestos conocidos como efectores (proteínas y metabolitos) que al estar en contacto con las plantas influyen en la fisiología y activan receptores de inmunidad, en particular nucleótidos y proteínas permitiendo a las plantas luchar contra los organismos invasores. Está documentado que existen más de 800 compuestos producidos por este género y su biosíntesis depende del tipo de cepa y expresión genética (Shenouda y Cox, 2021; Vicente et al., 2022).
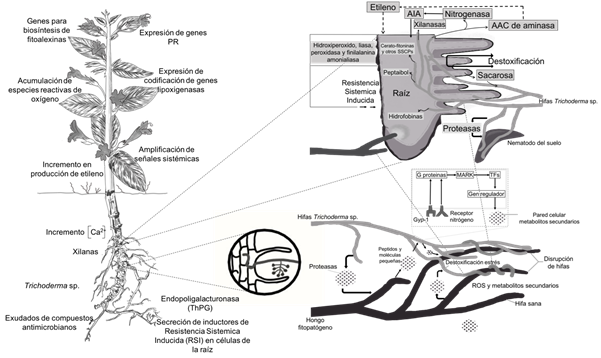
Figura 2 Interacción microscópica de Trichoderma spp. en planta (Imagen Viveros-Sánchez, 2023). A) Respuesta de planta ante la interacción de Trichoderma en el rizoplano; B) Compuestos producidos en la raíz por Trichoderma e interacción con organismos fitopatógenos y nematodos.
Los compuestos producidos por Trichoderma, de manera general, tiene potencial para combatir hongos patógenos e impulsar la defensa de las plantas inclusive en zonas alejadas del punto donde ocurre la simbiosis. Como ejemplo Nandini et al. (2021), reportaron presencia de compuestos anti-esporangióforos en el exudado extraído del xilema de plántulas de Mijo (Pennisetum glaucum) inoculadas con el saprofito. Estos mismos compuestos se encontraron en el filtrado del cultivo de Trichoderma y posteriormente fueron probados en el tejido foliar de la gramínea con resultados favorables. Por lo que quedo comprobado que los metabolitos secretados por el endófito ayudan a contrarrestar ciertos factores de estrés, que pudieran ser de origen ambiental o de deficiencia de nutrientes.
Metabolitos secundarios (MS). Los principales comprenden péptidos no ribosomales como peptaibióticos, sideróforos, gliotoxina y gliovirina similares a dicetopiperazinas, policétidos, terpenos, pironas y metabolitos de isociano (Khan et al., 2017). Estos MS son producidos por más del 50 % de las especies de Trichoderma, dentro de las que destacan Trichoderma asperellum, Trichoderma viride, Trichoderma virens y Trichoderma harzianum como la más populares (Nandini et al., 2021). Los peptaiboles son el grupo más grande de péptidos y se caracteriza por un N-terminal acilado y un amino-alcohol unido a amida en el carbono terminal como el fenilalaninol, valinol, triptófano, leucinol y el isoleucinol. En las diferentes especies de Trichoderma se han encontrado peptaiboles como las tricorzianinas, tricovirinas, la peptaibol sintetasa (sirve para la biosíntesis de atroviridinas) algunos son agentes antifúngicos y fitotóxicos (Khan et al., 2017).
Los péptidos no ribosomales son los más producidos por este género fúngico no patógeno y se encuentran en diversos productos biológicos comerciales, como son el ácido harziánico (Sideróforo), viridina, gliovirina y la 6-pentil-a -pirona (6PaP) catalogada como un compuesto orgánico volátil (COV) con propiedades antifúngicas y de ser la responsable del peculiar aroma a coco de algunas especies de Trichoderma. Estos compuestos están fuertemente identificados como promotores de crecimiento (Shenouda y Cox, 2021), ya que han demostrado tener potencial para estimular el crecimiento radicular e incrementar rendimientos y calidad en frutos. Así como inducir la germinación de semillas y aumentar la cantidad de brotes en las plantas, pues los derivados de pirona inducen la producción de hormonas de crecimiento pertenecientes al grupo auxínico (Nakkeeran et al., 2021).
Los sideróforos son moléculas producidas por microorganismos como bacterias y hongos, principalmente en situaciones que implican deficiencia de algún mineral. Actúan de manera específica como agentes quelantes para secuestrar hierro en presencia de otros metales y reducirlos a una forma mucho más soluble y aprovechable para su asimilación y por ende, la cantidad disponible es suficientemente alta para beneficiar la nutrición de las plantas (Nykiel-Szymańska, 2020). Por otro lado, la privación o secuestro de hierro por Trichoderma es un mecanismo de competencia para antagonizar a los microorganismos patógenos de las plantas. Zapparata et al. (2021), encontraron que Trichoderma gamsii reguló la activación de un gen que codifica la reductasa férrica, que cataliza la reducción de Fe3+ a Fe2+ tras la oxidación del NADPH citoplasmático. Los principales sideróforos fúngicos han sido encontrados en especies como Trichoderma atroviride, Trichoderma asperellum, Trichoderma gamsii, Trichoderma harzianum, Trichoderma hamatum, Trichoderma virens, Trichoderma reesei y Trichoderma polysporum como fusarininas, coprógenos, ferricrocinas, ácido dimérico, ácido harzianico y fusigenos, entre otros (Nakkeeran et al., 2021).
Las enzimas secretadas por Trichoderma son quitinasas, proteasas y glucanasas, que a decir de Zeilinger y Atanasova (2020) y Vicente et al. (2022), son reconocidas como armas moleculares que se encargan de hidrolizar la pared celular de los hongos fitopatógenos y desencadenar la ruptura de la membrana plasmática provocando cambios estructurales en el citoplasma. Por otra parte, impiden la germinación de esporas y la elongación de tubo germinativo de algunas especies patógenas. También producen la enzima 1-aminocyclopropana-1-carboxylicacid-deaminasa (ACCD), misma que interfiere en la biosíntesis de etileno promoviendo el desarrollo vegetal por vía de las giberelinas (Brotman et al., 2013). Cabe mencionar que la expresión de estos compuestos difiere de acuerdo a la genética de cada especie, tipo de cepa y su aislamiento, a través del tiempo algunas especies como Trichoderma reesei desarrollaron gran actividad degradadora de biomasa vegetal como celulosa y xilano, convirtiéndose en hongos saprofitos de alto valor para la industria biotecnológica (Shenouda y Cox 2021; Vicente et al., 2022). Por lo que los MS son intermediarios clave en la modulación de interacciones simbióticas entre hongos y otros microorganismos. Siendo que la señalización mediada por estos compuestos permite el intercambio de nutrimentos y el desarrollo de alianzas no patógenas que mejoran la competitividad ecológica de los simbiontes involucrados (Khan et al., 2020 y Shenouda y Cox, 2021).
EFECTO DE Trichoderma spp. ANTE ESTRÉS ABIÓTICO
Los organismos vegetales desarrollan características adaptativas que les permiten detectar cambios ambientales y responder a ellos minimizando los daños posibles para perpetuar su desarrollo. Entre los que se encuentran ajustes morfológicos como aumento del crecimiento y desarrollo radicular, abscisión de órganos aéreos y cierre estomático, como también fisiológicos, bioquímicos y moleculares.
Salinidad. Es uno de los problemas relacionados con el uso de fertilizantes químicos a mediano plazo, al dañar las propiedades físicas y químicas del suelo. Además de afectar procesos fisiológicos y bioquímicos en las plantas que reduce el porcentaje de germinación, peso fresco y seco de brotes. Así como el contenido de clorofila y proteínas, por lo que incide en la fotosíntesis y en los procesos de respiración, provocando la caída severa en la producción de la mayoría de los cultivos de importancia económica (Macías-Rodríguez et al., 2020). Se ha demostrado que el género Trichoderma ayuda a las plantas a mitigar el estrés salino, al estimular la fotosíntesis y la producción de antioxidantes e intervenir en el crecimiento vegetal (Macías-Rodríguez et al., 2020).
Aunque el mecanismo de Trichoderma por el cual se ejerce el efecto benéfico ante la salinidad puede ser de diversa índole, éste está relacionado con la producción de enzimas antioxidantes como guayacol peroxidasa, peroxidasa, superóxido dismutasa, catalasa, ascorbato peroxidasa y glutatión reductasa y con la acumulación de solutos compatibles que activan los mecanismos antioxidantes y, en efecto hay una reducción del daño oxidativo por problemas de exceso de aniones en las raíces y brotes de las plantas (Fu et al., 2017). Sin embargo, mucho se desconoce sobre los factores de estrés en diversas especies de plantas en entornos limitantes, por lo que es importante el estudio de la diversidad de especies del género Trichoderma en numerosos ecosistemas, ya que esto brinda mayor comprensión sobre su aporte ecológico, biotecnológico y económico a los agroecosistemas.
Estrés hídrico. El déficit de agua es el factor abiótico que impacta con mayor severidad a los cultivos, ya que limita su productividad. Éste afecta directamente a la disminución de la tasa fotosintética, debido al cierre estomático para evitar la pérdida de agua, esto afecta las plantas a nivel fisiológico, fenológico y de desarrollo (Kamanga et al., 2018). Sin embargo, Trichoderma es una alternativa confiable ante la carencia hídrica. Macías-Rodríguez et al. (2020), reportaron que libera ácido trans-abscísico, una hormona procedente de isoprenoide que regula el cierre estomático y, por ende, la eliminación de humedad en las plantas. Fu et al. (2017), reportaron que los tratamientos con Trichoderma asperellum en cultivo de maíz causó la síntesis y acumulación de osmolitos que, al ser solubles dentro de las células optimizaron la capacidad de absorción de agua, la actividad enzimática de antioxidantes y de los no enzimáticos y con ello se llegó a la reducción de las especies reactivas de oxígeno. Asimismo, se reportan hallazgos en donde la manipulación de ciertos genes que regulan la tolerancia al estrés abiótico en microorganismos se usa para generar plantas transgénicas (Macías-Rodríguez et al., 2020).
POTENCIAL PATOGÉNICO DE Trichoderma spp.
La mayoría de las especies de Trichoderma se consideran benéficas o no patógenas, y muchas de ellas son utilizadas en prácticas agrícolas sostenibles. Sin embargo, es importante considerar la variabilidad dentro del género Trichoderma y reconocer que ciertas cepas o especies pueden exhibir niveles variables de patogenicidad en circunstancias específicas. La patogenidad de diversas especies del hongo ha sido objeto de estudio en investigaciones recientes, revelando tanto su capacidad simbiótica como su potencial patogénico en sistemas agrícolas. El estudio de Zhao et al. (2023), identificó Trichoderma crassum y Trichoderma virens como agentes causales de una enfermedad foliar en el jitomate (Licopersicum sculentum), caracterizada por el desarrollo progresivo de manchas foliares irregulares que evolucionan hacia lesiones necróticas y, en etapas avanzadas, provocan enrollamiento y marchitez de las hojas. Por su parte Poveda et al. (2020), discuten la compleja interacción entre distintas especies de Trichoderma y las plantas huéspedes. Muestran que esta interacción puede manifestarse como una relación simbiótica o como un fenómeno de parasitismo, destacando la influencia del genotipo vegetal y la especie de Trichoderma involucrada. En particular, ciertas especies, como Trichoderma brevicompactum, han sido asociadas con efectos negativos en el crecimiento de las plantas debido a la producción de trichodermina. Además, enfatizan cómo la ausencia de una respuesta mediada por ácido salicílico (SA) facilita la colonización masiva de la raíz por Trichoderma, permitiendo su invasión en el tejido vascular y su conversión en un patógeno oportunista.
Por otro lado, Pfordt et al. (2020), han identificado casos donde especies de Trichoderma, a menudo consideradas simbiontes oportunistas, pueden actuar como patógenos, como se evidencia en la pudrición de la mazorca del maíz. Esta infección se caracteriza por la presencia de conidios azul verdosos entre los granos de las mazorcas, desencadenando una germinación prematura y una reducción significativa en el contenido de materia seca de las mazorcas infectadas, hallazgos que han sido observados en diversas regiones, incluido el sur de Alemania. Además, Hatvani et al. (2020), señalan específicamente la capacidad de Trichoderma aggressivum para causar la enfermedad del moho verde en la producción de Agaricus bisporus, demostrando que ciertas cepas tienen un impacto patogénico significativo en cultivos de hongos, tanto en Europa como en América del Norte. Por último, Sanna et al. (2020), han destacado la habilidad de Trichoderma spp. para inducir pudrición en las mazorcas de maíz. Estos hallazgos enfatizan la importancia de investigar su potencial para producir micotoxinas, destacando el informe inicial de T. afroharzianum como agente patógeno. En conjunto, estos estudios evidencian la variabilidad de respuestas de Trichoderma en diferentes sistemas vegetales, desde comportamientos simbióticos hasta la manifestación de patogenidad, lo que subraya la importancia de una comprensión más amplia de su papel en la salud de las plantas y la producción agrícola.
APLICACIONES AGRÍCOLAS DE Trichoderma spp. COMO PROMOTOR DE CRECIMIENTO
Trichoderma spp. puede ser un excelente promotor del crecimiento, dentro de los principales efectos se reportan la estimulación de la germinación, el crecimiento radical, altura de la planta y grosor del tallo, altos rendimientos, así como aumento en la concentración de minerales en suelo y tejidos foliares. En gramíneas como Maíz (Zea mays) se reportan incrementos en la germinación de las semillas, altura, longitud y área de la raíz, área de la hoja y peso seco y altos rendimientos para especies criollas ( Vázquez-Martínez et al., 2019). En cultivo de tomate (Solanum lycopersicum L.) se alcanzaron incrementos en la concentración de K, Cu, Fe y Zn en raíces, altos niveles de P, K, Mg y Fe en brotes y en compuestos minerales, azúcares y antioxidantes principalmente en frutos (Khan et al., 2017). Al-Askar et al. (2016), reportaron efectos positivos significativos en el vigor de los brotes, así como altos índices de clorofila foliar en cultivo de papa inoculado con una cepa de Trichoderma harzianum, en invernadero. En cultivo de Soja (Glycine max) se reportan aumentos en el crecimiento de las plantas inoculadas y la solubilización de fosfato, como incrementos en contenido de los minerales de K y Mn en las hojas y aumento significativo en contenido de clorofila a y clorofila total en la etapa de crecimiento (Conte et al., 2022). En hortalizas como las pertenecientes al género Brassica spp. se reporta una alta tasa de germinación y rendimientos, así como altos contenidos de clorofila, azúcar y proteína soluble, calidad del producto y altas concentraciones de nutrientes en la biomasa de la hoja (Caporale et al., 2019; Ji et al., 2020).
Las bondades de este género fúngico oportunista no se limitan a solo cultivos hortícolas, sino que también se aprovecha en el ámbito forestal, donde para pruebas de variables morfométricas, biomasa aérea y radicular, dependiendo la especie del hospedero ha dado resultados favorables (Santana-Díaz y Catellanos-González, 2018). De modo que gracias a su efecto en el sistema radicular podría tener capacidad de ser utilizado específicamente como enraizador, por consiguiente, Trichoderma demuestra ser un excelente promotor del crecimiento vegetal y como alternativa para minimizar el uso de fertilizantes químicos (Ji et al., 2020).
Trichoderma spp. EN LA REMEDIACIÓN DE LA FERTILIDAD DEL SUELO
Los efectos del cambio climático afectan de manera directa a la agricultura y el calentamiento global provoca efectos que afectan de forma negativa la producción agrícola (Fróna et al., 2019). La pérdida de materia orgánica del suelo por las altas temperaturas es uno de los problemas que enfrenta la fertilidad del suelo. Además, con el incremento de la temperatura y las precipitaciones se alteran de forma desproporcional la estacionalidad de los cultivos. Lo que permite que varias especies de insectos plaga tengan incrementos en sus ciclos reproductivos, y se ocasiona mayor dispersión de enfermedades en las plantas, dando como resultado pérdidas en las cosechas. Por lo anterior, los agricultores se ven en la necesidad de explotar los campos agrícolas con insumos químicos que en las últimas décadas han desencadenado problemas en los agroecosistemas, como saturación de bases y suelos compactados que merman el desarrollo de las plantas (de Oliveira Silva et al., 2020). Además, el exceso de la fertilización química para mejorar la productividad de los cultivos a fin de satisfacer la demanda de alimentos del mercado mundial causa contaminación de mantos freáticos, eutrofización, agotamiento de la fertilidad del suelo y acumulación de elementos tóxicos, afectando la fertilidad del suelo (Bononi et al., 2020).
Por otra parte, uno de los minerales más importantes es el fósforo como elemento esencial es necesario para el desarrollo y crecimiento de las plantas; constituye un poco más o menos del 0,2 % del peso seco del tejido vegetal de la planta. Esté y el nitrógeno son de los nutrientes minerales más escasos que frecuentemente delimitan el crecimiento de los cultivos. Está documentado que la fertilidad del suelo se asocia frecuentemente al contenido de materia orgánica, misma que se encuentra en las capas superficiales del suelo y a la tasa de mineralización entre otros (de Oliveira Silva et al., 2020). El suelo es un sistema vivo que obedece a la sostenibilidad de los procedimientos agrícolas entre otros factores como las interacciones que dan entre componentes físicos, químicos y biológicos en donde las entidades microbianas son fundamentales para su funcionamiento (Conte et al., 2022).
Por lo anterior, la utilización de agentes microbianos y quelantes como Trichoderma brindan oportunidades ante los efectos negativos provocados por las actividades antropogénicas en muchos aspectos, pues coadyuva a la mineralización de algunos elementos y secreta enzimas que degradan la materia orgánica. Como ejemplo, Caporale et al. (2019), experimentaron con esporas de dos cepas de Trichoderma harzianum (T22 y M10), probadas en tres tipos de suelos con escasez mineral, de diferente uso agrícola y génesis (forestal, cultivo de gramínea y un olivar). Sus pruebas fueron con y sin fertilización para Brassica rapa subsp. sylvestris cv. esculenta. Los resultados expuestos revelaron que los tratamientos inoculados y sin fertilización incrementaron la concentración de K, Ca, Mg y Fe. Conte et al. (2022), mostraron en sus resultados altos valores en materia orgánica, en la concentración de Ca, S, Cu, Zn y Mn y valores medios en P y K en suelo cultivado con soja inoculados con Trichoderma. Además, del potencial para remediar la fertilidad de los suelos cumplen una función biorreguladora en ambientes contaminados, la acumulación de metales pesados como el cadmio resultado de la contaminación industrial es otro problema que enfrenta la agricultura, perjudicando la calidad de algunos cultivos como el cacao (Theobroma cacao), que se ha visto afectada por este contaminante. En este sentido, Trichoderma tiene la capacidad de absorber este metal y utilizarlo como fuente de energía o acumularlo (Cayotopa-Torres et al. 2021). Así como también contribuye a solubilizar el fosfato para ayudar a las plantas a absorber fósforo, aunque las cepas con esta capacidad son contadas a comparación con otros organismos especializados, existen aislados con que brindan altos estándares. Bononi et al. (2020), reportaron que 47 de 251 aislados amazónicos presentaron potencial solubilizador y ocho de ellos alcanzaron halos de hasta 50 mm en medios sólidos. Además produjeron ácidos orgánicos (ácido fítico, ácido cítrico, ácido ascórbico, ácido glucónico, ácido fumárico, ácido d-isocítrico, ácido d-málico y ácido láctico), que estuvieron probablemente involucrados en el proceso de solubilización. Por lo que el uso de este microorganismo podría ser una estrategia para ayudar a mitigar la contaminación por algunos metales pesados y manejar las deficiencias de elementos esenciales en los suelos agrícolas.
IMPORTANCIA ECONÓMICA DE Trichoderma spp.
La importancia de este hongo dentro del sector económico radica en su capacidad de producir una amplia gama de metabolitos secundarios y enzimas. Por supuesto, como se mencionó anteriormente tiene una fundamentada relevancia en el sector agrícola por su capacidad de control biológico de hongos fitopatógenos y como promotor del crecimiento siendo una oportunidad de mejora en el área económica-ecológica del sector agroalimentario. Para el control de fitopatógenos se incluyen prácticas de manejo integrado, control biológico, uso de semillas resistentes y control químico. Estos últimos son de los más usados a pesar de tener un alto costo, y en el caso del control químico alta residualidad (Sánchez-García et al., 2017). Si bien, la contaminación que generan estos productos afecta la población de microorganismos benéficos, Trichoderma se vuelve una opción en los cultivos, ya que tiene la capacidad de sobrevivir en la superficie aun con alto contenido de productos fitosanitarios (Chiriboga et al., 2015), por lo que pudiera ser una alternativa ante fungicidas químicos.
En los mercados de la agricultura moderna los micoplaguicidas que se encuentran disponibles para el biocontrol de fitopatógenos están formulados con esporas ya sean conidios y clamidosporas del ascomiceto. La eficacia de estos productos está en su correcta aplicación tomando en cuenta la concentración del inóculo, la viabilidad de las esporas y en la selección de cepas de acuerdo a su mecanismo de acción y por supuesto contar con un riguroso control de calidad de dichos productos (Pineda-Insuasti et al., 2017; Martínez et al., 2019). Por lo tanto, su aplicación contribuye al creciente desarrollo de la agricultura orgánica y por ende se incrementa el potencial económico de los agricultores que apuestan al uso de productos biológicos.
Por otra parte, en la actualidad diversas enzimas de origen animal, vegetal y microbiológico se utilizan para la elaboración de piensos, que contribuyen de manera general al incremento en la producción de ganado (DOU, 2022). Además, en este año la Agencia Nacional de Vigilancia Sanitaria (ANVISA) de Brasil proporciono datos en la Resolución - RDC N° 728 donde se muestran enzimas y preparados enzimáticos para su uso como coadyuvantes tecnológicos en la producción de alimentos para consumo humano, dentro de las cuales se encuentran enzimas como la Beta-glucanasa, Beta-glucosidasa y celulasa pertenecientes al género Trichoderma entre otros, con el fin de fomentar el aprovechamiento de determinados compuestos el sector de la bioeconomía y la alimentación. Este tipo de invenciones deben cumplir con la normativa y reglamentos de producción concretas como son las especificaciones de identidad, pureza y composición establecidas en al menos una de las siguientes entidades: a) Comité Conjunto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA); b) Código de Sustancias Químicas Alimentarias (Food Chemicals Codex - FCC); o c) EE. UU. Administración de Alimentos y Medicamentos - FDA (DOU, 2022). Sin embargo, aún está en tela de juicio el uso correcto de algunas especies principalmente en la agricultura, ya que muchas están clasificadas de manera errónea. Por ello, se requieren hacer pruebas a profundidad, para de alguna manera pronosticar las propiedades biológicas de ciertas cepas y así tener criterios significativos para la selección de agentes para el control biológico, como promotores del crecimiento y para su uso en la alimentación. Por lo antepuesto, Trichoderma es una opción económica para el manejo de plagas y enfermedades, para mitigar la caída de la producción debido a un factor de estrés y para aumentar los rendimientos en los cultivos sin perjudicar al ambiente, es decir, sostenible. Ya que, de acuerdo con la Academia Nacional de Ciencias de Estados Unidos de América, la producción agrícola (ecológica o convencional) es calificada como sostenible si tiene una cantidad de producción adecuada o en aumento Además de contar con alta calidad en las mercancías, sin injerir la base de riquezas naturales y el ambiente, siendo económicamente factibles contribuyendo al bienestar socioeconómico y agrícola (Reganold y Wachter, 2016).
CONCLUSIONES
La capacidad de Trichoderma es variable y ello depende directamente de la cepa y su capacidad de acción, es decir; al ser un género con un número muy extenso de especies, existen algunos aislamientos que son más eficientes que otros ante algún patógeno o ante una condición de estrés por su variabilidad genética. Los procesos específicos de acción siguen estudiándose en la actualidad para valorar su efectividad. Ya que, a pesar de la frecuente aparición de Trichoderma en la agricultura, la identificación y aplicación de sus metabolitos aún no se han explotado completamente, por lo que la exposición de algunas especies del género fúngico Trichoderma como bioagente de control ante diversos efectos provocados por el cambio climático y la contaminación en el ambiente que repercuten en los suelos agrícolas está aún abierta para la investigación.
Por otra parte, los reportes actuales revelan que Trichoderma podría ser un insumo ECO friendly para contrarrestar algunos efectos negativos causados por la residualidad de productos agrícolas. Además de resaltar que podría ser un factor importante en la generación de productos de calidad que influirán directamente en la nutrición humana, la seguridad alimentaria y la salud, por lo que su uso en los campos agrícolas podría contribuir para el logro de más de tres objetivos de desarrollo sostenible de las naciones unidas. Sin embargo, hoy día la agricultura seguirá siendo dependiente del uso de fertilizantes químicos , donde productos a base de Trichoderma no los sustituyen.
Las exploraciones en campo como en laboratorio demuestran que algunas cepas de Trichoderma pueden controlar los daños causados por factores bióticos y abióticos en las plantas e influyen directamente en el crecimiento y el desarrollo de los cultivos, como también en optimizar la asimilación nutrimental mediante la remediación de la fertilidad del suelo, lo que lleva a un aumento en la producción y rendimiento al cultivo que esté asociado. Los mecanismos de Trichoderma que suelen estar implicados principalmente son la estimulación de la RSI y la producción de MS, los cuales pueden ser hormonas de crecimiento, compuestos antifúngicos o moléculas secuestradoras de minerales.















