INTRODUCCIÓN
Dentro de todos los géneros de la familia Araceae, el Anthurium constituye el más diverso (de Alcantara et al., 2019). Su área de distribución comprende desde México y las Antillas Mayores hasta el norte de Argentina (do Nascimento et al., 2019). Algunas especies incluidas en este género tienen importancia comercial por lo exótico de su follaje y la durabilidad de su inflorescencia (Muraleedharan et al., 2020).
En el comercio de follajes de corte, las especies del género Anthurium han mostrado un gran potencial para el futuro crecimiento de las exportaciones, con una calidad, belleza y durabilidad notables, además de su empleo como planta en maceta (de Morais et al., 2017). Entre las especies más apreciadas por su vistoso follaje se encuentran A. magnificum Linden, A. crystallinum Linden & André, A. forgetii N. E. Brown, A. regale Linden y A. warocqueanum T. Moore, todas incluidas en la sección Cardiolonchium Schott de este género. En la especie A. magnificum el mayor atractivo está en sus limbos de color verde intenso notablemente aterciopelado en el cual resaltan sus venas de color blanco. Además, los tejidos vegetales descelularizados de limbos de esta planta han sido utilizados como andamios adaptables para el cultivo de células humanas (Fontana et al., 2017).
Las especies de Anthurium pueden propagarse a través de semilla botánica, por esquejes y por división de los brotes que emergen del tallo. La propagación a partir de semilla botánica tiene ciertas desventajas debido a que estas solo son viables durante dos o tres días y su porcentaje de germinación es bajo, aproximadamente de 20 a 30% (Jahan et al., 2009). La propagación vegetativa es lenta y propicia la pérdida de individuos por infección por Xanthomonas campestris pv. dieffenbachiae (McCulloch & Pirone) Dye (Lee-Espinosa et al., 2003). No obstante, esto se puede evitar si se seleccionan plantas sanas y se introduce el material de siembra en una solución de funguicida y bactericida previo a su establecimiento (Gayosso-Rodríguez et al., 2013). Estas limitantes convierten al cultivo de tejidos vegetales en el método más eficiente para propagar plantas Anthurium con alta calidad genética y fitosanitaria a un ritmo más rápido que los métodos de propagación tradicionales (Gantait & Mandal, 2010).
El cultivo de tejidos vegetales puede definirse como un conjunto de técnicas que permiten el cultivo en condiciones asépticas de órganos, tejidos, células y protoplastos empleando medios nutritivos artificilaes (Jiménez, 1998). Estas técnicas se sustentan en la teoría de la Totipotencia Celular, propuesta por Haberlandt (1902), la cual plantea que todas las células vegetales tienen la capacidad de expresar todo el potencial genético de la planta a la que pertenecen sin importar su función o posición en ella, y por lo tanto tienen la capacidad de regenerar una nueva planta completa, es decir, que tienen totipotencialidad. Las técnicas de cultivo in vitro son indispensables para la producción de plantas libres de patógenos, la propagación masiva, la conservación de germoplasma, la transformación del genoma vegetal, el mejoramiento genético mediante la inducción de mutaciones y la selección in vitro y la producción de metabolitos secundarios derivados de plantas de importante valor comercial (Twaij et al., 2020). La organogénesis y la embriogénesis somática, son vías de regeneración de plantas bien conocidas basadas en la totipotencia de las células vegetales (Neves et al., 2021).
Las especies del género Anthurium se han propagado principalmente a través de organogénesis directa (Kunisaki, 1980; Atta-Alla et al., 1998; Martin et al., 2003; Martínez-Estrada et al., 2019; Tung et al., 2022), organogénesis indirecta (Pierik et al., 1974; Atak & Çelik, 2009; Thi et al., 2019; Huang et al., 2020; Hernández-Perez et al., 2021) y embriogénesis somática (Kuehnle et al., 1992; del Rivero et al., 2008; Bezerra et al., 2019; Wang et al., 2019; Bandyopadhyay et al., 2022).
En el cultivo de células y tejidos vegetales el nitrato de plata (AgNO3) actúa como un modulador de la morfogénesis y desempeña un papel crucial en la regulación de los procesos fisiológicos esenciales de las plantas (Isah et al., 2022). Los iones de plata aplicados en forma de AgNO3 en los medios de cultivo han sido ampliamente empleados en el cultivo de tejidos vegetales debido a su especificidad, solubilidad en agua y falta de fitotoxicidad en concentraciones efectivas (Kumar et al., 2009); además de ser un inhibidor de la acción del etileno (Bashir et al., 2022).
En la literatura científica son escasos los estudios que abordan el empleo del AgNO3 en el cultivo in vitro de especies del género Anthurium.Cardoso (2019), en estudios realizados en la especie A. andraeanum cultivares ‘Dakota’ y ‘Alabama’ demostró por primera vez que los brotes in vitro de estos cultivares son susceptibles a la acumulación de etileno en los frascos de cultivo. Este mismo autor, observó que los síntomas causados por la acumulación de etileno como son brotes con tallos delgados, disminución del área foliar y formación de callos indeseables en la región basal de los brotes pudieron ser revertidos cuando se adicionó 1,0 mg L-1 de AgNO3 en el medio de cultivo. En otras especies ornamentales como Zinnia angustifolia Kunth (Asteraceae), Gardenia jasminoides Ellis (Rubiaceae) y Dianthus caryophyllus L. (Caryophyllaceae), el AgNO3 se ha empleado como un inhibidor de la acción del etileno (Anantasaran & Kanchanapoom, 2008; El-Ashry et al., 2018; Maurya et al., 2022).
En la especie A. magnificum no existen referencias en la literatura científica, o no se han publicado investigaciones relacionadas con el efecto de diferentes concentraciones de AgNO3 en el crecimiento in vitro de brotes. Este trabajo tuvo como objetivo determinar el efecto de diferentes concentraciones de AgNO3 en el crecimiento in vitro de brotes de A. magnificum.
MATERIALES Y MÉTODOS
La presente investigación se realizó en el Instituto de Biotecnología de las Plantas (IBP), de la Universidad Central “Marta Abreu” de Las Villas en Santa Clara, Cuba.
Procedimientos generales
Para el experimento se emplearon frascos de cultivo con una capacidad de 250 mL. El pH del medio de cultivo fue ajustado a 5,8 con soluciones de hidróxido de sodio (NaOH) (0,1 N) y ácido clorhídrico (HCl) (0,1 N) antes de su esterilización en autoclave, a 1,2 kg cm-2 de presión y 121 oC, durante 20 minutos. Se añadieron 30 mL de medio de cultivo en cada frasco de cultivo.
Material vegetal
Como material vegetal se emplearon brotes in vitro de A. magnificum de 1,2 a 1,5 cm de longitud. Estos brotes se obtuvieron por organogénesis indirecta según la metodología descrita por Hernández-Perez et al. (2021). Los brotes fueron transferidos al medio de cultivo propuesto por Cardoso (2019) modificado para el crecimiento de brotes de A. andraeanum. El mismo estaba compuesto por las sales MS (Murashige & Skoog, 1962) (Duchefa Biochemie, Países Bajos) a la mitad de su concentración, vitaminas MS a la mitad de su concentración, 100,0 mg L-1 de mioinositol, 30 g L-1 de sacarosa y 2,5 g L-1 de Gelrite® (Duchefa Biochemie, Países Bajos). Se estudiaron diferentes concentraciones de AgNO3 (1,0; 2,0 y 3,0 mg L-1) y un tratamiento control sin AgNO3.
A los 60 días de cultivo se evaluaron las siguientes variables:
- Altura de la planta (cm): Se midió con una regla graduada desde la base de la planta hasta la yema apical.
- Número de hojas de la planta
- Número de raíces
- Longitud de raíces (cm): Se midió con una regla graduada.
- Área foliar de la planta (cm2)
Para calcular el área foliar se utilizó el método del trazado sobre papel descrito por Ruck & Bolas (1955). Para ello se tomaron 20 plantas por tratamiento y se trazó sobre papel el contorno de todos los limbos de la planta. Posteriormente se recortaron los contornos de las figuras de los limbos dibujadas en papel y se pesaron en una balanza electrónica. A continuación, se recortó un pedazo de papel cuadrado de 100 cm2 del mismo tipo utilizado para dibujar el contorno de los limbos de las plantas y se determinó el peso. El cálculo del área foliar total se realizó mediante la fórmula: At= Ac x Pf/ Pc
Donde:
At: Área foliar total de la planta.
Ac: Área de un cuadrado de papel de 100 cm2.
Pf: Peso de todas las figuras o siluetas de papel recortadas.
Pc: Peso del cuadrado de papel de 100 cm2.
Condiciones de cultivo in vitro
El material vegetal se colocó en una cámara de crecimiento con luz solar con una duración del período luminoso máximo y mínimo de 12 h, 34 min y 11 h, 36 min y 27±2 ºC. El flujo de fotones fotosintéticos (FFF) osciló entre 38,0-45,7 µmol.m-2.s-1, medido con un Luxómetro Extech 401025 (Extech Instruments, EUA).
Diseño experimental y análisis estadístico
Se utilizó un diseño experimental completamente al azar. Se colocaron cinco explantes en cada frasco de cultivo. Cada tratamiento estuvo compuesto por diez frascos de cultivo, para un total de 50 explantes. El experimento se repitió dos veces en el tiempo.
Para el análisis estadístico de los datos experimentales se utilizó el programa Statistical Package for the Social Sciences (SPSS) versión 26 para Windows, con un valor de significancia de p≤0,05. Los datos experimentales relacionados con altura de la planta, número de raíces y longitud de raíces, se procesaron estadísticamente mediante las pruebas no paramétricas H de Kruskall-Wallis y U de Mann-Whitney previa comprobación de los supuestos de normalidad y homogeneidad de varianza. Para el análisis estadístico de los datos de la variable área foliar de la planta se aplicó un ANOVA de clasificación simple y para determinar el grado de significación entre las medias se empleó la prueba de Tukey.
RESULTADOS Y DISCUSIÓN
Se determinó que el AgNO3 influyó en el crecimiento in vitro de brotes de A. magnificum. Los mejores resultados en la variable altura promedio de las plantas se obtuvo en el control y cuando se le adicionó al medio de cultivo 1,0 mg L-1 de AgNO3 sin diferencias significativas entre estos, pero superiores al resto de los tratamientos. Con esta misma concentración se obtuvieron los mayores valores en las variables número de raíces por planta y longitud promedio de la raíz que mostraron diferencias significativas con respecto al control y al resto de las concentraciones de AgNO3 empleadas. También se determinó que cuando se empleó la concentración más alta de AgNO3 en este estudio (3,0 mg L-1) se obtuvieron los menores valores en estas variables (Tabla 1 y Figura 1), al parecer por producirse un efecto inhibitorio bajo esta concentración.
Tabla 1 Efecto de la concentración de AgNO3 en el medio de cultivo sobre el crecimiento de las plantas in vitro de Anthurium magnificum Linden a los 60 días de cultivo.
| AgNO3 (mg L-1) | Número de raíces/ planta | Longitud promedio de la raíz (cm) | Altura promedio de las plantas (cm) | |||
|---|---|---|---|---|---|---|
| Media | Rango medio | Media | Rango medio | Media | Rango medio | |
| 0,0 | 3,18 | 97,96 b | 2,95 | 124,12 b | 2,40 | 119,55 a |
| 1,0 | 3,54 | 128,14 a | 3,16 | 152,13 a | 2,37 | 117,81 a |
| 2,0 | 3,22 | 102,36 b | 2,46 | 70,45 c | 2,25 | 90,43 b |
| 3,0 | 2,88 | 73,54 c | 2,29 | 55,30 c | 2,18 | 74,21 b |
Rangos medios con letras no comunes dentro de la misma columna indican diferencias según las pruebas H de Kruskall Wallis y U de Mann-Whitney para p≤0,05

Figura 1 Plantas in vitro de Anthurium magnificum Linden obtenidas con diferentes concentraciones de AgNO3, a los 60 días. (A) medio de cultivo control, (B) 1,0 mg L-1 de AgNO3, (C) 2,0 mg L-1 de AgNO3, (D) con 3,0 mg L-1 de AgNO3.
En la literatura científica son pocos los estudios que abordan el efecto de la concentración de AgNO3 en el crecimiento de plantas in vitro del género Anthurium. Los resultados obtenidos en esta investigación son similares a los obtenidos anteriormente por Cardoso (2019) en la especie A. andraeanum en los cultivares ‘Dakota’ y ‘Alabama’. Este autor determinó que a medida que aumentó la concentración de AgNO3 en el medio de cultivo disminuyó la altura de las plantas. Por otra parte, este autor determinó que la presencia de AgNO3 en las concentraciones 1,0 y 2,0 mg L-1 AgNO3 estimuló el enraizamiento de los brotes, mientras que cuando se adicionó 3,0 mg L-1 de AgNO3 lo inhibió.
En otras plantas monocotiledóneas, varios autores informaron incrementos en la altura y enraizamiento de las plantas al emplear concentraciones efectivas de AgNO3 (Giridhar et al., 2001; Al-Kaaby et al., 2015; Manokari et al., 2022). Por ejemplo Haque et al. (2015) en cebada (Hordeum vulgare L.) cultivares ‘BARI‐3’ y ‘BARI‐6’ perteneciente a la familia Poaceae obtuvieron el mayor número de raíces por planta cuando adicionaron 3,0 mg L-1 de AgNO3. No obstante cuando emplearon concentraciones superiores disminuyó gradualmente el número de raíces por planta en ambos cultivares. También, Tamini (2015) en Musa acuminata L. obtuvo el mayor número de raíces por planta (21,7) y longitud promedio de la raíz (12,68 cm) cuando adicionó al medio de cultivo 10,0 mg L-1 de AgNO3. Sin embargo, al incrementar la concentración de AgNO3 a 25,0 mg L-1 disminuyeron considerablemente ambas variables. Lo anterior demuestra que la respuesta del material vegetal es altamente dependiente del genotipo, debido a que las concentraciones de AgNO3 que estimulan el crecimiento en determinadas especies pueden inhibirlo en otras.
Por otra parte, no se encontraron diferencias significativas para la variable número promedio de hojas por planta, la cual osciló entre 2,96 y 3,14. No obstante, si se obtuvieron diferencias en la variable área foliar de las plantas. En esta variable los mayores valores se presentaron en los medios de cultivo que contenían AgNO3, sin presentar diferencias entre ellos, pero significativamente superiores al control (Figura 2).
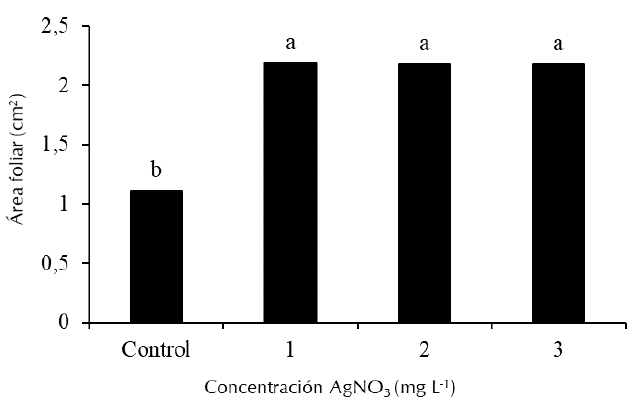
Medias con letras desiguales difieren estadísticamente según la prueba de Tukey para p≤0,05. EE=0,63
Figura 2 Efecto de la concentración de AgNO3 sobre el área foliar de las plantas in vitro de Anthurium magnificum Linden a los 60 días de cultivo.
Las hojas son el sitio de procesos fisiológicos determinantes que ocurren en las plantas, incluyendo la fotosíntesis y la transpiración (Tadesse et al., 2000). Además, el área foliar, el contenido de clorofila y nitrógeno son rasgos funcionales esenciales de la hoja, que están altamente correlacionados con la estrategia de utilización de recursos de la planta (Wang et al., 2020).
En un experimento similar en la especie A. andraeanum, Cardoso (2019) informó que la adición de AgNO3 al medio de cultivo independientemente de su concentración produjo un incremento en el área foliar de las plantas. Este mismo autor determinó en el cultivar ‘Dakota’ el mayor valor en esta variable se obtuvo cuando se adicionó 2,0 mg L-1 de AgNO3 al medio de cultivo, mientras que en el cultivar ‘Alabama’ un aumento en la concentración de AgNO3 de 1,0 a 5,0 mg L-1 incrementa gradualmente el área foliar de las plantas. Por otra parte, Tamini (2015) en Musa acuminata L. logró una mayor área foliar de las plantas (5,92 cm2) cuando adicionó 10,0 mg L-1 de AgNO3 al medio de cultivo. El efecto beneficioso que ejerce el AgNO3 en el área foliar también fue informado por otros autores como Al-Ramadan et al. (2021) y Samiei et al. (2021).
En este estudio, la promoción del crecimiento vegetal cuando se adicionó 1,0 mg L-1 de AgNO3 al medio de cultivo podría atribuirse al efecto inhibidor que ejerce este compuesto sobre la acción del etileno (Tahoori et al., 2018). Es conocido que el etileno acumulado en los frascos de cultivo provoca trastornos fisiológicos durante el cultivo in vitro (Ha et al., 2020). En especies susceptibles, los principales efectos asociados a la acumulación de etileno incluyen la reducción del área foliar, tallos débiles, inhibición de la formación de brotes, senescencia y pobre enraizamiento (Kumar et al., 1998). La biosíntesis de etileno comienza con el aminoácido metionina, que se convierte en etileno a través de tres reacciones enzimáticas. En la primera reacción, la metionina se convierte en S-adenosilmetionina (SAM) por la enzima SAM sintetasa (SAMS), luego la SAM se convierte en 1-aminociclopropano-1-ácido carboxílico (ACC) por la enzima ACC sintasa (ACS), y finalmente la enzima ACC oxidasa (ACO) degrada el ACC, liberando etileno (Wang et al., 2002).
Posteriormente el etileno es percibido por una familia de cinco receptores: ETR1, ETR2, ERS1, ERS2 y EIN4 localizados en la membrana celular y que son homólogos a las histidinas quinasas bacterianas involucradas en la detección de cambios ambientales (Sakai et al., 1998). La unión del etileno a ETR1 ocurre en el grupo radical hidrofóbico ubicado en el extremo N-terminal de los receptores y requiere un metal de transición, el cobre, como cofactor (Schaller & Bleecker, 1995). A su vez la proteína RAN1 participa en la entrega de cobre al receptor de etileno ya que esta vía de entrega de cobre es necesaria para crear receptores de etileno funcionales en las plantas (Wang et al., 2002). Este mecanismo de síntesis de etileno podría inhibirse al adicionar AgNO3 en el medio de cultivo. Esto puede explicarse sobre la base de que los iones de plata pueden remplazar al cofactor cobre presente en el sitio de unión del etileno y el receptor ETR1, y bloquearlo para así suprimir la respuesta al etileno (McDaniel & Binder, 2012).
También la promoción del crecimiento vegetal por la acción indirecta del AgNO3 podría atribuirse a la mejora de la biosíntesis de poliaminas en los explantes mediante la inhibición de la acción del etileno (Kumar et al., 2016). La biosíntesis de poliaminas y la biosíntesis de etileno están interrelacionadas, ya que utilizan el mismo precursor SAM (S-adenilmetionina) para su síntesis (Moshkov et al., 2008). La hipótesis más común es que las poliaminas y el etileno pueden regular la síntesis de cada uno, ya sea directamente o por competencia metabólica por SAM (Apelbaum et al., 1985). Por lo tanto, al compartir el etileno y las poliaminas un precursor común la reducción en la producción de etileno conduce a una mayor formación de poliaminas (Asgher et al., 2018). Las poliaminas están implicadas en varios procesos celulares importantes para las plantas como la división celular, la síntesis de proteínas, la replicación del ADN, regulación de las actividades enzimáticas, la permeabilidad de la membrana, la estabilización de los bucles en las moléculas de ARN y las respuestas de las plantas al estrés abiótico (Pal & Ravishankar, 2002).
CONCLUSIONES
Los resultados de este trabajo demostraron que con una concentración de 1,0 mg L-1 AgNO3 se logró incrementar el número de raíces, longitud de las raíces y altura de las plantas. Además, la adición AgNO3 en el medio de cultivo provocó un aumento en el área foliar de las plantas independientemente de la concentración empleada. Esta investigación constituye la primera referencia en la literatura científica sobre el efecto del AgNO3 en el crecimiento in vitro de brotes de A. magnificum.















