Introducción
Según la European Monitoring Centre for Drugs and Drug Addiction (EMCCDDA) el policonsumo de sustancias psicoactivas es cada vez más habitual. Este observatorio indica que las personas entre los 15 a 34 años, consumen especialmente alcohol y tabaco seguido de cannabis. En población joven, el abuso de alcohol está relacionado con mayor riesgo de consumo de cannabis o cocaína, mientras que la mayoría de consumidores de cannabis no son consumidores de drogas ilícitas (Mounteney et al., 2016). Adicionalmente en la última década, el abuso y dependencia al cannabis se ha incrementado mucho más rápido en comparación con otras drogas (OMS, 2020), con aparición de investigaciones que señalan que su uso prolongado genera deterioro en diferentes dominios del funcionamiento cognitivo (Hart et al., 2010). Sin embargo, el debate de si esta sustancia tiene efectos adversos persistentes sobre la cognición sigue abierto (Tziraki, 2012).
Consumir cannabis es un factor de riesgo asociado a psicosis, especialmente si el inicio es temprano, el consumo es habitual y se cuenta con predisposición genética para desarrollar enfermedad mental (Caspi et al., 2005; Konings et al., 2008). Igualmente, los efectos nocivos sobre la cognición pueden estar relacionados con una vulnerabilidad, aunque transitoria, similar a la observada en trastornos como la esquizofrenia, enfermedad en la cual es frecuente el consumo de cannabis y otras sustancias psicoactivas (Loberg & Hugdahl, 2009; Volkow, 2009). Entre las funciones neuropsicológicas afectadas, se ha observado fallas atencionales y para filtrar información irrelevante, dificultades en la velocidad del procesamiento, fallas en la coordinación motora, dificultades a nivel de percepción y en las habilidades de rastreo (OMS, 2020; Pozo-Hernández et al., 2019), efectos que pueden prolongarse, disminuyendo además el funcionamiento emocional y la capacidad de integrar emociones con recuerdos, experiencias y nuevas impresiones (Hart et al., 2010). Otras investigaciones han reportado deterioro en la flexibilidad cognitiva, la atención y la memoria a corto y a largo plazo, siendo este último el que tiene evidencias más sólidas (Ross et al., 2020).
Cuando el consumo de cannabis inicia en la infancia o la adolescencia, la neurotoxicidad producida por el A-9-tetrahidrocannabinol (A-9-THC) puede verse acelerada, generando alteración en importantes estructuras como la corteza frontal, las áreas temporales, el hipocampo y la amígdala (Tziraki, 2012). Estas alteraciones, están relacionadas con las zonas donde los receptores cannabinoides CB1 tienen mayor expresión, por lo que el A-9-THC puede precipitar alteraciones en las funciones ejecutivas superiores, por ser estas estructuras responsables de los procesos de motivación, aprendizaje, memoria, funcionamiento ejecutivo, actualización, inhibición de respuesta, flexibilidad y toma de decisiones (Volkow et al., 2016). Adicionalmente, la corteza frontal continúa su maduración hasta los 21 años de edad, por lo que el inicio temprano del consumo podría causar alteraciones severas en dicha estructura (Verdejo-García, 2011), siendo los niños y adolescentes la población más vulnerable para estos efectos (Volkow et al., 2016). Por otra parte, los déficits en la activación de áreas temporales mediales ha demostrado estar relacionada con fallas en la codificación y la evocación en los procesos de memoria (Murray et al., 2017).
Hasta el momento, la evaluación neuropsicológica sigue siendo el método de diagnóstico diferencial más efectivo para discriminar las alteraciones cognitivas, mientras que los métodos neurofisiológicos como el electroencefalograma (EEG) y los potenciales relacionados con eventos (ERP), permite la valoración de las actividades cerebrales que subyacen a la función y disfunción cognitivas (Seidman et al., 2008). En este sentido, la EEG ha permitido identificar alteraciones en los ERP en relación a la disfunción cognitiva derivada del consumo de cannabis. Broyd et al., (2016) describe incluso después de un mes de abstinencia de cannabis, déficits en el ERP mismatch negativity (MMN). El MMN que aparece entre los 150 a 200 milisegundos (ms) posteriores a un estímulo diferente o infrecuente, ha demostrado ser sensible a cambios en las características de un estímulo auditivo que se ha percibido como constante (Garrido et al., 2009). Los déficits en el MMN, dados por la reducción en la amplitud de este ERP, se han observado correlacionados con alteraciones en la memoria sensorial, lo que puede impactar negativamente en la atención y sensopercepción, funciones de importancia en la vida cotidiana (Naatanen et al., 2011).
Otro ERP que ha demostrado ser marcador de las funciones cognitivas es el P300, potencial que aparece 300 ms después del estímulo infrecuente y que ha demostrado estar estrechamente vinculado con los procesos de atención. A este respecto, se ha reportado alteraciones en la amplitud del P300 en consumidores habituales de cannabis durante la ejecución de tareas de reconocimiento de estímulos emocionales (Troup et al., 2016). Algunos investigadores postulan que este ERP se denomina P3b, mientras que otros consideran que constituye más bien la sub-fase del P300, en la cual, la señal del estímulo dirigida por la atención se transmite a estructuras tempo-parietales, como indicador de su relación con procesos de memoria (Polich, 2007). Otros autores reportan un leve deterioro en el procesamiento atencional asociado al aumento en la latencia del P300, en respuesta a las dificultades en la selección eficiente de información de los estímulos relevantes y filtración de material irrelevante (Solowij et al., 1995).
Por otra parte, la P3a parece ser resultado de la respuesta involuntaria de la corteza frontal derivada de un cambio en la memoria de trabajo al detectar un estímulo con características diferentes de otros ya identificados como comunes (Polich, 2007). Aunque la P3a ha sido muy poco estudiada en esta población, investigaciones recientes sobre el complejo MMN/P3a reportan un patrón diferente de expresión neurofisiológica en consumidores de cannabis con psicosis en comparación con pacientes no consumidores, con un aumento en la latencia de la P3a en relación con un tiempo mayor de consumo activo de cannabis y derivado posiblemente del aumento en la latencia del MMN (Pesa et al., 2012).
Hasta el momento, son escasas las investigaciones que evalúan el vínculo entre el MMN y la P3a en relación con dominios cognitivos específicos en la población consumidora de cannabis. El objetivo de este estudio es realizar un análisis comparativo del funcionamiento cognitivo de un grupo de consumidores de cannabis y controles sanos, en relación con los puntajes de pruebas neuropsicológicas y los ERP MMN y P3a, evaluando además su asociación con las características de consumo de cannabis.
Método
Participantes
Se realizó un estudio observacional de corte transversal, con muestreo por conveniencia no probabilístico en bola de nieve, en el cual se incluyeron cuarenta y tres sujetos entre los 18 y los 35 años. El grupo de consumidores exclusivos de cannabis (CN, n=21) estuvo constituido por personas de la Comunidad Cannábica Colombiana con diagnóstico de trastorno por consumo de cannabis según DSM-5, del cual se excluyeron aquellos sin consumo de cannabis en el último mes o con consumo de otras sustancias psicoactivas diferentes al cannabis. Por otro lado, los controles sanos (SN, n=22) fueron voluntarios sin consumo de sustancias psicoactivas reclutados de un sector de la ciudad.
Como criterios de exclusión, se tuvieron en cuenta el antecedente de diagnóstico de trastorno psicótico, trastorno depresivo mayor, trastorno afectivo bipolar, trastorno esquizoafectivo, discapacidad intelectual o trastorno neurocognitivo mayor según criterios DSM-5; agudeza visual uni o bilateral mayor a 20/70 con corrección; antecedente de enfermedad neurológica, trauma craneoencefálico, falla cardiaca hepática o renal, terapia electroconvulsiva o hipoacusia neurosensorial o de conducción y/o antecedente de familiar en primer grado con enfermedad mental; diagnóstico de intoxicación o abstinencia en la evaluación neurológica y consumo de otras sustancias psicoactivas según prueba de detección de drogas en orina.
Procedimientos
Una vez obtenidas las autorizaciones de las instituciones participantes para realizar la investigación, se invitó a participar a consumidores exclusivos de cannabis miembros de la Comunidad Cannábica Colombiana mediante las redes sociales. En un primer contacto telefónico se verificaron los criterios de inclusión/exclusión, se explicaron los objetivos y procedimientos y se agendó la fecha de las evaluaciones. Al inicio de la evaluación se realizó un examen neurológico completo y la verificación toxicológica por prueba de detección de drogas en orina. Los instrumentos fueron aplicados en un sitio libre de distracción en una única sesión de 3 horas con un espacio de descanso de 15 minutos entre la aplicación de los instrumentos, el protocolo de evaluación neuropsicológica y la recolección de datos EEG. Durante la aplicación de los instrumentos y la adquisición de los datos electroencefalográficos se salvaguardó la integridad física y emocional de los participantes.
Esta investigación cumplió con todos los estándares éticos para la investigación con seres humanos y contó con la aprobación del Comité de Ética de la institución donde se realizó el estudio.
Instrumentos
Las variables sociodemográficas y clínicas se evaluaron mediante la Entrevista Diagnóstica para Estudios Genéticos (DIGS), traducida y validada en Colombia, la cual permite detectar trastornos mentales con alta confiabilidad prueba-reprueba e inter-evaluador (kappa>0.8) (Palacio et al., 2004).
Para verificar el consumo de sustancias psicoactivas se realizó una prueba para detección cualitativa de drogas en orina («Urine Testing for Drugs of Abuse», 1986). La historia detallada del consumo de sustancias psicoactivas fue obtenido mediante un cuestionario heteroaplicado modificado a partir del instrumento propuesto por el SIDUC (Sistema Interamericano de Datos Uniformes) de la Comisión Interamericana para el Control del Abuso de Drogas de la Organización de Estados Americanos- CICAD/OEA (Observatorio Interamericano de Drogas OAS CICAD, 2011), el cual se complementó con los criterios para trastornos por consumo de sustancias del DSM-5 y el AUDIT (Babor et al., 2001).
Adicionalmente, se aplicó el Inventario de Edimburgo (IE) para evaluar la lateralidad (Zamora et al., 1990) y se realizó un examen neurológico completo. Este último permitió excluir participantes con enfermedad neurológica, intoxicación o abstinencia por cannabis, tabaco o alcohol.
Pruebas neuropsicológicas
Para evaluar el funcionamiento cognitivo, se diseñó un protocolo teniendo en cuenta lo reportado en investigaciones realizadas en consumidores de cannabis, el cual fue aplicado y calificado por un neuropsicólogo clínico. Los instrumentos se aplicaron en el mismo orden en todos los participantes. Este protocolo incluyó la Escala de Inteligencia de Wechsler para adultos IV (WAIS-IV) (Rosas et al., 2014; Wechsler et al., 2014) para evaluar el coeficiente intelectual total (CIT) y las subpruebas del WAIS-IV para obtener los índices comprensión verbal (analogías, vocabulario, comprensión), razonamiento perceptivo (diseño con cubos, matrices de razonamiento, rompecabezas visuales), memoria de trabajo (retención de dígitos, aritmética) y velocidad de procesamiento (búsqueda de símbolos, claves). La subprueba de Stroop, para evaluar la inhibición de respuesta/control inhibitorio y la subprueba de Clasificación de cartas (CCB) para la flexibilidad cognitiva, ambas contenidas en la Batería Neuropsicológica de Funciones Ejecutivas y Lóbulos Frontales (BANFE) (Lázaro et al., 2008). Por último, se incluyeron, la subprueba lista de palabras I y II de la Escala de Memoria de WechslerIII (WMS-III) (Wechsler, 2004) la cual fue aplicada para evaluar la memoria verbal y la prueba de tachado de la A del Test de Ejecución Continua visual (CPT) (Beck et al., 1956) para evaluar la atención sostenida. Para todas las pruebas y subpruebas, los valores crudos agrupados por dominio cognitivo fueron estandarizados según edad y escolaridad usando procedimientos normativos, exceptuando la prueba del tachado de la A del CPT, para la cual se usaron los valores crudos (Miller & Rohling, 2001).
Pruebas neurofisiológicas
El registro de la actividad electroencefalográfica, se obtuvo en un equipo Electrical Geodesic GES300 usando una malla de electrodos de 32 canales de acuerdo con el sistema internacional 10-20 (HydroCel Geodesic Sensor Net), con referencia prefijada al vertex (CZ). El registro se realizó a una frecuencia de muestreo de 250 Hz, con un filtro tipo Notch de 60 Hz y con impedancias menores a 5 kilo-ohmios (kíl).
Para obtener los ERP, se siguió el protocolo de Duncan et al (2009) a partir del cual se diseñó la tarea y el estímulo auditivo. Este estímulo consistió en un paradigma oddball de 1680 eventos con 80% sonidos frecuentes (100 ms de duración, 1000 Hz de frecuencia) y 20% infrecuentes: 10% diferentes en duración (250 ms de duración) y 10% diferentes en frecuencia (1300 Hz de frecuencia), el cual fue presentado mediante auriculares tipo diadema Sony MDR-XD 400, con diferencial de lateralidad e intensidad de 75 dB-SPL. Antes de iniciar la sesión, se indicó al participante enfocar la atención en una película sin sonido sin prestarle atención al estímulo auditivo. La tarea tuvo una duración de 16 minutos y fue implementada en E-Prime 2.0®.
Los registros EEG fueron procesados utilizando el software Matlab 2013b® y las librerías EEGLab (Swartz Center for Computational Neuroscience, University of California, San Diego) y ERPLab (Lopez-Calderon & Luck, 2014). La señal fue filtrada digitalmente con un filtro tipo pasa banda entre 1 y 30 Hz, re-referenciada al promedio (excluyendo los canales oculares EOG1 y EOG2). Se crearon épocas de 500 ms partiendo de 50 ms previos. Se descartaron las épocas con amplitudes mayores a ± 50 microvoltios (uV) y los registros cuyo número de épocas descartadas fue superior al 30%. Las épocas fueron promediadas obteniéndose así el potencial individual. Se generó el potencial de duración (MMNd) al substraer el potencial del estímulo frecuente al estímulo diferente en duración. De la misma manera, se generó el potencial de frecuencia (MMNf) al substraer el potencial del estímulo frecuente al estímulo diferente en frecuencia.
Para detectar en cuáles canales se visualizaron los ERP, se utilizó la librería Mass Univariate ERP Toolbox (Groppe et al., 2011). A partir de este análisis y de las ventanas descritas en los protocolos para MMN y P3 (Duncan et al., 2009; Light et al., 2010), se seleccionaron los electrodos más representativos y la ventana de tiempo para extraer los parámetros del potencial, el cual se realizó por separado para el MMN y el P3a. Así, se definieron las ventanas para el MMNd (200-280 ms) y P3a (300-400 ms) a la condición duración y para el MMNf (160-200 ms) y P3a (200-300 ms) a la condición frecuencia. Los parámetros calculados fueron latencia de la amplitud pico y amplitud promedio.
Análisis de datos
Los datos se analizaron con el paquete estadístico SPSS versión 23. Para responder a los objetivos de la investigación se emplearon estadísticos descriptivos. Se realizaron las comparaciones entre los grupos mediante el test t-student para muestras independientes, U Mann-Whitney para los datos sin distribución normal y la Prueba exacta de Fisher para las variables cualitativas. Se realizaron correlaciones de Spearman para evaluar posibles asociaciones entre los parámetros de los ERP y las variables neuropsicológicas con las características de consumo de cannabis.
El nivel de significancia estadística en todas las comparaciones realizadas se estableció en p< 0.05.
Resultados
De los 21 participantes con trastorno por consumo de cannabis (CN) incluidos en el estudio, 17 fueron hombres y cuatro mujeres, con una edad promedio de 24.9 + DE 4.1 años; 11.8 años de escolaridad + DE 2 años y en su mayoría con lateralidad derecha (95.2%). Por otra parte, de los 22 participantes sanos (SN), 17 fueron hombres y cinco mujeres, con un promedio de edad de 22.7 + DE 4.2 años; escolaridad de 12.2 + DE 2.1 años y el 100% con lateralidad derecha. Para ambos grupos el consumo de alcohol y tabaco fue similar, con un promedio de 4.2 y 2.7 tragos de alcohol por semana, y 1 y 1.36 cigarrillos de tabaco día respectivamente. En cuanto a las características de consumo de cannabis, el grupo CN presentó una edad de inicio del consumo de 15.3 + DE 3 años, con un tiempo total de consumo de 9.6 + DE 4.1 años y 14.1 + DE 21.5 cigarrillos de cannabis por semana, para un acumulado de 170 cigarrillos. El tiempo promedio del último consumo de cannabis antes de la aplicación de los instrumentos fue de 10.8 + DE 8.9 horas (Tabla 1).
Tabla 1 Factores sociodemográficos y características de consumo de los participantes

1 Frecuencia absoluta. 2 Desviación estándar. 3 Rango intercuartílico.
En las comparaciones entre ambos grupos, no se encontraron diferencias en sexo, edad, lateralidad, escolaridad, número de tragos de alcohol consumidos por semana y número de cigarrillos de tabaco al día.
Perfil cognitivo: resultados neuropsicológicos y ERP
En relación al perfil neuropsicológico de los participantes, el grupo CN presentó un puntaje más alto en todas las subpruebas del WAIS-IV, incluido los índices de comprensión verbal, razonamiento perceptual, memoria de trabajo, velocidad de procesamiento y capacidad intelectual, la lista de palabras I y II de la WMS-III para los dominios spam-atención, aprendizaje, memoria verbal a largo plazo y porcentaje de retención, y el tiempo en la subprueba de Stroop parte A y B. Por otra parte, este mismo grupo obtuvo un menor puntaje para reconocimiento en la lista de palabras II y en los aciertos, perseveraciones y error de mantenimiento en la subprueba de Clasificación de cartas. Sin embargo, estas diferencias fueron significativas únicamente para la subprueba lista de palabras IA de la WMS-III, en la cual el grupo CN puntuó más alto que los controles sanos (p=<0.028) y la Subprueba de Stroop parte A, en la cual este mismo grupo requirió más tiempo (p=0.032) (Tabla 2).
Tabla 2 Diferencias en el funcionamiento neuropsicológico entre los participantes: Media (DE), mediana (RIC), valorp e IC95% entre los grupos

* Correlación significativa al nivel p <0.05 (dos colas)
1 Escala de Inteligencia de Wechsler para adultos IV puntuación compuesta. 2 WAIS PC índice comprensión verbal. 3 WAIS PC índice razonamiento perceptual. 4 WAIS PC índice memoria de trabajo. 5 WAIS PC índice velocidad de procesamiento. 6 WAIS PC índice capacidad intelectual total. 7 Escala de Memoria de Wechsler-III. 8 WMS lista de palabras IA. 9 WMS lista de palabras II. 10 Prueba de tachado de la A del Test de Ejecución Continua visual. 11 Subprueba de Clasificación de Cartas de la BANFE. 12 Subprueba de Stroop de la BANFE parte A. 13 Subprueba de Stroop de la BANFE parte B.
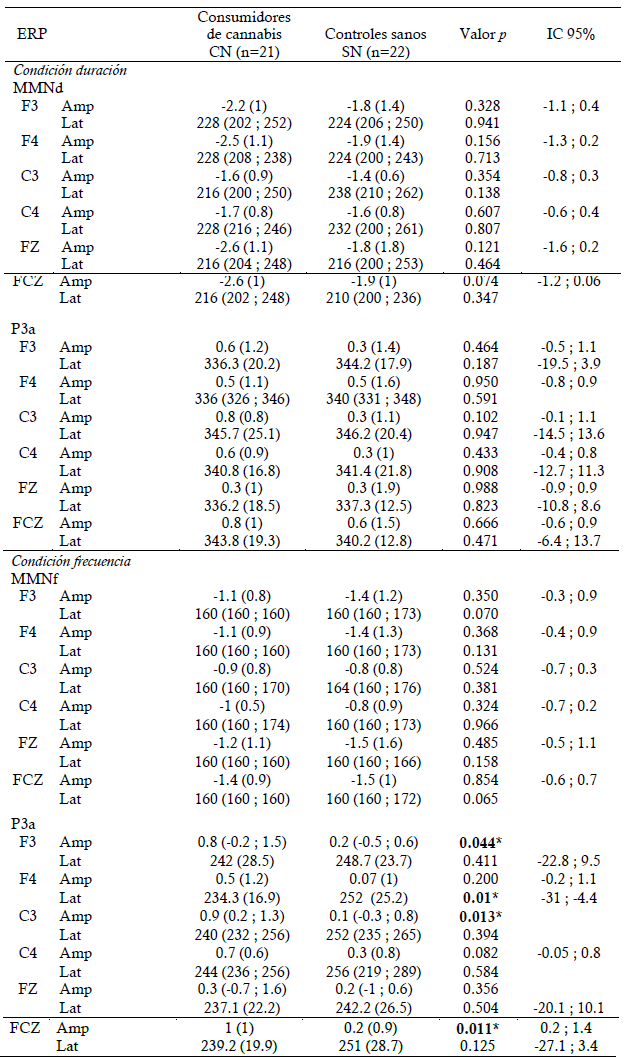
En cuanto a los ERP, para ambos se observó una distribución tipo dipolo alrededor de los electrodos. En el MMN se presentaron valores negativos en los electrodos centro-frontales y positivos en los electrodos occipitales alrededor de los 150 ms, mientras que el potencial P3a presentó valores más positivos en electrodos centrales y negativos en regiones frontales alrededor de los 230 ms. El análisis con la librería Mass Univariate ERP Toolbox indicó que en los canales F3, F4, C3, C4, FZ y FCZ se presentaron potenciales estadísticamente significativos, según lo registrado en la guía de (Duncan et al., 2009), por lo cual se realizaron todos los análisis estadísticos posteriores con el potencial registrado en estos canales.
En las comparaciones entre los grupos, se observaron diferencias en amplitud según la condición del ERP. Para la condición duración, la amplitud del MMNd y P3a fue menor en el grupo de controles sanos en comparación con el grupo de consumidores de cannabis. Para la condición frecuencia, el grupo de controles sanos presentó mayor amplitud del MMNf y menor amplitud de P3a en comparación con el grupo de consumidores de cannabis. Estas diferencias fueron significativas únicamente para la condición frecuencia de P3a, encontrándose reducción en la amplitud en el grupo SN en los electrodos F3 (p=0.044), C3 (p=0.013) y FCZ (p=0.011) y aumento de la latencia en F4 (p=0.01) (Tabla 3). No se encontraron diferencias significativas en la amplitud o latencia de MMNf para la condición frecuencia y amplitud o latencia de MMNd y P3a para la condición duración. En la figura 1 se observa el gran promedio y mapa topográfico de P3a para la condición frecuencia en los electrodos C3 y FCZ.
Tabla 3 Amplitud y latencia de MMN y P3a en consumidores de cannabis y controles sanos: Media (DE), mediana (RIC), valorp e IC95% entre los grupos
* Correlación significativa al nivel p <0.05 (dos colas)
1Event-related potentials. 2 Amplitud (uV). 3 Latencia (ms)
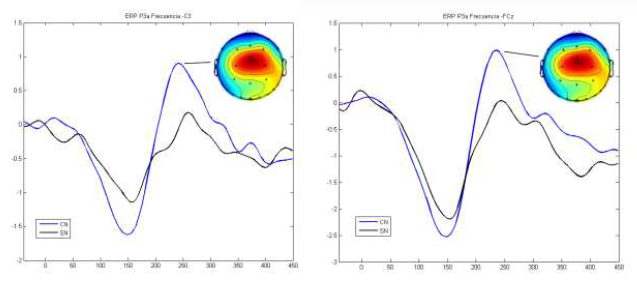
Figura 1 Gran promedio y mapa topográfico de P3a para la condición frecuencia en consumidores de cannabis (CN) y controles sanos (SN) en C3 y FCZ. Valores negativos (colores fríos), valores positivos (colores cálidos)
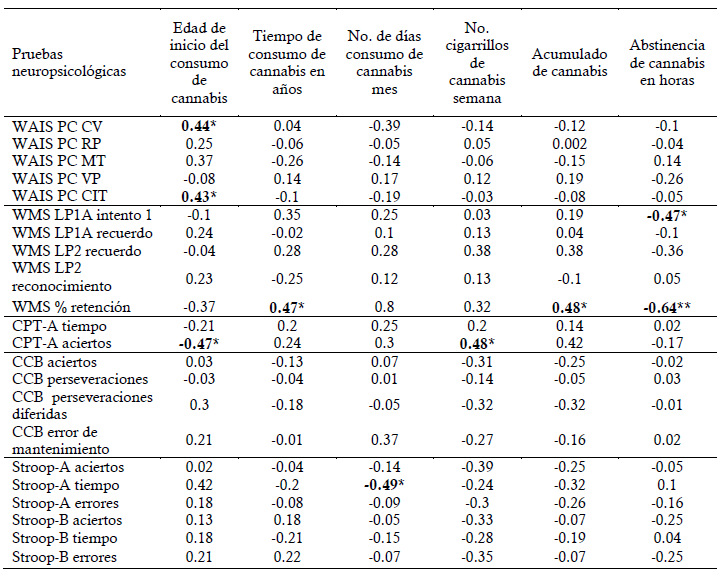
Por otro lado, el porcentaje de retención en la WMS-III se correlacionó positivamente con el tiempo de consumo en años (rho=0.47, p=0.028) y el acumulado de cannabis (rho=0.48, p=0.025), mientras que el tiempo en la subprueba de Stroop parte A se correlacionó negativamente con el número de días de consumo de cannabis al mes (rho= -0.49, p=0.021). Por último, la abstinencia de cannabis en horas presentó correlación negativa con la subprueba lista de palabras IA (rho=-0.47, p=0.03) y el porcentaje de retención de la WMS-III (rho=-0.64, p=0.001). No se observaron correlaciones significativas con la subprueba de Clasificación de cartas CCB y la subprueba de Stroop parte B (Tabla 4).
Tabla 4 Correlaciones entre el perfil neuropsicológico y las características de consumo de cannabis en participantes
* Correlación significativa al nivel p <0.05 (dos colas)
** Correlación significativa al nivelp <0.01 (dos colas)
1 Escala de Inteligencia de Wechsler para adultos IV puntuación compuesta. 2 WAIS PC índice comprensión verbal. 3 WAIS PC índice razonamiento perceptual. 4 WAIS PC índice memoria de trabajo. 5 WAIS PC índice velocidad de procesamiento. 6 WAIS PC índice capacidad intelectual total. 7 Escala de Memoria de Wechsler-III. 8 WMS lista de palabras IA. 9 WMS lista de palabras II. 10 Prueba de tachado de la A del Test de Ejecución Continua visual. 11 Subprueba de Clasificación de Cartas de la BANFE. 12 Subprueba de Stroop de la BANFE parte A. 13 Subprueba de Stroop de la BANFE parte B.
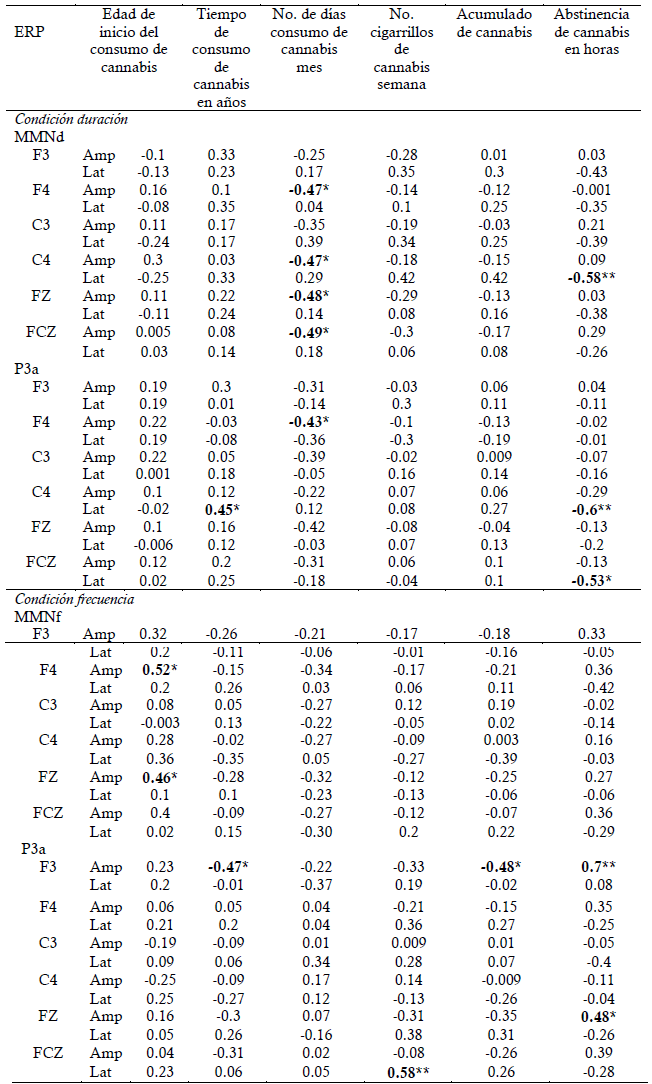
En cuanto a los ERP, se encontraron correlaciones significativas especialmente con la amplitud (Tabla 5). Para la condición duración, el número de días de consumo de cannabis se correlacionó negativamente con la amplitud del MMNd en F4 (rho=-0.47, p=0.028), C4 (rho=-0.47, p=0.03), FZ (rho=-0.48, p=0.025), FCZ (rho=-0.49, p=0.022) y la amplitud del P3a en F4 (rho=-0.43, p=0.049). En esta misma condición, el tiempo de consumo de cannabis en años presentó una correlación positiva con la latencia de P3a en C4 (rho=-0.45, p=0.03), mientras que el tiempo de abstinencia al cannabis se correlacionó negativamente con la latencia del MMNd en C4 (rho=-0.58, p=0.005) y P3a en C4 (rho=-0.6, p=0.004) y FCZ (rho=- 0.53, p=0.013).
Tabla 5 Correlaciones entre la amplitud y latencia de MMN y P3a y las características de consumo de cannabis en los participantes
* Correlación significativa al nivel p <0.05 (dos colas)
** Correlación significativa al nivelp <0.01 (dos colas)
1Event-related potentials. 2 Amplitud (uV). 3 Latencia (ms)
Para la condición frecuencia, la edad de inicio de consumo de cannabis presentó una correlación positiva con la amplitud del MMNf en F4 (rho=0.52, p=0.014) y FZ (rho=0.46, p=0.032). Por otro lado, la amplitud del P3a se correlacionó negativamente con el tiempo de consumo en años (rho=-0.47, p=0.029) y el acumulado de cannabis (rho=-0.48, p=0.027) y positivamente con el tiempo de abstinencia de cannabis en F3 (rho=0.7, p=<0.001) y FZ (rho=0.48, p=0.027). Por su parte, la latencia del P3a en FCZ se correlacionó positivamente con el número de cigarrillos de cannabis por semana (rho=0.58, p=0.005).
Discusión
Lo hallado en este trabajo confirma diferencias en el funcionamiento cognitivo de un grupo de consumidores habituales de cannabis con trastorno por consumo (CN) en comparación con un grupo de controles sanos (SN) y su asociación con variables de consumo de cannabis en los participantes. Dentro de los resultados más relevantes, el grupo CN puntuó más alto en la subprueba lista de palabras IA de la Escala de Memoria de Wechsler WMS-III y requirió mayor tiempo para realizar la subprueba Stroop parte A en comparación con el grupo SN, mientras que el grupo SN presentó una reducción significativa de la amplitud de P3a para la condición frecuencia en F3, C3 y FCZ y aumento de la latencia en F4 en comparación al grupo de consumidores de cannabis.
En relación a los resultados neuropsicológicos mencionados, nuestro estudio corrobora la presencia de alteraciones que no son generalizadas y apuntan más bien hacia alteraciones específicas (Pope et al., 2002), que distan mucho de ser consistentes en los diferentes estudios reportados (Schoeler & Bhattacharyya, 2013; Thames et al., 2014; Theunissen et al., 2012). Si bien nuestro grupo de participantes consumidores de cannabis presentó un puntaje mayor en lista de palabras IA del WMS-III, indicando mejor desempeño en spam-atención, no se observaron diferencias significativas en las otras subpruebas de este mismo instrumento. Por el contrario, otros estudios indican que el consumo crónico de cannabis, se relaciona con alteraciones en los diferentes tipos de procesamiento de la información en condiciones de atención selectiva que coincide con lo reportado por Kempel et al (2003). Por otro lado, que el grupo de consumidores de cannabis necesitara un tiempo mayor para completar la tarea del Stroop parte A, en comparación con los controles sanos, podría ser resultado de la influencia del cannabis en el funcionamiento de áreas fronto-mediales como el cíngulo anterior, indispensables para la discriminación de estímulos conflictivos y la selectividad en las respuestas, resultados que son consistentes con trabajos previos que demuestran que los consumidores de cannabis presentan un peor desempeño en tareas que implican control inhibitorio en relación con personas sin consumo (Gruber & Yurgelun-Todd, 2005; Thames et al., 2014).
Al respecto de las otras pruebas neuropsicológicas aplicadas, los participantes del grupo de consumidores de cannabis fue muy similar al grupo de controles sanos. Nuestra muestra de participantes del grupo CN, contrario a los estudios que reportan un coeficiente intelectual más bajo entre los consumidores de cannabis (Meier et al., 2012; Schreiner & Dunn, 2012), demostró un puntaje de capacidad intelectual total más alto que el grupo SN, aunque la diferencia no fue estadísticamente significativa, hallazgo que coincide con lo reportado por Thames et al (2014). Sin embargo, estos investigadores indican que a pesar del coeficiente intelectual alto, el cual ha demostrado estar asociado con el rendimiento cognitivo (Manly et al., 2002), los consumidores de cannabis no se desempeñaron mejor que los no consumidores en otros dominios cognitivos. Para explicar esto, se ha propuesto que la ausencia de diferencias significativas se debe a que el coeficiente intelectual puede constituirse en un factor protector contra los efectos adversos del cannabis o bien puede ser capaz de enmascarar su impacto en el funcionamiento cognitivo, por lo cual, los efectos adversos del cannabis podrían resultar más pronunciados en individuos con coeficiente intelectual bajo (Thames et al., 2014). Otra posible explicación es que la presencia de cannabidiol (CBD), puede proteger contra algunos déficits de memoria y aprendizaje verbal inducidos por el A-9-THC, principal componente psicoactivo del cannabis (Englund et al., 2013; Morgan et al., 2010, 2013).
En cuanto a los resultados neurofisiológicos, la reducción en la amplitud y aumento de la latencia de la P300 en controles sanos en comparación con los consumidores de cannabis difiere de lo reportado por algunos autores, mientras que otras investigaciones reportan resultados mixtos (Kempel et al., 2003; Skosnik et al., 2008). Esta falta de consistencia se explica porque son pocos los estudios que evalúan el componente P3a en consumidores de cannabis sin trastornos psicóticos (Pesa et al., 2012) y tanto los tiempos de exposición al cannabis en relación con el desarrollo de fenómenos de tolerancia como el paradigma neurofisiológico empleado varían en los diferentes estudios (Hart et al., 2010). En relación con el paradigma solo recientemente este ERP se ha analizado mediante paradigmas oddball pasivos diseñados para el MMN, pues en general la P3a se había obtenido a través de paradigmas oddball activos en los que era requerida la atención activa al estímulo (Hermens et al., 2010; Light et al., 2007). Para intentar aclarar el efecto del cannabis en la P3a, D'Souza et al (2012) realizó un ensayo clínico en sujetos sanos donde se administró A-9-THC endovenoso resultando en la reducción de la amplitud dosis-dependiente sugiriendo que esta sustancia puede interrumpir la orientación automática a un nuevo estímulo sin afectar el procesamiento sensorial atencional temprano. Otro factor que puede explicar la reducción del P3a en los controles sanos es el estrecho margen de edad de los participantes de la presente investigación. Un estudio realizado en Colombia, usando un paradigma oddball activo, demostró la asociación entre la amplitud del P300 en sujetos sanos, más específicamente del componente positivo tardío P3b, y la edad de los participantes (Gutiérrez et al., 2013). Adicionalmente, la mayoría de los estudios obtienen el potencial P3a para la condición duración, por lo que las diferencias en la P3a para la condición frecuencia está menos estudiado (Higuchi et al., 2014; Kaur et al., 2011).
Por el contrario, la reducción de la amplitud del MMN en consumidores de cannabis es un hallazgo mucho más frecuente en la literatura. En esta misma línea, Rentzsch et al (2011), reportaron reducción significativa de la amplitud del MMN para la condición frecuencia en una muestra de usuarios de cannabis en relación con los sujetos de control, mientras que el MMN para la condición duración e intensidad no difirió entre los grupos. Cabe anotar que la reducción de la amplitud del MMN en pacientes con esquizofrenia, ha sido un hallazgo consistente en la literatura, tanto que se ha propuesto como posible biomarcador de esta enfermedad (Umbricht & Krljes, 2005) y que por otra parte, el consumo de cannabis ha demostrado incrementar el riesgo para desarrollar esta enfermedad en individuos vulnerables (Moore et al., 2007), por lo cual es posible que la reducción de la amplitud del MMN reportado en consumidores de cannabis esté reflejando déficits inducidos por el A-9-THC, que hacen parte de la disfunción cognitiva presente en esquizofrenia (Javitt, 2015).
Para destacar, en nuestro estudio se observó reducción en la amplitud del MMN para la condición frecuencia en el grupo de consumidores de cannabis en comparación con los controles sanos, aunque esta diferencia no fue significativa. Adicionalmente, algunos estudios en pacientes con esquizofrenia han reportado reducción de la amplitud de la P3a (Atkinson et al., 2012), por lo cual se ha indicado que podría ser implementada junto al MMN en estudios clínicos multicéntricos para la evaluación y el seguimiento de esta población (Light et al., 2015). Sin embargo, Higuchi et al. (2014) no encontraron diferencias significativas en la amplitud del P3a en pacientes con primer episodio psicótico, esquizofrenia crónica y controles sanos, por lo que este hallazgo no parece específico de esta enfermedad. En cuanto a las correlaciones con las características de consumo de cannabis, es difícil realizar comparaciones con otros estudios, debido a que los estudios que evalúan estos ERP en consumidores de cannabis son escasos. En nuestro estudio, variables como el número de días de consumo de cannabis al mes y el tiempo de abstinencia al cannabis se correlacionaron con la amplitud y latencia para la condición duración de ambos ERP, mientras que para la condición frecuencia, la edad de inicio del consumo, el tiempo de consumo y el tiempo de abstinencia se correlacionaron con la amplitud. Por su lado Rentzsch et al (2011) reporto que aunque la frecuencia de MMN no estuvo correlacionada con las características de consumo de cannabis, la duración de MMN disminuyó con los años de exposición diaria al cannabis.
Por último, se observaron correlaciones significativas entre moderadas y fuertes entre las pruebas neuropsicológicas y algunas características de consumo de cannabis de los participantes. Dentro de estas se destaca la correlación entre el tiempo de abstinencia al cannabis, el tiempo de consumo en años y el acumulado total con el porcentaje de retención en la memoria verbal. En relación a estos resultados, Petker et al (2019), han reportado que el consumo de cannabis afecta el aprendizaje y la memoria de forma dependiente de la dosis, aunque con diferencias individuales significativas, donde si bien los estudios en consumidores pesados de cannabis son menos consistentes, los déficits de aprendizaje y de recuerdo inmediato se informan con mayor frecuencia en los consumidores activos de cannabis (Blest-Hopley et al., 2020). Sin embargo, en nuestros participantes se encontró que entre más tiempo de consumo de cannabis, mayor retención en la memoria verbal, la cual empeora al aumentar el número de horas de abstinencia. Sobre este hallazgo si bien existe consenso en que la intoxicación aguda por cannabis produce déficits cognitivos, los efectos cognitivos residuales del cannabis, es decir, los que persisten después de la intoxicación aguda, aún se debaten, si se mantienen después de un período de abstinencia (Hooper et al., 2014). Lo hallado por nosotros es contrario a lo referido por Schreiner & Dunn (2012), donde los efectos fueron casi imperceptibles después de algunos días o semanas de abstinencia antes de la evaluación.
Con respecto a la edad de inicio en el consumo de cannabis, numerosos estudios en adolescentes y adultos jóvenes han informado asociaciones entre el inicio temprano de cannabis y un rendimiento cognitivo más bajo en tareas que requieren funciones ejecutivas, atención y memoria episódica (Dougherty et al., 2013). Aunque nuestros hallazgos reportan una correlación positiva entre edad de inicio del consumo y los puntajes de comprensión verbal y capacidad intelectual, la relación con el número de aciertos de la prueba CPT-A es negativa, indicando que a menor edad de inicio del consumo mayor puntaje en esta prueba, lo cual puede estar en coherencia con la correlación positiva encontrada entre esta prueba y el número de cigarrillos de cannabis a la semana. Esta falta de consistencia en las relaciones entre estas variables son reportados en otros trabajos (Scott et al., 2017), mientras que otros investigadores han relacionado el consumo continuo de cannabis con el deterioro cognitivo en el coeficiente intelectual, las funciones ejecutivas y la memoria episódica (Tait et al., 2011). Adicionalmente, es importante destacar que aunque el grupo de consumidores de cannabis presentó un mejor desempeño en spam-atención, esta se correlacionó significativamente con el tiempo de abstinencia en horas por lo cual es posible que esta variable desempeñe un efecto de confusión en esta relación.
Dentro de las limitaciones de este estudio, deben considerarse el diseño transversal y el tamaño limitado de la muestra, la cual fue por conveniencia y sin cálculo del diseño de la muestra. Adicionalmente, el tiempo de abstinencia al cannabis fue de mínimo 3 horas, por lo que no se puede descartar que nuestros resultados se deban al tiempo corto de abstinencia de los participantes. Futuros estudios deben emplear un diseño longitudinal, evaluaciones estandarizadas y tener en cuenta tiempos mayores de abstinencia al cannabis (Rabin et al., 2017). Por otra parte, dentro de las limitaciones metodológicas, la referencia prefijada al vertex para la toma de los ERP que usa por defecto el equipo de EEG, hizo descartar los valores registrados en CZ, mientras que el protocolo de Duncan et al (2009) indica en la nariz como referencia. Igualmente, el protocolo neuropsicológico aplicado, aunque su intención fue evaluar las funciones cognitivas de interés, no permite establecer comparaciones con otros estudios, debido a que se usaron los instrumentos neuropsicológicos disponibles en nuestra institución (Marder & Fenton, 2004). Finalmente, en este estudio no fue posible identificar los efectos independientes o sinérgicos del alcohol y el tabaco, aunque la mayoría de los participantes informó el consumo reciente de estas sustancias y el examen neurológico previo a la prueba permitió excluir participantes con intoxicación o síntomas de abstinencia.
De resaltar, los grupos de participantes fueron similares en cuanto características sociodemográficas y consumo de alcohol y tabaco, lo que agrega valor a los hallazgos. También es relevante el control con respecto a variables de confusión, pues son reiterativos los estudios que reportan limitaciones en cuanto a la selección de los participantes que incluyen muestras heterogéneas, con diferencias en factores como la gravedad del consumo, el tiempo de abstinencia, el consumo de otras sustancias y la presencia de trastornos psiquiátricos comórbidos (Gonzalez et al., 2012), sin controlar muy bien la exposición al consumo. Nuestro estudio incluyó autoinforme y pruebas de drogas en orina, para confirmar el consumo de cannabis y descartar consumo concomitante de otras drogas en el momento de la evaluación. Si es de anotar que nuestra prueba de drogas por ser cualitativa, no dio cuenta de los niveles de A-9-THC del participante.
En resumen, a pesar de las limitaciones, nuestros hallazgos sugieren que los consumidores habituales de cannabis presentan mejor desempeño en la memoria verbal que los controles sanos, pero requieren más tiempo para los procesos de inhibición de la respuesta y control inhibitorio, lo cual puede estar relacionado con las diferencias en amplitud y latencia de la P3a para la condición frecuencia, observadas en los participantes. Sobre la base de hallazgos del presente estudio en población colombiana, se sugiere la utilidad de la P3a como posible marcador neurofisiológico en investigación clínica y traslacional de consumidores de cannabis, complementario a la evaluación del funcionamiento cognitivo mediante la aplicación de pruebas neuropsicológicas.
Sin embargo, no es posible descartar que los resultados se deban a características propias de la muestra, como la capacidad intelectual, y otras variables como los tiempos de abstinencia al cannabis.















