Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista U.D.C.A Actualidad & Divulgación Científica
Print version ISSN 0123-4226
rev.udcaactual.divulg.cient. vol.14 no.2 Bogotá Jul./Dec. 2011
CIENCIAS AGROPECUARIAS - Artículo Científico
SEROPREVALENCIA DE LEPTOSPIROSIS CANINA EN UNA COMUNIDAD RURAL DEL MUNICIPIO DE CIÉNAGA DE ORO, CÓRDOBA (COLOMBIA)
SEROPREVALENCE OF CANINE LEPTOSPIROSIS IN A RURAL COMMUNITY IN THE MUNICIPALITY OF CIENAGA DE ORO, CÓRDOBA (COLOMBIA)
Leonardo Álvarez1; Alfonso Calderón2; Virginia Rodríguez3; Germán Arrieta4
1MVZ, M.Sc. Clínica Veterinaria Julio E Cuervo. Docente Facultad de Medicina Veterinaria y Zootecnia. Universidad de Córdoba. Sede Berástegui. Correo electrónico:leofalar@hotmail.com
2MVZ, M.Sc. Instituto de Investigaciones Biológicas del Trópico (IIBT). Docente Facultad de Medicina Veterinaria y Zootecnia. Universidad de Córdoba. Salud Pública y Auditoria en Salud. Corporación Universitaria del Caribe, Sincelejo. Correo electrónico:alcaran1@yahoo.com
3Bacteriologa, M.Sc. IIBT. Docente Facultad de Medicina Veterinaria y Zootecnia. Universidad de Córdoba. Salud Pública y Auditoria en Salud. Corporación Universitaria del Caribe, Sincelejo. Correo electrónico:consuelorr1@yahoo.com
4Microbiólogo M.Sc. Instituto de Investigaciones Biológicas del Trópico (IIBT). Salud Pública y Auditoria en Salud. Corporación Universitaria del Caribe, Sincelejo. Correo electrónico:arrietager@yahoo.com
Rev. U.D.C.A Act. & Div. Cient. 14(2): 75 - 81, 2011
RESUMEN
La leptospirosis representa un problema con implicaciones en salud pública. En los caninos es una enfermedad no siempre diagnosticada, a pesar de su difusión y el rol que desempeñan éstos como reservorios de leptospiras patógenas, convirtiéndose en una importante fuente de infección hacia el humano y otras especies de interés zootécnico. Se hace necesario estudiar la epidemiología de la leptospirosis en la especie canina, para contribuir al diseño de estrategias de prevención y de control. Para determinar la seroprevalencia de Leptospira interrogans y los serovares más frecuentes, se adelantó un estudio epidemiológico transversal que incluyó una muestra de 70, caninos mayores de cuatro meses, existentes en la comunidad rural del corregimiento de Berástegui, municipio de Ciénaga de Oro (Córdoba) y por medio de la aglutinación microscópica (MAT,) implementado con 14 serovares. Se consideró un suero positivo cuando se observó aglutinación del 50%, en una dilución ≥ 1:100. La seroprevalencia de leptospirosis en la población canina fue del 47,14% y la mayor frecuencia fue para los serovares grippotyphosa, con el 37,14%, seguido de icterohaemorrhagiae y pomona, con el 34,29 y 25,71%, respectivamente. Al discriminar la seroprevalencia por el número de serovares, se encontró que el 10,01% de las infecciones ocurrió por un sólo serovar; el 5,72%, por dos; el 4,24%, por tres y el 27,17%, por cuatro o más serovares. Los patrones de coaglutinación más frecuentes fueron icterohaemorrhagiae–grippotyphosa. La mayor seropositividad, se determinó en los machos, por ser este el mayor grupo muestreado en la población canina evaluada. Estos resultados sugieren que la población canina puede ser un posible reservorio de leptospirosis en la zona de estudio; es necesario ejecutar estudios que permitan el aislamiento y la tipificación de los serovares prevalentes en esta región.
Palabras clave: Caninos, leptospirosis, serovares.
SUMMARY
Leptospirosis is a problem with public health implications. In dogs the disease is not always diagnosed, despite its diffusion and the role that the canines have as reservoirs of pathogenic leptospires, becoming an important source of infections for humans and species of zootechnical interest. It is necessary to study the epidemiology of canine leptospirosis in order to design strategies for prevention and control. To determine the seroprevalence of Leptospira interrognas and the most frequent serovars, an advanced cross sectional epidemiological study was carried out. Samples of 70 dogs over four months in the rural community of Berástegui township, municipality of Ciénaga de Oro, Córdoba, were analyzed through MAT with 14 serovars. A serum was considered positive with 50% of agglutination at a dilution ≥ 1:100 Seroprevalence of leptospirosis in the dog population was 47.14% and the highest frequency was for serovar gryppotyphosa with 37.14%, followed by icterohaemorrhagiae and pomona with 34.29% and 25.71% respectively. Seroprevalence, discriminated by the number of serotypes, was found in 10.01% of the infections that occurred by a single serovar, 5.72% for two, 4.24% for three and 27.17% for four or more serovars. A most frequent coagglutination pattern was grippotyphosa-icterohaemorrhagiae. The highest seroprevalences was found in males since it was the largest group in the canine population tested. These results suggest that the canine population may be a possible reservoir of leptospirosis in the studied area. It is necessary to conduct studies that permit the isolation and characterization of the serovars prevalent in this region.
Key words: Canine, leptospirosis, serovars.
INTRODUCCIÓN
La leptospirosis es producida por especies patógenas del género Leptospira, microorganismos aeróbicos obligadas, flexibles muy finas, helicoidalmente enrolladas y de gran movilidad, que pueden medir de 0,1µm de diámetro y 5 – 24µm de largo por 0,1 a 0,5µm de ancho; viven en asociación con hospederos animales (Faine et al. 1999). Las leptospiras patógenas, se clasificaron dentro de la especie Leptospira interrogans y los serovares de vida libre (apatógenos) se incluyeron en la especie Leptospira biflexa (McDonough, 2001). La leptospirosis es una antropozoonosis reemergente de distribución mundial (Levett, 2004; Batista et al. 2004), y afecta a una amplia variedad de mamíferos domésticos y silvestres, tanto en zonas urbanas como rurales (Faine et al. 1999; Adler & de la Pena Moctezuma, 2010).
Los caninos pueden sufrir la enfermedad o ser reservorios y fuente de infección para los humanos, por la eliminación del agente etiológico en la orina (leptospiruria) y su estrecho contacto, siendo un factor de riesgo importante para el mantenimiento de la enfermedad. El contacto directo es la vía más importante de transmisión entre los caninos, bien sea por la aspersión de gotas de orina cuando ellos marcan su territorio o al lamer los genitales de sus congéneres (Faine et al. 1999; Murhekar et al. 1998; Luna et al. 2008).
Se define como un animal portador, aquel que mantiene las leptospiras viables y con capacidad de multiplicarse en sus riñones, excretándolas intermitentemente por la orina (Céspedes, 2005). Esta condición se puede presentar en los caninos durante años, presentando enfermedad clínica con presencia de falla renal o, en forma subclínica, convirtiéndose en fuente de infección para humanos y otros animales (Blazius et al. 2005).
Los serovares más importantes que actúan como agente etiológico de leptospirosis canina son canicola y icterohaemorrhagiae (Jouglard & Brod, 2000; Blazius et al. 2005; Jiménez et al. 2008). El canino, se puede convertir en reservorio principal (McDonough, 2001), ya que el agente se aloja en los riñones, pudiéndose excretar por largos períodos y convirtiéndose en un riesgo de infección, tanto para humanos como para otros animales domésticos (Moore et al. 2006; Blazius et al. 2005; Fontaine, 2006). La leptospirosis en los caninos varía dependiendo de la edad, de la respuesta inmune y del serovar implicado, entre otros factores (Faine et al. 1999). Debido a las manifestaciones clínicas es conveniente describir la sinología producida por el serovar, canicola no icterogénica e icterohemorragiae, que es icterogénica (Luna et al. 2008).
La enfermedad por el serovar canicola produce anorexia, polidipsia, emesis, deshidratación, miositis, dolor sublumbar, paresia del tren posterior, inflamación muscular, meníngea, estupor, somnolencia, caquexia fiebre o hipotermia progresiva y daño renal, como nefritis, nefrosis o esclerosis renal. La serovariedad icterohemorragiae origina un cuadro ictérico grave, aumento transitorio de la temperatura corporal, anorexia, polidipsia, emesis, deshidratación, hemorragias petequiales o equimóticas en conjuntiva y cavidad oral, ulceras, halitosis oral, dolor abdominal con constipación inicial, mucorrea o mixorrea, melena, trastornos respiratorios, rara vez se torna crónica y la muerte se presenta a los 4 ó 5 días de iniciados los signos; esta serovariedad afecta el hígado, produciendo acumulación de pigmentos biliares en los canalículos y ductos hepáticos y el grado de ictericia está relacionado con el nivel de obstrucción (Hartman, 1984; Birnbaum et al. 1998; Harkin et al. 2003).
En Norteamérica la leptospirosis canina es producida por los serovares pomona, grippotyphosa y bratislava; la signología clínica de los serovares pomona, grippotyphosa y bratislava son menos intensos que los descritos anteriormente (Faine et al. 1999).
La trasmisión hacia los humanos, se produce por contacto directo con orina, con sangre o con órganos de animales contaminados o, indirectamente, por exposición con el ambiente con leptospiras, como suelos anegadizos y aguas (Adagio et al. 2000). En el hombre, se puede manifestar como una enfermedad inaparente e inespecífica y evolucionar hasta una forma fatal, como una falla respiratoria (Seijo et al. 2002) o daño miocárdico grave (Velasco et al. 2009).
El objetivo fue determinar la seropositividad a diferentes serovares de L. interrogans en caninos, del corregimiento de Berástegui, en el municipio de Ciénaga de Oro (Córdoba, Colombia).
MATERIALES Y MÉTODOS
Mediante un muestreo de conveniencia (Martin et al. 1997) empleando un estudio epidemiológico transversal, sin importar sexo, raza, ni condiciones socio-económicas de sus propietarios, se tomó una población de 70 caninos, mayores de cuatro meses, existentes en la zona urbana del corregimiento de Berástegui, que asistieron a una jornada de vacunación contra rabia, realizada en marzo de 2010. A cada persona responsable o propietario de la mascota, se le realizó una encuesta en la que se consignaron datos como: edad, sexo, raza y antecedentes de vacunación y otras enfermedades infecciosas de los caninos.
El corregimiento de Berástegui esta localizado en el municipio de Ciénaga de Oro, situado a 8° 45' de latitud norte y 75° 53' de longitud oeste del meridiano de Greenwich, ubicado en el valle medio del río Sinú, microrregión sabanas de Córdoba y Sucre, con una altitud de 18 msnm y donde predomina el clima sub-húmedo tropical, con una humedad relativa promedia del 75% y la temperatura promedio es de 28°C (Santana, 1999; Pulido et al. 2002).
Las muestras de sangre, se tomaron por punción de la vena cefálica o yugular, obteniendo 5mL en tubos estériles al vacío sin anticoagulante, previamente rotulados. Se transportaron en refrigeración al Instituto de Investigaciones Biológicas del Trópico (IIBT), de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de Córdoba, donde el suero se obtuvo por centrifugación a 3.500 rpm, durante 5 minutos; una vez obtenidos fueron almacenados en tubos eppendorf y congelados a -70°C, para su procesamiento.
Se realizó el diagnóstico, mediante la prueba serológica de aglutinación microscópica (MAT), de acuerdo a las especificaciones del manual de la Sociedad Internacional de Leptospirosis (ILS, 2003); esta prueba aumenta su confiabilidad en cuanto a más serovares de referencia se utilicen en la reacción. Los sueros, se enfrentaron a una batería de 14 antígenos vivos de serovares de Leptospira grippotyphosa, icterohaemorragiae, pomona, bataviae, hardjobovis, mini, canicola, copenhageni, autumnalis, hardjoprajitmo, australis, tarassovi, zanoni y bratislava. Se consideró como seropositivos a L. interrogans, los sueros que presentaron aglutinación igual o superior al 50% de leptospira en una dilución ≥1:100 para uno o más serovares (Faine et al. 1999).
Los datos, se tabularon en una tabla de excel y por medio del programa estadístico SAS versión 8.0, se realizó un análisis estadístico descriptivo para las frecuencias y mediante la prueba de t student, se compararon la seropositividad por sexo, por raza, entre otras características.
El estudio contó con la aprobación del Comité de Ética del IIBT, de la Facultad de Medicina Veterinaria y Zootecnia y fue realizado de acuerdo con las normas éticas, determinadas por la ley 84 de 1989 o Estatuto de Protección Animal de la República de Colombia (Congreso de Colombia, 1989).
RESULTADOS Y DISCUSIÓN
La población, se conformó por 39 (55,7%) caninos machos y 31 (49,3%) hembras; el 12,8% (n=9) fueron caninos menores de un año y el 87,14% (n=61) mayores de un año (tabla 1). Se evidenció que todos los caninos fueron vacunados periódicamente contra la rabia y nunca contra leptospirosis.
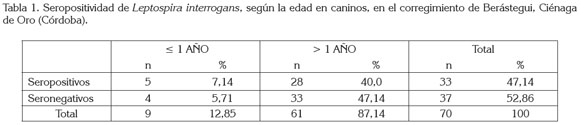
El 47,14% (n=33) de los caninos, se determinaron como seropositivos a leptospirosis; estos títulos corresponderían a exposiciones previas y no a reacciones post-vacunales (Faine et al. 1999), ya que los antecedentes reportados en los anamnésicos no referenciaron vacunación contra la leptospirosis. Esta seropositividad del 47,14% fue mayor a la de estudios previos en la misma zona, como las reportadas por Navarrete et al. (1981), del 27,3%, en caninos urbanos de Montería y Sánchez et al. (2010), del 12%, en caninos de áreas rurales de Montería. Esta mayor seropositividad, se puede explicar por el mayor número de serovares (catorce) empleados en el presente estudio, en comparación con los estudios citados, en los que sólo usaron cuatro serovares; el empleo de una mayor cantidad de antígenos dentro de la batería diagnóstica del MAT, aumenta la probabilidad de identificar un mayor número de seroreactores.
Así mismo, Rodríguez et al. (2004), en la ciudad de Cali, determinaron una seroprevalencia del 41,1%, en caninos callejeros, usando siete serovares, muy similar a la hallada en el presente estudio. Seroprevalencias menores han sido reportados en diferentes regiones de Colombia; por ejemplo, Romero & Sánchez (2009), en las zonas urbanas del Tolima, empleando seis serovares, la seroprevalencia fue del 20,2%; Romero et al. (2009), en caninos de zonas urbanas de Buenaventura, con 18 serovares, la seroprevalencia encontrada fue del 31%; Romero et al. (2010), en caninos de zonas rurales del Tolima, la seroprevalencia determinada fue del 21,4%, empleando seis serovares; Bermúdez et al. 2010 reportaron una seroprevalencia del 67,2%, empelando seis serovares, en caninos de tres barrios marginales de la ciudad de Tunja; esta última seroprevalencia es mayor a la reportada en el presente estudio empleándose seis serovares en el diagnóstico del MAT.
La alta seropositividad determinada en el presente estudio (47,14%), se podría deber al contacto permanente de los caninos con otros animales de interés zootécnico (bovinos y porcinos); a las características geoclimáticas de la región, que facilitan la formación de zonas pantanosas (Santana,1999; Pulido et al. 2002) y que favorecen la sobrevivencia de las leptospiras (McDonough, 2001).
Como se mencionó, las condiciones topográficas de zonas planas inundables favorecen la supervivencia de las leptospiras (Faine et al. 1999; McDonough, 2001; Céspedes et al. 2009), convirtiéndose así, el área del medio y bajo Sinú, en zona potencialmente apta para leptospiras patógenas, como lo propuso Almenteros et al. (2004), quienes determinaron una seroprevalencia del 43% en granjas porcinas de la zona media del Sinú; igualmente, Agudelo et al. (2007), para el Urabá antioqueno, halló una prevalencia de anticuerpos contra Leptospira spp., del 12,5% por inmunofluorescencia indirecta (IFI); región muy similar por las condiciones agroecológicas a la del medio Sinú.
El serovar que presentó la mayor frecuencia fue grippotyphosa, con el 37,14% (n=26) fue seguido de icterohaemorrhagiae, con el 34,29% (n=24), pomona, con el 25,71% (n=18), bataviae, con el 21,43% (n=15) y hardjobovis, con el 20% (tabla 2). De los estudios reportados en Colombia sobre leptospirosis en caninos, los serovares más prevalentes han sido: icterohaemorrhagiae, canicola, grippotyphosa, pomona, hardjobovis y hardjoprajitmo (Navarrete et al. 1981; Bermúdez et al. 2010; Rodríguez et al. 2004; Romero & Sánchez, 2009; Pulido et al. 2002; Sánchez et al. 2010 y Romero et al. 2010), respectivamente.
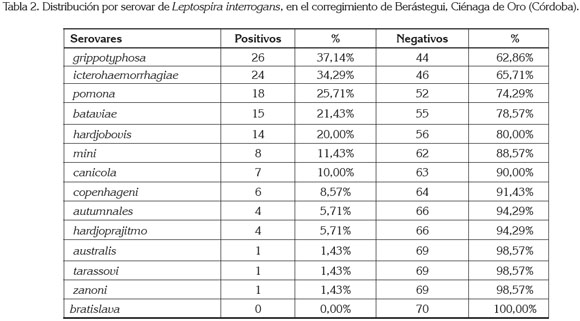
Los serovares grippotyphosa y pomona son propios de los bovinos y porcinos y han sido considerados como reemergentes en la leptospirosis canina (Ribotta et al. 2000). Los caninos son susceptibles a todos los serovares conocidos de Leptospira (Jouglard & Brod, 2000).
El serovar grippotyphosa fue uno de los más seroprevalentes en caninos callejeros de la ciudad Cali, con el 47,7% (Rodríguez et al. 2004) y en caninos de las zonas urbanas y rurales del Tolima (Romero et al. 2010). Este serovar ha sido asociado a ratas y a roedores (McDonough, 2001). A diferencia con Romero et al. (2010), donde los serovares icterohaemorrhagiae y canicola fueron menos seroprevalentes, debido, posiblemente, a la continua vacunación de poblaciones de caninos en zonas urbanas y rurales del Tolima; en el presente estudio, no existe evidencia de vacunación contra esta enfermedad y es común ver vagar a los caninos por áreas rurales, donde comparten con otros. Estudios en caninos que incluyan los serovares mini, copenhageni y zanoni, no habían sido reportados en Colombia.
Meeyam et al. (2006) determinaron que el serovar bataviae fue el más seroreactivo y los serovares mini y sejroe, como el menos seroreactivo en Tailandia. En el actual estudio para el serovar mini, se halló una seropositividad del 11,43%. De los catorce serovares empleados en el MAT, sólo el serovar bratislava no mostró reacción aglutinante; Sánchez et al. (2010) establecieron una seropositividad del 1%, para este serovar y consideraron que esta seroprevalencia no fue representativa.
Cuando se discriminó la seroprevalencia por el número de serovares, se observó que el 10,01% (n=7) de las infecciones se dio por un sólo serovar; el 5,72% (n=4), por dos serovares; el 4,24% (n=3), tres serovares y el 27,17% (n=19), cuatro o más serovares (tabla 2). El patrón de coaglutinación más frecuente fue icterohaemorrhagiae y grippotyphosa. Este patrón de coaglutinación fue diferente al reportado por Rodríguez et al. (2004), donde hallaron los serovares canicola–grippotyphosa. Estas reacciones cruzadas entre serovares han sido ampliamente reconocidas y se explican por la presencia de antígenos compartidos entre serovares y serogrupos (Levett, 2001).
El 7,14% % (n=5) de los caninos menores de un año y el 40% (n=28) de los mayores de uno fueron seropositivos (tabla 1). La mayor seropositividad correspondió al rango de caninos >1 año; este hallazgo, se puede explicar, ya que este grupo aportó el mayor número de caninos en la población muestreada. Igualmente, la raza no fue un factor importante, puesto que la totalidad de la población evaluada correspondió a caninos mestizos o criollos.
Al comparar los caninos por sexo, se encontró que la seroprevalencia en machos fue del 46,51% y en las hembras del 48,39%, siendo estos dos valores estadísticamente iguales al t-student (P>0.05). A diferencia del presente estudio, Herrer et al. (1958) hallaron una seroprevalencia del 50% en machos y del 35,9% para hembras y concluyó que la mayor seroprevalencia en machos se puede deber a que este grupo fue el que aportó el mayor número de individuos, también al hábito que tienen los caninos de lamer los genitales durante el período de celo, donde es mayor el contacto con la orina.
Estos resultados sugieren que las poblaciones caninas pueden ser un posible reservorio de leptospirosis, siendo necesario adelantar estudios seropidemiológicos, con un mayor número de serovares y tratar de implementar el cultivo bacteriológico, con el fin de tener aislamientos, que permitan identificar las cepas que están circulando entre los caninos y proponer una vacuna que de inmunidad contra todos estos serovares.
Agradecimientos:
Los autores agradecen al proyecto "Aislamiento de cepas de Leptospira spp. en explotaciones porcinas y en aguas asociadas a las porquerizas, en los municipios de Montería, de Cereté y de Ciénaga de Oro", por la financiación. Conflicto de intereses: Este manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que pongan en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ADLER, B.; DE LA PENA MOCTEZUMA, A. 2010. Leptospira and leptospirosis. Vet Microbiol. 140, 287- 296 [ Links ]
2. ADAGIO, L.; D´AMICO, G.; WHEELER, J.T; LATTANZI, D.; HAGGE, M.; HIERRO, J.; SOMOZA, J.; TORIBIO, M.; ÁLVAREZ, E. 2000. Estudio preliminar serológico de Leptospirosis Canina y Humana en la ciudad de General Pico y zona de influencia. Ciencia Veterinaria. 2:5-11. [ Links ]
3. AGUDELO, F.P.; RESTREPO, J.B.N.; ARBOLEDA, N.M. 2007. Situación de la leptospirosis en el Urabá antioqueño colombiano: estudio seroepidemiológico y factores de riesgo en población general urbana. Cad. Saúde Pública. 23(9):2094-2102. [ Links ]
4. ALMENTEROS, C.; ARRIETA, G.; MÁTTAR, S.; BARGUIL, A.; TAMAYO, L.; PADILLA, T.; BEDOYA, Z.; MENDOZA, S.; ESTERETA, F.; DÍAZ, N.; MEDINA, A.; RODRÍGUEZ, A.; DE LA OSSA, M.; PÉREZ, A.; RÍOS, R. 2004. Seroprevalencia de leptospirosis porcina en el departamento de Córdoba. Rev. Col. Cienc. Pec. 17:141-147. [ Links ]
5. BATISTA, C.S.A.; AZEVEDO, S.S.; ALVES, C.J.; VASCONCELLOS, S.A.; MORAIS, Z.M.; CLEMENTINO, I.J.; LIMA, S.F.; NETO, A.J.O. 2004. Soroprevalência de leptospirose em cães errantes da cidade de Patos, Estado da Paraíba, Brasil. Braz. J. Vet. Res. Anim. Sci. 41(2):131-136. [ Links ]
6. BERMÚDEZ, C.S.; PULIDO, M.; ANDRADE, R. 2010. Seroprevalencia de Leptospira spp. en caninos y humanos de tres barrios de Tunja, Colombia. Rev. MVZ Córdona. 15(3)2185-2193. [ Links ]
7. BIRNBAUM, N.; BARR, S.C.; CENTER, S.A.; SCHERMERHORN, T.; RANDOLPH, J.F.; SIMPSON, K.W. 1998. Naturrally acquired leptospirosis in 36 dogs serological and clinicalpathological feactures. J. Small Anim. Pract. 39:231-236. [ Links ]
8. BLAZIUS, R.D.; ROMANO, P.R.; BLAZIUZ, E.M.C.; SILVA, O.S. 2005. Ocorrênce de câes errantes seropositivos para Leptospira spp. na Cidade de Itapema, Santa Catarina, Brasil. Cad. Saúde Pública 21:1952-1956. [ Links ]
9. CÉSPEDES, M. 2005. Leptospirosis: enfermedad zoonótica reemergente. Rev. Perú Med. Exp. Salud Pública. 4:290-307. [ Links ]
10. CÉSPEDES, M.; TAPIA, R.; BALDA, L.; GONZÁLEZ, D.; GLENNY, M.; VINETZ, J.M. 2009. Brote de leptospirosis asociado a la natación en una zona costera, Lima – Perú. Rev. Perú. Med. Exp. Salud Pública 26(4):41-448. [ Links ]
11. CONGRESO DE COLOMBIA. 1989. Estatuto Nacional de Protección Animal. Ley 84 de 1989. Por la cual se adopta el Estatuto Nacional de Protección de los Animales y se crean unas contravenciones y se regula lo referente a su procedimiento y competencia. Disponible desde Internet en: "http://spac-05.tripod. com/id24.html (con acceso 03/03/2011). [ Links ]
12. F AINE, S.; ADLER, B.; BOLIN, C.; PEROLAT, P. 1999. Leptospira and Leptospirosis. 2nd ed. Med. Sci. Melbourne (Australia). 272p. [ Links ]
13. F ONTAINE, G.A. 2006. Canine leptospirosis - do we have a problem? fuente de agua subterránea en una zona costera, Lima, Perú. Rev. Peru Med. Exp. Salud Pública. 26(4):441-48. [ Links ]
14. HARTMAN, E.G. 1984. Epidemiological aspects of canine leptopspirosis in the Netherlands. Zentralbl. Bakteriol. Mikrobiol. Hyg. A. 258(2-3):350-359. [ Links ]
15. HARKIN, K.R.; ROSHTO Y.M.; SULLIVAN, J.T. 2003. Clinical application of a polymerase chain reaction assay for diagnosis of leptospirosis in dogs. J. Am. Vet. Med. Assoc. 222(9):1224-1229. [ Links ]
16. HERRER, A.; LICERAS, J.; MENESES, O. 1958. Leptospirosis en el Perú. Identificación de las cepas de Leptospira presentes en el perro y el gato e incidencias de la infección. Rev. Méd. Exp. 12:65-86. [ Links ]
17. INTERNACIONAL LEPTOSPIROSIS SOCIETY ILS. 2003. Human leptospirosis guidance for diagnosis surveillance and control. World health organization. Malta. 109p. [ Links ]
18. JIMÉNEZ-COELLO, M.; VADO-SOLIS, I.; CÁRDENASMARRUFO, M.F.; RODRÍGUEZ-BUENFIL, J.C.; ORTEGA-PACHECO, A. 2008. Serological survey of canine leptospirosis in the tropics of Yucatan Mexico using two different tests. Acta Trop. 106:22-26. [ Links ]
19. JOUGLARD, S.D.D.; BROD, C.S. 2000. Leptospirosis en câes prevalence e factores de risco no meio rural do municipio de Pelotas, RS. Arq. Inst. Biol S. Sâo Paulo. 67(2):181-185. [ Links ]
20. LEVETT, P.N. 2004. Leptospirosis: A forgotten zoonosis? Clin Microbiol Rev. 4:435-448. [ Links ]
21. LEVETT, P.N. 2001. Leptospirosis. Clinical Microbiology Review (USA). 14(2):296-326. [ Links ]
22. LUNA, A.M.A.; MOLES, C.L.P.; GAVALDÓN, R.D.; NAVA, V.C.; SALAZAR, G.F. 2008. Leptospirosis canina y su problemática en México. Rev. Salud Anim. 30(1):1-11. [ Links ]
23. MARTIN, S.W.; MEEK, A.H.; WILLEBERG, P. 1997. Epidemiología veterinaria. Principios y métodos. Ed. Acribia. Zaragoza (España). p.321-370. [ Links ]
24. McDONOUGH, P. 2001. Leptospirosis en caninos - estado actual. Department of Population Medicine and Diagnostic Science, Diagnostic Laboratory, College of Veterinary Medicine, Cornell University, New York (USA). Disponible desde internet en: URL: http://www.ivis.org/ advances/infect_dis_carmichael/mcdonough_es/ivis. pdf(con acceso (27/06/10). [ Links ]
25. MEEYAM, T.; TABLERK, P.; PETCHANOK, B.; PICHPOL, D.; PADUNGTOD, P. 2006. Seroprevalence and risk factors associated with leptospirosis in dogs. Southeast Asian J. Trop. Med. Public Health (Bangkok, Thailand). 37(1):148-153. [ Links ]
26. MOORE, F.E.; GUPTILL, L.F.; GLICKMAN, N.W.; CALDANARO, R.J.; AUCOIN, D.; GLICKMAN, L. 2006. Canine leptospirosis, United States 2002-2004. Emerging Infec. Dis. 3:501-503. [ Links ]
27. MURHEKAR, M.U.; SUGUNON, A.P.; VIJAYACHARI, P.; SHARMAS, S. 1998. Risk factors in the transmission of leptospiral infection. Indian J. Med. Res. 107:218-223. [ Links ]
28. NAVARRETE, M.; SEJIN, R.; VÉLEZ, P. 1981. Estudio preliminar de leptospirosis en caninos en la ciudad de Montería. Revista ICA. 16:165-172. [ Links ]
29. PULIDO, I.; MANDIUS, R.; RIVERO, T.; DUARTE, O. 2002. Atlas de los sistemas de producción bovina. Modulo región Caribe. Plan de modernización tecnológica de la ganadería bovina colombiana. Corpoica. Bogotá [ Links ].
30. RIBOTTA, M.; HIGGINS, R.; GOTTSCHALK, M.; LALLIER, R. 2000. Development of an indirect enzyme-linked inmunoabsorbent assay for the detection of leptospiral antibodies in dogs. J. Vet. Res. Canada. 64:32-37. [ Links ]
31. RODRÍGUEZ, A.L.; FERRO, B.E.; VARONA, M.X. 2004. Santafé M. Evidencia de exposición a Leptospira en perros callejeros de Cali. Biomédica. 24: 291-295. [ Links ]
32. ROMERO, P.M.; SÁNCHEZ, V.J. 2009. Seroprevalencia de la leptospirosis canina de tres municipios del departamento del Tolima, Colombia. Rev. MVZ Córdoba. 14:1684-1689. [ Links ]
33. ROMERO, P.M.; SÁNCHEZ, V.J.; HAYEK, L. 2010. Prevalencia de anticuerpos contra leptospira en población urbana y canina del departamento del Tolima. Rev. Salud Pública. 12(2):268-275. [ Links ]
34. ROMERO, P.M.H.; HERNÁNDEZ, M.A.; QUINTERO, M.M.C. 2009. Seroprevalencia y serotipificación de leptospirosis canina en el municipio de Buenaventura (Valle del Cauca). Biosalud 8:71-76. [ Links ]
35. SÁNCHEZ, G.A.E.; BALLUT, P.J.C.; CALDERÓN, R.A.; RODRÍGUEZ, R.V.C. 2010. Seroprevalencia de Leptospira spp. en caninos de la zona rural de Montería (Córdoba). Orinoquia. 14(2):160-167. [ Links ]
36. SANTANA, V.J. 1999. Diccionario Cultural de Córdoba. Segunda edición. Domus Libri. Bogotá (Colombia). p.285-291. [ Links ]
37. SEIJO, A.; COTO, H.; SAN JUAN, J.; VIDELA, J.; DEODATO, B.; CERNIGOI, B.; GARCIA, M.O.; COLLIA, O.; DE BASSADONI, D.; SCHTIRBU, R.; OLENCHUK, A.; DORTA, D.E.M.; PARMA, A. 2002. Distres respiratorio debido a hemorragia pulmonar por leptospirosis. Medicina (Buenos Aires) 62:135-140. [ Links ]
38. VELASCO, C.O.; RIVAS, S.B.; SORIANO, R.J.; RIVERA, R.H.H. 2009. Daño miocárdico grave por leptospirosis. Informe de un caso fatal en México. Arch. Cardiol. Mex. 79(4):268-273 [ Links ]
Recibido: Febrero 14 de 2011; Aceptado: Octubre 12 de 2011













