Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista U.D.C.A Actualidad & Divulgación Científica
versão impressa ISSN 0123-4226
rev.udcaactual.divulg.cient. vol.17 no.2 Bogotá jul./dez. 2014
CIENCIAS AGROPECUARIAS-Artículo Científico
PREVALENCIA DE Mycoplasma spp., EN FINCAS LECHERAS DEL ALTIPLANO BOYACENSE (COLOMBIA)
PREVALENCE OF Mycoplasma spp., AT MILKING FARMS OF THE HIGH ALTITUDE PLATEAU OF BOYACA (COLOMBIA)
Roy José Andrade-Becerra1, Zonya Caro-Carvajal2, Martin Pulido-Medellín3, Michael López-Cepeda4
1 Profesor Titular. Ph.D. Facultad de Ciencias Agropecuarias. Escuela de Medicina Veterinaria y Zootecnia. Laboratorio de Microbiología Veterinaria. UPTC Tunja, Boyacá Colombia, Grupo de Investigación GIDIMEVETZ, e-mail: royjandrade@yahoo.com
2 Estudiante Escuela Medicina Veterinaria y Zootecnia. UPTC. Grupo de Investigación GIDIMEVETZ, Tunja (Boyacá-Colombia), e-mail: zelizabeth-92@hotmail.com
3 Médico Veterinario Zootecnista. UPTC. Grupo de Investigación GIDIMEVETZ, e-mail: agame_el_coraire@hotmail.com
4 Docente Coordinador Grupo GIDIMEVETZ. Facultad de Ciencias Agropecuarias. Escuela de Medicina Veterinaria y Zootecnia. UPTC, e-mail: mopm1@hotmail.com
Rev. U.D.C.A Act. & Div. Cient 17(2): 461-466, Julio-Diciembre, 2014
RESUMEN
El objetivo del presente trabajo fue el aislamiento de las diferentes bacterias causantes de mastitis, haciendo énfasis en la diferenciación de las especies de Mycoplasmas, de las muestras de leche de tanque y de vacas individuales, procedentes de fincas lecheras del Altiplano Boyacense. Mediante un muestreo probabilístico de conveniencia y por medio de un estudio descriptivo longitudinal retrospectivo, entre 2010 y 2012, se estudiaron 30 fincas, especializadas en la producción de leche, con promedios de 50 animales en lactancia, por finca. Streptococcus agalactiae, se aisló en el 9,1% y se convirtió en el principal patógeno aislado. Staphylococcus aureus fue aislado, en promedio, en el 6,6%. Mycoplasma bovis, no se encontró en ninguna muestra, a través de los tres años. M. californicum, se recuperó a partir de 14 muestras, en los tres años (1,5%); M. alcalescens, de 31 muestras (3%), en los tres años y Acholeplasma spp., se aisló de 19 muestras (1,4%). Este trabajo es el primer reporte de aislamiento de Mycoplasma spp., a partir de muestras de leche en Colombia, en el Altiplano Boyacense.
Palabras clave: Mastitis, Mycoplasmosis, leche, vacas.
SUMMARY
This paper had as objective the isolation of different bacteria, which cause mastitis and, simultaneously, make emphasis on the differentiation of Mycoplasma species, taken from stored milk samples and individual cows. The animals and the milk were provided by farms from the Boyaca's high altitude plateau. The process was carried out through a convenience probabilistic sampling and also a descriptive, longitudinal and retrospective research, during 2010 and 2012. The researches took into account 30 technically managed milking farms, each with approximately 50 milking cows. Streptococcus agalactiae was isolated from 9.1%, being the most detected pathogen. The mean Staphylococcus aureus isolates was of 6.6%. Mycoplasma bovis was not found in any sample during the three year period of the research, while M californicum was recovered from 14 samples (1.5%) during this time lapse and M. alcalescens was detected in 31 samples (3%). Acholeplasma spp. was isolated from 19 samples (1.4%). This research corresponds to first report of Mycoplasma spp. Isolation from milk samples at the Altiplano Boyacense Colombia.
Key words: Mastitis, Mycoplasmosis, milk, cattle.
INTRODUCCIÓN
La mastitis bovina causada por Micoplasmas, se caracteriza por una fase aguda, con participación frecuente de todos los cuartos glandulares, descenso súbito de la producción, tumefacción intensa de la ubre y anormalidades manifiestas de la leche, sin signos evidentes de sintomatología general (Jasper, 2011).
Los Micoplasmas, se han asociado con una amplia gama de enfermedades infecciosas del ganado bovino, por ejemplo, neumonía, artritis, sinovitis y mastitis (González et al. 2003; Hjerpe & Knight, 2002; Langsford, 2007). Los animales de leche de diferentes edades pueden ser portadores asintomáticos de Micoplasmas y varias especies de estos microorganismos son parte de la la microbiota de los tractos respiratorio y urogenital, de estos animales.
La mastitis bovina por Micoplasma, se reportó por primera vez en Inglaterra, en 1960 (Davidson & Stuart, 1960; Stuart et al. 1963), siendo Mycoplasma bovigenitalium el agente etiológico. El primer brote de la enfermedad causada por M. bovis fue reportado en Connecticut, EE.UU., en 1961 (Hale et al. 2002). Más tarde, se informó de una serie de brotes de epizootias, por M. bovis, produciendo mastitis en el estado de Nueva York (Carmichael et al. 2003). Desde entonces, la mastitis por Micoplasmas ha sido diagnosticada en muchas partes del mundo (Jasper, 2011). Este tipo de mastitis podría ser una enfermedad muy devastadora para un hato de vacas lecheras, debido a que: 1) es una enfermedad contagiosa; 2) el tratamiento con antibióticos no es eficaz; 3) los signos clínicos persisten durante períodos de tiempo variables (Boughton, 2009; Jasper, 2011; Bushnell, 2004; González Sears, 2003) y, 4) las vacas con mastitis subclínica crónica, frecuentemente, transmiten la infección a otras vacas y pueden ser portadoras de la enfermedad durante varios meses o años; además, la caída de la producción es brusca (Jasper, 2011; González & Sears, 2003; González et al. 2003).
La producción de leche en el Altiplano Boyacense, se ha incrementado durante los últimos diez años, a una tasa de, aproximadamente, 10% anual, alcanzando un promedio de producción de 1.500.000 de litros de leche diarios, entregada a las industrias lácteas en 2012 (Andrade et al. 2012). Más del 90% de las fincas lecheras ordeñan con máquina y los productores de leche, después del ordeño, desinfectan los pezones, como medida de control de mastitis, en forma rutinaria.
La mastitis bovina es una enfermedad común entre las vacas lecheras y el principal patógeno de mastitis, frecuentemente aislado de vacas con mastitis clínicas y subclínicas en países industrializados, es Staphylococcus aureus, seguido de Streptococcus agalactiae (Osteras & Martin, 2009; Kruze, 2002; León, 2007; Zurita, 2012; Andrade et al. 2012).
Se ha observado en el Altiplano Boyacense que, en los últimos tres años, algunas de las grandes fincas lecheras han estado sufriendo de una alta incidencia de mastitis clínica, que no responden a los tratamientos convencionales con antibióticos (superior al 40%, Andrade et al. 2012), con altos recuentos en leche de células somáticas, caída abrupta del volumen y los resultados son negativos, en los medios de cultivo convencionales; sin embargo, ningún intento ha sido hecho previamente para aislar otros patógenos de mastitis, que los tradicionales.
El presente artículo informa sobre el aislamiento de las diferentes bacterias causantes de mastitis y hace énfasis en la diferenciación de las especies de Micoplasmas de las muestras de leche de tanque y de vacas individuales, procedentes de fincas lecheras del Altiplano Boyacense.
MATERIALES Y MÉTODOS
Tipo de estudio: Mediante un muestreo probabilístico de conveniencia y por medio de un estudio descriptivo longitudinal retrospectivo (Martin & Meek, 2007), entre 2010 y 2012, se estudiaron 30 fincas, especializadas en la producción de leche, con promedios de 50 animales en lactancia por finca, ubicadas entre los 2.300 y los 2.800msnm, con temperaturas anuales promedios de 13°C y pluviosidades entre 800 y 1.200mm/año (IDEAM, 2012). Todas las fincas contaban con ordeño mecánico y dos ordeños por día. La base genética del ganado fue 100% Holstein Friesian y el principal recurso forrajero fue el pasto kikuyo (Pennisetum clandestinum).
Se tomaron 1.349 vacas de leche, en total 5.396 cuartos. La producción de leche promedio estaba en 4.500 l/vaca/año y el número de células somáticas en el tanque de leche en promedio fue de 380.000 cel/mL.
Toma de muestras: A partir de 2010 hasta 2012, se ejecutaron pruebas de California Mastitis Test (CMT). De los cuartos resistentes a los tratamientos con antibióticos y de los cuartos positivos (CMT positivo o positivo fuerte), se tomaron muestras de leche en frascos estériles, previa limpieza y desinfección de la punta del pezón; se siguió el procedimiento descrito por National Mastitis Council y se adaptó en algunas de sus partes (NMC, 2004). Lavado de pezones, secado y desinfección con solución jabonosa; luego, se enjuagó con agua estéril, se secó con gasa estéril y se desinfectó con solución iodada. Una vez finalizada la asepsia, se descartó el primer chorro de leche y se recolectó, en bolsas de plástico nuevas y estériles (Whirl-pak). Las muestras recolectadas fueron mantenidas y transportadas en cavas refrigeradas hasta su llegada al laboratorio, para su análisis. Las muestras no se deben congelar.
Las muestras fueron tomadas por el veterinario y transportadas al Laboratorio de Microbiología de la Universidad Pedagógica y Tecnológica de Colombia, en Tunja. En total, se tomaron 30mL de leche por cuarto. El Laboratorio de Microbiología procede en el diagnóstico rutinario, así como con el aislamiento de gérmenes no comunes, siguiendo la metodología propuesta por el Consejo Nacional de la Mastitis de Estados Unidos (NMC, 2004).
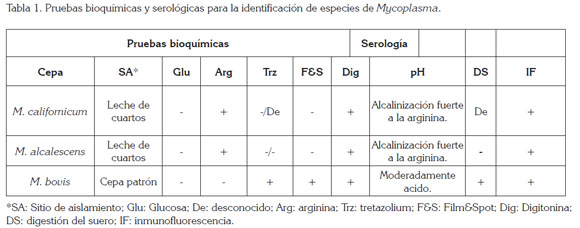
Identificación bacteriana: Para el aislamiento de Mycoplasma de las muestras de leche, se sembró 0.01ml de cada muestra individual, en placas con medio sólido de Hayflick modificado (Freundt, 2003), mediante el empleo de asa de platino. Las placas, se incubaron a 37°C en cámara húmeda, con 10% de CO2, durante 10 días; luego de aislados, se sometieron a sensibilidad a la digitonina, para la diferenciación del género Acholeplasma (Tully, 2012), fermentación de la glucosa (Razin & Cirillo, 2003), hidrólisis de la arginina (Tully, 2012), reducción del tetrazolium (Razin & Cirillo, 2003) y detección de la producción de film & spot (Tully, 2012).
La caracterización inmunológica de microorganismo, se hizo por inmunofluorescencia indirecta (Tabla 1).
Se recolectó, aproximadamente, 15µL de leche, para estudiar las otras bacterias, que fueron sembradas en agar base sangre; sangre de ovino, para determinar tipo de hemolisis y agar Mac Conkey, para identificar Enterobacterias y diferenciar tipo de fermentación e incubadas por 24 a 48 horas. Luego del crecimiento, se realizó coloración de Gram, para su clasificación en Gram-positivas y Gram-negativas, al mismo tiempo, morfología, cocos o bacilos. A los cocos Grampositivos, se les practicó prueba de catalasa y se diferenciaron, como coagulasas positivos y negativos. Posteriormente, se llevó la colonia a un sistema comercial ID32 STAPH, para identificar y confirmar género y especie, así se diferenció Staphylococcus aureus de otros Staphylococcus coagulasa positivo. A los Streptococcus, se les efectuó CAMP, hidrólisis de esculina, hipurato e inulina y crecimiento en NaCl. A los bacilos Gram negativos, se les sometió a las pruebas de oxidasa, indol, triple azúcar, RM-VP, LIA, urea y citrato.
Análisis estadístico: Los datos obtenidos, se registraron en la base de datos, con la ayuda del ordenador dBASE 5.0 y fueron analizados estadísticamente, mediante el programa SPSS para Windows versión 17. Se utilizó estadística descriptiva (Martin & Meek, 2007). Los resultados del análisis estadístico fueron interpretados, con un nivel de confianza del 95%.
RESULTADOS Y DISCUSIÓN
De los cuartos positivos al CMT (California Mastitis Test) fueron aislados 419 microorganismos involucrados en la patogénesis de la mastitis bovina, durante los tres años de estudio (Tabla 2). Mycoplasma bovis, no se encontró en ninguna muestra, durante este periodo. Mycoplasma californicum, se recuperó a partir de 14 muestras, en los tres años (1,5%); Mycoplasma alcalescens, de 31 muestras (3%), en el mismo lapso; en el último año, no se encontró y Acholeplasma spp., de 19 muestras (1,4%), de las 1.226 muestras de leche cruda, de los cuartos de las vacas ordeñadas.
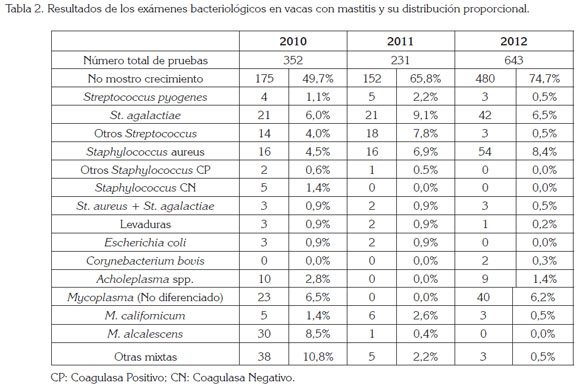
En la tabla 2, se observa cómo a través de los años St. aureus, que es un microorganismo contagioso va creciendo en su incidencia, como causa de mastitis: en el primer año representa un 4,5%, en el segundo, un 6,9% y, en el tercero, un 8,4%, en promedio (6,6%); este valor es bajo comparado con otros países. En Venezuela, estado de Zulia, se halló en el 17% de los casos (Valero et al. 2010); en los países nórdicos, el St. aureus fue aislado entre el 30 y el 40% de los casos subclínicos. En general, en los países industrializados, el St. aureus es el patógeno contagioso más aislado de casos de mastitis en vacas lecheras (Osteras & Martin, 2009).
Los porcentajes de otros Staphylococcus Coagulasa Positivos (diferentes al St. aureus) fueron del 0,6%, para el primer año; el 0,5%, para el segundo y, en el tercero, del 0,0%. En otros estudios en Colombia, en el altiplano cundiboyacense, la prevalencia en un sólo año fue de 4,04% (Calderón & Rodríguez, 2008), valor superior al reportado en este trabajo; en otros trabajos en Colombia, para el Valle de Ubaté (Contreras & Ordóñez, 2004), encontraron el 0,15%, mientras que en Venezuela fue del 23% (Valero et al. 2010).
Para el caso de Streptococcus agalactiae, en el primer año, fue de 6,0%; en el segundo, del 9,1 y, en el tercer año, del 6,5%. Se considera que es un porcentaje muy bajo frente a lo reportado por Rodríguez (2008), del 50%, en la misma zona en Colombia; del 35,4%, para Contreras &Ordóñez (2004), en Colombia o en Venezuela, con el 26%, para Valero et al. (2010). Países como Israel, han erradicado a este microorganismo con prácticas, como el aislamiento en grupos de portadores, tratamientos con dosis de penicilinas y seguimiento bacteriológico (Sargeant et al. 2010). En Finlandia, Suecia y Noruega, el S. agalactiae es un germen poco común, con prevalencias menores al 1% (Rebhum et al. 2006), debido a procedimientos estrictos en los programas nacionales de control de la mastitis.
El Corynebacterium bovis, se aisló apenas en el último año, con el 0,3%. En el trabajo de Calderón & Rodríguez (2008) fue aislado en el 8,44%, valor muy superior a lo reportado por Gómez et al. (2009), para la misma zona, donde obtuvo el 2,5% y que sigue siendo un valor alto, para lo reportado por este estudio. Para diversos autores (Rebhum et al. 2006; Sargeant et al. 2010; Calderón & Rodríguez, 2008), C. bovis es un habitante normal del conducto del pezón, de donde se aísla sin estar asociado a mastitis, aunque se asocia su aislamiento a un sellado deficiente de pezones, ya sea por mal manejo del producto o por la técnica empleada.
Estos estudios permiten afirmar que la mastitis por microorganismos contagiosos es la principal problemática en sistemas especializados, en la producción de leche. Mientras que los microorganismos de origen ambiental, como en el caso de los otros Streptococcus (St. uberis y St. dysgalactiae), representaron el 4,0%, para el primer año; el 7,8%, para el segundo y, apenas el 0,5%, para el tercer año. Es posible que estos patógenos estén disminuyendo, debido a las buenas prácticas de prevención y de control de la mastitis.
Las infecciones mixtas, St. aureus + St. agalactiae, representaron el 0,9%, el primer año; el 0,9%, el segundo y, el 0,5%, para el tercer año. Valores ligeramente inferiores fueron reportados en Colombia por Contreras & Ordóñez, en 2004, con el 1,9% y muy inferior a lo reportado por Rodríguez, en 2008, con el 5% y por Andrade et al. (2012), con el 8,14%.
En los resultados, no se evidenció crecimiento bacteriano en el medio de cultivo, en el 49,7%, para el 2010; para el 2011, el 65,8% y, en el 2012, con el 74,7%, de las muestras del presente estudio. En otros estudios, no se obtuvieron crecimientos en el 15% (Calderón & Rodríguez, 2008) de las muestras que resultaron positivas a la mastitis subclínica, mediante la prueba CMT. Las variaciones, se pueden deber a la presencia de antibiótico o tratamientos que no fueron reportados o residuos de desinfectantes, en los elementos de ordeño.
En enero de 2010 fue demostrado, por primera vez, vacas resistentes a terapia por mastitis y se encontró, como agente etiológico, Mycoplasma spp., en los pezones ordeñados (Tabla 2). M. californicum, en el 1,4%, para 2010; para 2011, con el 2,6% y, para el 2012, se logró disminuir al 0,5%, con terapia y manejo. M. alcalescens, en el 2010, con el 8,5%; para el 2011, con el 0,4% y, para el 2012, con el 0,0%. No se encontró M. bovis, que es en realidad el Micoplasma patógeno y que produce grandes pérdidas. En Colombia, si bien son frecuentes los brotes de mastitis clínicas y subclínicas resistentes a los tratamientos convencionales, no se había informado del aislamiento de Micoplasmas, por lo mismo, este es el primer reporte científico de aislamiento de Mycoplasma californicum y M. alcalescens en Colombia, produciendo mastitis en vacas lecheras.
En caso de infección mixta, donde se encuentra micoplasma involucrado, este cuarto, se cuenta como mastitis por Mycoplasma spp. En las infecciones que se mezcla St. agalactiae con otro germen, solamente se reporta el germen de mayor importancia. En base a las características bioquímicas y serológicas de las cepas aisladas, se puede afirmar que las mismas corresponden a M. californicum y M. alcalescens, pero no se encontró M. bovis. El alto número de colonias observadas en las muestras de leche individual, se correlacionan con una fase aguda de la mastitis por micoplasmas (Bushnell, 1984).
Los datos de estudios bacteriológicos previos fueron de suma importancia para sospechar de un brote de micoplasmosis (altos recuentos de celulas somáticas con bajos porcentajes de aislamiento de microorganismos patógenos), ya que coincide con los datos publicados por otros investigadores (Bushnell, 1984; González & Sears, 2003). Otros elementos a tener en cuenta y que también se hallan bien documentados (Boughton, 2009; Bushnell, 1984; González & Sears, 2003; Zurita, 2012) fueron el alto número de animales con los cuatro cuartos comprometidos, la marcada baja de producción (aproximadamente, 12L/día), la falta de respuesta a las terapias antimicrobianas y, por último, la observación de un sedimento de aspecto arenoso, en algunas de las muestras de leche positivas, al aislamiento. Todos estos factores deberían ser tenidos en cuenta, tanto por los veterinarios de campo como por los laboratorios de diagnóstico bacteriológico, a fin de detectar posibles brotes de esta enfermedad. Si bien los porcentajes de aislamiento de Micoplasmas son bajos a nivel mundial, las pérdidas económicas que ocasiona son considerables, debido a la ineficacia de la antibioterapia, la rápida diseminación de la enfermedad, la alta pérdida de la producción lechera y los inconvenientes de manejo, como aislamiento de animales, ordeñar por separado y no ordeñar con la misma máquina todos los animales. Por tales motivos, en los últimos años, se hace énfasis en el diagnóstico de Micoplasmas, como causa de mastitis. En Colombia, los productores lecheros, se preocupan cada vez más en mejorar su producción con la incorporación de nuevas tecnologías y el control sanitario. A partir de los resultados obtenidos en este estudio, se considera de suma importancia tener en cuenta a los Micoplasmas como agentes productores de mastitis, en fincas lecheras, del Altiplano Boyacense.
Conflicto de intereses: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses, que ponga en riesgo la validez de los resultados presentados.
BIBLIOGRAFÍA
1. ANDRADE, R.; PULIDO, M.; RODRÍGUEZ, C. 2012. Sanidad de Ubre, Calidad de leche. Editorial UPTC. Tunja-Colombia. 170p. [ Links ]
2. BOUGHTON, E. 2009. Mycoplasma bovis mastitis. Vet. Bull. 49:377-388. [ Links ]
3. BUSHNELL, R.B. 1984. Mycoplasma mastitis. Vet. Clin. North Am. Large Anim. Pract. 6:301-312. [ Links ]
4. CALDERÓN, A.; RODRÍGUEZ, V. 2008. Prevalencia de mastitis bovina y su etiología infecciosa en sistemas especializados en producción de leche en el altiplano Cundiboyacense (Colombia). Rev. Col. Cien. Pec. 21:582-589. [ Links ]
5. CONTRERAS, D.; ORDÓÑEZ, P. 2004. Prevalencia y dinámica de la mastitis bovina en el valle de Ubate. Rev. Col. Cienc. Pec. 14:10-16. [ Links ]
6. CARMICHAEL, L.; GUTHRIE, R.; FINCHER, M.; FIELD, L.; JOHNSON, S.; LINQUIST, W. 2003. Bovine Mycoplasma mastitis. Am. J. Mast. 14:220-234. [ Links ]
7. DAVIDSON, P.; STUART, P. 1960. Isolation of Mycoplasma-like organism from an outbreak of bovine mastitis. Vet. Rec. 12:72-76. [ Links ]
8. FREUNDT, E. 2003. Culture media for classic Mycoplasma. J. Dairy. Res. 24:127-135. [ Links ]
9. GÓMEZ, L; PINILLA, R.; JARAMILLO, E. 2009. Mastitis bovina y su etiología infecciosa en la region Umbita (Boyacá). Rev. Col. Cienc. Pec. 18(2):16-20. [ Links ]
10. GONZÁLEZ, R.; JAVARAO, B.; OLIVER, S.; SEARS, P. 2003. Pneumomia, arthritis and mastitis in dairy cows due to Mycoplasma bovis. Am. J. Epi. Med. 56:178-186. [ Links ]
11. GONZÁLEZ, R.; SEARS, P. 2003. Diagnosis, control, and effect on milk production of Mycoplasma bovis intramammary infections. J. Dairy. Res. 26:681-684. [ Links ]
12. HALE, H.; HELMBOLDT, C.; PLASTRIDGE, W.N.; STULA, E. 2002. Bovine mastitis caused by a Mycoplasma species. Cornell Vet. 52: 582-591. [ Links ]
13. HJERPE, C.; KNIGHT, H. 2002. Polyarthritis and synovitis associated with Mycoplasma bovi mastitis feedlot cattle. J. Am. Vet. Med. Ass. 160:1414-1418. [ Links ]
14. IDEAM. Instituto de Hidrología Meteorología y Estudios Ambientales de Colombia. 2012. Disponible desde Internet en sistema de información ambiental. http://www.ideam.gov.co/jsp/index.jsf (con acceso 13/02/2014). [ Links ]
15. JASPER, D.E. 2011. Bovine mycoplasmal mastitis. J. Dairy Res. 26:45-56. [ Links ]
16. KRUZE, J. 2002. Etiología y epidemiología de la mastitis. Rev. Holstein Chile. 34:14-15. [ Links ]
17. LANGSFORD, E. 2007. Mycoplasma agalactiae subsp. bovis in pneumonia and arthritis of bovine. Can. J. Comp. Med. 41:89-94. [ Links ]
18. LEÓN, B. 2007. Frecuencia de aislamiento de los principales agentes de mastitis en el sur de Chile. Rev. Cooprinforma. 40:1-6. [ Links ]
19. MARTIN, S; MEEK, A. 2007. Epidemiología Veterinaria. Principios y métodos. Editorial Acribia. Zaragoza, España.341p. [ Links ]
20. NMC. National Mastitis Council. 2004. Microbiological Procedures for the Diagnosis of Bovine Udder Infection and Determination of Milk Quality. Fourth Edition. Verona. USA. 47p. [ Links ]
21. OSTERAS, O.; MARTIN, S. 2009. Possible risk factors associated with penicillin-resistant strains of Staphylococcus aureus from bovina subclinical mastitis nearly lactation. J. Dairy Sci. 2:345-356. [ Links ]
22. RAZIN, S; CIRILLO, V. 2003. Sugar fermentation. Methods in Mycoplasmology. 1:337-343. [ Links ]
23. REBHUM, W.; GUARD, C.; RICHARD, C. 2006. Disease of dairy cattle. Australian, Vet. J. 1:122-136. [ Links ]
24. RODRÍGUEZ, G. 2008. La mastitis bovina y el potencial para su cntrol en la Sabana de Bogotá. Colombia. Ica-Gtz, Proyecto Colombo-Alemán. Bogotá.13:1333-1342. [ Links ]
25. SARGEANT, J.; LESLIE, K.; SHIRLE, J.; PULKRABEK, B.; LIM, G. 2010. Sensitivity and specificity of somatic cell count and California mastitis test for identifying intramammary infection in early lactation. J. Dairy Sci. 48:1212-1423. [ Links ]
26. STUART, P.; DAVIDSON, I.; SLAVIN, G.; EDSON, F.; HOWELL, D. 1963. Bovine mastitis caused by a Mycoplasma. Vet. Rec. 75:59-64. [ Links ]
27. TULLY, J. 2012. Test for digitonin sensitivity and sterol requirement. Methods in Mycoplasmology. 26:355-362. [ Links ]
28. VALERO, K.; VALBUENA, E.; CHACÓN, F.; OLIVARES, Y.; CASTRO, G.; BRIÑEZ, W. 2010. Patógenos contagiosos y ambientales aislados de cuartos mamarios con mastitis subclinica de alto riesgo en tres fincas del estado de Zulia. Rev. Cientif. FCVLUZ.20(5):498-505. [ Links ]
29. ZURITA, E. 2012. Bovine mastitis caused by a Mycoplasma species. CornellVet.52:582-591. [ Links ]
Recibido: Noviembre 5 de 2013 Aceptado: Junio 19 de 2014













