Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista U.D.C.A Actualidad & Divulgación Científica
versão impressa ISSN 0123-4226
rev.udcaactual.divulg.cient. vol.19 no.2 Bogotá jul./dez. 2016
CIENCIAS AGRARIAS-Artículo científico
PRODUCCIÓN DE XILITOL POR Candida guilliermondii A PARTIR DE FERMENTACIÓN DE RESIDUOS DE PALMA DE ACEITE
XYLITOL PRODUCTION BY Candida guilliermondii FROM FERMENTATION OF WASTE OIL PALM
Katherine Manjarres-Pinzón1, Mario Arias-Zabala2, Yuly Andrea Molina-Ramírez3, María Isabel Betancur-Nieto4, Eduardo Rodríguez-Sandoval5
1 Ingeniera de Alimentos, Candidata Doctorado en Biotecnología, Facultad de Ciencias, Escuela de Química. Universidad Nacional de Colombia, calle 59a # 63-20, Medellín, Antioquia, e-mailjkmanjarresp@unal.edu.co
2 Ingeniero Químico, Ph.D, Profesor Titular, Facultad de Ciencias, Escuela de Química. Universidad Nacional de Colombia, calle 59a # 63-20, Medellín, Antioquia, e-mailmarioari@unal.edu.co
3 Biotecnóloga, Facultad Ciencias de la Salud, Institución Universitaria Colegio Mayor de Antioquia, Carrera 78 # 65-46 Medellín, Antioquia, e-mail yuly.molina@colmayor.edu.co
4 Ingeniero Químico, MSc, Facultad de Ciencias Agrarias, Departamento de Ingeniería Agrícola y Alimentos, calle 59a # 63-20. Universidad Nacional de Colombia, Medellín, Antioquia, e-mail labcca_med@unal.edu.co
5Ingeniero Químico, Ph.D, Profesor Asociado, Facultad de Ciencias Agrarias, Departamento de Ingeniería Agrícola y Alimentos, calle 59a # 63-20. Universidad Nacional de Colombia, Medellín, Antioquia, e-mailedrodriguezs@unal.edu.co
Rev. U.D.C.A Act. & Div. Cient. 19(2): 403-409, Julio-Diciembre, 2016
RESUMEN
La hidrólisis ácida diluida del residuo lignocelulósico de raquis de palma de aceite produce azúcares fermentables, como la xilosa, principal fuente de carbono para la producción de xilitol, por Candida guilliermondii En este estudio, se evaluó el efecto de diferentes medios de cultivo y de condiciones de fermentación sobre la producción de xilitol, a partir de raquis de palma de aceite, utilizando C guilliermondii. El hidrolizado ácido de raquis de palma suplementado con 4g/L extracto de levadura, 3g(NH4)2SO4/L, 0,5g/ MgSO4.7H2O/L y 0,1gCaCl2.2H2O/L mostró ser el mejor medio para el crecimiento de la levadura en cultivo sumergido, debido a que presentó los valores mayores, estadísticamente significativos, de la velocidad específica máxima de crecimiento, de 0,12h-1 y producción de biomasa, de 5,5g/L (p<0,05). Las condiciones de fermentación más apropiadas se obtuvieron con hidrolizado de raquis suplementado a pH de 5,5, concentración inicial de xilosa de 17g/L y un inóculo de 3g/L. La microaerobiosis mostró ser un factor importante en el proceso de fermentación, con un volumen de 40mL de medio, en un matraz de 100mL, se produjo la mayor concentración de xilitol de 6,7 g/L (p<0,05).
Palabras clave: Residuos ligninocelulósicos, fermentación líquida, hidrólisis ácida, edulcorante, microaerobiosis.
SUMMARY
The dilute-acid hydrolysis of oil palm empty fruit bunch produces fermentable sugars such as xylose, main carbon source for xylitol production by Candida guilliermondii. The influence of different culture media and fermentation conditions were evaluated on the production of xylitol from oil palm empty fruit bunch using C guilliermondii. The acid hydrolyzated oil palm empty fruit bunch supplemented with4g yeast extract/L, 3g (NH4)2SO4/L, 0.5g MgSO4.7H2O/L y 0.1g CaCl2.2H2O/L, was the best culture medium for the yeast growth in submerged culture because it had the highest values, statistically significant, of the specific growth rate 0.12h-1 and biomass production 5.5g/L (p<0,05). The suitable fermentation conditions were obtained with hydrolyzated oil palm empty fruit bunch supplemented at pH 5.5, initial xylose concentration of 17g/L and an inoculum of 3g/L. Microaerobic condition is an important factor on the fermentation process, with a volume of 40mL in a flask of 100mL, that produces the highest concentrations of xylitol (6.7g/L) (p<0,05).
Key words: Lignocellulosic waste, liquid fermentation, acid hydrolysis, sweetener, microaerobic.
INTRODUCCIÓN
La reutilización de residuos agroindustriales es un campo importante, a nivel biotecnológico, debido a su potencial, como materias primas, para la producción de energía y productos de valor agregado (Albuquerque et al 2015); además, el uso de estos residuos contribuye a una reducción de la contaminación ambiental (Silva & Roberto, 2001a). El proceso de beneficio del fruto de palma de aceite en Colombia es una de las agroindustrias con mayor generación de material contaminante. En términos conservadores, 1ha de plantación de aceite de palma, anualmente, produce 55t de materia seca, en forma de biomasa fibrosa, mientras que la producción de aceite asciende a 5,5t. Adicionalmente, este cultivo tiene un alto rendimiento en la producción de aceite, si se compara con otras oleaginosas, como por ejemplo, con soya, 13 veces mayor; con girasol, 8 veces y con canola, 6,5 (Chang, 2014). Los principales residuos generados por esta agroindustria son: racimos vacíos, fibra, cuesco o cáscara del fruto y efluentes líquidos, principalmente. De los racimos de fruta fresca, alrededor de 20 a 23%, son racimos vacíos o raquis; 11 a 14% son fibras; 5 a 7% es cuesco o cáscara del fruto y 65 a 85% son efluentes líquidos (García et al 2010). La producción nacional de racimos de fruta fresca, para el 2014, fue de 5,4 millones de toneladas, lo cual, representa un estimativo de 1,24 millones de racimos vacíos o raquis de palma (Fedepalma, 2015). Los racimos vacíos están conformados por celulosa (23,7-65%), hemicelulosa (20,58-33,52%), lignina (14,1-30,4%) y cenizas (1,3-13%) (Chang,2014). El polisacárido más abundante de la hemicelulosa es el xilano, que puede ascender a 95% del total de los polisacáridos no celulósicos de la biomasa. El porcentaje de xilano en los raquis de palma varía entre 20-27% (Shatalov& Pereira, 2012; Chin et al. 2015). Estos residuos, por su composición, constituyen un sustrato potencial para obtener azúcares fermentables, tales como glucosa y xilosa, que pueden ser convertidos, biotecnológicamente, en productos de valor económico, como xilitol y etanol (Pereira et al 2011; Albuquerque et al 2015).
El pretratamiento de lignocelulosa, para obtener azúcares fermentables, es un paso esencial para la conversión con fermentación microbiana. Una variedad de pretratamientos, como el mecánico, químico y biológico, han sido desarrollados para cambiar la estructura y la composición química de la lignocelulosa y así mejorar la producción de azúcares (Duangwang & Sangwichien, 2015; Carvalho et al2003). Entre estos métodos, el pretratamiento con hidrolisis ácida puede ser aplicado con ácido diluido o concentrado, aunque el empleo de ácidos concentrados es menos deseable, porque se forman compuestos inhibitorios. La hidrolisis ácida diluida es el método más aplicado generalmente y el más estudiado entre los pretratamientos químicos. El objetivo principal de la hidrolisis ácida es solubilizar la fracción de hemicelulosa de la biomasa e incrementar la accesibilidad de la celulosa por parte de las enzimas (Zhang et al. 2012).
Algunas especies de levaduras, se encuentran entre los mejores productores de xilitol, fermentando la xilosa, mediante la enzima xilosa-reductasa (XR), dependiente de la Nicotinamida Adenina Dinucleótido Fosfato (NADPH+), produciendo xilitol (Tomotani et al 2009; Arruda et al. 2011). Entre las levaduras más destacadas en este proceso, se registran Candida guilliermondii (Acosta et al 2005; Arruda et al 2011; Sene et al 2011), Candida tropicalis (Ling et al 2011) y Pichia guilliermondii (Zou et al 2010).
El xilitol, un alcohol pentahidroxilado de la xilosa, puede ser producido química o bioquímicamente, a partir de xilosa (Acosta et al. 2005; Arruda et al 2011). Este poliol es usado como edulcorante en la industria de alimentos, así como en productos para la higiene bucal, farmacéuticos y cosméticos. Tiene propiedades anticariogénicas y se puede usar por personas diabéticas, ya que su metabolismo es independiente de la insulina; además, es un compuesto benéfico para personas obesas, porque contribuye a la baja formación de grasa en el tejido adiposo (Arruda et al. 2011; Sene et al 2011).
Diferentes estudios enfocados en la producción de xilitol, vía fermentación, han evaluado diversas condiciones de fermentación, como la aireación, a fin de aumentar su rendimiento (Soleimani & Tabil, 2014), el pH (Cheng et al 2009), la concentración de sustrato (Chang, 2014; Camargo et al 2015), el tiempo y sistemas de fermentación (Carvalho et al 2003). También, se han evaluado las condiciones de hidrólisis (Pereira et al 2011; Sene et al 2011), la adaptación de la levadura y los métodos de detoxificación (Kamal et al. 2011). El objetivo de este estudio fue evaluar diferentes medios de cultivo y diversas condiciones de fermentación, en la producción de xilitol por Candida guilliermondii, a partir de hidrolizados ácidos de raquis de palma de aceite, a escala de matraz agitado.
MATERIALES Y MÉTODOS
Materiales. Los racimos vacíos de frutos o raquis de palma fueron suministrados por la planta de beneficio Palmares del Oriente S.A.S. Los racimos se lavaron, secaron y molieron, en una máquina pica pasto (Molino #1, JM. ESTRADA.S.A, La Estrella, Colombia), hasta un tamaño de partícula de 3 a 5mm.
Hidrólisis ácida del raquis de palma. La hidrólisis ácida de los raquis, se realizó en matraces Erlenmeyer de 500mL, con una relación 1:8 sólido/líquido, tomando 40g del raquis y 320mL de ácido sulfúrico, diluido al 2%. Los matraces fueron esterilizados por 30min, a 121°C y posteriormente sumergidos en un baño de hielo, para detener la hidrólisis. Finalmente, se filtró todo el contenido del hidrolizado y se ajustó el pH a 5,0, 5,5 y 6,0 con NaOH al 98%, para los diferentes tratamientos.
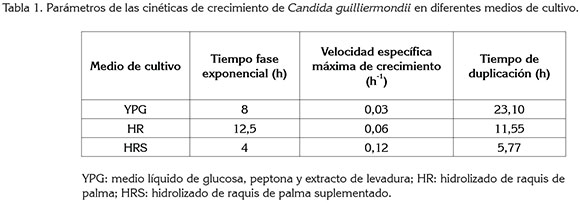
Crecimiento de la levadura en diferentes medios. El crecimiento de Candida guilliermondiii ATCC 6260, se determinó en los siguientes medios, a 30°C y 108 rpm: a) medio líquido de glucosa, peptona y extracto de levadura (YPG); b) hidrolizado de raquis de palma (HR) y, c) hidrolizado de raquis de palma suplementado (HRS), con 4g extracto de levadura/L, 3g (NH4)2SO4/L, 0,5g MgSO4.7H2O/L y 0,1g CaCl2.2H2O/L. La biomasa, se determinó por peso seco. En el método de peso seco, se tomaron 10mL de muestra, se centrifugó a 3900rpm, durante 20min, a 25°C, se lavó dos veces con agua destilada y se secó en cajas Petri, a 60°C, por 72h, para luego registrar el peso seco (Niño-Camacho & Torres-Sáenz, 2010). De las curvas de crecimiento, se obtuvieron los siguientes parámetros: tiempo de fase exponencial, tiempo de duplicación (h) y velocidad específica máxima de crecimiento (h-1).
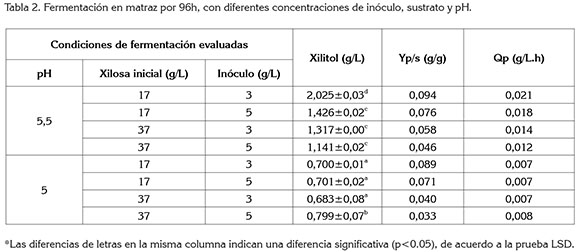
Fermentación a diferentes condiciones. Se seleccionó el mejor medio de cultivo empleado, con base en el menor tiempo de duplicación de la biomasa Las condiciones de fermentación evaluadas fueron: pH (5,0 y 5,5), concentración de inóculo (3 y 5g/L) y concentración de xilosa (17 y 37g/L). La fermentación, se llevó a cabo en matraces Erlenmeyer de 100mL, tomando 47mL de medio de cultivo, se incubó en un agitador, a 200rpm y 30°C, por 96 h. Los parámetros evaluados fueron: concentración de xilitol, rendimiento de producto con respecto al sustrato (Yp/s) y velocidad volumétrica de formación de producto (Qp). Las concentraciones de xilosa y de xilitol fueron determinadas por HPLC (Shimadzu Prominence 20A, Kyoto, Japan), con una columna Aminex HPX-87H (Biorad) y un detector RI (Piñeros-Castro et al 2011).
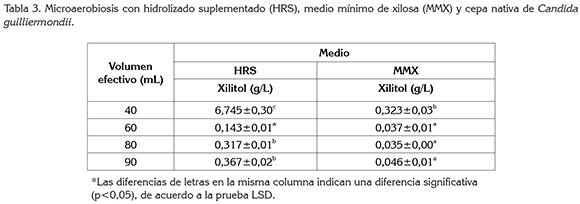
Microaerobiosis. Se estudiaron diferentes condiciones de aireación a escala de matraz Erlenmeyer de 100mL, con variaciones en el volumen de medio efectivo, utilizado de 40, 60, 80 y 90mL (Villalba et al 2009). La microaerobiosis, se determinó utilizando el medio de cultivo previamente seleccionado y un medio mínimo de xilosa (MMX), los cuales, fueron inoculados con 5g de la levadura/L, a 200rpm y 30°C, con un pH y una concentración inicial de xilosa específicos. Se realizaron al menos dos repeticiones de cada tratamiento.
Diseño experimental. En las pruebas de crecimiento de la levadura y microaerobiosis, se empleó un diseño factorial de una sola vía, tomando como factores el tipo de medio y el volumen efectivo, respectivamente. Además, en las pruebas de fermentación, se aplicó un diseño factorial 2k completamente aleatorizado, con los siguientes factores: pH, concentración de inóculo y concentración de xilosa. Los datos experimentales, se sometieron a ANOVA, con un nivel de significancia del 5% y se utilizó diferencia mínima significativa (LSD), para comparar los tratamientos con diferencias significativas. El análisis estadístico, se aplicó mediante Statgraphics plus 5,1. Los resultados se presentan como el promedio ± desviación estándar.
RESULTADOS Y DISCUSIÓN
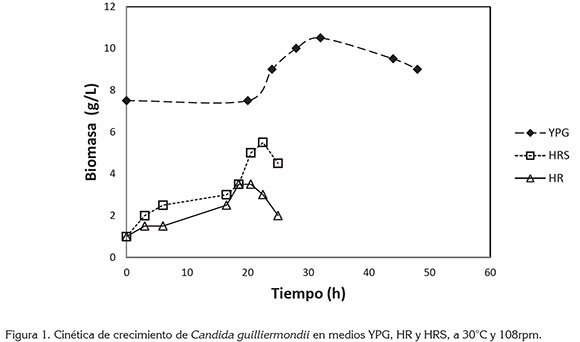
Cinéticas de crecimiento en diferentes medios. Las curvas de crecimiento de C guilliermondii en los medios YPG, HR y HRS, se observan en la figura 1. En la tabla 1, se reportan los valores de la velocidad específica máxima de crecimiento, el tiempo de duplicación y el tiempo de la fase exponencial. El tratamiento que se seleccionó para el montaje de las fermentaciones en matraz agitado fue HRS, debido a que presentó el mayor valor de la velocidad específica máxima de crecimiento (0,12h-1), correspondiente a un tiempo de duplicación de 5,77h y la mayor concentración final de biomasas (5,5g/L). Los compuestos usados para suplementar el hidrolizado excluyen cualquier limitación del crecimiento de la levadura, debido a una deficiencia nutricional. Adicionalmente, en la curva de crecimiento con YPG, se observó una fase de adaptación prolongada de 20h, dado que la cepa se mantuvo por debajo de su temperatura óptima (30°C). El comportamiento de la levadura en HR no muestra una disminución de la concentración de biomasa en las primeras horas de la fermentación, a pesar de la presencia de compuestos tóxicos, como por ejemplo, hidroximetilfurfural (0,0023g/L), determinado en ensayos preliminares. Este compuesto es conocido como inhibidor en el crecimiento de la levadura; sin embargo, la concentración obtenida en este estudio no fue lo suficientemente alta para afectar metabólicamente la levadura (Carvalheiro et al2005).
Fermentación a escala de matraz. En la tabla 2, se observan los resultados de Yp/s, Qp y concentración final de xilosa, para las diferentes condiciones de fermentación. El tratamiento que mostró la mayor producción de xilitol (2,025 g/L) corresponde a un pH de 5,5, concentración inicial de xilosa de 17 g/L y un inóculo de 3 g/L. A esas mismas condiciones, Yp/s y Qp fueron de 0,094 g/g y 0,021 g/L.h, respectivamente. Otros estudios sobre fermentación con hidrolizados de residuos agroindustriales, utilizando C guilliermondii para la producción de xilitol, reportan rendimientos de 0,7g de xilitol/g de sustrato bajo, condiciones semiaeróbicas a partir de 150g xilosa/L inicial (Mohamad et al. 2014). Así, por ejemplo, Arruda et al (2011), al utilizar C guilliermondii para la producción de xilitol con bagazo de caña, halló que la máxima producción fue de 50,5g/L a escala matraz (125mL), con un rendimiento (Yp/s) de 0,81g/g y una productividad volumétrica (Qp) de 0,60g/L.h, después de 96 h de fermentación, a un pH 5,5 y 30°C. También, se ha reportado una producción de xilitol de 52g/L, con un factor de rendimiento de 0,65g/g, usando C guilliermondii e hidrolizado de cascarilla de arroz, como sustrato (Silva & Roberto, 2001b). Una posible causa del bajo rendimiento de xilitol en este estudio podría ser la baja concentración de xilosa inicial, de aproximadamente 17-37g/L. Una mayor concentración de sustrato aumenta la concentración final de producto en el hidrolizado de raquis (Silva & Mussatto, 2006).
Microaerobiosis. La disponibilidad de oxígeno es un factor importante en la producción biotecnológica de xilitol, a partir de D-xilosa. En condiciones limitadas de oxígeno, la fosforilación oxidativa no puede volver a oxidar todo el Dinucleótido de Nicotinamida y Adenina (NADH) generado, lo cual, conduce a una acumulación de xilitol, a nivel intracelular (Albuquerque et al 2014). Además, la presencia de alta cantidad de oxígeno favorece la conversión de xilosa a biomasa, mientras que una baja cantidad de oxígeno aumenta el rendimiento de xilitol (Aguiar et al 2002; Carvalho et al. 2003). La producción de xilitol por medio de microaerobiosis, a un pH de 5,5 y una concentración inicial de xilosa de 17g/L, en este estudio, se observa en la tabla 3. Los medios de cultivo estudiados fueron HRS y MMX. El mejor resultado, se obtuvo con HRS a 40mL de medio, en matraces de 100mL, con una producción de 6,7g xilitol/L. Esto indica, que la microaerobiosis a un volumen de 40mL, en un matraz de 100mL y en cultivo HRS, es apropiado para la producción de xilitol, tomando en cuenta los valores reportados de los demás tratamientos (Tabla 3); sin embargo, son valores bajos comparados con los de otros estudios (Silva & Roberto, 2001b; Arruda et al. 2011). Es necesario tener en cuenta que estos estudios emplean mayor cantidad de sustrato, lo que indica la aplicación de un proceso de concentración de la xilosa, procedimiento que no fue necesario para obtener xilitol a partir de hidrolizado de raquis de palma. La microaerobiosis para la producción de xilitol es importante, debido a que la acumulación de xilitol en la levadura está directamente asociada al desequilibrio redox, limitando las coenzimas, para mayor generación de producto (Mohamad et al 2014). Previamente, se ha reportado que el volumen de medio ideal es de 40%, para el crecimiento de biomasa y 88%, para la producción de xilitol en microaerobiosis, bajo condiciones controladas de O2, inóculo y pH, entre otros (Aguiar et al 2002); sin embargo, Nolleau et al. (1993) reportaron un rendimiento (Yp/s) en la producción de xilitol, de 0,69g/g, con C guilliermondii, bajo condiciones de aerobiosis, con una concentración inicial de 300g xilosa/L. Dicha condición de oxígeno disponible presentó una alta densidad celular, garantizando óptima generación de xilitol.
En general, el crecimiento de la levadura C guilliermondii ATCC 6260 en hidrolizados de raquis de palma suplementado (HRS) presentó los mayores valores de velocidad específica máxima de crecimiento (0,12h-1), correspondiente a un tiempo de duplicación de 5,77h y de producción de biomasa de 5,5g/L. Las condiciones de fermentación con cultivo HRS que tuvieron la mayor producción de xilitol fueron pH de 5,5, concentración inicial de xilosa de 17g/L y un inóculo de 3g/L. Además, al aplicar microaerobiosis, con un volumen de 40mL, en matraces de 100mL, a las condiciones de fermentación anteriormente mencionadas, aumenta la concentración de xilitol a 6,7g/L, lo que representa un parámetro de gran importancia para aumentar la producción de xilitol, utilizando esta cepa
Agradecimientos: Los autores agradecen a Colciencias, por la beca otorgada a Katherine Manjarres-Pinzón. Conflictos de interés: El manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe conflicto de interés que ponga en riesgo la validez de los resultados presentados. Financiación: Este estudio fue financiado por la Universidad Nacional de Colombia, sede Medellín.
BIBLIOGRAFÍA
1. ACOSTA, E.; ALMEIDA, J.B.; GIULIETTI, M.; FRADE, J.A.; NÁPOLES, A.L. 2005. Producción de xilitol en fermentador de 15 litros. ICIDCA. 29(3):45-51. [ Links ]
2. AGUIAR, W.B.; FARIA, L.F.F.; COUTO, M.A.P.G.; ARAUJO, O.Q.F.; PEREIRA, N. 2002. Growth model and prediction of oxygen transfer rate for xylitol production from D-xylose by Candida guilliermondii. Biochem. Eng. J. 12:49-59. [ Links ]
3. ALBUQUERQUE, T.L.; GOMES, S.D.L.; MARQUES, J.E.; SILVA, I.J.; ROCHA, M.V.P. 2015. Xylitol production from cashew apple bagasse by Kluyveromyces marxianus CCA510. Catal. Today 255:33-40. [ Links ]
4. ALBUQUERQUE, T.L.; SILVA, I.J.; MACEDO, G.R.; D.-VALDEREZ, M.; ROCHA, M.V.P. 2014. Biotechnological production of xylitol from lignocellulosic wastes : A review. Process Biochem. 49:1779-1789. [ Links ]
5. ARRUDA, P.V.; RODRIGUES, R.C.L.B.; SILVA, D.D.V.; FELIPE, M.G.A. 2011. Evaluation of hexose and pentose in pre-cultivation of Candida guilliermondii on the key enzymes for xylitol production in sugarcane hemicellulosic hydrolysate. Biodegradation. 22:815-22. [ Links ]
6. CAMARGO, D.; SENE, L.; VARIZ, D.I.L.S.; FELIPE, M.G.A. 2015. Xylitol bioproduction in hemicellulosichydrolysate obtained from sorghum forage biomass. Appl. Biochem. Biotechnol. 175(8):3628-3642. [ Links ]
7. CARVALHEIRO, F.; DUARTE, L.C.; LOPES, S.; PARAJÓ, J.C.; PEREIRA, H.; GIRIO, F.M. 2005. Evaluation of the detoxification of brewery's spent grain hydrolysate for xylitol production by Debaryomyces hansenii CCMI 941. Process Biochem. 40:1215-1223. [ Links ]
8. CARVALHO, W.; SILVA, S.S.; SANTOS, J.C.; CONVERTI, A. 2003. Xylitol production by Ca-alginate entrapped cells: comparison of different fermentation systems. Enzyme Microb. Technol. 32:553-559. [ Links ]
9. CHANG, S.H. 2014. An overview of empty fruit bunch from oil palm as feedstock for bio-oil production. Biomass Bioenerg. 62:174-181. [ Links ]
10. CHENG, K.K.; ZHANG, J.A.; LING, H.Z.; PING, W.X.; HUANG, W.; GE, J.P.; XU, J.M. 2009. Optimization of pH and acetic acid concentration for bioconversion of hemicellulose from corncobs to xylitol by Candida tropicalis. Biochem. Eng. J. 43:203-207. [ Links ]
11. CHIN, S.X.; CHIA, C.H.; ZAKARIA, S.; FANG, Z.; AHMAD, S. 2015. Ball milling pretreatment and diluted acid hydrolysis of oil palm empty fruit bunch (EFB) fibres for the production of levulinic acid. J. Taiwan Inst. Chem. Eng. 52:85-92. [ Links ]
12. DUANGWANG, S.; SANGWICHIEN, CH. 2015. Utilization of Oil Palm Empty Fruit Bunch Hydrolysate for Ethanol Production by Baker's Yeast and Loog-Pang. Energy Procedia. 79:157-162. [ Links ]
13. FEDEPALMA. 2015. Minianuario Estadístico 2015. Federación Nacional de Cultivadores de Palma de Aceite. Bogota. 64p. [ Links ]
14. GARCÍA, J.A.; CÁRDENAS, M.M.; YÁÑEZ, E.E. 2010. Generación y uso de biomasa en plantas de beneficio de palma de aceite en Colombia. Palmas. 31(2):41-48 [ Links ]
15. KAMAL, S.M.M.; MOHAMAD, N.L.; ABDULLAH, A.G.L.; ABDULLAH, N. 2011. Detoxification of sago trunk hydrolysate using activated charcoal for xylitol production. Procedia Food Sci. 1:908-913. [ Links ]
16. LING, H.; CHENG, K.; GE, J.; PING, W. 2011. Statistical optimization of xylitol production from corncob hemicellulose hydrolysate by Candida tropicalis HDY-02. N. Biotechnol. 28:673-678. [ Links ]
17. MOHAMAD, N.L.; KAMAL, S.M.M.; MOKHTAR, M.N.2014. Xylitol biological production: A review of recent studies. Food Rev. Int. 31(1):74-89. [ Links ]
18. NIÑO-CAMACHO, L.; TORRES-SÁENZ, R. 2010. Implementación de diferentes técnicas analíticas para la determinación de biomasa bacteriana de cepas Pseudomonas putida biodegradadoras de fenol. Rev. Ion. 23:41-46. [ Links ]
19. NOLLEAU, V.; DELGENES, J.P.; NAVARRO, J.M. 1993. Xylitol production from xylose by two yeast strains: Sugar tolerance. Curr. Microbiol. 27:191-197. [ Links ]
20. PEREIRA, R.S.; MUSSATTO, S.I.; ROBERTO, I.C. 2011. Inhibitory action of toxic compounds present in lignocellulosic hydrolysates on xylose to xylitol bioconversion by Candida guilliermondii. J. Ind. Microbiol. Biotechnol. 38:71-78. [ Links ]
21. PIÑEROS-CASTRO, Y.; VELASCO, G.A.; PROAÑOS, J.; CORTES, W.; BALLESTEROS, I. 2011. Producción de azúcares fermentables por hidrólisis enzimática de cascarilla de arroz pretratada mediante explosión con vapor. Rev. Ion. 24:23-28. [ Links ]
22. SENE, L.; ARRUDA, P.V.; OLIVEIRA, S.M.M.; FELIPE, M.G.A. 2011. Evaluation of sorghum straw hemicellulosic hydrolysate for biotechnological production of xylitol by Candida guilliermondii. Braz. J. Microbiol. 42:1141-1146. [ Links ]
23. SHATALOV, A.A.; PEREIRA, H. 2012. Xylose production from giant reed (Arundo donax L.): Modeling and optimization of dilute acid hydrolysis. Carbohydr. Polym. 87:210-217. [ Links ]
24. SILVA, C.J.S.M.; ROBERTO, I.C. 2001a. Improvement of xylitol production by Candida guilliermondii FTI 20037 previously adapted to rice straw hemicellulosic hydrolysate. Lett. Appl. Microbiol. 32:248-252. [ Links ]
25. SILVA, C.J.S.; ROBERTO, I.C. 2001b. Optimization of xylitol production by Candida guilliermondii FTI 20037 using response surface methodology. Process Biochem. 36:1119-1124. [ Links ]
26. SILVA, C.J.S.M.; MUSSATTO, S.I.; ROBERTO, I.C. 2006. Study of xylitol production by Candida guilliermondii on a bench bioreactor. J. Food Eng. 75:115-119. [ Links ]
27. SOLEIMANI, M.; TABIL, L. 2014. Evaluation of biocomposite-based supports for immobilized-cell xylitol production compared with a free-cell system. Biochem. Eng. J. 82:166-173. [ Links ]
28. TOMOTANI, E.J.; ARRUDA, P.V.; VITOLO, M.; FELIPE, M.G.A. 2009. Obtaining partial purified xylose reductase from Candida guilliermondii Braz. J. Microbiol. 40:631-635. [ Links ]
29. VILLALBA, M.; VÉLEZ, T.; ARIAS, M.; ARRÁZOLA, G. 2009. Producción de xilitol a partir de cascarilla de arroz utilizando Candida guilliermondii Rev. Fac. Nal. Agr. 62(1):4897-4905. [ Links ]
30. ZHANG, W.; GENG, Y.A. 2012. Improved ethanol production by a xylose-fermenting recombinant yeast strain constructed through a modified genome shuffling method. Biotechnol. Biofuels. 5(1):46. DOI:10.1186/1754-6834-5-46 [ Links ]
31. ZOU, Y.; QI, K.; CHEN, X.; MIAO, X.; ZHONG, J. 2010. Favorable effect of very low initial kLa value on xylitol production from xylose by a self-isolated strain of Pichia guilliermondii. J. Biosci. Bioeng. 109:149-152. [ Links ]
Recibido: Agosto 21 de 2016 Aceptado: Noviembre 29 de 2016

Revista U.D.C.A Actualidad & Divulgación Científica por Universidad de Ciencias Aplicadas y Ambientales se distribuye bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.














