INTRODUCTION
La uchuva (Physalis peruviana L.) es una fruta exótica que se cultiva en casi todos los altiplanos de los países tropicales, subtropicales e, incluso, templados, siendo Colombia su principal productor (Álvarez-Herrera et al. 2015). Se le atribuyen propiedades medicinales y se destaca por su alto nivel en ácido ascórbico, además de ß-caroteno, Fe, Ca, entre otros (Olivares-Tenorio et al. 2017). Este fruto ha sido identificado como fruto exótico entre una serie de productos con potencial agroindustrial, por sus características fisico-químicas (Carvalho et al. 2015), propiedades nutricionales (Olivares-Tenorio et al. 2017) y medicinales (Rabie et al. 2015), adquiriendo gran importancia por su constante demanda en los mercados europeos y norteamericanos.
Los alimentos funcionales proporcionan un efecto benéfico para la salud sobre una o más funciones en el organismo, más allá de su valor nutricional básico, de forma que permita, tanto mejorar la salud como reducir el riesgo de algunas enfermedades (Bigliardi & Galati, 2013). Los mismos autores mencionan que estos efectos, se encuentran relacionados con la adición de vitaminas y de minerales, identificados como componentes fisiológicamente activos (CFA). La OMS realizó una selección de CFA, que interactúan con las enfermedades de mayor recurrencia, destacándose el Ca y las vitaminas B9, C, D3 y E, cuyas deficiencias se relacionan con problemas de mineralización ósea, síntesis de proteínas, estrés oxidativo, entre otros (WHO, 2003).
Ha sido confirmada la posibilidad de aplicar la técnica de impregnación a vacío (IV), para la incorporación de CFA, en matrices porosa de frutas (Castagnini et al. 2015; Betoret et al. 2015); consiste en el intercambio del gas o del líquido ocluido en los poros o espacios extracelulares, por una disolución externa, mediante la acción de mecanismos hidrodinámicos (HDM), por gradientes de presión y fenómenos de deformación-relajación (FDR) (Carciofi et al. 2015). Los frutos IV, al ser sometidos a procesos de conservación, como el secado por aire caliente (SAC), remueven, parcialmente, su contenido de agua, permitiendo ampliar su vida útil al disminuir su actividad del agua (aw) (Tappi et al. 2016); así, se disminuye la disponibilidad y la movilidad de agua en los alimentos y se reduce la posibilidad de reacciones químicas, bioquímicas y de crecimiento de microorganismos que produzcan alteraciones (Stevenson et al. 2015).
El objetivo del trabajo fue evaluar el efecto de la temperatura, el tiempo y las condiciones de empacado en uchuvas adicionadas por IV con calcio y vitaminas B9, C, D3, E y deshidratadas por aire, durante el almacenamiento.
MATERIALES Y MÉTODOS
Materias primas: Se utilizaron uchuvas frescas (UF) (Ecotipo Colombia), con peso entre 5 y 7g y con estado de madurez entre 3 y 5, según la Norma Técnica Colombiana 4580 de 2004. Se utilizó una emulsión de impregnación (EI), cuya formulación contenía cloruro y fumarato de calcio, como fuentes de Ca, vitaminas B9 (ácido fólico), C, D3 (colecalciferol) y E (DL-α-tocoferol acetato), proteína aislada de soja, sucralosa, Tween 80 y Span 60, grado alimentario.
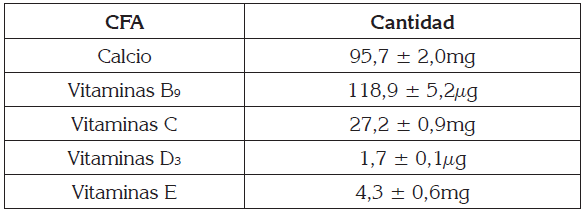
Proceso de impregnación a vacío: La EI fue preparada utilizando un homogeneizador Ultraturrax (UTL 50 INLINE Janke & Kunkel IKA- Labortechnik), a 10.000rpm, durante 10 min. Las UF fueron sometidas a IV aplicando una primera etapa de presión de vacío (20,0kPa), durante 5 min y restableciendo, posteriormente, la presión atmosférica (presión barométrica local = 85,3kPa), manteniendo las muestras sumergidas, durante 5 min más (Peña et al. 2015). El cálculo de los parámetros de impregnación para uchuvas enteras, se llevó a cabo, determinándose la fracción volumétrica de impregnación (X1 y X, m3 SI/m3 UF), deformación volumétrica (γ 1 y γ, m3/m3 UF), al final de la etapa de vacío y al final del proceso, respectivamente, y la porosidad efectiva (εe, m3 gas/m3 UF). Para la EI, se fijó una relación de adición de CFA, de acuerdo con el valor diario recomendado (VDR) de nutrientes, establecidos por la norma colombiana vigente, para niños mayores de 4 años y adultos (Ministerio de Protección Social, 2011), de manera que se obtuviera, aproximadamente, el 10% VDR, para el Ca (100mg) y el 15% VDR, para las vitamina B9 (60g), C (9mg), D3 (1,5g) y E (4,5mg DL-α-tocoferol acetato), sobre la base de100g de UF.
Deshidratación por aire caliente: Para el proceso de deshidratación, se utilizó un secador de bandejas tipo túnel (Centricol S.A.), construida en acero inoxidable y conformada por un ventilador, un sistema de calentamiento por resistencia y una cámara de secado con 3 bandejas, en malla perforada, con un volumen de carga de 6,5 x 10-4 m3/bandeja, una balanza, anemómetros, termohigrómetros y un sistema integrado de adquisición de datos. El proceso se desarrolló a 60°C y 2m/s, hasta que el producto alcanzó una aw ≈ 0,600; en un tiempo de proceso de 20,1 ± 1,1 horas.
Almacenamiento: Las UISAC, se almacenaron a temperaturas controladas de 4, 20 y 30ºC, en bolsas plásticas, con multicapa de poliamida-polietileno, marca ALICO S.A., con barrera al vapor de agua (< 15g/m2/24h/atm, T = 38ºC), O2 (60cc/m2/24h/atm, 23ºC), N2 y CO2. El envasado, se realizó en condiciones atmosféricas (SV) y con aplicación de vacío (CV).
Determinación analítica de los CFA: El Ca, se determinó por absorción atómica con flama, basada en la Norma Técnica Colombiana 5151 de 2003. La extracción de las vitaminas, se realizó tomando alícuotas de, aproximadamente, 7g de UISAC, obtenidos por homogeneización, en un equipo Ultraturrax (IKA® T25 digital), a 10.000 rpm, durante 5 min. La vitamina B9, se extrajo, mediante la metodología propuesta por Arcot & Shrestha (2005); la vitamina C, por el método de Gutiérrez et al. (2007)) y las vitaminas liposolubles (D3 y E), por el método descrito por Cortés-Rodríguez et al. (2016a). La cuantificación de las vitaminas, se realizó por cromatografía líquida de alta resolución, en un equipo marca Shimadzu (serie 204 Prominence 20Å), provisto de un detector UV/VIS, con arreglo de diodos, una columna C18 RP- 5µm 4,0mm x 250mm y un flujo de 1,0mL/min. Para las vitamina B9 y C, se evaluó el extracto acuoso, usando una fase móvil de ácido Orto-Fosfórico (85%, 0,02M, pH = 3,0), a una temperatura de horno de 35°C, con una detección y tiempos de retención de 283nm, 244nm y 7,6 ± 0,1; 4,5 ± 0,1 min, respectivamente, mientras que para las vitaminas D3 y E, se evaluó el extracto oleoso, con una fase móvil, acetonitrilo: metanol (25:75), una temperatura de horno de 45°C y una detección y tiempos de retención de 264nm, 285nm y 8,9 ± 0,0 y 11,8 ± 0,1 min, respectivamente.
Propiedades fisicoquímicas y ópticas: Se determinó el contenido de humedad en base húmeda (Hbh), por el método termo gravimétrico, norma AOAC 934.06 (AOAC, 1990); la aw, con un higrómetro de punto de rocío, a 25ºC, con un equipo AquaLAB Decagon serie 3TE, norma AOAC 978.18 (AOAC, 1990); el contenido de sólidos solubles (SS), con un refractómetro Leica Auto ABBE (escala 0 - 32ºBrix), norma AOAC 932.12 (AOAC, 1990); la acidez por titulación con NaOH 0,1N, utilizando como indicador fenolftaleína, norma AOAC 942.15 (AOAC, 1990) y el pH con un potenciómetro Schott CG840B, norma AOAC 981.12 (AOAC, 1990). El color, se determinó mediante un espectro fotocolorímetro (X-RITE, modelo SP64), utilizando el iluminante D65, con el observador de 10°, como referencia y ventana de observación de 4mm, obteniendo, a partir de los espectros de reflexión, las coordenadas de color del CIEL*a*b, donde L* es un indicador de la luminosidad, cromaticidad a* verde (-) a rojo (+) y cromaticidad b* azul (-) a amarillo (+).
Diseño experimental y análisis de datos: Completamente aleatorizado con arreglo factorial, considerando tres factores: temperatura: 4, 20 y 30°C, tiempo: 0, 1, 2, 3, 4, 5, 6 meses y envasado: CV, SV. Los resultados fueron analizados a partir de ANOVAS, utilizando el método LSD (mínimas diferencias significativas), como método de comparaciones múltiples, con un nivel de confianza del 95% (α = 0,05). Las variables dependientes, se evaluaron por triplicado, para cada condición de almacenamiento. Se utilizó el paquete estadístico STATGRAPHICS PLUS versión 5.1.
RESULTADOS Y DISCUSIÓN
Proceso de impregnación a vacío: La incorporación de la EI durante el proceso IV, se produce, principalmente, por el área del pedúnculo (punto de ruptura entre el fruto y el capacho) (Peña et al. 2013a); además, el fruto posee una película cérea de características semipermeables (≈ 95%) (Cortés-Rodríguez et al. 2015), que influye negativamente en la respuesta a la IV, restringiendo la transferencia de masa de la EI durante el proceso.
Los resultados mostraron que la uchuva es una matriz alimentaria adecuada para el proceso de IV, permitiendo la incorporación de la EI en los espacios intercelulares, evidenciándose con la porosidad efectiva obtenida (εe = 6,6 ± 0,9%); sin embargo, en la etapa de vacío, se presenta salida de líquido nativo del interior de la estructura
(X1 = -4,2 ± 1,1%) (Cortés-Rodríguez et al. 2016a), lo que produce un ligero colapso volumétrico de expansión ( γ1 = 0,5 ± 0,5%) (Cortés-Rodríguez et al. 2015). El restablecimiento de la presión atmosférica permite la incorporación de la EI al interior de la estructura (X = 5,9 ± 0,8%) y un colapso volumétrico de compresión (γ = -2,2 ± 1,0%), resultado del acoplamiento del mecanismo hidrodinámico y del fenómeno de relajación y deformación que experimenta la estructura, por los cambios de presión (Yang et al. 2017). Algunas investiga-ciones han reportado valores similares de los parámetros de impregnación en uchuva entera: Peña et al. (2015) (X: 3,5 0,7%, X1: -3,5 ± 0,5%, γ: -4,2 ± 0,5%, γ1: -0,3 ± 0,2%, εe: 8,2± 0,2%) y en uchuvas semiesférica: Cortés-Rodríguez et al. (2016a) (X: 24,9 ± 1,0%, X1: -10,6 ± 0,1%, γ: 11,8 ± 0,0%; γ1: 0,9 ± 0,0% y εe: 2,7 ±0,1%), los cuales, han identificado que la respuesta a la IV depende de múltiples factores: formulación y viscosidad del líquido de impregnación, forma del fruto, condiciones del proceso (tiempos y presiones en cada etapa), entre otros.
En la tabla 1, se presentan los niveles alcanzados de los CFA incorporados por IV, sobre la base de 100g de UF, teniendo en cuenta, dentro del balance de materia, que los contenidos iniciales de Ca y vitamina C en la UF fueron 1,6 ± 3,6 y 19,8 3,9mg/100g UF, respectivamente. Se observa que el proceso IV confiere un cambio composicional positivo causada por los cambios de presión, durante la acción del mecanismo hidrodinámico (Fito et al. 1996). Esta situación ha sido descrita en uchuva (Cortés-Rodríguez et al. 2016b; Peña et al. 2015) y en otras matrices alimentarias: manzana (Cortés-Rodríguez et al. 2016b); Castagnini et al. 2015) y plátano (Dávila et al. 2016), entre otros.
Estabilidad de los CFA durante el proceso de secado: El proceso de secado permitió obtener UISAC con valores de aw del orden de 0,593 ± 0,009, considerado dentro del rango de seguridad microbiana (Stevenson et al. 2015). Bajo las condiciones utilizadas, se produjeron pérdidas de los CFA del orden de 2,7 ± 1,0%; 32,8 ± 4,1%; 42,9 ± 5,8%; 1,1±0,3% y 3,4 ± 2,2% para Ca y vitaminas B9, C, D3 y E, respectivamente. Las bajas pérdidas presentadas por las vitaminas D3 y E, se podrían atribuir a la protección ofrecida por la matriz seca colapsada, al quedar los CFA encapsulados en su interior, además, por el carácter hidrofóbico de las formas químicas utilizadas (Betoret et al. 2015). Para el Ca, adicionalmente, su conservación se le atribuye a la fijación de este en la matriz por su interacción con los componentes pécticos de las paredes celulares (Gras et al. 2003) y su poca interacción con otros componentes (Peña et al. 2013a).
Las vitaminas hidrosolubles B9 y C representaron las mayores pérdidas, por estar directamente influenciada por la temperatura y el tiempo de secado (Cabrera-Ordoñez et al. 2017); además, puede estar presentándose una salida del líquido de impregnación posterior a la IV (Peña et al. 2015). Por otro lado, la vitamina C podría experimentar una degradación enzimática, así, como reacciones de óxido reducción, que la convierten a ácido deshidroascórbico (Sánchez-Chávez et al. 2015). Algunas investigaciones han reportado el efecto del proceso de secado de la uchuva sobre los CFA: De Jesús-Jungueira et al. (2017) reportaron pérdidas de vitamina C en secado por convección, del 77,4%, a 60ºC y 2m/s; Hernández-Sandoval et al. (2014) informaron de pérdidas de vitaminas B9 y C en polvo de uchuva, obtenida por secado por aspersión del 9,1 y 30,3%, respectivamente; Aredo et al. (2012) obtuvieron pérdidas de vitamina C, del 74,3 y 68,8%, en uchuva deshidratada con y sin pretratamiento con NaCl y, por otro lado, Cortés-Rodríguez et al. (2015), no hallaron pérdidas en Ca ni vitaminas C y B9 en uchuva liofilizada.
En este contexto, las UISAC a la salida del proceso o inicio del almacenamiento alcanzaron niveles de 472,7 ± 49,7mg, 243,6 ± 35,6µg, 34,7 ± 9,9mg, 5,9 ± 1,5µg y 14,7 ± 3,9mg, para Ca y vitaminas B9, C, D3 y E, respectivamente, para una porción de 100g UISAC.
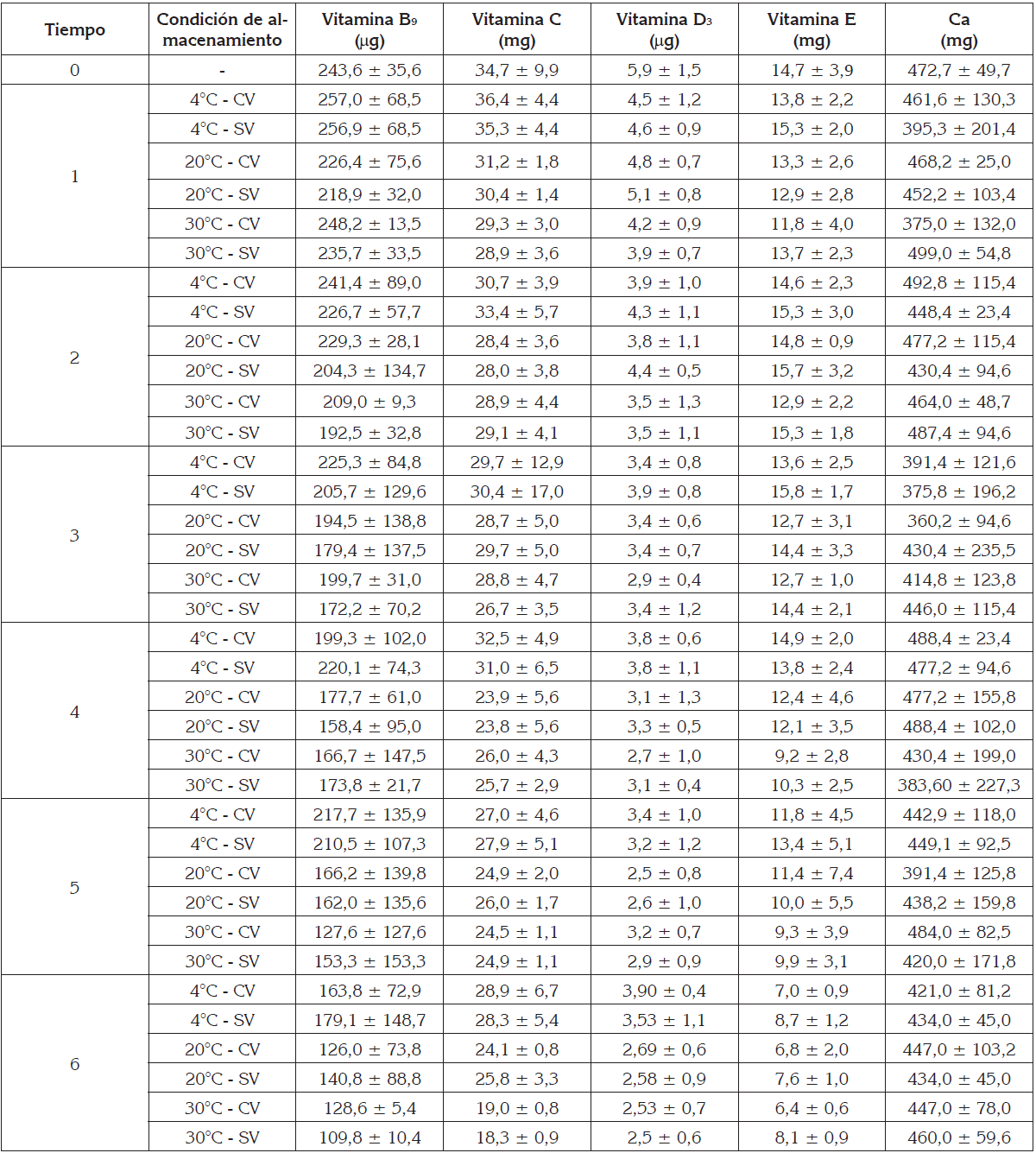
Estabilidad de los CFA durante el almacenamiento: La tabla 2 presenta los valores medios más la desviación estándar de los CFA, en una porción de 100g de UISAC, durante el almacenamiento. El ANOVA no mostró diferencias estadísticas (p>0,05) en los CFA, por efecto del factor empacado, lo cual, se podría deber al buen nivel de protección que ofrece la matriz seca de la uchuva frente a la oxidación del compuesto, dificultando la difusión de O2 hasta las moléculas de los CFA. Por otro lado, sí hubo diferencias estadísticas (p<0,05) en las Vitaminas B9, C, D3 y E, por efecto del factor tiempo y en las vitaminas C, y D3, por efecto de la temperatura.
El Ca no estuvo afectado por ninguna variable independiente, lo que revalida la buena estabilidad, mencionada anteriormente, en el proceso de secado (Peña et al. 2013b; Gras et al. 2003), por lo que el promedio global, durante los 6 meses de almacenamiento, fue de 445,5 ± 61,7mg /100g UISAC.
La vitamina B9 presentó un comportamiento similar hasta el mes 2, posteriormente, se observa una tendencia a disminuir con el tiempo, siendo mayor la disminución con el incremento de la temperatura y alcanzando en el mes 6, pérdidas del 29,0, 46,9 y 49,9% a 4, 20 y 30°C, respectivamente. Esta degradación podría ser atribuida a la integración de diversos factores: efecto térmico, luz, permeabilidad al O2 en el empaque y a los cambios de pH (Olivares et al. 2006).
Hernández-Sandoval et al. (2014) registraron un efecto de la temperatura y el tiempo sobre la vitamina B9 en uchuva en polvo, empacado en condiciones atmosféricas, durante 6 meses, a 4, 20 y 30ºC, siendo las pérdidas de 2,6, 6,0 y 13,8%, respectivamente. Peña et al. (2013b) reportaron en uchuva, mínimamente procesada, adicionada con CFA, pérdidas de vitamina B9, del 27,5%, durante 21 días, a 4ºC. Strålsjö et al. (2003) encontraron una parcial estabilidad del escaramujo o rosa canina, por la presencia de agentes reductores, como la vitamina C, que ejerce un efecto protector desde el proceso de secado. Por otro lado, Hernández et al. (2008) relacionan la pérdida de la vitamina B9 en la fresa, con la concentración de O2.
La vitamina C presentó degradación con el tiempo y con el incremento de la temperatura, alcanzando pérdidas del 15,3, 34,3 y 42,3%, para 4, 20 y 30°C, respectivamente. Diversos factores afectan la estabilidad oxidativa de esta la vitamina C: temperatura, O2, luz, metales y la presencia de ácido ascórbico oxidasa (Gębczyński et al. 2017).
La mejor estabilidad de la vitamina C fue a 4ºC, lo que se podría asociar a un efecto sinérgico por la presencia de otras sustancias, como ácidos orgánicos, azúcares reductores propios de la fruta y producidos por hidrólisis de polifenoles.
Por otro lado, el pH en la UISAC (3,5 ± 0,1) juega un papel importante en su estabilidad, ya que la vitamina podría estar completa o parcialmente protonada, lo cual, representa un estado de mayor estabilidad (Gębczyński et al. 2017). Hernández-Sandoval et al. (2014) reportaron pérdidas de vitamina C en uchuva en polvo, empacada en condiciones atmosféricas, durante 6 meses, a 4, 20 y 30ºC, de 30,0, 40,6 y 71,8%, respectivamente y empacada al vacío, de 29,6, 37,6 y 68,3%, respectivamente. De Jesús-Junqueira et al. (2017) informaron pérdidas entre 54 y 77%, luego del secado por convección, a 60°C y a 2m/s. Mendoza-Corvis et al. (2017) hallaron una pérdida del 43,6% de vitamina C, en un producto en polvo de mango y lactosuero, durante 8 semanas, mientras que a 4ºC, se conservó.
La vitamina D3 presenta, en los primeros 3 meses, una pérdida gradual con el tiempo de almacenamiento y con el incremento de temperatura; posteriormente, la vitamina se comporta de manera muy estable, a 4ºC, mientras que a 20 y 30ºC, continúa su degradación, con una pendiente menor. Las pérdidas durante los 6 meses fueron del 30,1, 56,3 y 60,0% a 4, 20 y 30°C, respectivamente. Se considera que esta vitamina es estable en ausencia de agua y, a bajas temperaturas, no le afecta la presencia del O2, por lo que puede ser empacada en condiciones atmosférica y es menos susceptible a pérdidas por oxidación, que las vitaminas E, β-caroteno y retinol (Sánchez-Chávez et al. 2015); no obstante, a condiciones ácidas, como el caso de la UISAC, se puede isomerizar, siendo la oxidación la ruta predominante para su descomposición; además, se ha demostrado que la exposición a la luz puede ocasionar pérdidas significativas de esta vitamina (Peña et al. 2015).
Pocos autores reportan la estabilidad de vitamina D en frutas frescas o deshidratadas: Peña et al. (2013b) encontraron una conservación de la vitamina D3 en uchuva, mínimamente procesada, durante 21 días, a 4ºC, mientras que Ruiz et al. (2017) señalan pérdidas del orden de 50-47% de vitamina D3, en polvo de aguacate, almacenado a 35°C, durante 6 meses y empacado al vacío y N2.
La vitamina E, en forma de acetato, presentó una buena estabilidad durante los primeros 3 meses, favorecida por las condiciones ácida del medio; a partir de este tiempo, se potencia el proceso degradativo, llegando las pérdidas a valores de 49,4%, a los 6 meses. La degradación del DL-α-tocoferol acetato, se podría deber a diversos factores, que incluyen las reacciones oxidativas, la luz, la presencia de diferentes metales que catalizan las reacciones oxidativas y, finalmente, por los radicales libres presentes (Hernández et al. 2008).
Peña et al. (2013b) encontraron en uchuva, mínimamente procesada, pérdidas de vitamina C, del 9,4%, durante 21 días de almacenamiento, a 4ºC. Cortés et al. (2009) reportaron en manzana, adicionada con vitamina E por IV y liofilizada, durante 180 días, pérdidas de 33,6, 48,5 y 47,0% a 4, 20 y 30ºC, respectivamente, mientras que secada por convección, a 40°C, las pérdidas fueron de 6,9, 27,7 y 37,5 a 4, 20 y 30ºC, respectivamente (Cortés et al. 2007). En fresa, mínimamente procesada adicionada, por IV con vitamina E, no se reportaron pérdidas durante el almacenamiento, a 4ºC (Restrepo et al. 2009).
Propiedades fisicoquímicas y ópticas: La figura 1 presenta los valores medios con los intervalos LSD (95%) de los parámetros fisicoquímicos de las UISAC, durante 6 meses de almacenamiento. El ANOVA presentó diferencias significativas (p < 0,05) en la aw y Hbh con respecto a los factores tipo de empacado, temperatura y tiempo y, los SS, respecto a la temperatura, mientras que el pH y la acidez no presentaron diferencias significativas (p>0,05), siendo sus valores globales 3,5 ± 0,1 y 2,1 ± 0,3%, respectivamente.
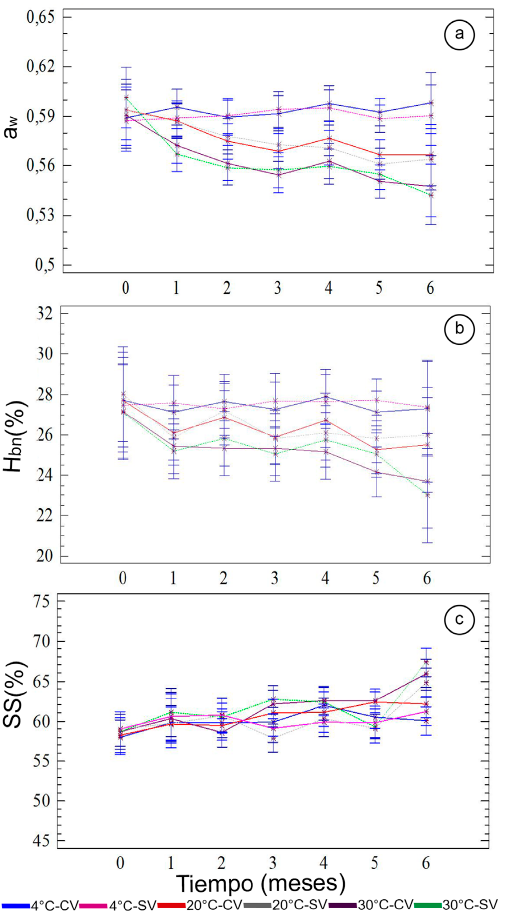
Figura 1 Evolución de las propiedades a. aw, b. Hbh y c. SS en las UISAC, durante el almacenamiento.
La evolución en el tiempo de la aw y Hbh es muy similar para cada temperatura, al estar ambas relacionadas, a través de las curvas de sorción. Se observa que las muestras almacenadas a 4ºC tienen un comportamiento prácticamente estable durante el período de almacenamiento, siendo la variación entre 0,580-0,620 (aw) y de 25-29% (Hbh), mientras que, a 20 y 30ºC, se produce una disminución a lo largo del tiempo, siendo más acentuada a 30ºC; este descenso, se puede deber a diferencias en el potencial químico del agua entre el ambiente interno del empaque y el producto. La dependencia a la temperatura, se debe, probablemente, al incremento de la presión de vapor del agua, a medida que aumenta la temperatura y de los coeficientes de transferencia de masa, con lo que se va produciendo una pérdida mayor de agua de la muestra, a temperaturas más altas (Yao et al. 2015). Las UISAC, a los 6 meses de almacenamiento y a las condiciones de aw obtenidas (0,530 - 0,600), pueden ser catalogadas como alimentos de humedad intermedia (Hbh ≈ 22-30%); bajo estas condiciones existe una inhibición del crecimiento de patógenos, hongos y levaduras (Stevenson et al. 2015).
Los SS presentaron un comportamiento similar durante los primeros 5 meses, pero con alta variabilidad (56 - 67%), lo cual, se podría deber a varios factores: a las diferencias en los niveles de maduración de la UF, a las diferencias en los niveles de IV de las muestras a la entrada del proceso de secado y a una posible hidrólisis del almidón y de los polisacáridos de la pared celular, que dan origen a azúcares solubles (Balaguera-López et al. 2014). En el mes 6, se observa una tendencia a incrementar los SS y mucho más con el incremento de la temperatura, lo que se podría explicar por la reducción de la Hbh.
Algunos autores señalan comportamientos diversos de las propiedades fisicoquímicas de la uchuva. Peña et al. (2013b), en uchuva impregnada con CFA, mostraron ligeras fluctuaciones del pH (3,5 - 3,7), acidez (1,4-1,8%), aw (0,980- 0,984) y SS (14,6-15,8%), durante 21 de almacenamiento. Reyes et al. (2017), en UF adicionada con Ca, cambios en el pH (3,4 - 3,6) y conservación de los SS (16,3%), durante 35 días, a 14ºC y Balaguera-López et al. (2014) encontraron un comportamiento similar de los SS en uchuvas, con y sin cáliz, durante 22 días de almacenamiento, a 16ºC.
La figura 2 presenta los valores medios con los intervalos LSD (95%) de los parámetros de color (L*, a* y b*) de las UISAC, durante los 6 meses de almacenamiento. El ANOVA presentó diferencias significativas (p<0,05), en los parámetros de color, con respecto a los factores temperatura y tiempo, mientras que el tipo de empacado (SV, CV), no fue relevante a las mismas condiciones de almacenamiento. A 4ºC, las UISAC mostraron un comportamiento uniforme del color durante los 180 días, mientras que al aumentar la temperatura almacenamiento (20 y 30ºC), disminuyen con el incremento del tiempo, siendo más incidente a mayor temperatura. Esta situación hace que las muestras se perciban más oscuras (< L*), lo cual, se podría asociar a reacciones de pardeamiento no enzimático, por la presencia de azúcares reductores (glucosa) y aminoácidos presentes en la proteína aislada de soja (lisina y arginina); además, por otras reacciones de carácter oxidativo, asociadas al ácido ascórbico presente, que contribuyen igualmente al oscurecimiento (Mendoza-Corvis et al. 2015). La disminución de los parámetros a* y b* a 20 y 30ºC identifica una pérdida de las tonalidades rojas y amarillas, lo cual, se podría atribuir a la degradación de pigmentos carotenoides, propios del fruto (Mendoza-Corvis et al. 2015). La evolución del color en el plano cromático a*b*, durante los 6 meses, desplaza las muestras desde la zona de los anaranjados hacia la zona de los grises, lo cual, es correspondiente a una menor intensidad o saturación de color que, sumado a la disminución de L*, hace percibir las muestras como opacas y pardas.
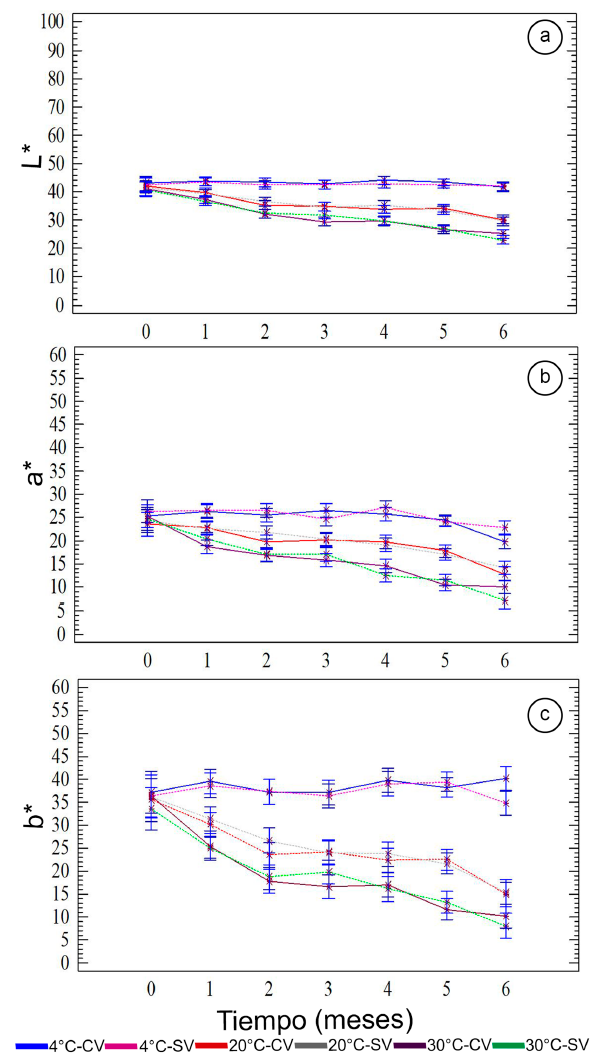
Figura 2 Evolución de Los parámetros de color a. L*, b. a* y c. b* en las UISAC, durante el almacenamiento.
El proceso de IV permite la incorporación efectiva de CFA en la matriz de uchuva. El proceso de secado por aire por convección, a 60°C y 2 m/s, permitió obtener productos de UISAC seguros microbiológicamente; no obstante, evidenció unas pérdidas importantes, principalmente, en las vitaminas B9 y C. Durante los 6 meses de almacenamiento, el Ca se conserva en la matriz, mientras que las vitaminas B9, C, D3 y E están afectadas por el tiempo o la temperatura. Se estableció que la mejor condición de almacenamiento de las UISAC fue a 4ºC y empacado atmosférico, presentando los mayores contenidos de CFA y mejores atributos de calidad (fisicoquímicos y físicos). En el contexto de la normativa colombiana (Ministerio de Protección Social, 2011) y en concordancia con los descriptores permitidos en el etiquetado nutricional, 100g de UISAC, almacenados durante 6 meses, a 4°C, 20ºC y 30ºC, aportan contenidos superiores al 20% del VDR, para cada nutriente, por lo que se permite declarar, como “Excelente fuente de Ca y vitaminas B9, C, D3 y E”.