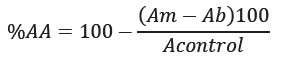INTRODUCCIÓN
En el continente americano, se han originado especies de plantas que han sido domesticadas y contribuyen a la alimentación del mundo, dentro de estas especies, algunas son más conocidas y cultivadas, como la papa, el maíz, la yuca, el camote y el fríjol. Por el contrario, existen otras especies que poseen un alto potencial para ser usadas en la agroindustria (Cadima et al. 2003); sin embargo, no son muy conocidas y, por tanto, no existe un uso amplio de ellas. Dentro de estas últimas, se destacan nueve especies de raíces y de tubérculos andinos: la achira, ahipa, arracacha, maca, cubio (mashua), mauka, oca (ibia), ulluco (melloco) y yacón, de importancia económica y nutricional para la subsistencia de los agricultores de los Andes (Barrera et al. 2004). Lo anterior, debido a buen rendimiento en producción, propiedades medicinales, alto contenido de almidón y presencia de micronutrientes, vitaminas, antioxidantes y propiedades antimicrobianas (Barrera et al. 2004).
Dentro de estas especies, se destacan el cubio y el ulluco. Por su parte, el cubio (Tropaeolum tuberosum) es un tubérculo, al cual, se le han atribuido propiedades antioxidantes y ha sido comparado con el arándano y otras bayas, que poseen alto contenido de flavonoides y de polifenoles (Chirinos et al. 2008b).
En el ulluco (Ullucus tuberosus), se han encontrado betalainas en forma ácida de betaxantinas y betacianinas (Campos et al. 2006); además, contiene aminoácidos esenciales, minerales y vitaminas; posee pigmentos con usos en la industria alimentaria o textil. Sus hojas han sido utilizadas para alimentación humana y animal (Espín et al. 2004). Estos dos tubérculos han sido asociados con oca y papas nativas para repeler insectos, nemátodos y otros patógenos, debido a la presencia de diversos fitoquímicos (Morillo et al. 2016).
En consecuencia, estos dos tubérculos poseen potencial para el cultivo y el consumo, además, debido a sus características antioxidantes y antimicrobianas, pueden ser evaluadas como fuente de compuestos bioactivos, con aplicación en la industria alimentaria y farmacéutica. La posibilidad de fomentar el cultivo de las raíces y tubérculos andinos, incluyendo el cubio y ulluco, depende del conocimiento sobre su composición química, características nutricionales y funcionales, para orientar sus posibles usos y aplicaciones (Espín et al. 2004).
Por lo anterior, en este trabajo, se plantea como objetivo, evaluar la capacidad antioxidante y antimicrobiana de hojas, tallos y tubérculos de las especies T. tuberosum y U. tuberosus, en busca de identificar usos potenciales, que permitan revalorizar estas materias primas autóctonas y promover, de esta manera, su uso, como estrategia y aprovechar la biodiversidad.
MATERIALES Y MÉTODOS
Material vegetal: Se trabajó con tallos, hojas y tubérculos de cubio y de ulluco (Figura 1). Las diferentes partes del cubio fueron cosechadas en la vereda Arrayanes, municipio de Suesca (Cundinamarca), coordenadas 5°06’48.4”N 73°45’11.0”W, a 3.000m s.n.m. El ulluco fue cosechado en la Vereda Barragán, municipio de Tuluá (Valle del Cauca), coordenadas 4°01’41.1”N 75°53’07.8”W, a 3.100m s.n.m.

Figura 1 Ulluco Ullucus tuberosus: a) hojas, b) tubérculo; Cubio Tropaeolum tuberosum: c) hojas, d) tubérculo.
Las diferentes partes de cada planta fueron transportadas a 10°C. Una vez en el laboratorio fueron lavadas con agua corriente y desinfectadas por inmersión, durante 10 minutos, en una solución al 0,3% (v/v) de Citrosan (Tecnas, Colombia.). Posteriormente, fueron troceadas y secadas en una estufa con circulación de aire forzado (Binder, Alemania), a 38°C, durante 90 horas, hasta obtener peso constante. Las muestras finalmente fueron maceradas con un mortero.
Los extractos etanólicos fueron realizados con el material obtenido a partir de las hojas, los tallos y los tubérculos de cubio y de ulluco (de manera independiente), con una solución de etanol en agua (50% v/v) y una relación 1:4 (material vegetal: etanol). La mezcla, se agitó durante una hora, a 150 revoluciones por minuto (rpm), en un agitador orbital (WEG, Brasil); posteriormente, se centrifugó durante 20 minutos, a 1.500rpm, en una centrifuga (Clay Adams, USA.) y se recolectaron los sobrenadantes. El precipitado, se sometió a un segundo proceso de extracción, siguiendo el mismo proceso detallado anteriormente.
Determinación de la capacidad antioxidante (CA): Con los extractos obtenidos a partir de tallo, de hojas y de tubérculo de cubio y de ulluco, se midió la capacidad antioxidante, mediante las técnicas DPPH y ABTS+.
Técnica DPPH: Se utilizó la metodología propuesta por Brand et al. (1995), con algunas modificaciones; se preparó el reactivo DPPH (2,2-difenil-1-picrilhidracilo) 0,1mM y se ajustó la absorbancia a 1 unidades de absorbancia (UA), con metanol (99%). Se realizó una mezcla de 0,05mL de extracto etanólico (obtenido de las diversas partes de las plantas) o metanol (empleado como blanco); se añadieron 2mL de radical DPPH y la mezcla se dejó reaccionar durante 30 minutos en oscuridad. Posterior al tiempo de reacción, se midió la absorbancia a 517nm, en un espectrofotómetro (Thermo scientific, USA.).
Para la evaluación de los extractos por el método ABTS+, se preparó con 16 horas de anterioridad el reactivo ABTS+ (ácido 3-etilbenzotiazolina-6-sulfónico). Para esto, se puso en reacción el persulfato de potasio con el precursor ácido 2,2’-azinobis (3-etilbenzotiazolín)-6-sulfónico (ABTS+) y se ajustó la absorbancia a 0,7UA con etanol (99%). La medición, se realizó añadiendo a un tubo ambar 50µL de los extractos etanólicos o etanol (empleado como blanco), 1450µL de reactivo ABTS. La mezcla se homogenizó y se dejó reaccionar por 30 minutos en la oscuridad. Finalmente, se midió la absorbancia, a 732nm. La capacidad antioxidante, se expresó en equivalente Trolox, utilizando la ecuación y=0,01x-0,0084, donde, y es la absorbancia de la muestra y x es el equivalente de Trolox (TEAC).
Los cambios en la absorbancia del reactivo (con respecto al blanco), por efecto de la adición de los extractos etanólicos, se empleó para calcular la capacidad antioxidante, empleando la ecuación 1.
Donde, AA es el porcentaje de actividad antioxidante, Am es la absorbancia de la muestra, Ab es la absorbancia del blanco y Acontrol es la absorbancia del DPPH o del ABTS.
Evaluación de la capacidad antimicrobiana: Se seleccionaron microorganismos de diferente naturaleza, los cuales, se activaron previamente en temperatura y medios específicos, Escherichia coli ATCC 35218 (Bacilo Gram negativo patógeno) 37ºC, caldo tripticasa de soya (TSB) (Scharlau, España), Lactobacillus fermentum ATCC 9338 (Bacilo Gram positivo Probiótico, banal) 37ºC, caldo Man Rogosa Sharpe (Scharlau, España), Cándida utilis ATCC 9950 (Levadura alterante) 30ºC, (TSB), Saccharomyces cerevisiae ATCC 4098 (Levadura alterante) 30ºC, (TSB), Staphylococcus aureus ATCC 33591 (Coco Gram negativo Patógeno) 37ºC, (TSB).
Se preparó medio Müeller Hinton (Panreac, España), se esterilizó a 121ºC y se dejó enfriar a 37°C, se sirvió en cajas de petri y se dejó solidificar: este medio, se utilizó para inocular los microorganismos, previamente activados.
Se realizaron antibiogramas con la técnica de discos. Se prepararon 7 discos, cada uno de 4mm de diámetro, en cada caja de petri. Para la medición, empleando las diferentes partes del ulluco, la preparación de los discos, se realizó de la siguiente manera: extracto de hojas de ulluco, extracto de tallos de ulluco, extracto de tubérculo de ulluco. Adicionalmente, se realizó un control con sensidiscos impregnados de 2 antibióticos, penicilina (10µg/Disco) y vancomicina (30µg/ Disco), un disco sumergido en etanol al 50% y un disco sumergido en agua estéril.
Las cajas de petri se pusieron en incubación durante 72 horas, a 30°C, para C. utilis y S. cerevisiae, los otros microrganismos, E. coli, L. fermentum y S. aureus, fueron incubados a 37°C, por 72 horas. Una vez pasado el periodo de incubación, se midió el diámetro del halo de inhibición presente en cada disco, empleando un calibrador digital. Para la medición de las características antimicrobianas de cubio, se realizó el procedimiento detallado anteriormente, con algunas modificaciones. La preparación de los discos, se realizó de la siguiente manera: extracto de hojas de cubio, extracto de tallos de cubio, extracto de tubérculo de cubio; como control, se utilizaron sensidiscos con 2 antibióticos, penicilina (10µg/Disco) y tetraciclina (30µg/Disco), un disco sumergido en etanol al 50% y un disco sumergido en agua estéril. Se dejó incubar por 48 horas, a 30°C, para C. utilis y el resto de microorganismos, E. coli, L. fermentum y S. aureus, a 37°C, por 48 horas. Se midió finalmente el halo de inhibición de cada disco, empleando un calibrador digital.
Diseño experimental: Para la medición de las propiedades antioxidantes y antimicrobianas de las dos plantas, se empleó un diseño factorial completamente al azar. Los factores estudiados fueron cubio y ulluco, con tres niveles cada una (hojas, tallos y tubérculos). Como variable de respuesta, se tuvo la capacidad antioxidante (ABTS+ y DPPH) y el halo de inhibición respecto a los 5 microrganismos evaluados. Las mediciones, se hicieron por triplicado y todos los datos se presentan como el valor medio ± desviación estándar. Los resultados fueron analizados, a través de una ANOVA y el Test HSD (Honestly-significant-difference) de Tukey, como método de comparaciones múltiples, con un nivel de confianza del 95% (P=0,05). El análisis de varianza, se realizó con el paquete estadístico STATGRAPHICS Centurion versión XXVII.
RESULTADOS Y DISCUSIÓN
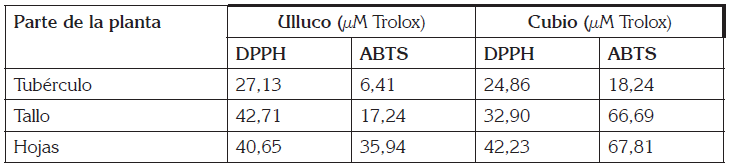
Determinación de las características antioxidantes: Mediante la técnica DPPH, se pudo encontrar un porcentaje de actividad antioxidante, entre 18,89 y 60,96%, en las diferentes partes de las plantas de ulluco; para el cubio, estos valores estuvieron entre 58,09 y 69,37% (Figura 2). En el caso del tubérculo de ulluco, se obtuvo 18,89% de actividad antioxidante, el cual, es cercano al reportado por Zavaleta et al. (2005), con un 27,62%, quien realizó su estudio, usando la técnica DPPH y extractos etanólicos, obtenidos con tubérculos frescos triturados, centrifugados a 3.500rpm, durante 15 minutos. Esta actividad antioxidante se puede deber, principalmente, al contenido de betalaínas en forma ácida de betaxantinas y betacianinas (Campos et al. 2006), presentes en el tubérculo de ulluco. Los resultados por DPPH en hojas y tallo de ulluco fueron 54,44 y 61,28%, respectivamente, mientras que para hojas y tallo de cubio, de 69,42 y 69,37%, respectivamente. Con relación a la capacidad antioxidante de estos tubérculos, no fueron encontrados reportes en la literatura (hojas y tallos).
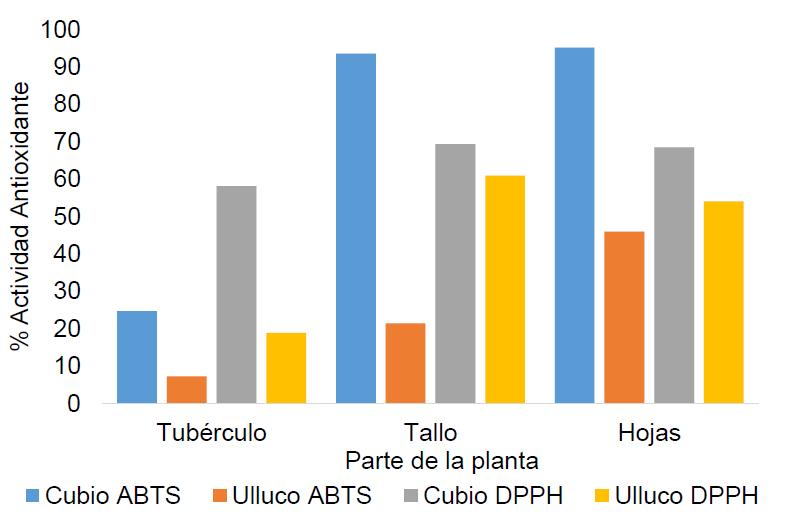
Figura 2 Porcentaje de la actividad antioxidante de tres estructuras de las plantas ulluco Ullucus tuberosus y cubio Tropaeolum tuberosum, por las técnicas DPPH y ABTS.
Comparando los valores de hojas de cubio y hoja de ulluco con las de maca y yacon, se obtuvo una CA levemente inferior, ya que para estas se reportan valores de CA, entre 78 y 75%, en extractos metanólicos (Castañeda et al. 2008).
Los resultados obtenidos de actividad antioxidante por la técnica ABTS presentes en tallo de cubio y hojas de cubio, se observan en la figura 2. Estos valores de actividad antioxidante son superiores a los obtenidos por otros productos, como la tuna roja (Opuntia ficusindica), que presenta una actividad antioxidante, de 77,65% (Repo de Carrasco et al. 2008) y el arándano (Vaccinium corymbosum L.), en el que se reporta una actividad antioxidante de 91,1% (Samad et al. 2014).
Mediante las dos técnicas realizadas para evaluar la capacidad antioxidante, se obtuvo que la parte de la planta que mayor actividad antioxidante presenta son las hojas, lo cual se puede atribuir a la presencia de flavonoides, los que tienen una alta capacidad antioxidante (Martínez et al. 2002).
La CA de los tubérculos de ulluco y cubio fue menor que en las otras partes de la planta; sin embargo, es superior a la de otros tubérculos, como Solanum tuberosum, el cual, tiene una CA del 15,5%, según los resultados de Reyes et al. (2014), quien realizó su estudio con extractos etanólicos y mediante la técnica DPPH. Esta CA en el cubio, se debe a la presencia de compuestos, como las proantocianidinas, los ácidos fenólicos, monómeros de flavan 3-ols, flavonoles y antocianinas (Chirinos et al. 2008a).
En los extractos de tallo y tubérculo de cubio, se observó una coloración azul-morado que, según lo reportado por Reyes et al. (2014) y Chirinos et al. (2008a), se puede atribuir a la presencia de 2 tipos de antocianina, 2,3-diglucosido de malvidina y 3-glucosido de malvidinan.
Este resultado es importante, ya que las antocianinas son de interés particular para la industria de colorantes alimenticios, debido a su capacidad para impartir colores atractivos (Konczak et al. 2004). Recientemente, diversos materiales con antocianinas están siendo incorporados a productos alimenticios, durante el paso del tracto digestivo al torrente sanguíneo de los mamíferos; las antocianinas permanecen intactas (Miyazawa et al. 1999) y ejercen efectos terapéuticos conocidos, que incluyen la reducción de la enfermedad coronaria, efectos anticancerígenos, antitumorales, antiinflamatorios y antidiabéticos, además del mejoramiento de la agudeza visual y del comportamiento cognitivo (Aguilera et al. 2011). Los resultados evidencian que los tubérculos, hojas y tallo de cubio y de ulluco contienen un alto contenido de antioxidantes, lo que permite un aprovechamiento integral de las plantas y las convierte en una potencial fuente de extracción de antioxidantes, a nivel industrial. Esto permitiría establecer alternativas de uso determinado, dado que existe un creciente interés en el uso de antioxidantes para la prevención y el tratamiento del cáncer, la aterosclerosis, la artritis, la diabetes y otras afecciones del envejecimiento y las dietas ricas en antioxidantes, juegan un papel importante en la prevención de estas enfermedades (Tsao & Deng, 2004).
Evaluación de la capacidad antimicrobiana: En la evaluación de la capacidad antimicrobiana sobre el microorganismo Candida utilis, se obtuvo para los controles (Penicilina y tetraciclina) un halo de inhibición de 14,17mm y 14,33mm, respectivamente, mientras que para el extracto etanolico de tubérculo de cubio, se obtuvo un halo de inhibición de 4.38mm; las otras partes de la planta no presentaron inhibición. El efecto que se observó para la penicilina fue bactericida, mientras que para la tetraciclina y el extracto de tubérculo de cubio fue bacteriostático. En el resto de microorganismos solamente los antibióticos presentaron un efecto inhibitorio. El efecto antimicrobiano del tubérculo del cubio se ha demostrado, debido a que tiene efecto antibiótico contra bacterias, tales como la Escherichia coli y el Staphylococcus, así como los hongos, como la Candida albicans, que se puede dar, posiblemente, por el efecto de los glucosinolatos volátiles, como los isotiocianatos, presentes en el cubio, que han mostrado un amplio rango de efectos antibacteriales y antifungicos (Morillo et al. 2016).
En el caso de los extractos de ulluco, en el microorganismo donde se presentó capacidad antimicrobiana, fue en E. coli, por parte de los extractos etanólicos de tubérculo y hojas, presentando un halo de inhibición, con un diámetro de 4.53mm y 4.85mm, respectivamente y se observó un efecto bactericida, mientras que en los antibióticos usados como control en la E. coli, no se presentó inhibición del crecimiento. El tallo no mostró capacidad antimicrobiana; en el caso de los microrganismos Saccharomyces cerevisiae y Staphylococcus aureus, se presentó un efecto bactericida del control vancomicina, con un halo de inhibición, de 10,75mm y 10,95mm, respectivamente. No se encontraron reportes en los que se mencione, debido a que metabolito se genera este efecto bacteriostático por parte del tubérculo de ulluco sobre el microorganismo E. coli.
En la figura 3, se muestra la prueba de Tukey, donde se puede observar que existe un efecto significativo por parte del extracto del tubérculo de cubio sobre el microorganismo C.utilis; sin embargo, este efecto no se presentó en la misma proporción que los antibióticos penicilina y tetraciclina, de amplio espectro, acción bactericida y obtenidos mediante síntesis química. La prueba de Tukey realizada al antibiograma con extractos de ulluco en E. coli, se observa en la figura 4, en donde se muestra que los extractos de hojas y de tubérculo de ulluco presentan un efecto inhibitorio similar entre sí y muy cercano al efecto realizado por el etanol, compuesto químico con efecto sobre bacterias Gram-negativas, como es el caso de E. coli. Los resultados obtenidos en la evaluación de la capacidad antimicrobiana permiten identificar una oportunidad de aprovechamiento para el cubio y el ulluco en la industria alimentaria, debido a que, actualmente, ha aumentado el interés por los agentes antimicrobianos de origen natural (derivados de vegetales), que permitan controlar la carga microbiana en matrices alimentarias, aunque cabe señalar que la velocidad de deterioro microbiológico de los alimentos no solo depende de los microorganismos presentes, sino también de la combinación de factores asociados al producto y su carga microbiana inicial (Rodríguez, 2011).
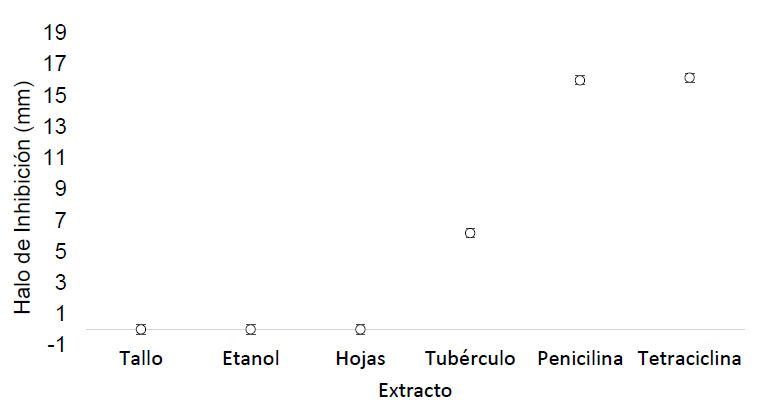
Figura 3 Prueba de Tukey del efecto de los extractos de la planta de cubio Tropaeolum tuberosum sobre Candida utilis.
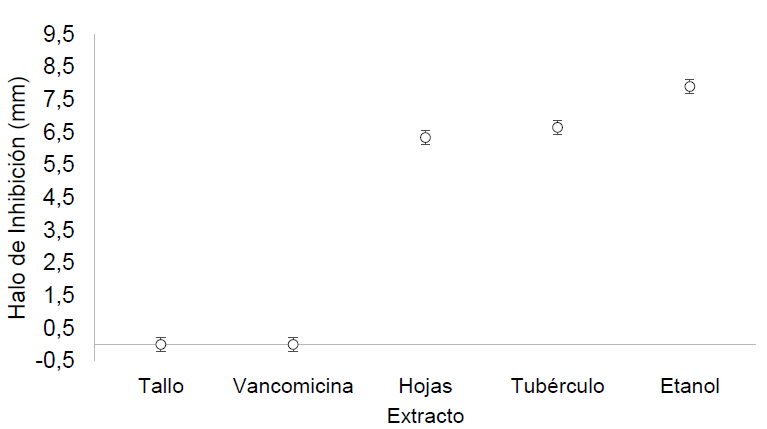
Figura 4 Prueba de Tukey del efecto de los extractos de la planta de ulluco Ullucus tuberosus sobre Escherichia coli.
La evaluación de la actividad antioxidante y antimicrobiana en cubio y en ulluco es de gran importancia, ya que se pudo encontrar un alto porcentaje de actividad antioxidante en todas las partes de las plantas (hojas, tallo y tubérculo) (Tabla 1). Los valores antioxidantes en estos tubérculos son más altos o comparables a las fuentes conocidas de antioxidantes naturales, como los arándanos, lo que indica que estos cultivos tienen el potencial de ser considerados como nuevas fuentes importantes de nutracéuticos. Además, presentan actividad antimicrobiana sobre microorganismos, como E. coli y C. utilis. La información obtenida en este tipo de estudios busca estimular un aumento en la producción y en la conservación de la diversidad de estos productos dentro de la región andina y en la identificación de estos cultivos, como nuevas fuentes de alimentos funcionales y productos saludables, agregándoles valor para, de esta manera, aprovechar el crecimiento actual de este sector del mercado, tanto en la industria alimentaria como farmacéutica, lo cual, se reflejaría, a su vez, en un beneficio económico, para quienes cultivan este tipo de productos.